人教版高中化学选修四2.3《化学平衡(第一课时)化学平衡状态》教学课件(共19张ppt)
文档属性
| 名称 | 人教版高中化学选修四2.3《化学平衡(第一课时)化学平衡状态》教学课件(共19张ppt) |

|
|
| 格式 | ppt | ||
| 文件大小 | 393.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-10-31 22:13:38 | ||
图片预览





文档简介
第二节 化学平衡状态
NaCl 的溶解平衡:
20℃时,将一块质量为40 g 的NaCl晶体投入到100 g 水中,充分搅拌,至固体不再溶解为止,静置.经过相当长的时间后,发现NaCl晶体质量不再发生变化,但NaCl晶体的形状在不断发生改变,为什么?
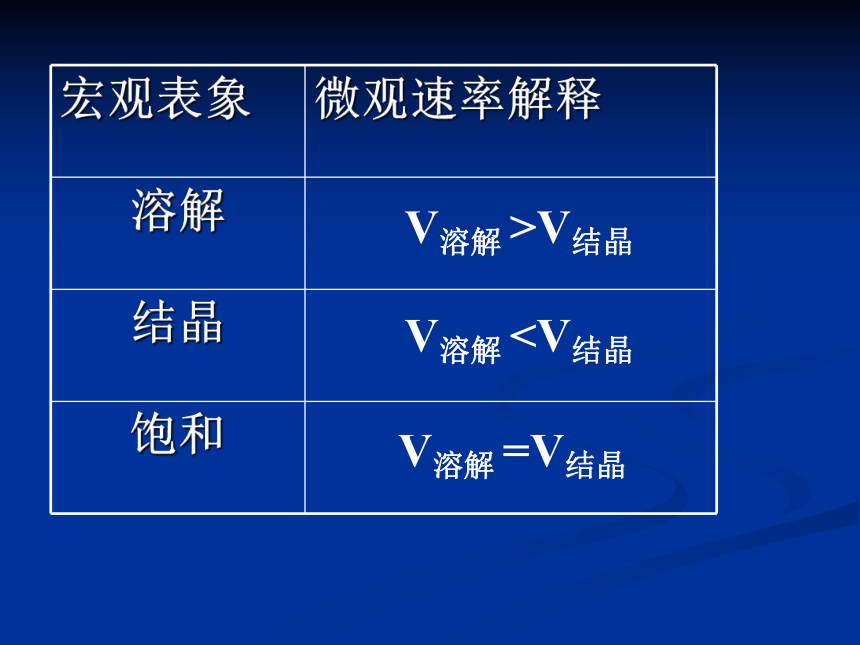
宏观表象
微观速率解释
溶解
结晶
饱和
V溶解 >V结晶
V溶解V溶解 =V结晶
可逆反应:
速率
含义
与浓度关系
V正
V逆
正反应:从左向右进行的反应。
逆反应:从右向左进行的反应。
单位时间反应物浓度的减少或生成物浓度的增加
单位时间反应物浓度的增加或生成物浓度的减少
决定于生成物浓度
决定于反应物浓度
在同一条件下向正反应方向进行的同时又向逆反应方向进行的反应.
用 表示。 例:
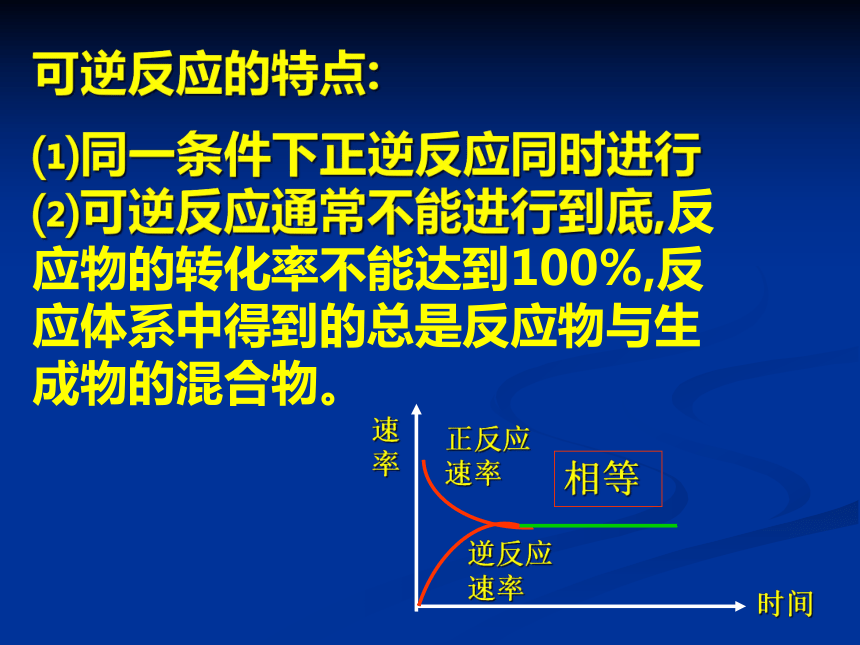
可逆反应的特点:
⑴同一条件下正逆反应同时进行
⑵可逆反应通常不能进行到底,反应物的转化率不能达到100%,反应体系中得到的总是反应物与生成物的混合物。
正反应速率
逆反应速率
相等
时间
速率
1、定义
化学平衡状态,就是指在一定条件下的可逆反应里,正反应速率和逆反应速率相等,反应混合物中各组分的浓度保持不变的状态。
注意三点
前提(适用范围):可逆反应
内在本质:v(正)= v(逆) ≠0
外在标志:反应混合物中各组分的浓度保持不变
思考与讨论:动态平衡有哪些特征?
特征:
1、正逆过程都在同时进行——“逆”
2、v(正)≠0,v(逆)≠0——“动”
3、v(正)= v(逆)——“等”
4、外界条件不发生变化,体系组分不发生
变化——“定”
5、外界条件变化,平衡将改变——“变”。
如何判断可逆反应达到平衡状态?
①速率:v正=v逆
(即任何一种物质的生成速率等于其消耗速率)
②各成分的含量保持不变
v正=v逆
1、同一物质
2、消耗=生成
含量保持不变:
1、物质的量
2、物质的量浓度
3、百分含量
1.在一定温度下,可逆反应A(气)+3B(气) 2C(气)达到平衡的标志是
A. C的生成速率与C分解的速率相等
B. 单位时间生成n molA,同时生成3n molB
C. 单位时间生成B的速率,与生成C的速率 相等 (数值)
D. 单位时间生成nmolA,同时生成2nmolC
AD
2.在500℃、钒触媒的作用下,某密闭容器中反应 2SO2 + O2 2SO3 △ H< 0 达到化学平衡状态时的标志是 ( )
A SO2的消耗速率等于SO3的生成速率
B SO2的生成速率等于SO3的生成速率
C SO2的消耗速率等于O2消耗速率的2倍
D SO3的生成速率等于O2生成速率的 2倍
BD
3.下列说法可以证明反应N2+3H2 2NH3 已达平衡状态的是( )
A.1个N≡N键断裂时,有3个H-H键形成
B.1个N≡N键断裂时,有3个H-H键断裂
C.1个N≡N键断裂时,有6个N-H键断裂
D.1个N≡N键断裂时,有6个N-H键形成
AC
4.下列说法中可以充分说明反应: P(气)+Q(气) R(气)+S(气),在恒温恒容下已达平衡状态的是
(A) P、Q、R、S的浓度不再变化
(B) P、Q、R、S的分子数比为1:1:1:1
(C)反应容器内总物质的量不随时间而变化
(D)混合气体的压强
(E)气体的平均分子量
(F)各组分的质量分数不再改变
(G)混合气体的密度
5.下列说法中可以充分说明反应:
A(固)+3B(气) 2C(气)+D(气) , 在恒温恒容下已达平衡状态的是( )
(A)混合气体的压强
(B)气体的平均分子量
(C)各组分的质量分数不再改变
(D)混合气体的密度
6.下列说法中可以充分说明反应: A(g)+3B(g) 2C(g)+D(g),在恒温恒容下已达平衡状态的是( )
(A)混合气体的压强
(B)气体的平均分子量
(C)各组分的质量分数不再改变
(D)混合气体的密度
7.下列说法中可以充分说明反应: A(g)+3B(g) 2C(g)+2D(g),在恒温恒容下已达平衡状态的是( )
(A)混合气体的压强
(B)气体的平均分子量
(C)各组分的质量分数不再改变
(D)混合气体的密度
化学平衡的影响因素
内因:反应本身
外因:浓度、压强、温度
速率?时间图像及应用(以可逆反应为例分析)
(1)改变反应物浓度
(2)改变生成物浓度
(3)改变气体体系的压强
①对于正反应方向气体体积增大的反应
②对于反应前后气体体积不变的反应
(4)改变温度
对于正反应放热的反应
(5)加催化剂
NaCl 的溶解平衡:
20℃时,将一块质量为40 g 的NaCl晶体投入到100 g 水中,充分搅拌,至固体不再溶解为止,静置.经过相当长的时间后,发现NaCl晶体质量不再发生变化,但NaCl晶体的形状在不断发生改变,为什么?
宏观表象
微观速率解释
溶解
结晶
饱和
V溶解 >V结晶
V溶解
可逆反应:
速率
含义
与浓度关系
V正
V逆
正反应:从左向右进行的反应。
逆反应:从右向左进行的反应。
单位时间反应物浓度的减少或生成物浓度的增加
单位时间反应物浓度的增加或生成物浓度的减少
决定于生成物浓度
决定于反应物浓度
在同一条件下向正反应方向进行的同时又向逆反应方向进行的反应.
用 表示。 例:
可逆反应的特点:
⑴同一条件下正逆反应同时进行
⑵可逆反应通常不能进行到底,反应物的转化率不能达到100%,反应体系中得到的总是反应物与生成物的混合物。
正反应速率
逆反应速率
相等
时间
速率
1、定义
化学平衡状态,就是指在一定条件下的可逆反应里,正反应速率和逆反应速率相等,反应混合物中各组分的浓度保持不变的状态。
注意三点
前提(适用范围):可逆反应
内在本质:v(正)= v(逆) ≠0
外在标志:反应混合物中各组分的浓度保持不变
思考与讨论:动态平衡有哪些特征?
特征:
1、正逆过程都在同时进行——“逆”
2、v(正)≠0,v(逆)≠0——“动”
3、v(正)= v(逆)——“等”
4、外界条件不发生变化,体系组分不发生
变化——“定”
5、外界条件变化,平衡将改变——“变”。
如何判断可逆反应达到平衡状态?
①速率:v正=v逆
(即任何一种物质的生成速率等于其消耗速率)
②各成分的含量保持不变
v正=v逆
1、同一物质
2、消耗=生成
含量保持不变:
1、物质的量
2、物质的量浓度
3、百分含量
1.在一定温度下,可逆反应A(气)+3B(气) 2C(气)达到平衡的标志是
A. C的生成速率与C分解的速率相等
B. 单位时间生成n molA,同时生成3n molB
C. 单位时间生成B的速率,与生成C的速率 相等 (数值)
D. 单位时间生成nmolA,同时生成2nmolC
AD
2.在500℃、钒触媒的作用下,某密闭容器中反应 2SO2 + O2 2SO3 △ H< 0 达到化学平衡状态时的标志是 ( )
A SO2的消耗速率等于SO3的生成速率
B SO2的生成速率等于SO3的生成速率
C SO2的消耗速率等于O2消耗速率的2倍
D SO3的生成速率等于O2生成速率的 2倍
BD
3.下列说法可以证明反应N2+3H2 2NH3 已达平衡状态的是( )
A.1个N≡N键断裂时,有3个H-H键形成
B.1个N≡N键断裂时,有3个H-H键断裂
C.1个N≡N键断裂时,有6个N-H键断裂
D.1个N≡N键断裂时,有6个N-H键形成
AC
4.下列说法中可以充分说明反应: P(气)+Q(气) R(气)+S(气),在恒温恒容下已达平衡状态的是
(A) P、Q、R、S的浓度不再变化
(B) P、Q、R、S的分子数比为1:1:1:1
(C)反应容器内总物质的量不随时间而变化
(D)混合气体的压强
(E)气体的平均分子量
(F)各组分的质量分数不再改变
(G)混合气体的密度
5.下列说法中可以充分说明反应:
A(固)+3B(气) 2C(气)+D(气) , 在恒温恒容下已达平衡状态的是( )
(A)混合气体的压强
(B)气体的平均分子量
(C)各组分的质量分数不再改变
(D)混合气体的密度
6.下列说法中可以充分说明反应: A(g)+3B(g) 2C(g)+D(g),在恒温恒容下已达平衡状态的是( )
(A)混合气体的压强
(B)气体的平均分子量
(C)各组分的质量分数不再改变
(D)混合气体的密度
7.下列说法中可以充分说明反应: A(g)+3B(g) 2C(g)+2D(g),在恒温恒容下已达平衡状态的是( )
(A)混合气体的压强
(B)气体的平均分子量
(C)各组分的质量分数不再改变
(D)混合气体的密度
化学平衡的影响因素
内因:反应本身
外因:浓度、压强、温度
速率?时间图像及应用(以可逆反应为例分析)
(1)改变反应物浓度
(2)改变生成物浓度
(3)改变气体体系的压强
①对于正反应方向气体体积增大的反应
②对于反应前后气体体积不变的反应
(4)改变温度
对于正反应放热的反应
(5)加催化剂
