2021届鲁教版中考化学大一轮单元总复习:第八单元 海水中的化学第二节 溶 解 度 (共25张PPT)
文档属性
| 名称 | 2021届鲁教版中考化学大一轮单元总复习:第八单元 海水中的化学第二节 溶 解 度 (共25张PPT) |  | |
| 格式 | ppt | ||
| 文件大小 | 1.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-11-02 10:42:26 | ||
图片预览






文档简介
第二节 溶 解 度
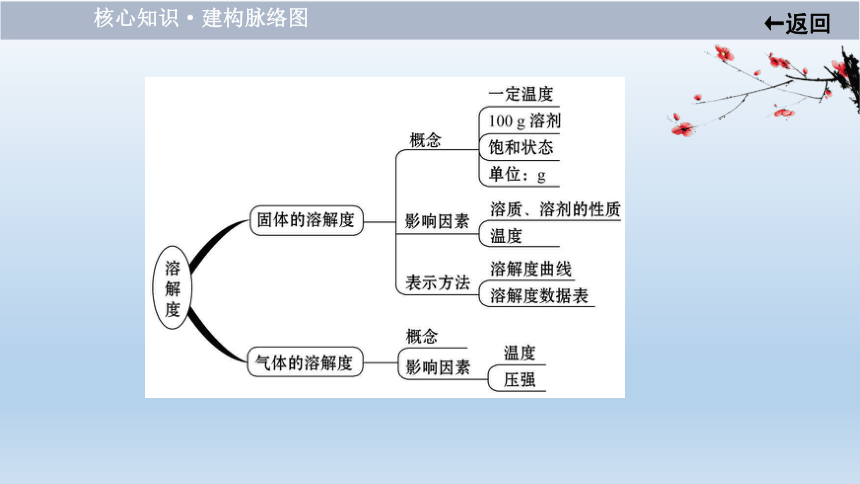
核心知识·建构脉络图
【主干回顾】
一、固体物质的溶解度
1.概念:在_______________,某固体物质在__________溶剂里达到_________
_____时所溶解的质量。?
【微点拨】 溶解度的概念要有四要素:温度、溶剂100 g、饱和状态、单位克,
四者缺一不可。
主干回顾·厚积知识力
一定温度下
100 g
饱和状
态
2.影响因素:
(1)内因:_______________的性质。?
(2)外因:_________。?
【微点拨】 一种固体在一种溶剂里的溶解度只与温度有关,与溶质和溶剂的
量无关。
溶质和溶剂
温度
3.溶解性与溶解度的关系:
4.溶解度曲线:
(1)概念:以纵坐标表示___________,横坐标表示_________,画出的表示物质溶
解度随温度变化的曲线。?
(2)规律。
a.大多数固体物质的溶解度随温度升高而_________,如硝酸钾;?
b.少数固体物质的溶解度受温度的影响_________,如___________;?
c.极少数固体物质的溶解度随温度的升高而_________,如___________。?
溶解度
温度
增大
很小
氯化钠
减小
熟石灰
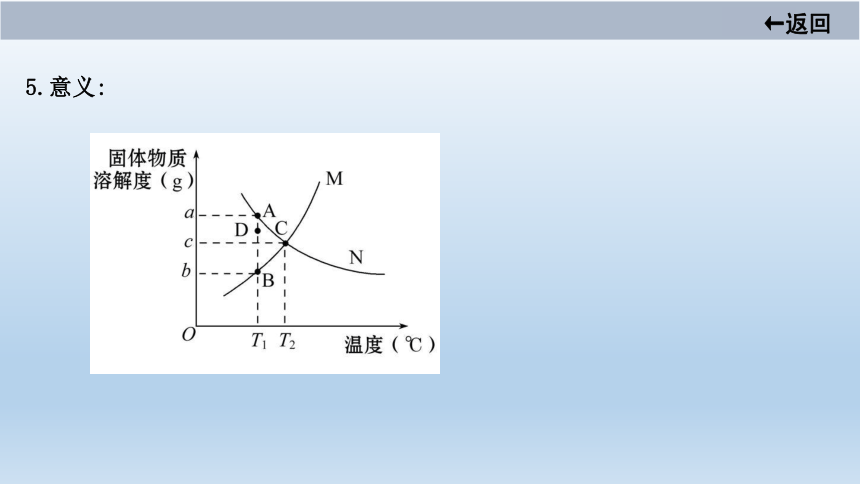
5.意义:
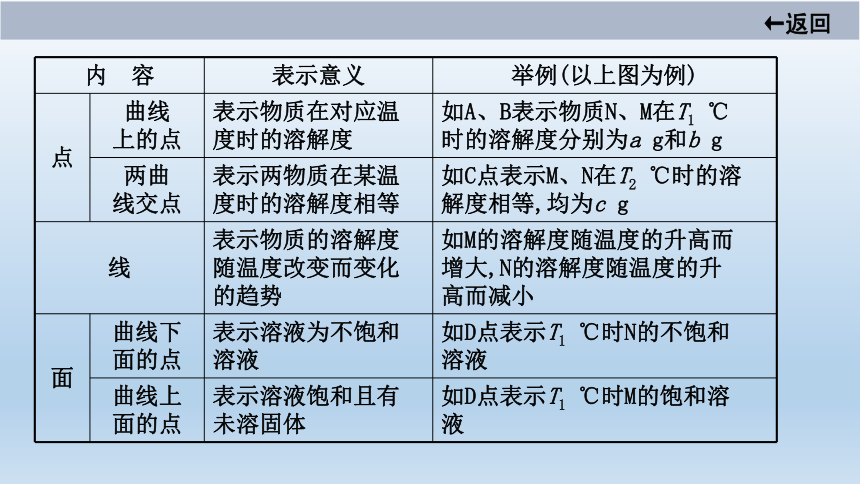
内 容
表示意义
举例(以上图为例)
点
曲线
上的点
表示物质在对应温
度时的溶解度
如A、B表示物质N、M在T1 ℃
时的溶解度分别为a g和b g
两曲
线交点
表示两物质在某温
度时的溶解度相等
如C点表示M、N在T2 ℃时的溶
解度相等,均为c g
线
表示物质的溶解度
随温度改变而变化
的趋势
如M的溶解度随温度的升高而
增大,N的溶解度随温度的升
高而减小
面
曲线下
面的点
表示溶液为不饱和
溶液
如D点表示T1 ℃时N的不饱和
溶液
曲线上
面的点
表示溶液饱和且有
未溶固体
如D点表示T1 ℃时M的饱和溶
液
6.应用:
(1)判断某种物质在不同温度下的溶解度大小;
(2)比较不同物质在同一温度下的溶解度大小;
(3)判断物质的溶解度受温度影响的变化趋势;
(4)确定不饱和溶液和饱和溶液相互转化的方法;
(5)确定结晶的方法。
①陡升型:从溶液中析出该物质时,可采取降温结晶的方法,并可采取降温的方法,使该物质的不饱和溶液变为饱和溶液。
②缓升型:从溶液中析出该物质时,可采取蒸发结晶的方法,并可采取蒸发溶剂的方法,使该物质的不饱和溶液变为饱和溶液。
③下降型:从溶液中析出该物质时,可采用升温结晶的方法,并可通过升温的方法,使该物质的不饱和溶液变为饱和溶液。
④陡升和缓升混合型:物质中混有少量缓升型的物质时,可采用降温结晶的方法进行提纯;缓升型的物质中含有少量陡升型物质时,可采用蒸发结晶的方法进行提纯。
二、气体的溶解度
溶解度
概念
_____________、_____________下____________中最多溶
解_________________。?
影响
因素
(1)内部因素:气体本身的性质和溶剂的种类。
(2)外界因素:
①压强:压强越大,气体溶解度_________;?
②温度:温度越高,气体溶解度_________。?
一定压强
一定温度
1体积水
气体的体积数
越大
越小
【自我测评】
1.(2020·淄博沂源期中)下列对“20 ℃时KNO3的溶解度为31.6 g”的解释正
确的是 ( )
A.20 ℃时,31.6 g KNO3溶解在水中
B.20 ℃时,100 g溶液中含有31.6 g KNO3
C.31.6 g KNO3溶解在100 g水中达到饱和状态
D.20 ℃时,31.6 g KNO3溶解在100 g水中达到饱和状态
D
2.(2020·牡丹江中考)固体硝酸钾的溶解度曲线如图所示,下列说法正确的是
( )
A.70 ℃时,硝酸钾的溶解度为114
B.70 ℃时,C点为硝酸钾的不饱和溶液
C.70 ℃时,B点为硝酸钾的饱和溶液
D.A、C两点对应溶液的溶质质量分数相同
D
3.(2020·济南历下区模拟)把一定质量的30%的某溶液加热蒸发10 g水,冷却
至20 ℃时有2 g晶体析出,此时溶液的溶质质量分数为40%,则该物质在20 ℃
时的溶解度为 ( )
A.20 g B.33.3 g C.40 g D.66.7 g
D
4.(2019·德州中考)如图是X、Y两种固体物质的溶解度曲线。下列叙述正确
的是 ( )
A.温度低于t2 ℃时,物质Y的溶解度小于X
B.X、Y的溶解度都随温度升高而增大
C.a点表示t1 ℃时X、Y的溶液都不饱和
D.Y的饱和溶液降低温度后,溶质质量分数不变
D
5.(2020·福建中考)NaCl和KNO3在不同温度时的溶解度如下表。下列说法错
误的是 世纪金榜导学号( )
A.20 ℃时,100 g H2O最多能溶解36.0 g NaCl
B.40 ℃时,KNO3饱和溶液的溶质质量分数小于63.9%
C.可用冷却海水的方法获取大量食盐
D.其他条件不变,升温可将KNO3饱和溶液变为不饱和溶液
温度/℃
0
20
40
60
NaCl的溶解度/g
35.7
36.0
36.6
37.3
KNO3的溶解度/g
13.3
31.6
63.9
110
C
6.(2020·烟台模拟)如图为KNO3的溶解度曲线,a、b在溶解度曲线上。 世纪金榜导学号
(1)a点对应的溶液是_________溶液。(填“饱和”或“不饱和”)?
(2)a点对应的溶液的质量分数是___________________。(只列计算式)?
(3)将a点对应的溶液升温到70 ℃,其质量分数_________。(填写“变大”“变
小”或“不变”)?
(4)欲使KNO3溶液的状态从b点转化为c点,可采取的措施是_________。?
不变
加水
饱和
考点研磨·提升审题力
命题点 溶解度及溶解度曲线
【典例】(2020·巴中中考)图中是a、b、c三种物质的溶解度曲线,回答下列问题。 世纪金榜导学号
(1)P点的含义:_______________________________________。?
(2)在t3 ℃时,将120 g a物质加入200 g水中,充分溶解后所得到的溶液质量为
________g。?
(3)b中混有少量a,提纯b的方法是_____________(选填“蒸发结晶"或“降温结
晶”)。?
(4)分别将t3 ℃时a、b的饱和溶液降温到t2 ℃析出晶体的质量大小关系为
_______(选填一个序号)。?
①a>b ②a t1 ℃时,a、c物质溶解度相等,均为20 g
300
蒸发结晶
④
【方法点拨】解答有关溶解度曲线的题目时,应围绕以下几点思考:
(1)明确溶解度曲线中点、线、面的意义。
(2)知道各种类型的溶解度曲线分离和提纯的方法。
①对于溶解度曲线为“陡升型”的物质,降温时可以得到晶体或使不饱和溶液变为饱和溶液。
②对于溶解度曲线为“缓升型”的物质,可以用蒸发溶剂的方法获得晶体。
③对于溶解度曲线为“下降型”的物质,升温可获得晶体或使不饱和溶液变为饱和溶液。
【题组过关】
1.(2020·荆门中考)甲、乙两种物质溶解度曲线如图所示。下列叙述不正确
的是 ( )
A.t3 ℃时,在100 g水中加入20 g甲,形成不饱和溶液
B.t2 ℃时甲、乙溶解度相同
C.甲、乙饱和溶液由t3 ℃降至t1 ℃,甲质量分数下降,
乙质量分数升高
D.乙溶解度随温度的升高而降低
C
2.(2020·营口中考)如图是A、B、C三种固体物质的溶解度曲线,请回答下列问题:
(1)t2 ℃时,A物质的溶解度为_________。?
(2)_________(填“t1 ℃”或“t2 ℃”)时,A、C两物质的溶解度相等。?
(3)t2 ℃时,将30 g A物质放入50 g水中充分溶解,所得溶液是_____________
(填“饱和溶液”或“不饱和溶液”)。?
(4)t2 ℃时,将A、B、C三种物质的饱和溶液分别降温到t1 ℃,此时所得溶液中
溶质的质量分数由大到小的顺序为_______________。?
40 g
t1 ℃
饱和溶液
B>A>C(BAC)
本课结束
核心知识·建构脉络图
【主干回顾】
一、固体物质的溶解度
1.概念:在_______________,某固体物质在__________溶剂里达到_________
_____时所溶解的质量。?
【微点拨】 溶解度的概念要有四要素:温度、溶剂100 g、饱和状态、单位克,
四者缺一不可。
主干回顾·厚积知识力
一定温度下
100 g
饱和状
态
2.影响因素:
(1)内因:_______________的性质。?
(2)外因:_________。?
【微点拨】 一种固体在一种溶剂里的溶解度只与温度有关,与溶质和溶剂的
量无关。
溶质和溶剂
温度
3.溶解性与溶解度的关系:
4.溶解度曲线:
(1)概念:以纵坐标表示___________,横坐标表示_________,画出的表示物质溶
解度随温度变化的曲线。?
(2)规律。
a.大多数固体物质的溶解度随温度升高而_________,如硝酸钾;?
b.少数固体物质的溶解度受温度的影响_________,如___________;?
c.极少数固体物质的溶解度随温度的升高而_________,如___________。?
溶解度
温度
增大
很小
氯化钠
减小
熟石灰
5.意义:
内 容
表示意义
举例(以上图为例)
点
曲线
上的点
表示物质在对应温
度时的溶解度
如A、B表示物质N、M在T1 ℃
时的溶解度分别为a g和b g
两曲
线交点
表示两物质在某温
度时的溶解度相等
如C点表示M、N在T2 ℃时的溶
解度相等,均为c g
线
表示物质的溶解度
随温度改变而变化
的趋势
如M的溶解度随温度的升高而
增大,N的溶解度随温度的升
高而减小
面
曲线下
面的点
表示溶液为不饱和
溶液
如D点表示T1 ℃时N的不饱和
溶液
曲线上
面的点
表示溶液饱和且有
未溶固体
如D点表示T1 ℃时M的饱和溶
液
6.应用:
(1)判断某种物质在不同温度下的溶解度大小;
(2)比较不同物质在同一温度下的溶解度大小;
(3)判断物质的溶解度受温度影响的变化趋势;
(4)确定不饱和溶液和饱和溶液相互转化的方法;
(5)确定结晶的方法。
①陡升型:从溶液中析出该物质时,可采取降温结晶的方法,并可采取降温的方法,使该物质的不饱和溶液变为饱和溶液。
②缓升型:从溶液中析出该物质时,可采取蒸发结晶的方法,并可采取蒸发溶剂的方法,使该物质的不饱和溶液变为饱和溶液。
③下降型:从溶液中析出该物质时,可采用升温结晶的方法,并可通过升温的方法,使该物质的不饱和溶液变为饱和溶液。
④陡升和缓升混合型:物质中混有少量缓升型的物质时,可采用降温结晶的方法进行提纯;缓升型的物质中含有少量陡升型物质时,可采用蒸发结晶的方法进行提纯。
二、气体的溶解度
溶解度
概念
_____________、_____________下____________中最多溶
解_________________。?
影响
因素
(1)内部因素:气体本身的性质和溶剂的种类。
(2)外界因素:
①压强:压强越大,气体溶解度_________;?
②温度:温度越高,气体溶解度_________。?
一定压强
一定温度
1体积水
气体的体积数
越大
越小
【自我测评】
1.(2020·淄博沂源期中)下列对“20 ℃时KNO3的溶解度为31.6 g”的解释正
确的是 ( )
A.20 ℃时,31.6 g KNO3溶解在水中
B.20 ℃时,100 g溶液中含有31.6 g KNO3
C.31.6 g KNO3溶解在100 g水中达到饱和状态
D.20 ℃时,31.6 g KNO3溶解在100 g水中达到饱和状态
D
2.(2020·牡丹江中考)固体硝酸钾的溶解度曲线如图所示,下列说法正确的是
( )
A.70 ℃时,硝酸钾的溶解度为114
B.70 ℃时,C点为硝酸钾的不饱和溶液
C.70 ℃时,B点为硝酸钾的饱和溶液
D.A、C两点对应溶液的溶质质量分数相同
D
3.(2020·济南历下区模拟)把一定质量的30%的某溶液加热蒸发10 g水,冷却
至20 ℃时有2 g晶体析出,此时溶液的溶质质量分数为40%,则该物质在20 ℃
时的溶解度为 ( )
A.20 g B.33.3 g C.40 g D.66.7 g
D
4.(2019·德州中考)如图是X、Y两种固体物质的溶解度曲线。下列叙述正确
的是 ( )
A.温度低于t2 ℃时,物质Y的溶解度小于X
B.X、Y的溶解度都随温度升高而增大
C.a点表示t1 ℃时X、Y的溶液都不饱和
D.Y的饱和溶液降低温度后,溶质质量分数不变
D
5.(2020·福建中考)NaCl和KNO3在不同温度时的溶解度如下表。下列说法错
误的是 世纪金榜导学号( )
A.20 ℃时,100 g H2O最多能溶解36.0 g NaCl
B.40 ℃时,KNO3饱和溶液的溶质质量分数小于63.9%
C.可用冷却海水的方法获取大量食盐
D.其他条件不变,升温可将KNO3饱和溶液变为不饱和溶液
温度/℃
0
20
40
60
NaCl的溶解度/g
35.7
36.0
36.6
37.3
KNO3的溶解度/g
13.3
31.6
63.9
110
C
6.(2020·烟台模拟)如图为KNO3的溶解度曲线,a、b在溶解度曲线上。 世纪金榜导学号
(1)a点对应的溶液是_________溶液。(填“饱和”或“不饱和”)?
(2)a点对应的溶液的质量分数是___________________。(只列计算式)?
(3)将a点对应的溶液升温到70 ℃,其质量分数_________。(填写“变大”“变
小”或“不变”)?
(4)欲使KNO3溶液的状态从b点转化为c点,可采取的措施是_________。?
不变
加水
饱和
考点研磨·提升审题力
命题点 溶解度及溶解度曲线
【典例】(2020·巴中中考)图中是a、b、c三种物质的溶解度曲线,回答下列问题。 世纪金榜导学号
(1)P点的含义:_______________________________________。?
(2)在t3 ℃时,将120 g a物质加入200 g水中,充分溶解后所得到的溶液质量为
________g。?
(3)b中混有少量a,提纯b的方法是_____________(选填“蒸发结晶"或“降温结
晶”)。?
(4)分别将t3 ℃时a、b的饱和溶液降温到t2 ℃析出晶体的质量大小关系为
_______(选填一个序号)。?
①a>b ②a
300
蒸发结晶
④
【方法点拨】解答有关溶解度曲线的题目时,应围绕以下几点思考:
(1)明确溶解度曲线中点、线、面的意义。
(2)知道各种类型的溶解度曲线分离和提纯的方法。
①对于溶解度曲线为“陡升型”的物质,降温时可以得到晶体或使不饱和溶液变为饱和溶液。
②对于溶解度曲线为“缓升型”的物质,可以用蒸发溶剂的方法获得晶体。
③对于溶解度曲线为“下降型”的物质,升温可获得晶体或使不饱和溶液变为饱和溶液。
【题组过关】
1.(2020·荆门中考)甲、乙两种物质溶解度曲线如图所示。下列叙述不正确
的是 ( )
A.t3 ℃时,在100 g水中加入20 g甲,形成不饱和溶液
B.t2 ℃时甲、乙溶解度相同
C.甲、乙饱和溶液由t3 ℃降至t1 ℃,甲质量分数下降,
乙质量分数升高
D.乙溶解度随温度的升高而降低
C
2.(2020·营口中考)如图是A、B、C三种固体物质的溶解度曲线,请回答下列问题:
(1)t2 ℃时,A物质的溶解度为_________。?
(2)_________(填“t1 ℃”或“t2 ℃”)时,A、C两物质的溶解度相等。?
(3)t2 ℃时,将30 g A物质放入50 g水中充分溶解,所得溶液是_____________
(填“饱和溶液”或“不饱和溶液”)。?
(4)t2 ℃时,将A、B、C三种物质的饱和溶液分别降温到t1 ℃,此时所得溶液中
溶质的质量分数由大到小的顺序为_______________。?
40 g
t1 ℃
饱和溶液
B>A>C(BAC)
本课结束
同课章节目录
- 第七单元 常见的酸和碱
- 第一节 酸及其性质
- 第二节 碱及其性质
- 第三节 溶液的酸碱性
- 第四节 酸碱中和反应
- 到实验室去:探究酸和碱的化学性质
- 第八单元 海水中的化学
- 第一节 海洋化学资源
- 第二节 海水“晒盐“
- 第三节 海水“制碱“
- 到实验室去:粗盐中难溶性杂质的去除
- 第九单元 金属
- 第一节 常见的金属材料
- 第二节 金属的化学性质
- 第三节 钢铁的锈蚀与防护
- 到实验室去 探究金属的性质
- 第十单元 化学与健康
- 第一节 食物中的有机物
- 第二节 化学元素与人体健康
- 第三节 远离有毒物质
- 第十一单元 化学与社会发展
- 第一节 化学与能源开发
- 第二节 化学与材料研制
- 第三节 化学与农业生产
- 第四节 化学与环境保护
