2021届鲁教版中考化学大一轮单元总复习:第七单元 常见的酸和碱第一节 酸 和 碱(共63张PPT)
文档属性
| 名称 | 2021届鲁教版中考化学大一轮单元总复习:第七单元 常见的酸和碱第一节 酸 和 碱(共63张PPT) |  | |
| 格式 | ppt | ||
| 文件大小 | 1.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-11-02 10:44:52 | ||
图片预览








文档简介
第七单元 常见的酸和碱
第一节 酸 和 碱
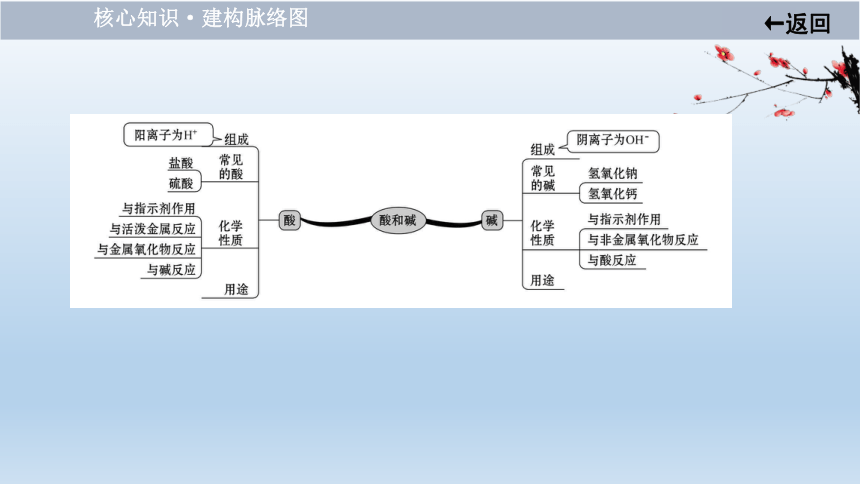
核心知识·建构脉络图
【主干回顾】
一、常见的酸
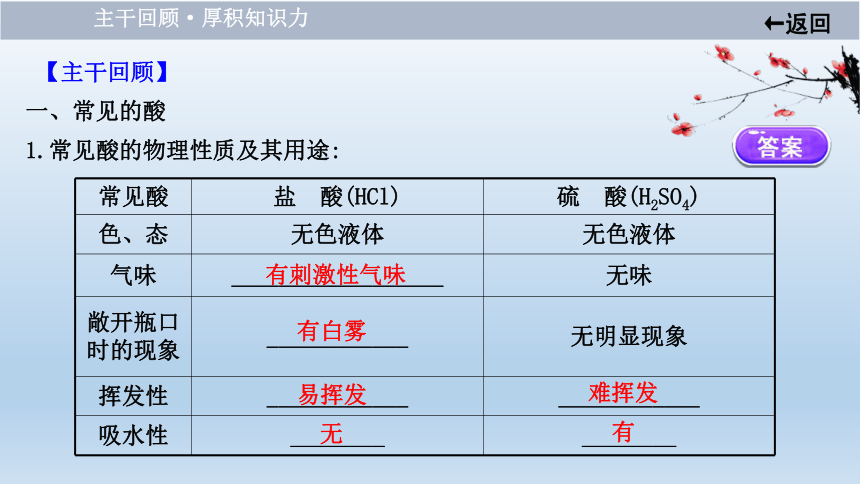
1.常见酸的物理性质及其用途:
主干回顾·厚积知识力
常见酸
盐 酸(HCl)
硫 酸(H2SO4)
色、态
无色液体
无色液体
气味
__________________
无味
敞开瓶口时的现象
____________
无明显现象
挥发性
____________
____________
吸水性
________
________
有刺激性气味 ?
有白雾 ?
易挥发 ?
无 ?
难挥发 ?
有 ?
常见酸
盐 酸(HCl)
硫 酸(H2SO4)
用途
金属除锈、制造药物、胃液中的盐酸帮助消化等
用于化工原料、精炼石油、金属除锈、冶炼金属、作干燥剂等
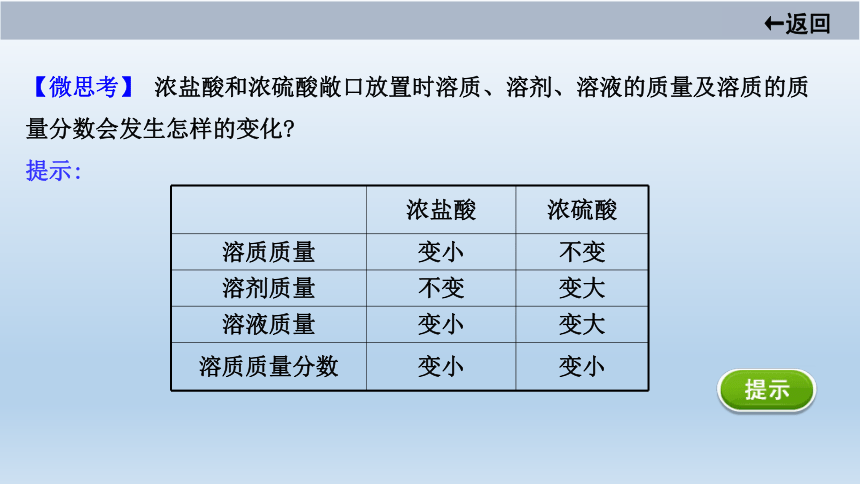
【微思考】 浓盐酸和浓硫酸敞口放置时溶质、溶剂、溶液的质量及溶质的质
量分数会发生怎样的变化?
提示:
浓盐酸
浓硫酸
溶质质量
变小
不变
溶剂质量
不变
变大
溶液质量
变小
变大
溶质质量分数
变小
变小
2.浓硫酸的特性:
吸水性
浓硫酸具有很强的吸水性,因此可
用作___________,常用来干燥O2、H2、CO2、CO等气体,不能用来干燥
碱性气体,如________
属于_____
性质
腐蚀性
(脱水性)
浓硫酸具有强烈的腐蚀性,能够夺
取纸张、木材、布料、皮肤里的
_________,生成黑色的炭?
属于_____
性质
干燥剂
NH3 ?
水分
物理
化学
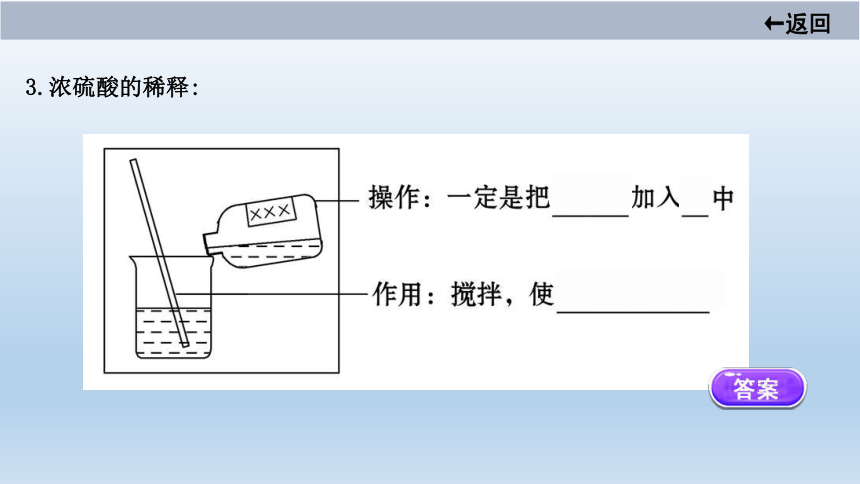
3.浓硫酸的稀释:
【微点拨】 如果不慎将浓硫酸沾到皮肤或衣服上,应立即用大量水冲洗,然后再涂上3%~5%的碳酸氢钠溶液。
4.酸的化学性质:
化学性质
现象(或化学方程式)
与指示剂作用
酸溶液能使紫色石蕊溶液变_______色,无色的酚酞遇酸
_________色?
酸与活泼金属反应
2HCl+Fe====____________
H2SO4+Zn====_______________
红
不变
FeCl2+H2↑
ZnSO4+H2↑ ?
化学性质
现象(或化学方程式)
酸与某些金属氧化物反应
2HCl+CuO====_____________
3H2SO4+Fe2O3====__________________
酸与碱
反应
2HCl+Ca(OH)2====____________
____________________________
酸与某些盐反应
2HCl+Na2CO3====_________________
HCl+AgNO3====________________
H2SO4+BaCl2====_________________
CuCl2+H2O ?
Fe2(SO4)3+3H2O ?
CaCl2+2H2O
H2SO4+2NaOH==== Na2SO4+2H2O ?
2NaCl+H2O+CO2↑
AgCl↓+HNO3 ?
2HCl+BaSO4↓ ?
【微点拨】 稀盐酸(稀硫酸)与铁反应生成氯化亚铁(硫酸亚铁),溶液为浅绿色,和氧化铁反应生成氯化铁(硫酸铁),溶液为棕黄色。
二、常见的碱
1.常见碱的物理性质和用途及制法:
氢氧化钠
氢氧化钙
俗称
烧碱、火碱、苛性钠
熟石灰、消石灰
物理性质
色、态
_____________
_______________
溶解性
_________溶于水,并放出大
量的热?
_______溶于水,溶
解度随温度升高而
_________
吸水性
易吸收水分而_________
腐蚀性
有强腐蚀性
有较强腐蚀性
白色固体 ?
白色粉末状固体?
极易
微
降低 ?
潮解 ?
氢氧化钠
氢氧化钙
制法(写化
学方程式)
____________________
________________
____________
_______
用途
作气体干燥剂、去除油污
作建筑材料、改良酸性土壤
Ca(OH)2+Na2CO3====
CaCO3↓+2NaOH ?
CaO+H2O ====
Ca(OH)2
【微点拨】 (1)氢氧化钠有强烈的腐蚀性,如果不慎沾到皮肤上,要用大量的水冲洗,再涂上硼酸溶液。
(2)氢氧化钠可以用来干燥H2、O2等气体,不能干燥CO2、SO2等酸性气体。
2.碱的化学性质:
化学
性质
现象(或化学方程式)
备注
与指示剂作用
氢氧化钠和氢氧化钙都可以使紫色石蕊溶液变_______,使无色酚酞溶液变________
与某些非金属氧化物反应
CO2+Ca(OH)2====
________________
检验二氧化碳的方法
CO2+2NaOH====_______________
氢氧化钠变质的原因
蓝
红 ?
CaCO3↓+H2O ?
Na2CO3+H2O ?
化学
性质
现象(或化学方程式)
备注
与酸反应
H2SO4+Ca(OH)2====__________
中和反应
与部分盐反应
2NaOH+CuSO4====
________________
Ca(OH)2+Na2CO3====
_______________
碱与盐都溶于水
CaSO4+2H2O
Cu(OH)2↓+Na2SO4
2NaOH+CaCO3↓
【微思考】 实验室常用澄清石灰水来检验CO2气体,常用氢氧化钠溶液来吸
收CO2的原因是什么?
提示:因为二氧化碳能使澄清石灰水变浑浊,有明显的现象,便于观察;氢氧
化钠易溶于水,可以充分地反应,更完全地吸收二氧化碳。 ?
【核心反应】
1.盐酸(HCl)和硫酸(H2SO4)的化学性质
①________________________、?
_________________________
②________________________、?
_________________________
③________________________、?
_________________________
④___________________________、?
_________________________________
Zn+2HCl====ZnCl2+H2↑
Zn+H2SO4====ZnSO4+H2↑ ?
Fe+2HCl====FeCl2+H2↑
Fe+H2SO4====FeSO4+H2↑ ?
CuO+2HCl====CuCl2+H2O
CuO+H2SO4====CuSO4+H2O ?
Fe2O3+6HCl====2FeCl3+3H2O
Fe2O3 +3H2SO4====Fe2(SO4)3+3H2O ?
⑤____________________________
⑥__________________________________
_________________________________
⑦___________________________________
__________________________________
⑧___________________________________
HCl+AgNO3====AgCl↓+HNO3 ?
CaCO3+2HCl====CaCl2+H2O+CO2↑ 、?
CaCO3+H2SO4====CaSO4+H2O+CO2↑ ?
Na2CO3+2HCl====2NaCl+H2O+CO2↑ 、?
Na2CO3+H2SO4====Na2SO4+H2O+CO2↑ ?
H2SO4+Ba(NO3)2====BaSO4 ↓+2HNO3 ?
⑨__________________________
_____________________________
⑩________________________________
______________________________
_______________________________
HCl+NaOH====NaCl+H2O 、?
H2SO4+2NaOH====Na2SO4+2H2O ?
2HCl+Ca(OH)2====CaCl2+2H2O 、?
H2SO4+Ca(OH)2====CaSO4+2H2O ?
H2SO4+BaCl2====BaSO4 ↓+2HCl ?
2.氢氧化钠(NaOH)和氢氧化钙[Ca(OH)2]的化学性质
①__________________________、?
______________________________
②__________________________________、?
____________________________________
③__________________________________、?
________________________________________
2NaOH+CO2====Na2CO3+H2O
Ca(OH)2+CO2====CaCO3↓+H2O ?
2NaOH+CuSO4====Cu(OH)2↓+Na2SO4
Ca(OH)2+CuSO4====Cu(OH)2↓+CaSO4 ?
3NaOH+FeCl3====Fe(OH)3↓+3NaCl
3Ca(OH)2+2FeCl3====2Fe(OH)3↓+3CaCl2 ?
④__________________________________、?
____________________________________
⑤___________________________________
⑥________________________、?
_______________________________
⑦_____________________________、?
_______________________________
2NaOH+MgCl2====Mg(OH)2↓+2NaCl
Ca(OH)2+MgCl2====Mg(OH)2↓+CaCl2 ?
Ca(OH)2+Na2CO3====CaCO3↓+2NaOH ?
HCl+NaOH====NaCl+H2O
2HCl+Ca(OH)2====CaCl2+2H2O ?
H2SO4+2NaOH====Na2SO4+2H2O
H2SO4+Ca(OH)2====CaSO4+2H2O ?
【自我测评】
1.下列物质存放在烧杯中一段时间后,质量变小且不变质的是( )
A.烧碱 B.浓硫酸
C.浓盐酸 D.生石灰
2.(2020·泸州中考)下列物质不能与NaOH溶液反应的是 ( )
A.二氧化碳 B.硝酸
C.硫酸铜 D.氢氧化铁
C
D
3.(2020·郴州中考)下列物质溶于水因发生化学反应放出热量的是 ( )
A.NaOH B.NH4NO3
C.NaCl D.CaO
4.李伟同学在探究稀盐酸的化学性质时,用稀盐酸分别和下列物质反应,能得到
无色溶液的是 ( )
A.Fe2O3 B.Fe
C.Zn D.Cu(OH)2
D
C
5.(2020·济宁嘉祥模拟)小王同学往厨房的纯碱中滴加白醋,发现有气体生成。
已知白醋里含3%~5%的醋酸(CH3COOH),醋酸与盐酸的化学性质相似,下列
说法不正确的是 ( )
A.白醋里含有氢离子
B.生成的气体是二氧化碳
C.白醋能使紫色石蕊溶液变红
D.白醋与纯碱的反应属于中和反应
D
6.(2020·泰安岱岳区模拟)下列关于H2SO4性质描述中,不属于酸的通性的
是( )
A.使紫色石蕊溶液变红
B.与NaOH发生中和反应
C.浓硫酸滴到白纸上使纸变黑
D.与Mg反应放出氢气
C
7.以下是我们所学的部分化学物质,它们与生产、生活息息相关。
①自然界中最坚硬的物质名称是___________;干冰的化学式是_______;二氧
化碳灭火是利用了二氧化碳_____________________________________的性
质。?
②写出图中Ⅰ的化学方程式_____________________。氧化钙俗称_______。
Ⅱ的转化过程中_________(选填“放出”或“吸收”)热量。属于物理
变化的过程是_______(选填“Ⅰ”“Ⅱ”“Ⅲ”或“Ⅳ”)。?
金刚石
CO2
不燃烧、不支持燃烧、密度比空气大
CaCO3 CaO+CO2↑
生石灰
放出
Ⅲ
高温
====
8.实验室的许多化学药品需要密封保存。
(1)打开盛放浓盐酸的试剂瓶瓶塞,观察到的现象为_____________________。?
(2)氢氧化钙溶液敞口放置,表面会出现一层白膜,请用化学方程式解释出现这
一现象的原因____________________________。?
瓶口上方出现白雾
Ca(OH)2+CO2 ==== CaCO3↓+H2O
9.(2020·聊城冠县模拟)某实验小组在探究碱的化学性质实验时,用到了氢氧
化钠溶液和氢氧化钙溶液。 世纪金榜导学号
(1)甲同学不小心将这两种溶液混合在一起,结果产生_____________________
的现象,说明氢氧化钠溶液变质了。写出变质时发生反应的化学方程式 ________________________。?
白色沉淀(或白色浑浊)
2NaOH+CO2====Na2CO3+H2O
(2)同学们对变质的氢氧化钠溶液中溶质的成分产生了兴趣,进行如下探究:
【提出问题】变质的氢氧化钠溶液中溶质的成分是什么?
【做出猜想】猜想一:Na2CO3
猜想二:________________(写化学式)?
【进行讨论】甲同学取少量待测液加入足量的稀盐酸,有气泡产生。认为猜想
一成立。乙同学不同意甲同学的观点,理由是____________________________
_______________________。?
Na2CO3和NaOH
猜想二中也含有碳酸钠,加入足
量的盐酸也能产生气泡
【设计实验】请你验证猜想二成立,并完成实验报告。
【反思评价】在实验室中,氢氧化钠应_________保存。?
实验操作
实验现象
实验
结论
①取一定量的待测液于试管中,加入_____________________________
______________________________
__________________________
________________溶液。?
_____________
____________
______ ?
猜想二
成立
②充分反应后静置,取上层清液加入无色酚酞溶液
_____________
_____ ?
过量的氯化钙(或足量的氯化钙;
过量或足量的氯化钡,过量或足量
的硝酸钙等可溶性钙盐或钡盐,
答化学式也可)
产生白色沉淀
(或产生白色
浑浊)
无色酚酞溶液
变红
密封
【命题点一】 酸的化学性质
【典例1】(2020·铁岭中考)在学习了酸的化学性质之后,某实验小组选用稀盐酸做了如下图所示实验。
考点研磨·提升审题力
请回答下列问题:
(1)A烧杯中,铜不与稀盐酸发生反应的原因是___________________________
___________。?
(2)能产生气泡的是_______(填字母序号)。?
(3)写出C烧杯中反应的化学方程式____________________________。?
在金属活动性顺序表中铜排在
氢的后面
BE
Fe2O3+6HCl====2FeCl3+3H2O
(4)D烧杯中,溶液由红色变为_______色,说明盐酸与氢氧化钠发生了反应。?
同学们进一步对D烧杯中反应后的溶液进行探究,对其溶质的成分(除酚酞外)
做出如下猜想。猜想一:只含有一种溶质;猜想二:含有两种溶质。为了验证上
述猜想,进行如下实验,请完成下列表格。
实验操作
测定结果
得出结论
用玻璃棒蘸取D烧杯中反应后的溶液,滴在pH试纸上,与标准比色卡比较
pH<7
猜想_______正确,溶液
中的溶质是_________
___________________
______。?
无
二
NaCl、
HCl(或氯化钠、氯化
氢)
小组同学选用稀硫酸代替稀盐酸重复实验,证明了硫酸与盐酸具有相似的化
学性质。酸有一些相似的化学性质,是因为在不同的酸溶液中都含有相同的
________________。?
H+(或氢离子)
【方法点拨】形象记忆酸的化学性质
酸的化学性质一共有五条,可放在一个手掌中,每一个指头代表一条性质。
从中还可以看出,酸的五条性质中生成盐的有四条。
【题组过关】
1.(2020·遵义中考)醋酸(CH3COOH)是食醋的成分之一,其水溶液中存在H+和
CH3COO-。下列说法正确的是 ( )
A.醋酸属于氧化物
B.醋酸不能用于除铁锈
C.醋酸能与镁反应产生氢气
D.醋酸中碳元素的质量分数最大
C
2.(2020·烟台招远模拟)小明同学归纳总结了初中所学稀硫酸的化学性质,并
用“H2SO4+X→盐+Y”这种表达式进行整理。下列小明的观点错误的是 ( )
选项
X的物质类别
观点描述
A
金属
若X为Cu,则反应能够发生
B
金属氧化物
若X为MgO,则Y为H2O
C
碱
若X为NaOH,则盐为Na2SO4
D
盐
若X为BaCl2 ,则生成白色沉淀
A
3.(2020·枣庄山亭区模拟)如图是包含物质A、B、C、D和盐酸卡片的“化学拼图”,相邻两张卡片所标的物质(或其溶液)间能发生反应。
(1)A不可能是______(填标号)。?
a.Mg b.Fe c.Ag d.Zn
(2)若B为铁锈的主要成分Fe2O3,B与盐酸反应的化学方程式为 __________________________。?
c
Fe2O3+6HCl====2FeCl3+3H2O
(3)若C为碳酸钠
①C与D的反应属于_______________(填基本反应类型)。?
②D与盐酸反应的化学方程式为___________________________
_______________________________(写一个)。?
③将二氧化碳通入C溶液,可化合生成碳酸氢钠(NaHCO3),该反应的反应物
有______种。?
复分解反应
2HCl+Ca(OH)2====CaCl2+2H2O
(或2HCl+Ba(OH)2====BaCl2+2H2O)
3
4.(2020·北京中考)补全实验报告。
装置及操作
现象
解释或结论
(1)向1中滴加 ____________
______________
______溶液?
铁片上附着红色固体,溶液颜色变浅
Fe的金属活动性比Cu的强
(2)向2中滴加盐酸
固体减少,得到黄色溶液
化学方程式: ______________
____________ ?
(3)向3中滴加足量盐酸
_____________
_______
Ca(OH)2能与盐酸反应
CuSO4或CuCl2
(其他答案合理
也可)
Fe2O3+6HCl====
2FeCl3+3H2O
溶液由红色变
为无色
【命题点二】 碱的化学性质
【典例2】(2020·潍坊中考)某同学总结的Ca(OH)2的化学性质如图。下列说
法错误的是 ( )
A.甲一定是碳酸盐
B.反应②为放热反应
C.反应③可用于检验某种温室气体
D.向澄清石灰水中加入紫色石蕊试液,
试液由紫色变为蓝色
A
【方法点拨】解答此类问题时,首先弄清碱的通性,熟练书写有关化学方程式,并学会迁移运用。
碱的通性
【题组过关】
1.(2020·郴州中考)下列关于Ca(OH)2的说法错误的是 ( )
A.微溶于水,水溶液呈碱性
B.能与酸反应,可用于治疗胃酸过多
C.与CuSO4溶液按一定比例混合,可配制波尔多液
D.澄清溶液可用来检验CO2
B
2.(2020·济南章丘区模拟) 下列验证“CO2与NaOH溶液反应”的装置中,不能
观察到明显现象的是(装置气密性均良好) ( )
A
3.氢氧化钙在生产和生活中有广泛的用途。
(1)氢氧化钙的俗名是___________________,写出氢氧化钙的一种用途_____
_________________________。?
(2)下列关于氢氧化钙的性质中,属于碱的共同性质的是_______。?
A.与紫色石蕊溶液反应
B.与硫酸反应
C.与碳酸钾溶液反应
熟石灰或消石灰
改良
酸性土壤(合理答案均可)
AB
(3)氢氧化锂(LiOH)与氢氧化钙具有相似的化学性质。下列物质中,能与氢氧
化锂溶液反应的是_______。?
A.盐酸 B.氧化铁 C.氯化铜溶液
(4)实验室可用氢氧化钙与另一种物质反应来制取氢氧化钠,反应的化学方程
式为__________________________________
AC
Ca(OH)2+Na2CO3====2NaOH+CaCO3↓ ?
实验突破·强化探究力
【实验】 关于氢氧化钠、氢氧化钙变质的探究
1.氢氧化钠变质的探究
(1)原因:NaOH与空气中的CO2反应生成碳酸钠,
反应原理:2NaOH+CO2====Na2CO 3+H2O。
(2)成分分析。
①没有变质:NaOH;
②部分变质:NaOH和Na2CO3;
③全部变质:Na2CO3。
(3)检验氢氧化钠是否变质的方法(实质为C 的检验)
试剂选择
现象
化学方程式
酸
稀盐酸
有气泡产生
Na2CO3+2HCl====2NaCl+H2O+CO2↑
碱
澄清石灰水
有白色沉淀生成
Ca(OH)2+Na2CO3====CaCO3↓+2NaOH
盐
氯化钙
溶液(或氯化钡溶液)
有白色沉淀生成
CaCl2+Na2CO3====CaCO3↓+2NaCl(或BaCl2+Na2CO3====BaCO3↓+2NaCl)
(4)除杂:若NaOH中混有Na2CO3,在溶液中滴入澄清石灰水至不再产生沉淀为止,
过滤,反应原理:Na2CO3+Ca(OH)2====CaCO3↓+2NaOH。
(5)探究已变质氢氧化钠是部分变质还是完全变质的方法。
实验
目的
实验步骤
现象
化学方程
式或结论
除去氢氧化钠溶液中的碳酸钠
取少量样品于试管中,加适量水溶解制成溶液,滴入足量的氯化钙或氯化钡溶液
产生白色沉淀
CaCl2+Na2CO3 ==== CaCO3↓+2NaCl(或BaCl2+
Na2CO3===BaCO3↓+2NaCl)
检验是否存在氢氧化钠
过滤,取滤液少许,滴入几滴酚酞溶液
若溶液变红色
氢氧化钠_________变质?
若溶液不变色
氢氧化钠_________变质?
部分
全部
【特别提醒】
要确认是否有NaOH,在检验NaOH时必须排除Na2CO3的干扰,因为Na2CO3溶液也呈碱性,也能使酚酞溶液变红。在除Na2CO3时,不能用盐酸,因为盐酸与NaOH也反应,也不能用Ca(OH)2,因为会与Na2CO3反应生成NaOH,干扰原溶液中NaOH的检验。
(6)联想与启示:氢氧化钠固体暴露在空气中极易潮解,同时与空气中的二氧化碳反应,故应密封保存。
2.氢氧化钙变质的探究
(1)原因:Ca(OH)2与空气中的CO2反应生成碳酸钙,
反应原理:Ca(OH)2+CO2====CaCO3↓+H2O。
(2)成分分析。
①没有变质:Ca(OH)2;
②部分变质:Ca(OH)2和CaCO3;
③全部变质:CaCO3。
(3)检验氢氧化钙是否变质的方法。
①分析:由于Ca(OH)2为微溶物,故不能通过观察是否有白色固体析出来判断久置的Ca(OH)2溶液是否已变质。
②方法:加入盐酸,若有气泡产生则说明氢氧化钙已变质。
原理:CaCO3+2HCl====CaCl2+H2O+CO2↑。
(4)探究氢氧化钙是部分变质还是全部变质的方案设计:
方案
步骤
现象
结论
1
取少量样品于烧杯中,加入适量的水,充分搅拌溶解,过滤,取少量的滤液于试管中
通入二
氧化碳
有_____________生成?
氢氧化钙部分变质
无白色沉淀生成
氢氧化钙完全变质
2
滴加酚
酞溶液
溶液变红色
氢氧化钙部分变质
溶液不变色
氢氧化钙完全变质
3
滴加碳酸
钠溶液
有白色沉淀生成
氢氧化钙部分变质
无白色沉淀生成
氢氧化钙完全变质
白色沉淀
(5)联想与启示:氢氧化钙变质是由于它与空气中的二氧化碳发生反应,因此氢氧化钙应密封保存。
【典例】(2020·成都中考)忘盖瓶塞的氢氧化钠溶液可能变质。下表中分析
与设计错误的是 ( )
选项
问题
分析与设计
A
为何变质
2NaOH+CO2 ==== Na2CO3 + H2O
B
是否变质
取样,加入足量稀盐酸,观察是否产生气泡
C
选项
问题
分析与设计
C
是否全部变质
取样,加入足量氯化钙溶液,观察产生沉淀多少
D
如何除去杂质
取样,加入适量氢氧化钙溶液,过滤
本课结束
第一节 酸 和 碱
核心知识·建构脉络图
【主干回顾】
一、常见的酸
1.常见酸的物理性质及其用途:
主干回顾·厚积知识力
常见酸
盐 酸(HCl)
硫 酸(H2SO4)
色、态
无色液体
无色液体
气味
__________________
无味
敞开瓶口时的现象
____________
无明显现象
挥发性
____________
____________
吸水性
________
________
有刺激性气味 ?
有白雾 ?
易挥发 ?
无 ?
难挥发 ?
有 ?
常见酸
盐 酸(HCl)
硫 酸(H2SO4)
用途
金属除锈、制造药物、胃液中的盐酸帮助消化等
用于化工原料、精炼石油、金属除锈、冶炼金属、作干燥剂等
【微思考】 浓盐酸和浓硫酸敞口放置时溶质、溶剂、溶液的质量及溶质的质
量分数会发生怎样的变化?
提示:
浓盐酸
浓硫酸
溶质质量
变小
不变
溶剂质量
不变
变大
溶液质量
变小
变大
溶质质量分数
变小
变小
2.浓硫酸的特性:
吸水性
浓硫酸具有很强的吸水性,因此可
用作___________,常用来干燥O2、H2、CO2、CO等气体,不能用来干燥
碱性气体,如________
属于_____
性质
腐蚀性
(脱水性)
浓硫酸具有强烈的腐蚀性,能够夺
取纸张、木材、布料、皮肤里的
_________,生成黑色的炭?
属于_____
性质
干燥剂
NH3 ?
水分
物理
化学
3.浓硫酸的稀释:
【微点拨】 如果不慎将浓硫酸沾到皮肤或衣服上,应立即用大量水冲洗,然后再涂上3%~5%的碳酸氢钠溶液。
4.酸的化学性质:
化学性质
现象(或化学方程式)
与指示剂作用
酸溶液能使紫色石蕊溶液变_______色,无色的酚酞遇酸
_________色?
酸与活泼金属反应
2HCl+Fe====____________
H2SO4+Zn====_______________
红
不变
FeCl2+H2↑
ZnSO4+H2↑ ?
化学性质
现象(或化学方程式)
酸与某些金属氧化物反应
2HCl+CuO====_____________
3H2SO4+Fe2O3====__________________
酸与碱
反应
2HCl+Ca(OH)2====____________
____________________________
酸与某些盐反应
2HCl+Na2CO3====_________________
HCl+AgNO3====________________
H2SO4+BaCl2====_________________
CuCl2+H2O ?
Fe2(SO4)3+3H2O ?
CaCl2+2H2O
H2SO4+2NaOH==== Na2SO4+2H2O ?
2NaCl+H2O+CO2↑
AgCl↓+HNO3 ?
2HCl+BaSO4↓ ?
【微点拨】 稀盐酸(稀硫酸)与铁反应生成氯化亚铁(硫酸亚铁),溶液为浅绿色,和氧化铁反应生成氯化铁(硫酸铁),溶液为棕黄色。
二、常见的碱
1.常见碱的物理性质和用途及制法:
氢氧化钠
氢氧化钙
俗称
烧碱、火碱、苛性钠
熟石灰、消石灰
物理性质
色、态
_____________
_______________
溶解性
_________溶于水,并放出大
量的热?
_______溶于水,溶
解度随温度升高而
_________
吸水性
易吸收水分而_________
腐蚀性
有强腐蚀性
有较强腐蚀性
白色固体 ?
白色粉末状固体?
极易
微
降低 ?
潮解 ?
氢氧化钠
氢氧化钙
制法(写化
学方程式)
____________________
________________
____________
_______
用途
作气体干燥剂、去除油污
作建筑材料、改良酸性土壤
Ca(OH)2+Na2CO3====
CaCO3↓+2NaOH ?
CaO+H2O ====
Ca(OH)2
【微点拨】 (1)氢氧化钠有强烈的腐蚀性,如果不慎沾到皮肤上,要用大量的水冲洗,再涂上硼酸溶液。
(2)氢氧化钠可以用来干燥H2、O2等气体,不能干燥CO2、SO2等酸性气体。
2.碱的化学性质:
化学
性质
现象(或化学方程式)
备注
与指示剂作用
氢氧化钠和氢氧化钙都可以使紫色石蕊溶液变_______,使无色酚酞溶液变________
与某些非金属氧化物反应
CO2+Ca(OH)2====
________________
检验二氧化碳的方法
CO2+2NaOH====_______________
氢氧化钠变质的原因
蓝
红 ?
CaCO3↓+H2O ?
Na2CO3+H2O ?
化学
性质
现象(或化学方程式)
备注
与酸反应
H2SO4+Ca(OH)2====__________
中和反应
与部分盐反应
2NaOH+CuSO4====
________________
Ca(OH)2+Na2CO3====
_______________
碱与盐都溶于水
CaSO4+2H2O
Cu(OH)2↓+Na2SO4
2NaOH+CaCO3↓
【微思考】 实验室常用澄清石灰水来检验CO2气体,常用氢氧化钠溶液来吸
收CO2的原因是什么?
提示:因为二氧化碳能使澄清石灰水变浑浊,有明显的现象,便于观察;氢氧
化钠易溶于水,可以充分地反应,更完全地吸收二氧化碳。 ?
【核心反应】
1.盐酸(HCl)和硫酸(H2SO4)的化学性质
①________________________、?
_________________________
②________________________、?
_________________________
③________________________、?
_________________________
④___________________________、?
_________________________________
Zn+2HCl====ZnCl2+H2↑
Zn+H2SO4====ZnSO4+H2↑ ?
Fe+2HCl====FeCl2+H2↑
Fe+H2SO4====FeSO4+H2↑ ?
CuO+2HCl====CuCl2+H2O
CuO+H2SO4====CuSO4+H2O ?
Fe2O3+6HCl====2FeCl3+3H2O
Fe2O3 +3H2SO4====Fe2(SO4)3+3H2O ?
⑤____________________________
⑥__________________________________
_________________________________
⑦___________________________________
__________________________________
⑧___________________________________
HCl+AgNO3====AgCl↓+HNO3 ?
CaCO3+2HCl====CaCl2+H2O+CO2↑ 、?
CaCO3+H2SO4====CaSO4+H2O+CO2↑ ?
Na2CO3+2HCl====2NaCl+H2O+CO2↑ 、?
Na2CO3+H2SO4====Na2SO4+H2O+CO2↑ ?
H2SO4+Ba(NO3)2====BaSO4 ↓+2HNO3 ?
⑨__________________________
_____________________________
⑩________________________________
______________________________
_______________________________
HCl+NaOH====NaCl+H2O 、?
H2SO4+2NaOH====Na2SO4+2H2O ?
2HCl+Ca(OH)2====CaCl2+2H2O 、?
H2SO4+Ca(OH)2====CaSO4+2H2O ?
H2SO4+BaCl2====BaSO4 ↓+2HCl ?
2.氢氧化钠(NaOH)和氢氧化钙[Ca(OH)2]的化学性质
①__________________________、?
______________________________
②__________________________________、?
____________________________________
③__________________________________、?
________________________________________
2NaOH+CO2====Na2CO3+H2O
Ca(OH)2+CO2====CaCO3↓+H2O ?
2NaOH+CuSO4====Cu(OH)2↓+Na2SO4
Ca(OH)2+CuSO4====Cu(OH)2↓+CaSO4 ?
3NaOH+FeCl3====Fe(OH)3↓+3NaCl
3Ca(OH)2+2FeCl3====2Fe(OH)3↓+3CaCl2 ?
④__________________________________、?
____________________________________
⑤___________________________________
⑥________________________、?
_______________________________
⑦_____________________________、?
_______________________________
2NaOH+MgCl2====Mg(OH)2↓+2NaCl
Ca(OH)2+MgCl2====Mg(OH)2↓+CaCl2 ?
Ca(OH)2+Na2CO3====CaCO3↓+2NaOH ?
HCl+NaOH====NaCl+H2O
2HCl+Ca(OH)2====CaCl2+2H2O ?
H2SO4+2NaOH====Na2SO4+2H2O
H2SO4+Ca(OH)2====CaSO4+2H2O ?
【自我测评】
1.下列物质存放在烧杯中一段时间后,质量变小且不变质的是( )
A.烧碱 B.浓硫酸
C.浓盐酸 D.生石灰
2.(2020·泸州中考)下列物质不能与NaOH溶液反应的是 ( )
A.二氧化碳 B.硝酸
C.硫酸铜 D.氢氧化铁
C
D
3.(2020·郴州中考)下列物质溶于水因发生化学反应放出热量的是 ( )
A.NaOH B.NH4NO3
C.NaCl D.CaO
4.李伟同学在探究稀盐酸的化学性质时,用稀盐酸分别和下列物质反应,能得到
无色溶液的是 ( )
A.Fe2O3 B.Fe
C.Zn D.Cu(OH)2
D
C
5.(2020·济宁嘉祥模拟)小王同学往厨房的纯碱中滴加白醋,发现有气体生成。
已知白醋里含3%~5%的醋酸(CH3COOH),醋酸与盐酸的化学性质相似,下列
说法不正确的是 ( )
A.白醋里含有氢离子
B.生成的气体是二氧化碳
C.白醋能使紫色石蕊溶液变红
D.白醋与纯碱的反应属于中和反应
D
6.(2020·泰安岱岳区模拟)下列关于H2SO4性质描述中,不属于酸的通性的
是( )
A.使紫色石蕊溶液变红
B.与NaOH发生中和反应
C.浓硫酸滴到白纸上使纸变黑
D.与Mg反应放出氢气
C
7.以下是我们所学的部分化学物质,它们与生产、生活息息相关。
①自然界中最坚硬的物质名称是___________;干冰的化学式是_______;二氧
化碳灭火是利用了二氧化碳_____________________________________的性
质。?
②写出图中Ⅰ的化学方程式_____________________。氧化钙俗称_______。
Ⅱ的转化过程中_________(选填“放出”或“吸收”)热量。属于物理
变化的过程是_______(选填“Ⅰ”“Ⅱ”“Ⅲ”或“Ⅳ”)。?
金刚石
CO2
不燃烧、不支持燃烧、密度比空气大
CaCO3 CaO+CO2↑
生石灰
放出
Ⅲ
高温
====
8.实验室的许多化学药品需要密封保存。
(1)打开盛放浓盐酸的试剂瓶瓶塞,观察到的现象为_____________________。?
(2)氢氧化钙溶液敞口放置,表面会出现一层白膜,请用化学方程式解释出现这
一现象的原因____________________________。?
瓶口上方出现白雾
Ca(OH)2+CO2 ==== CaCO3↓+H2O
9.(2020·聊城冠县模拟)某实验小组在探究碱的化学性质实验时,用到了氢氧
化钠溶液和氢氧化钙溶液。 世纪金榜导学号
(1)甲同学不小心将这两种溶液混合在一起,结果产生_____________________
的现象,说明氢氧化钠溶液变质了。写出变质时发生反应的化学方程式 ________________________。?
白色沉淀(或白色浑浊)
2NaOH+CO2====Na2CO3+H2O
(2)同学们对变质的氢氧化钠溶液中溶质的成分产生了兴趣,进行如下探究:
【提出问题】变质的氢氧化钠溶液中溶质的成分是什么?
【做出猜想】猜想一:Na2CO3
猜想二:________________(写化学式)?
【进行讨论】甲同学取少量待测液加入足量的稀盐酸,有气泡产生。认为猜想
一成立。乙同学不同意甲同学的观点,理由是____________________________
_______________________。?
Na2CO3和NaOH
猜想二中也含有碳酸钠,加入足
量的盐酸也能产生气泡
【设计实验】请你验证猜想二成立,并完成实验报告。
【反思评价】在实验室中,氢氧化钠应_________保存。?
实验操作
实验现象
实验
结论
①取一定量的待测液于试管中,加入_____________________________
______________________________
__________________________
________________溶液。?
_____________
____________
______ ?
猜想二
成立
②充分反应后静置,取上层清液加入无色酚酞溶液
_____________
_____ ?
过量的氯化钙(或足量的氯化钙;
过量或足量的氯化钡,过量或足量
的硝酸钙等可溶性钙盐或钡盐,
答化学式也可)
产生白色沉淀
(或产生白色
浑浊)
无色酚酞溶液
变红
密封
【命题点一】 酸的化学性质
【典例1】(2020·铁岭中考)在学习了酸的化学性质之后,某实验小组选用稀盐酸做了如下图所示实验。
考点研磨·提升审题力
请回答下列问题:
(1)A烧杯中,铜不与稀盐酸发生反应的原因是___________________________
___________。?
(2)能产生气泡的是_______(填字母序号)。?
(3)写出C烧杯中反应的化学方程式____________________________。?
在金属活动性顺序表中铜排在
氢的后面
BE
Fe2O3+6HCl====2FeCl3+3H2O
(4)D烧杯中,溶液由红色变为_______色,说明盐酸与氢氧化钠发生了反应。?
同学们进一步对D烧杯中反应后的溶液进行探究,对其溶质的成分(除酚酞外)
做出如下猜想。猜想一:只含有一种溶质;猜想二:含有两种溶质。为了验证上
述猜想,进行如下实验,请完成下列表格。
实验操作
测定结果
得出结论
用玻璃棒蘸取D烧杯中反应后的溶液,滴在pH试纸上,与标准比色卡比较
pH<7
猜想_______正确,溶液
中的溶质是_________
___________________
______。?
无
二
NaCl、
HCl(或氯化钠、氯化
氢)
小组同学选用稀硫酸代替稀盐酸重复实验,证明了硫酸与盐酸具有相似的化
学性质。酸有一些相似的化学性质,是因为在不同的酸溶液中都含有相同的
________________。?
H+(或氢离子)
【方法点拨】形象记忆酸的化学性质
酸的化学性质一共有五条,可放在一个手掌中,每一个指头代表一条性质。
从中还可以看出,酸的五条性质中生成盐的有四条。
【题组过关】
1.(2020·遵义中考)醋酸(CH3COOH)是食醋的成分之一,其水溶液中存在H+和
CH3COO-。下列说法正确的是 ( )
A.醋酸属于氧化物
B.醋酸不能用于除铁锈
C.醋酸能与镁反应产生氢气
D.醋酸中碳元素的质量分数最大
C
2.(2020·烟台招远模拟)小明同学归纳总结了初中所学稀硫酸的化学性质,并
用“H2SO4+X→盐+Y”这种表达式进行整理。下列小明的观点错误的是 ( )
选项
X的物质类别
观点描述
A
金属
若X为Cu,则反应能够发生
B
金属氧化物
若X为MgO,则Y为H2O
C
碱
若X为NaOH,则盐为Na2SO4
D
盐
若X为BaCl2 ,则生成白色沉淀
A
3.(2020·枣庄山亭区模拟)如图是包含物质A、B、C、D和盐酸卡片的“化学拼图”,相邻两张卡片所标的物质(或其溶液)间能发生反应。
(1)A不可能是______(填标号)。?
a.Mg b.Fe c.Ag d.Zn
(2)若B为铁锈的主要成分Fe2O3,B与盐酸反应的化学方程式为 __________________________。?
c
Fe2O3+6HCl====2FeCl3+3H2O
(3)若C为碳酸钠
①C与D的反应属于_______________(填基本反应类型)。?
②D与盐酸反应的化学方程式为___________________________
_______________________________(写一个)。?
③将二氧化碳通入C溶液,可化合生成碳酸氢钠(NaHCO3),该反应的反应物
有______种。?
复分解反应
2HCl+Ca(OH)2====CaCl2+2H2O
(或2HCl+Ba(OH)2====BaCl2+2H2O)
3
4.(2020·北京中考)补全实验报告。
装置及操作
现象
解释或结论
(1)向1中滴加 ____________
______________
______溶液?
铁片上附着红色固体,溶液颜色变浅
Fe的金属活动性比Cu的强
(2)向2中滴加盐酸
固体减少,得到黄色溶液
化学方程式: ______________
____________ ?
(3)向3中滴加足量盐酸
_____________
_______
Ca(OH)2能与盐酸反应
CuSO4或CuCl2
(其他答案合理
也可)
Fe2O3+6HCl====
2FeCl3+3H2O
溶液由红色变
为无色
【命题点二】 碱的化学性质
【典例2】(2020·潍坊中考)某同学总结的Ca(OH)2的化学性质如图。下列说
法错误的是 ( )
A.甲一定是碳酸盐
B.反应②为放热反应
C.反应③可用于检验某种温室气体
D.向澄清石灰水中加入紫色石蕊试液,
试液由紫色变为蓝色
A
【方法点拨】解答此类问题时,首先弄清碱的通性,熟练书写有关化学方程式,并学会迁移运用。
碱的通性
【题组过关】
1.(2020·郴州中考)下列关于Ca(OH)2的说法错误的是 ( )
A.微溶于水,水溶液呈碱性
B.能与酸反应,可用于治疗胃酸过多
C.与CuSO4溶液按一定比例混合,可配制波尔多液
D.澄清溶液可用来检验CO2
B
2.(2020·济南章丘区模拟) 下列验证“CO2与NaOH溶液反应”的装置中,不能
观察到明显现象的是(装置气密性均良好) ( )
A
3.氢氧化钙在生产和生活中有广泛的用途。
(1)氢氧化钙的俗名是___________________,写出氢氧化钙的一种用途_____
_________________________。?
(2)下列关于氢氧化钙的性质中,属于碱的共同性质的是_______。?
A.与紫色石蕊溶液反应
B.与硫酸反应
C.与碳酸钾溶液反应
熟石灰或消石灰
改良
酸性土壤(合理答案均可)
AB
(3)氢氧化锂(LiOH)与氢氧化钙具有相似的化学性质。下列物质中,能与氢氧
化锂溶液反应的是_______。?
A.盐酸 B.氧化铁 C.氯化铜溶液
(4)实验室可用氢氧化钙与另一种物质反应来制取氢氧化钠,反应的化学方程
式为__________________________________
AC
Ca(OH)2+Na2CO3====2NaOH+CaCO3↓ ?
实验突破·强化探究力
【实验】 关于氢氧化钠、氢氧化钙变质的探究
1.氢氧化钠变质的探究
(1)原因:NaOH与空气中的CO2反应生成碳酸钠,
反应原理:2NaOH+CO2====Na2CO 3+H2O。
(2)成分分析。
①没有变质:NaOH;
②部分变质:NaOH和Na2CO3;
③全部变质:Na2CO3。
(3)检验氢氧化钠是否变质的方法(实质为C 的检验)
试剂选择
现象
化学方程式
酸
稀盐酸
有气泡产生
Na2CO3+2HCl====2NaCl+H2O+CO2↑
碱
澄清石灰水
有白色沉淀生成
Ca(OH)2+Na2CO3====CaCO3↓+2NaOH
盐
氯化钙
溶液(或氯化钡溶液)
有白色沉淀生成
CaCl2+Na2CO3====CaCO3↓+2NaCl(或BaCl2+Na2CO3====BaCO3↓+2NaCl)
(4)除杂:若NaOH中混有Na2CO3,在溶液中滴入澄清石灰水至不再产生沉淀为止,
过滤,反应原理:Na2CO3+Ca(OH)2====CaCO3↓+2NaOH。
(5)探究已变质氢氧化钠是部分变质还是完全变质的方法。
实验
目的
实验步骤
现象
化学方程
式或结论
除去氢氧化钠溶液中的碳酸钠
取少量样品于试管中,加适量水溶解制成溶液,滴入足量的氯化钙或氯化钡溶液
产生白色沉淀
CaCl2+Na2CO3 ==== CaCO3↓+2NaCl(或BaCl2+
Na2CO3===BaCO3↓+2NaCl)
检验是否存在氢氧化钠
过滤,取滤液少许,滴入几滴酚酞溶液
若溶液变红色
氢氧化钠_________变质?
若溶液不变色
氢氧化钠_________变质?
部分
全部
【特别提醒】
要确认是否有NaOH,在检验NaOH时必须排除Na2CO3的干扰,因为Na2CO3溶液也呈碱性,也能使酚酞溶液变红。在除Na2CO3时,不能用盐酸,因为盐酸与NaOH也反应,也不能用Ca(OH)2,因为会与Na2CO3反应生成NaOH,干扰原溶液中NaOH的检验。
(6)联想与启示:氢氧化钠固体暴露在空气中极易潮解,同时与空气中的二氧化碳反应,故应密封保存。
2.氢氧化钙变质的探究
(1)原因:Ca(OH)2与空气中的CO2反应生成碳酸钙,
反应原理:Ca(OH)2+CO2====CaCO3↓+H2O。
(2)成分分析。
①没有变质:Ca(OH)2;
②部分变质:Ca(OH)2和CaCO3;
③全部变质:CaCO3。
(3)检验氢氧化钙是否变质的方法。
①分析:由于Ca(OH)2为微溶物,故不能通过观察是否有白色固体析出来判断久置的Ca(OH)2溶液是否已变质。
②方法:加入盐酸,若有气泡产生则说明氢氧化钙已变质。
原理:CaCO3+2HCl====CaCl2+H2O+CO2↑。
(4)探究氢氧化钙是部分变质还是全部变质的方案设计:
方案
步骤
现象
结论
1
取少量样品于烧杯中,加入适量的水,充分搅拌溶解,过滤,取少量的滤液于试管中
通入二
氧化碳
有_____________生成?
氢氧化钙部分变质
无白色沉淀生成
氢氧化钙完全变质
2
滴加酚
酞溶液
溶液变红色
氢氧化钙部分变质
溶液不变色
氢氧化钙完全变质
3
滴加碳酸
钠溶液
有白色沉淀生成
氢氧化钙部分变质
无白色沉淀生成
氢氧化钙完全变质
白色沉淀
(5)联想与启示:氢氧化钙变质是由于它与空气中的二氧化碳发生反应,因此氢氧化钙应密封保存。
【典例】(2020·成都中考)忘盖瓶塞的氢氧化钠溶液可能变质。下表中分析
与设计错误的是 ( )
选项
问题
分析与设计
A
为何变质
2NaOH+CO2 ==== Na2CO3 + H2O
B
是否变质
取样,加入足量稀盐酸,观察是否产生气泡
C
选项
问题
分析与设计
C
是否全部变质
取样,加入足量氯化钙溶液,观察产生沉淀多少
D
如何除去杂质
取样,加入适量氢氧化钙溶液,过滤
本课结束
同课章节目录
- 第七单元 常见的酸和碱
- 第一节 酸及其性质
- 第二节 碱及其性质
- 第三节 溶液的酸碱性
- 第四节 酸碱中和反应
- 到实验室去:探究酸和碱的化学性质
- 第八单元 海水中的化学
- 第一节 海洋化学资源
- 第二节 海水“晒盐“
- 第三节 海水“制碱“
- 到实验室去:粗盐中难溶性杂质的去除
- 第九单元 金属
- 第一节 常见的金属材料
- 第二节 金属的化学性质
- 第三节 钢铁的锈蚀与防护
- 到实验室去 探究金属的性质
- 第十单元 化学与健康
- 第一节 食物中的有机物
- 第二节 化学元素与人体健康
- 第三节 远离有毒物质
- 第十一单元 化学与社会发展
- 第一节 化学与能源开发
- 第二节 化学与材料研制
- 第三节 化学与农业生产
- 第四节 化学与环境保护
