2021届鲁教版中考化学大一轮单元总复习:第七单元 常见的酸和碱第二节 溶液的酸碱性及酸碱中和反应(共42张PPT)
文档属性
| 名称 | 2021届鲁教版中考化学大一轮单元总复习:第七单元 常见的酸和碱第二节 溶液的酸碱性及酸碱中和反应(共42张PPT) |

|
|
| 格式 | ppt | ||
| 文件大小 | 1.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-11-02 10:46:48 | ||
图片预览










文档简介
第二节 溶液的酸碱性及酸碱中和反应
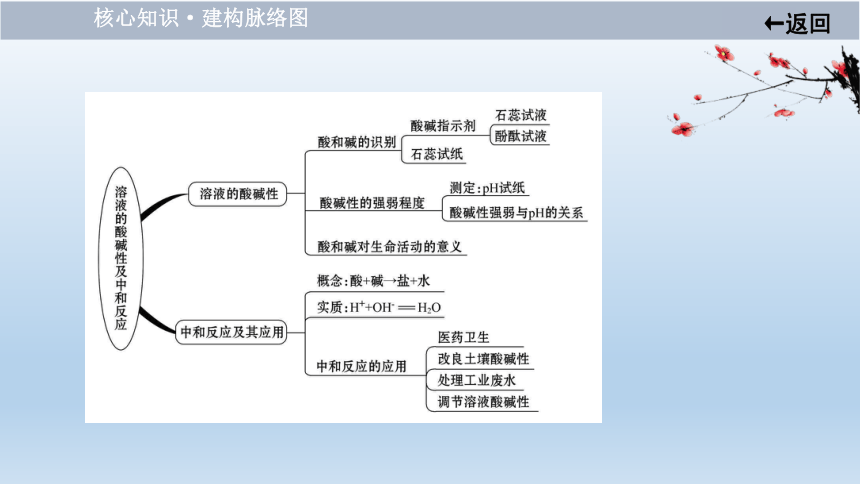
核心知识·建构脉络图
【主干回顾】
一、溶液的酸碱性
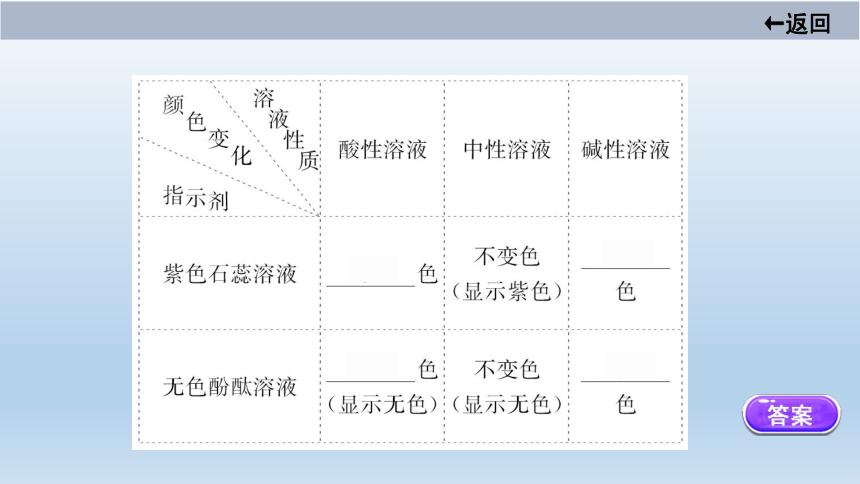
(一)酸、碱与指示剂作用
1.概念:能跟酸或碱起反应而 _____________ 的物质。?
2.指示剂在不同性质的物质中的颜色:
主干回顾·厚积知识力
显示不同颜色
【微点拨】 酸碱指示剂遇酸性溶液或碱性溶液后,变色的是指示剂,而不是酸性溶液或碱性溶液。
【微思考】 “能使石蕊溶液变红的一定是酸溶液,使酚酞溶液变红的一定是碱溶液”,这种说法是否正确?为什么?
提示:不正确。根据指示剂颜色的变化,能判断溶液的酸碱性,但不能确定溶液一定是酸或碱。因为某些盐的溶液也可能显酸性或碱性。 ?
(二)溶液酸碱度的表示法——pH
1.溶液酸碱度的表示:
溶液的酸碱度常用 ___ 表示,pH的范围通常在 ______ 。?
pH
0~14
【微点拨】 酸、碱溶液与溶液酸碱性的关系
(1)酸溶液一定显酸性,碱溶液一定显碱性。
(2)酸性溶液不一定是酸溶液,碱性溶液不一定是碱溶液,盐溶液不一定呈中性。
(3)pH可以反映溶液的酸碱度,但不能反映是否是酸、碱、盐溶液。
2.pH的测定:
(1)用品: _______ 。?
(2)操作:在 _______________ 上放一小片pH试纸,用 _______ 蘸取待测
液点在pH试纸上,把试纸显示的颜色与 ___________ 比较,即可得出待测液
的pH。?
pH试纸
白瓷板或玻璃片
玻璃棒
标准比色卡
【微点拨】 ①pH试纸只能粗略测定溶液的酸碱度,测得的pH一般是整数。
②用pH试纸测定溶液的酸碱度时,pH试纸不能用水润湿,否则会影响溶液的pH的测定。
③不能将pH试纸直接放入待测试样溶液中,否则会污染试剂。
3.溶液酸碱性的意义:
(1)化工生产中要控制pH范围。
(2)农作物适宜在pH为7或接近7的土壤中生长。
(3)测定雨水的pH,正常雨水pH约为5.6,pH小于5.6的雨水为酸雨。
(4)测定人体内液体的pH,了解人体健康状况。
【微思考】 正常雨水的pH为什么小于7?
提示:正常的雨水由于溶解了二氧化碳形成碳酸,pH小于7。 ?
二、中和反应
1.概念: _______ 作用生成 _______ 的反应。?
2.实质:酸溶液中的 __ 和碱溶液中的 ___ 结合生成 ___ ,
即 _____________ 。?
3.表达式:酸+碱→ ______ ?
酸与碱
盐和水
H+
OH-
水
H++OH-====H2O
盐+水
【微思考】 生成盐和水的反应一定是中和反应吗?
提示:不一定。判断中和反应不仅要看生成物是否是盐和水,最重要的是看反
应物是否是酸和碱,只有酸与碱发生的反应,才是中和反应。 ?
4.盐:由 _________ 和 _________ 构成的化合物。?
金属离子
酸根离子
5.应用:
改良
土壤
① _______ 中和酸性土壤;?
②用碳酸水来中和碱性土壤
处理工
厂废水
用熟石灰中和硫酸厂的污水(反应原理:
__________________________ )?
用于医
药卫生
①用胃舒平(有效成分是氢氧化铝)等药物来医治胃酸过多(反应原理: __________________________ );?
②蚊虫叮咬后用牙膏、肥皂水涂抹
熟石灰
H2SO4+Ca(OH)2====CaSO4+2H2O
3HCl+Al(OH)3====AlCl3+3H2O
【微点拨】 (1)治疗胃酸过多的药物很多,但不能用NaOH和Ca(OH)2,因为二者具有强烈的腐蚀性。
(2)改良酸性土壤,处理工厂的酸性废水,通常用熟石灰而不用氢氧化钠,因为熟石灰价格便宜。
【自我测评】
1.(2020·烟台福山区模拟)紫甘蓝是大众爱吃的蔬菜,含有丰富的花青素。花
青素遇酸性溶液变红色,遇碱性溶液变蓝色。在凉拌紫甘蓝丝时,观察到菜丝
变成红色,可能是加入了下列哪种调味品 ( )
A.食盐 B.味精 C.食醋 D.香油
C
2.(2020·怀化中考)生活中一些常见食物的pH如下:
上述食物中,胃酸过多的人不宜食用的是 ( )
A.柠檬汁 B.牛奶 C.鸡蛋 D.红豆汁
食物
柠檬汁
鸡蛋清
纯水
牛奶
红豆汁
pH
2.0~2.5
7.4~7.6
7
6.3~8.5
10.2~11.4
A
3.(2019·重庆中考B)头发油腻是因为油脂的分泌,清洗时碱性溶液效果更好。
从pH角度考虑效果最好的洗发水的pH为 ( )
A.8 B.7 C.6 D.4
4.(2020·南京中考)按如图所示装置,玻璃棒末端固定一团喷有酚酞溶液的脱
脂棉Y。先加入物质X,再塞上带玻璃棒的橡胶塞。片刻后,能观察到喷有酚酞
溶液的脱脂棉Y变红,则物质X可能是 ( )
A.浓盐酸 B.浓氨水
C.浓醋酸 D.浓氢氧化钠溶液
A
B
5.(2020·济南钢城区模拟)如图是生活中常见洗涤用品的 pH, 混用会降低去
污效果的组合是 ( )
A.洁厕灵和消毒液
B.肥皂水和炉具清洁剂
C.消毒液和肥皂水
D.消毒液和炉具清洁剂
A
6.(易错题)向下列物质中加入稀盐酸,无明显现象的是 ( )
A.NaHCO3溶液 B.滴有酚酞的NaOH溶液
C.Fe2O3粉末 D.NaCl溶液
7.(2020·泰安岱岳区模拟)中和反应在生活中有广泛应用。下列应用不属于
中和反应的是 ( )
A.用盐酸除铁锈
B.服用含有氢氧化镁的药物治疗胃酸过多
C.用熟石灰改良酸性土壤
D.用硫酸处理印染厂含碱废水
D
A
8.(2020·衢州中考)将稀盐酸分别滴入NaOH溶液和NaCl溶液中,充分混合后均
无明显现象。混合后相关变化的微观示意图如图,下列说法正确的是( )
A.物质间均未发生化学反应
B.变化中都有新物质产生
C.混合后溶液酸碱性都不变
D.图甲可表示酸碱反应的实质
D
9.(2020·青岛黄岛区模拟)某实验小组做中和反应的实验,向盛有氢氧化钠溶液(滴有酚酞试液)的烧杯中逐滴加入稀盐酸,并不断搅拌。如图为依据实验数据绘制的V(盐酸)-pH 图。
(1)滴加盐酸的体积为V1时,溶液呈 _______________ 颜色。?
(2)滴加盐酸的体积为V2时,溶液中除了水分子外,主要的微粒有
___________________________ 。?
(3)举出中和反应的一个应用实例: __________________________________
____________________________________________________________。?
红色(或粉红色)
钠离子、氯离子(或Na+、 Cl-)
用熟石灰改良酸性土壤(或用熟石灰处
理硫酸厂废水、用稀硫酸处理印刷厂废水等。其他合理答案均可)
10.(2020·攀枝花中考)在宏观、微观、符号之间建立联系,是化学学科的主要学习内容和方法。世纪金榜导学号
回答下列问题:
(1)根据图1,HCl在水中会解离出H+和Cl-,表示为HCl====H++Cl-,则NaOH在水中
解离可表示为 _______________ 。?
(2)根据图2,氢氧化钠溶液与盐酸反应的实质可表示为:H++OH-====H2O。图3是
氯化钡溶液与硫酸钠溶液反应的微观示意图,该反应的实质可表示为
____________________ 。?
NaOH====Na++OH-
Ba2++ ====BaSO4↓
(3)氢氧化钠溶液与硫酸铜溶液反应的实质可表示为
_____________________ 。?
2OH-+Cu2+====Cu(OH)2↓
【命题点一】溶液的酸碱性和pH的关系
【典例1】(2020·临沂中考)一些食物的近似pH如表所示,下列说法正确的
是 ( )
食物苹果汁西瓜汁牛奶鸡蛋清pH2.95.86.47.6
A.牛奶放置一段时间后变酸,pH变大
B.西瓜汁比苹果汁酸性强
C.鸡蛋清和牛奶都显碱性
D.胃酸过多的人应该少饮苹果汁
考点研磨·提升审题力
食物
苹果汁
西瓜汁
牛奶
鸡蛋清
pH
2.9
5.8
6.4
7.6
D
【题组过关】
1.(2020·温州中考)新鲜果汁是常见的饮料,下列四种饮料呈弱碱性的是 ( )
D
2.(2020·德州中考)夏天我们被蚊虫叮咬后,蚊虫会在人的皮肤内分泌蚁酸(一
种酸),从而使皮肤肿痛。要减轻痛痒,可在叮咬处涂抹下列物质中的( )
A.食醋 B.酱油 C.肥皂水 D.食盐水
物质
食醋
酱油
食盐水
肥皂水
pH
2~3
4~5
7
8~9
C
【命题点二】酸碱中和反应的理解
【典例2】(2020·滨州中考)某校化学小组在利用硫酸和氢氧化钾两溶液探究
酸碱中和反应时,利用数字化传感器测得烧杯中溶液pH的变化图象如图所示。
下列说法正确的是世纪金榜导学号( )
A.图中c点所示溶液呈碱性
B.图中a点所示溶液中,含有的溶质是K2SO4和H2SO4
C.该实验是将氢氧化钾溶液逐滴滴入盛有硫酸溶液的烧杯中
D.由c点到d点的变化过程中没有发生化学反应
D
【方法点拨】
(1)根据图象判断酸滴碱还是碱滴酸的方法。
①pH开始时的图象起点小于7——碱滴酸;
②pH开始时的图象起点大于7——酸滴碱;
(2)如何判定滴定终点。
①当pH=7时恰好完全中和。如酸滴到含有无色酚酞试液的碱溶液中,若红色刚好褪去,溶液呈无色,则恰好完全反应;②如果酸滴碱时最终观察到溶液变为无色,则有2种结果,即可能恰好中和,也可能酸过量。
【题组过关】
1.(2020·泰安中考)将一定量的氢氧化钠溶液与稀盐酸混合,二者恰好完全反
应的微观示意图如下。下列说法不正确的是 ( )
A.反应前后阴、阳离子的总数目不变
B.反应前后溶液的总质量不变
C.反应后溶液呈中性
D.反应前后元素种类不变
A
2.(2020·黔西南州中考)室温下,将氢氧化钠溶液滴加到盛有一定量稀盐酸
的容器中,边滴边搅拌,用数字pH仪连接电脑实时测得pH变化曲线如图。下列相
关叙述错误的是 世纪金榜导学号( )
A.容器中发生的反应属于中和反应
B.a点溶液能使紫色石蕊溶液变红
C.b点表示HCl与NaOH等质量反应
D.c点溶液中的溶质是NaCl和NaOH
C
实验突破·强化探究力
【实验】 酸碱中和反应探究
1.原理:中和反应(如氢氧化钠溶液与盐酸的反应)中,往往无明显的实验现象,
无法确定反应是否发生及反应进行的程度,因此,需要借助指示剂或其他方法
来判断。
2.指示剂的选择
(1)一般选用酚酞溶液。NaOH等碱溶液中滴入酚酞溶液,溶液变 ___ 色。滴
入稀盐酸或稀硫酸恰好中和时,溶液呈中性,变为 ___ 色,标志着中和反应
完成。?
(2)指示剂不选用紫色石蕊溶液的原因是紫色石蕊溶液在碱溶液中呈蓝色,在
中性溶液中呈紫色,蓝色和紫色之间没有明显的界限,反应现象不明显。
红
无
3.判断中和反应是否发生的方法
判断依据
注意事项
方法一
借助酸碱指示剂的颜色变化(若用酸中和碱时)
①先在碱溶液中滴加几滴酚酞试液;
②为防止酸过量,应逐滴加入,并不断搅拌或振荡;
③当溶液恰好由红色变为无色时,恰好完全中和
方法二
借助反应中的温度变化(若用酸中和碱时)
①先测量加入烧杯中的碱溶液的温度;
②边加酸溶液边不断搅拌并及时测量、记录溶液的温度
方法三
借助反应中溶液pH的变化(若用碱中和酸时)
①先测出酸溶液的pH;
②逐滴加入碱溶液并不断搅拌,同时测定溶液的pH;③需保证溶液的pH≥7,才能证明反应发生了
4.中和反应过程中所得溶液溶质成分的判断(以氢氧化钠与盐酸反应为例)
(1)酸入碱(如图1):
取氢氧化钠溶液,滴加几滴无色酚酞溶液,慢慢滴加稀盐酸,边滴边用玻璃棒搅拌。
①A点,pH>7,溶质为NaOH;
②A~B段,pH>7,溶质为NaCl、NaOH;
③B点,pH=7,溶质为NaCl;
④B~C段,pH<7,溶质为NaCl、HCl。
(2)碱入酸(如图2):
取稀盐酸,滴加几滴无色酚酞溶液,慢慢滴加氢氧化钠溶液,边滴边用玻璃棒搅拌。
①A点,pH<7,溶质为HCl;
②A~B段,pH<7,溶质为NaCl、HCl;
③B点,pH=7,溶质为NaCl;
④B~C段,pH>7,溶质为NaOH、NaCl。
5.实验拓展
(1)酸滴定碱时检验酸是否过量的方法:a.滴加石蕊溶液;b.用pH试纸;c.加入比较活泼的金属;d.加入碳酸盐。
(2)酸滴定碱(如氢氧化钠)时,如观察到有气体产生则可能的原因是氢氧化钠已变质。
【典例】(2020·黔东南中考)做“中和反应”实验时,小聪同学向盛有氢氧化
钠溶液的烧杯中滴加稀硫酸,一会儿后发现忘了滴加酸碱指示剂,于是他停止
滴加稀硫酸。同学们对反应后溶液中含有哪些溶质展开了讨论。 世纪金榜导
学号
【提出问题】上述实验中发生反应的化学方程式为
_________________________ ,那反应后溶液中的溶质是什么??
2NaOH+H2SO4====Na2SO4+2H2O
【提出猜想】猜想一:溶质是Na2SO4
猜想二:溶质是Na2SO4 和NaOH
猜想三:溶质是 _____________ ?
【查阅资料】Na2SO4 溶液呈中性
Na2SO4 和H2SO4
【实验探究】小聪同学设计如下的实验方案
方法步骤
实验现象
实验结论
方案一
取少量烧杯中的溶液于洁净的试管中,滴入几滴无色酚酞溶液
酚酞不变红色
猜想一正确
猜想二不正确
方案二
取少量烧杯中的溶液于洁净的试管中,滴加BaCl2溶液
出现白色沉淀
猜想三正确
方案三
取少量烧杯中的溶液于洁净的试管中,加入少量的黑色CuO粉末,振荡
________________
___________ ?
猜想三正确
粉末溶解,溶液由
无色变蓝色
【方案评价】同学们对小聪的实验方案讨论后认为:
①方案一存在缺陷,该方案不能证明猜想一是正确的,其原因是
__________________________________ 。?
②方案二也不能证明猜想三是正确的,理由是
_________________________________________ 。?
③同学们经过讨论,一致认为方案三能够证明猜想三是正确的,并讨论除此方
案外,还可以向烧杯的溶液中加入活泼金属或碳酸盐等物质进行证明。
【实验反思】在分析化学反应后所得物质成分时,还需考虑反应物的用量。
稀硫酸显酸性,也不能使酚酞溶液变色
硫酸钠也能和氯化钡反应生成白色沉淀硫酸钡
本课结束
核心知识·建构脉络图
【主干回顾】
一、溶液的酸碱性
(一)酸、碱与指示剂作用
1.概念:能跟酸或碱起反应而 _____________ 的物质。?
2.指示剂在不同性质的物质中的颜色:
主干回顾·厚积知识力
显示不同颜色
【微点拨】 酸碱指示剂遇酸性溶液或碱性溶液后,变色的是指示剂,而不是酸性溶液或碱性溶液。
【微思考】 “能使石蕊溶液变红的一定是酸溶液,使酚酞溶液变红的一定是碱溶液”,这种说法是否正确?为什么?
提示:不正确。根据指示剂颜色的变化,能判断溶液的酸碱性,但不能确定溶液一定是酸或碱。因为某些盐的溶液也可能显酸性或碱性。 ?
(二)溶液酸碱度的表示法——pH
1.溶液酸碱度的表示:
溶液的酸碱度常用 ___ 表示,pH的范围通常在 ______ 。?
pH
0~14
【微点拨】 酸、碱溶液与溶液酸碱性的关系
(1)酸溶液一定显酸性,碱溶液一定显碱性。
(2)酸性溶液不一定是酸溶液,碱性溶液不一定是碱溶液,盐溶液不一定呈中性。
(3)pH可以反映溶液的酸碱度,但不能反映是否是酸、碱、盐溶液。
2.pH的测定:
(1)用品: _______ 。?
(2)操作:在 _______________ 上放一小片pH试纸,用 _______ 蘸取待测
液点在pH试纸上,把试纸显示的颜色与 ___________ 比较,即可得出待测液
的pH。?
pH试纸
白瓷板或玻璃片
玻璃棒
标准比色卡
【微点拨】 ①pH试纸只能粗略测定溶液的酸碱度,测得的pH一般是整数。
②用pH试纸测定溶液的酸碱度时,pH试纸不能用水润湿,否则会影响溶液的pH的测定。
③不能将pH试纸直接放入待测试样溶液中,否则会污染试剂。
3.溶液酸碱性的意义:
(1)化工生产中要控制pH范围。
(2)农作物适宜在pH为7或接近7的土壤中生长。
(3)测定雨水的pH,正常雨水pH约为5.6,pH小于5.6的雨水为酸雨。
(4)测定人体内液体的pH,了解人体健康状况。
【微思考】 正常雨水的pH为什么小于7?
提示:正常的雨水由于溶解了二氧化碳形成碳酸,pH小于7。 ?
二、中和反应
1.概念: _______ 作用生成 _______ 的反应。?
2.实质:酸溶液中的 __ 和碱溶液中的 ___ 结合生成 ___ ,
即 _____________ 。?
3.表达式:酸+碱→ ______ ?
酸与碱
盐和水
H+
OH-
水
H++OH-====H2O
盐+水
【微思考】 生成盐和水的反应一定是中和反应吗?
提示:不一定。判断中和反应不仅要看生成物是否是盐和水,最重要的是看反
应物是否是酸和碱,只有酸与碱发生的反应,才是中和反应。 ?
4.盐:由 _________ 和 _________ 构成的化合物。?
金属离子
酸根离子
5.应用:
改良
土壤
① _______ 中和酸性土壤;?
②用碳酸水来中和碱性土壤
处理工
厂废水
用熟石灰中和硫酸厂的污水(反应原理:
__________________________ )?
用于医
药卫生
①用胃舒平(有效成分是氢氧化铝)等药物来医治胃酸过多(反应原理: __________________________ );?
②蚊虫叮咬后用牙膏、肥皂水涂抹
熟石灰
H2SO4+Ca(OH)2====CaSO4+2H2O
3HCl+Al(OH)3====AlCl3+3H2O
【微点拨】 (1)治疗胃酸过多的药物很多,但不能用NaOH和Ca(OH)2,因为二者具有强烈的腐蚀性。
(2)改良酸性土壤,处理工厂的酸性废水,通常用熟石灰而不用氢氧化钠,因为熟石灰价格便宜。
【自我测评】
1.(2020·烟台福山区模拟)紫甘蓝是大众爱吃的蔬菜,含有丰富的花青素。花
青素遇酸性溶液变红色,遇碱性溶液变蓝色。在凉拌紫甘蓝丝时,观察到菜丝
变成红色,可能是加入了下列哪种调味品 ( )
A.食盐 B.味精 C.食醋 D.香油
C
2.(2020·怀化中考)生活中一些常见食物的pH如下:
上述食物中,胃酸过多的人不宜食用的是 ( )
A.柠檬汁 B.牛奶 C.鸡蛋 D.红豆汁
食物
柠檬汁
鸡蛋清
纯水
牛奶
红豆汁
pH
2.0~2.5
7.4~7.6
7
6.3~8.5
10.2~11.4
A
3.(2019·重庆中考B)头发油腻是因为油脂的分泌,清洗时碱性溶液效果更好。
从pH角度考虑效果最好的洗发水的pH为 ( )
A.8 B.7 C.6 D.4
4.(2020·南京中考)按如图所示装置,玻璃棒末端固定一团喷有酚酞溶液的脱
脂棉Y。先加入物质X,再塞上带玻璃棒的橡胶塞。片刻后,能观察到喷有酚酞
溶液的脱脂棉Y变红,则物质X可能是 ( )
A.浓盐酸 B.浓氨水
C.浓醋酸 D.浓氢氧化钠溶液
A
B
5.(2020·济南钢城区模拟)如图是生活中常见洗涤用品的 pH, 混用会降低去
污效果的组合是 ( )
A.洁厕灵和消毒液
B.肥皂水和炉具清洁剂
C.消毒液和肥皂水
D.消毒液和炉具清洁剂
A
6.(易错题)向下列物质中加入稀盐酸,无明显现象的是 ( )
A.NaHCO3溶液 B.滴有酚酞的NaOH溶液
C.Fe2O3粉末 D.NaCl溶液
7.(2020·泰安岱岳区模拟)中和反应在生活中有广泛应用。下列应用不属于
中和反应的是 ( )
A.用盐酸除铁锈
B.服用含有氢氧化镁的药物治疗胃酸过多
C.用熟石灰改良酸性土壤
D.用硫酸处理印染厂含碱废水
D
A
8.(2020·衢州中考)将稀盐酸分别滴入NaOH溶液和NaCl溶液中,充分混合后均
无明显现象。混合后相关变化的微观示意图如图,下列说法正确的是( )
A.物质间均未发生化学反应
B.变化中都有新物质产生
C.混合后溶液酸碱性都不变
D.图甲可表示酸碱反应的实质
D
9.(2020·青岛黄岛区模拟)某实验小组做中和反应的实验,向盛有氢氧化钠溶液(滴有酚酞试液)的烧杯中逐滴加入稀盐酸,并不断搅拌。如图为依据实验数据绘制的V(盐酸)-pH 图。
(1)滴加盐酸的体积为V1时,溶液呈 _______________ 颜色。?
(2)滴加盐酸的体积为V2时,溶液中除了水分子外,主要的微粒有
___________________________ 。?
(3)举出中和反应的一个应用实例: __________________________________
____________________________________________________________。?
红色(或粉红色)
钠离子、氯离子(或Na+、 Cl-)
用熟石灰改良酸性土壤(或用熟石灰处
理硫酸厂废水、用稀硫酸处理印刷厂废水等。其他合理答案均可)
10.(2020·攀枝花中考)在宏观、微观、符号之间建立联系,是化学学科的主要学习内容和方法。世纪金榜导学号
回答下列问题:
(1)根据图1,HCl在水中会解离出H+和Cl-,表示为HCl====H++Cl-,则NaOH在水中
解离可表示为 _______________ 。?
(2)根据图2,氢氧化钠溶液与盐酸反应的实质可表示为:H++OH-====H2O。图3是
氯化钡溶液与硫酸钠溶液反应的微观示意图,该反应的实质可表示为
____________________ 。?
NaOH====Na++OH-
Ba2++ ====BaSO4↓
(3)氢氧化钠溶液与硫酸铜溶液反应的实质可表示为
_____________________ 。?
2OH-+Cu2+====Cu(OH)2↓
【命题点一】溶液的酸碱性和pH的关系
【典例1】(2020·临沂中考)一些食物的近似pH如表所示,下列说法正确的
是 ( )
食物苹果汁西瓜汁牛奶鸡蛋清pH2.95.86.47.6
A.牛奶放置一段时间后变酸,pH变大
B.西瓜汁比苹果汁酸性强
C.鸡蛋清和牛奶都显碱性
D.胃酸过多的人应该少饮苹果汁
考点研磨·提升审题力
食物
苹果汁
西瓜汁
牛奶
鸡蛋清
pH
2.9
5.8
6.4
7.6
D
【题组过关】
1.(2020·温州中考)新鲜果汁是常见的饮料,下列四种饮料呈弱碱性的是 ( )
D
2.(2020·德州中考)夏天我们被蚊虫叮咬后,蚊虫会在人的皮肤内分泌蚁酸(一
种酸),从而使皮肤肿痛。要减轻痛痒,可在叮咬处涂抹下列物质中的( )
A.食醋 B.酱油 C.肥皂水 D.食盐水
物质
食醋
酱油
食盐水
肥皂水
pH
2~3
4~5
7
8~9
C
【命题点二】酸碱中和反应的理解
【典例2】(2020·滨州中考)某校化学小组在利用硫酸和氢氧化钾两溶液探究
酸碱中和反应时,利用数字化传感器测得烧杯中溶液pH的变化图象如图所示。
下列说法正确的是世纪金榜导学号( )
A.图中c点所示溶液呈碱性
B.图中a点所示溶液中,含有的溶质是K2SO4和H2SO4
C.该实验是将氢氧化钾溶液逐滴滴入盛有硫酸溶液的烧杯中
D.由c点到d点的变化过程中没有发生化学反应
D
【方法点拨】
(1)根据图象判断酸滴碱还是碱滴酸的方法。
①pH开始时的图象起点小于7——碱滴酸;
②pH开始时的图象起点大于7——酸滴碱;
(2)如何判定滴定终点。
①当pH=7时恰好完全中和。如酸滴到含有无色酚酞试液的碱溶液中,若红色刚好褪去,溶液呈无色,则恰好完全反应;②如果酸滴碱时最终观察到溶液变为无色,则有2种结果,即可能恰好中和,也可能酸过量。
【题组过关】
1.(2020·泰安中考)将一定量的氢氧化钠溶液与稀盐酸混合,二者恰好完全反
应的微观示意图如下。下列说法不正确的是 ( )
A.反应前后阴、阳离子的总数目不变
B.反应前后溶液的总质量不变
C.反应后溶液呈中性
D.反应前后元素种类不变
A
2.(2020·黔西南州中考)室温下,将氢氧化钠溶液滴加到盛有一定量稀盐酸
的容器中,边滴边搅拌,用数字pH仪连接电脑实时测得pH变化曲线如图。下列相
关叙述错误的是 世纪金榜导学号( )
A.容器中发生的反应属于中和反应
B.a点溶液能使紫色石蕊溶液变红
C.b点表示HCl与NaOH等质量反应
D.c点溶液中的溶质是NaCl和NaOH
C
实验突破·强化探究力
【实验】 酸碱中和反应探究
1.原理:中和反应(如氢氧化钠溶液与盐酸的反应)中,往往无明显的实验现象,
无法确定反应是否发生及反应进行的程度,因此,需要借助指示剂或其他方法
来判断。
2.指示剂的选择
(1)一般选用酚酞溶液。NaOH等碱溶液中滴入酚酞溶液,溶液变 ___ 色。滴
入稀盐酸或稀硫酸恰好中和时,溶液呈中性,变为 ___ 色,标志着中和反应
完成。?
(2)指示剂不选用紫色石蕊溶液的原因是紫色石蕊溶液在碱溶液中呈蓝色,在
中性溶液中呈紫色,蓝色和紫色之间没有明显的界限,反应现象不明显。
红
无
3.判断中和反应是否发生的方法
判断依据
注意事项
方法一
借助酸碱指示剂的颜色变化(若用酸中和碱时)
①先在碱溶液中滴加几滴酚酞试液;
②为防止酸过量,应逐滴加入,并不断搅拌或振荡;
③当溶液恰好由红色变为无色时,恰好完全中和
方法二
借助反应中的温度变化(若用酸中和碱时)
①先测量加入烧杯中的碱溶液的温度;
②边加酸溶液边不断搅拌并及时测量、记录溶液的温度
方法三
借助反应中溶液pH的变化(若用碱中和酸时)
①先测出酸溶液的pH;
②逐滴加入碱溶液并不断搅拌,同时测定溶液的pH;③需保证溶液的pH≥7,才能证明反应发生了
4.中和反应过程中所得溶液溶质成分的判断(以氢氧化钠与盐酸反应为例)
(1)酸入碱(如图1):
取氢氧化钠溶液,滴加几滴无色酚酞溶液,慢慢滴加稀盐酸,边滴边用玻璃棒搅拌。
①A点,pH>7,溶质为NaOH;
②A~B段,pH>7,溶质为NaCl、NaOH;
③B点,pH=7,溶质为NaCl;
④B~C段,pH<7,溶质为NaCl、HCl。
(2)碱入酸(如图2):
取稀盐酸,滴加几滴无色酚酞溶液,慢慢滴加氢氧化钠溶液,边滴边用玻璃棒搅拌。
①A点,pH<7,溶质为HCl;
②A~B段,pH<7,溶质为NaCl、HCl;
③B点,pH=7,溶质为NaCl;
④B~C段,pH>7,溶质为NaOH、NaCl。
5.实验拓展
(1)酸滴定碱时检验酸是否过量的方法:a.滴加石蕊溶液;b.用pH试纸;c.加入比较活泼的金属;d.加入碳酸盐。
(2)酸滴定碱(如氢氧化钠)时,如观察到有气体产生则可能的原因是氢氧化钠已变质。
【典例】(2020·黔东南中考)做“中和反应”实验时,小聪同学向盛有氢氧化
钠溶液的烧杯中滴加稀硫酸,一会儿后发现忘了滴加酸碱指示剂,于是他停止
滴加稀硫酸。同学们对反应后溶液中含有哪些溶质展开了讨论。 世纪金榜导
学号
【提出问题】上述实验中发生反应的化学方程式为
_________________________ ,那反应后溶液中的溶质是什么??
2NaOH+H2SO4====Na2SO4+2H2O
【提出猜想】猜想一:溶质是Na2SO4
猜想二:溶质是Na2SO4 和NaOH
猜想三:溶质是 _____________ ?
【查阅资料】Na2SO4 溶液呈中性
Na2SO4 和H2SO4
【实验探究】小聪同学设计如下的实验方案
方法步骤
实验现象
实验结论
方案一
取少量烧杯中的溶液于洁净的试管中,滴入几滴无色酚酞溶液
酚酞不变红色
猜想一正确
猜想二不正确
方案二
取少量烧杯中的溶液于洁净的试管中,滴加BaCl2溶液
出现白色沉淀
猜想三正确
方案三
取少量烧杯中的溶液于洁净的试管中,加入少量的黑色CuO粉末,振荡
________________
___________ ?
猜想三正确
粉末溶解,溶液由
无色变蓝色
【方案评价】同学们对小聪的实验方案讨论后认为:
①方案一存在缺陷,该方案不能证明猜想一是正确的,其原因是
__________________________________ 。?
②方案二也不能证明猜想三是正确的,理由是
_________________________________________ 。?
③同学们经过讨论,一致认为方案三能够证明猜想三是正确的,并讨论除此方
案外,还可以向烧杯的溶液中加入活泼金属或碳酸盐等物质进行证明。
【实验反思】在分析化学反应后所得物质成分时,还需考虑反应物的用量。
稀硫酸显酸性,也不能使酚酞溶液变色
硫酸钠也能和氯化钡反应生成白色沉淀硫酸钡
本课结束
同课章节目录
- 第七单元 常见的酸和碱
- 第一节 酸及其性质
- 第二节 碱及其性质
- 第三节 溶液的酸碱性
- 第四节 酸碱中和反应
- 到实验室去:探究酸和碱的化学性质
- 第八单元 海水中的化学
- 第一节 海洋化学资源
- 第二节 海水“晒盐“
- 第三节 海水“制碱“
- 到实验室去:粗盐中难溶性杂质的去除
- 第九单元 金属
- 第一节 常见的金属材料
- 第二节 金属的化学性质
- 第三节 钢铁的锈蚀与防护
- 到实验室去 探究金属的性质
- 第十单元 化学与健康
- 第一节 食物中的有机物
- 第二节 化学元素与人体健康
- 第三节 远离有毒物质
- 第十一单元 化学与社会发展
- 第一节 化学与能源开发
- 第二节 化学与材料研制
- 第三节 化学与农业生产
- 第四节 化学与环境保护
