2021届鲁教版中考化学大一轮单元总复习:第九单元 金 属(共66张PPT)
文档属性
| 名称 | 2021届鲁教版中考化学大一轮单元总复习:第九单元 金 属(共66张PPT) |  | |
| 格式 | ppt | ||
| 文件大小 | 2.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-11-02 10:31:47 | ||
图片预览








文档简介
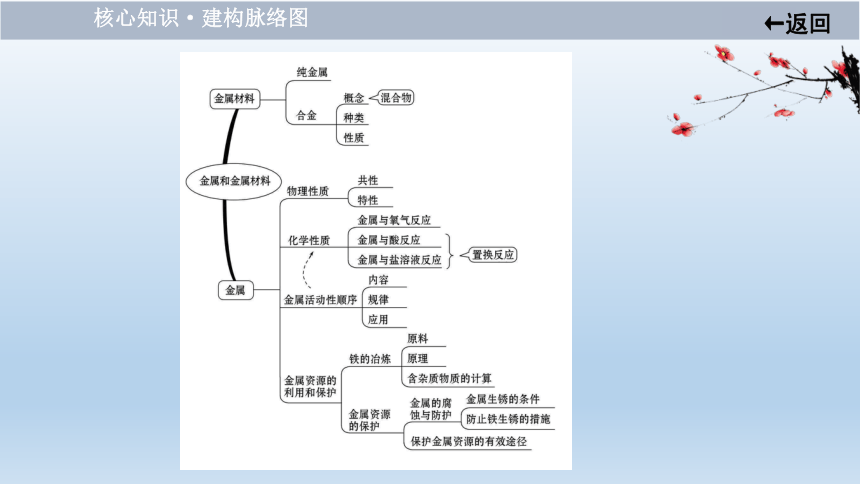
第九单元 金 属
核心知识·建构脉络图
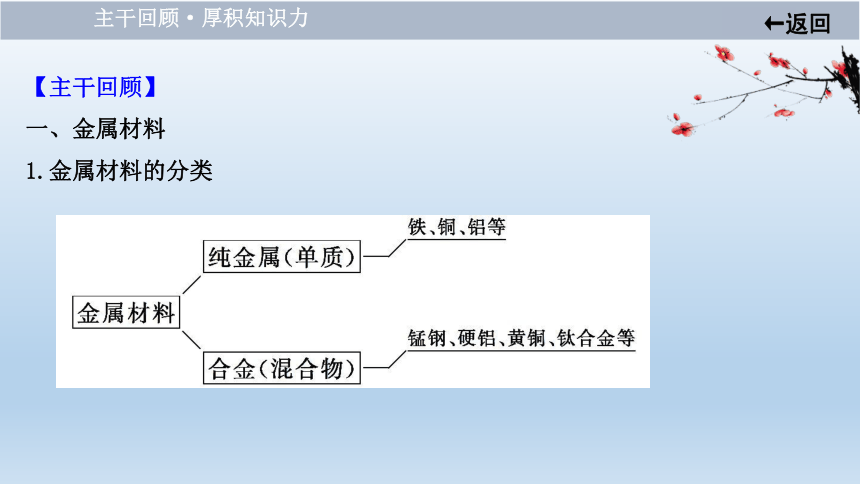
【主干回顾】
一、金属材料
1.金属材料的分类
主干回顾·厚积知识力
2.金属的物理性质
颜色
状态
(常温下)
其他
共性
银白色
固体
良好的导电性、导热性、延展性
特性
铜呈紫红色、金为黄色
汞为液态
不同金属差异较大
3.合金
概念
在金属中加热熔化某些_________或___________,形成的
具有金属特性的物质?
性能
一般比组成它的纯金属的熔点_______,硬度_______,机
械性能好?
常见的
合金
铁和钢(其区别在于___________不同),铝合金、钛合金等?
金属
非金属
低
大
含碳量
【微点拨】 (1)合金一定是混合物,可由多种金属和金属或非金属熔合而成,该过程没有生成新物质,属于物理变化。
(2)合金中一定有金属存在,但不一定都是金属与金属熔合而成,还有可能是金属与非金属熔合而成。
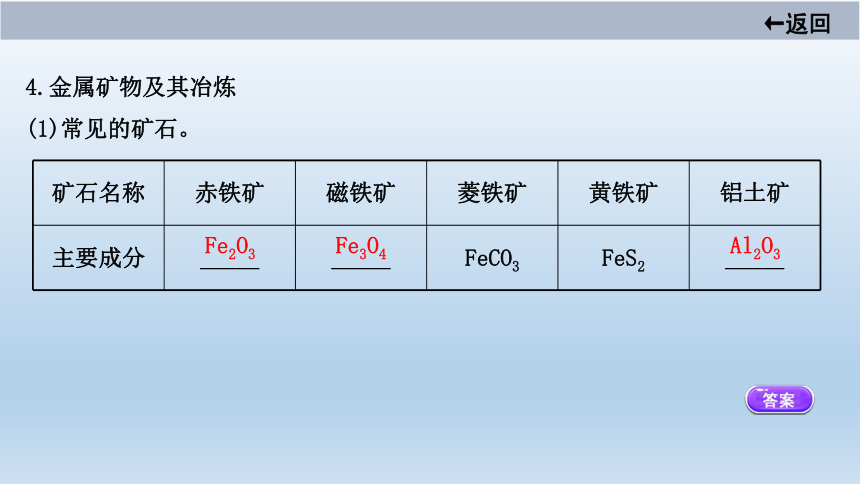
4.金属矿物及其冶炼
(1)常见的矿石。
矿石名称
赤铁矿
磁铁矿
菱铁矿
黄铁矿
铝土矿
主要成分
_____
_____
FeCO3
FeS2
_____
Fe2O3
Fe3O4
Al2O3
(2)铁的冶炼。
工业炼铁原理:化学方程式:___________________________。?
(3)还原反应:___________________________的反应。?
(4)铝的冶炼:工业上采用电解法冶炼铝,反应方程式为2Al2O3 4Al+3O2↑
3CO+Fe2O3 2Fe+3CO2
含氧化合物中的氧被夺去
高温
====
通电
====
二、金属的化学性质
1.与氧气反应
(1)规律:金属+氧气→_______________。?
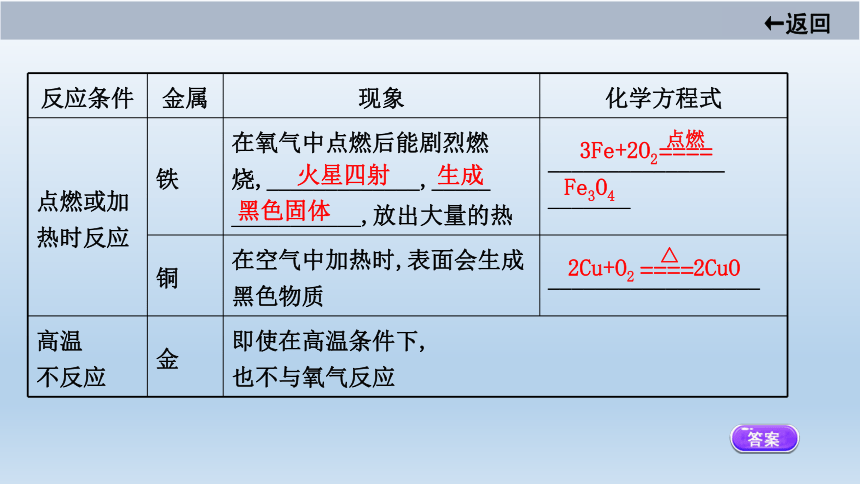
(2)常见金属与氧气反应的比较。
反应条件
金属
现象
化学方程式
常温下
能反应
镁
打磨过的镁在空气中表面逐渐变暗
__________________?
铝
打磨过的铝在空气中表面逐渐变暗
___________________?
金属氧化物
2Mg+O2====2MgO
4Al+3O2====2Al2O3
反应条件
金属
现象
化学方程式
点燃或加
热时反应
铁
在氧气中点燃后能剧烈燃
烧,_____________,_____
___________,放出大量的热?
_______________
_______?
铜
在空气中加热时,表面会生成黑色物质
__________________?
高温
不反应
金
即使在高温条件下,
也不与氧气反应
火星四射
生成
黑色固体
3Fe+2O2
Fe3O4
2Cu+O2 2CuO
点燃
====
△
====
【微思考】 铝制品和黄金制品都耐腐蚀,其原理是否相同?
提示:不相同。铝制品耐腐蚀是因为铝与氧气反应时,生成一层致密的氧化铝保护膜,黄金制品耐腐蚀是因为金的化学性质稳定,不与氧气反应。 ?
2.与稀盐酸、稀硫酸反应
(1)规律:金属+酸→____________。?
(2)反应发生的条件:排在金属活动性顺序中_________的金属与_________发生
反应。?
盐+氢气
氢前
稀酸
(3)反应现象及化学方程式。
金
属
现象
反应的化学方程式
(稀盐酸/稀硫酸)
镁
剧烈反应,产生大量气泡,溶液仍为无色
_________________________、?
_________________________?
锌
反应比较剧烈,产生大量气泡,溶液仍为无色
_____________________、
_____________________
铁
反应缓慢,有气泡生成,溶液颜色由_______
逐渐变为_________
_____________________、
_____________________
铜
无现象(不反应)
Mg+2HCl====MgCl2+H2↑
Mg+H2SO4====MgSO4+H2↑
Zn+2HCl====ZnCl2+H2↑
Zn+H2SO4====ZnSO4+H2↑
Fe+2HCl====FeCl2+H2↑
Fe+H2SO4====FeSO4+H2↑
无色
浅绿色
【微点拨】 (1)金属与酸反应都产生气泡,放出热量。
(2)越活泼的金属越容易与盐酸或稀硫酸反应。
(3)金属与酸反应后,溶液质量均增加。
(4)置换反应。
①定义:由一种_________和一种___________反应,生成另一种_________和
另一种___________的反应。?
②形式:A+BC====B+AC。
③特点:“一换一”,即一种单质从一种化合物中置换出另一种单质。注意:置
换反应过程一定存在化合价的变化。
单质
化合物
单质
化合物
【微点拨】 (1)有单质和化合物参加的反应不一定是置换反应,如CH4+2O2
CO2+2H2O。
(2)有单质和化合物生成的反应不一定是置换反应,如CO+CuO Cu+CO2。
3.与盐溶液反应
(1)规律:金属+盐→________________。?
(2)反应发生的条件。
①必须是_____________置换_______________。(K、Ca、Na除外)?
②反应中的盐必须___________。?
新盐+新金属
活泼金属
不活泼金属
溶于水
(3)常见金属与盐的反应。
反应物
现象
化学方程式
铁与硫酸铜溶液
铁丝表面覆盖一层紫红色的物质,
溶液由蓝色逐渐变为_________
色?
_______________
__________?
铝与硫酸铜溶液
铝丝表面覆盖一层紫红色的物质,
溶液由_______色逐渐变为_______
色?
________________
_______________
铜与硝酸银溶液
铜丝表面覆盖一层_________色的
物质,溶液由_______色逐渐变为
_______色?
_______________
______________
浅绿
Fe+CuSO4====
Cu+FeSO4
蓝
无
2Al+3CuSO4====
Al2(SO4)3+3Cu ?
银白
无
蓝
Cu+2AgNO3====
Cu(NO3)2+2Ag ?
【微点拨】 铁单质与酸或盐溶液发生置换反应时,生成的化合物中铁元素为+2价,读作亚铁,溶液呈浅绿色。
三、金属活动性顺序
1.金属活动性顺序
2.意义:
在金属活动性顺序里:
(1)金属的位置越靠前,它的活动性_________。?
(2)位于_______前面的金属能置换出酸中的_______。(3)_____________的金
属能把_____________的金属从它们的盐溶液里置换出来(K、Ca、Na除外)。
越强
氢
氢
位于前面
位于后面
3.应用:
四、钢铁的锈蚀与防护
1.钢铁锈蚀的条件
钢铁的锈蚀是铁与空气中的_________、___________等物质发生化学反应的
结果。?
2.减缓钢铁锈蚀的方法:
(1)保持钢铁制品表面的_______________。?
(2)在金属表面覆盖保护层,镀上一层___________________。?
(3)改变金属的_______________(制成合金)。?
3.回收利用废旧金属的意义:回收利用废旧金属,既保护环境,又能节约资源和
能源。
氧气
水蒸气
清洁、干燥
不易锈蚀的金属
组成和结构
【核心反应】
请以铁(Fe)为中心,按照思路盘点并规范书写化学方程式。
①_______________________
②_____________________________________________________
③___________________________
④_______________________________________________________________
⑤____________________________?
3Fe+2O2 Fe3O4 ?
Fe +H2SO4====FeSO4+ H2↑、Fe+ 2HCl====FeCl2+ H2↑ ?
Fe+ CuSO4====FeSO4+ Cu ?
Fe2O3+ 6HCl====2FeCl3+ 3H2O、Fe2O3 +3H2SO4====Fe2(SO4)3+ 3H2O ?
3CO+ Fe2O3 2Fe +3CO2
点燃
====
高温
====
【自我测评】
1.(2020·河南中考)金属材料在生产,生活中使用广泛。下列金属的用途利用
了金属导电性的是 ( )
A.铜制电线 B.铁制铁锅
C.金制项链 D.铝制饮料罐
2.(2020·淄博博山月考)下列物质中,属于合金的是 ( )
A.赤铁矿 B.水银
C.四氧化三铁 D.不锈钢
A
D
3.下列四种金属中,能与稀硫酸反应放出H2的是 ( )
A.Cu B.Ag
C.Zn D.Hg
4.(2020·台州中考)铁在海水中容易被锈蚀、通常在轮船的吃水线以下焊接比
铁更活泼的金属块,用于保护铁质船壳。该金属块的材料可以是 ( )
A.金 B.银
C.铜 D.锌
C
D
5.(2020·湘潭中考)我国第一艘国产航母“山东舰”在制造的过程中使用了大
量的金属材料。下列有关金属材料的说法错误的是 ( )
A.合金的硬度一般比组成它们的纯金属更高
B.钢铁是使用最多的金属材料
C.金属在常温下都是固体
D.大多数金属为电和热的优良导体
C
6.(2020·济宁曲阜模拟)如图所示反应,有关说法错误的是 ( )
A.铝丝需要砂纸打磨
B.溶液由蓝色变为无色
C.金属活动性强弱:Al>Cu
D.反应的化学方程式为Al+CuSO4====Cu+AlSO4
D
7.按如图装置进行实验,一周后发现铁钉锈蚀最严重的位置是 ( )
A.a处 B.b处
C.c处 D.三处同样严重
B
8.下面对金属的利用,不是由金属活动性决定的是 ( )
A.用焊锡焊接金属
B.用铁回收含银废液中的银
C.古代金银制品能保存至今
D.用锌与稀硫酸反应制取氢气
A
9.(2020·济南天桥区模拟)下列关于铁、锌、铜三种金属及其合金的说法不正
确的是 ( )
A.铁在潮湿的空气中易生锈
B.可以用铁桶盛放硫酸铜溶液
C.可以用稀硫酸鉴别锌与铜的金属活动性强弱
D.黄铜(铜与锌的合金)的硬度大于纯铜
B
10.下列描述与事实不符的是 ( )
A.将铁钉放在硫酸铜溶液中,铁钉上有红色固体附着,溶液的颜色不变
B.氢气在空气中燃烧时放出大量的热,火焰呈淡蓝色
C.铁丝在氧气中剧烈燃烧,火星四射,生成四氧化三铁
D.镁与稀盐酸反应有无色、无味气体产生,放出热量
A
11.(2020·淄博期末)某些化学小组设计了验证Fe、Cu、Ag的金属活动性顺序
的四种方案,各个方案选用的试剂如下,其中不可行的是 世纪金榜导学号( )
A.Fe、CuSO4溶液、Ag
B.FeCl2溶液、Cu、AgNO3溶液
C.Ag、CuSO4溶液、FeSO4溶液
D.Fe、Cu、AgNO3溶液、盐酸
C
12.(2019·镇江中考)合金是重要的金属材料。
(1)Mg、Al按一定比例熔合后冷却可得到储氢合金材料。该过程属于_________
(选填“物理”或“化学”)变化。?
(2)图中能表示锡铅合金的是______(选填“a”“b”或“c”)?
物理
a
13.(2020·苏州中考)铝是大自然赐予人类的宝物,是现代文明不可缺少的物
质基础。 世纪金榜导学号
(1)人类冶炼和使用金属铝的时间较晚。可能是因为______(填字母)。?
a.地壳中铝元素含量少
b.冶炼铝的技术要求高
(2)用铝锂合金制造“神舟号”航天飞船的一些部件,主要是利用其强度高、耐
腐蚀和___________________(写一条)等性质。高温下,铝与Li2O反应可置换出金
属锂,写出该反应的化学方程式:____________________________。?
b
密度小(质轻等)
2Al+3Li2O 6Li+Al2O3
高温
====
(3)用砂纸去除铝片表面的氧化膜,将其浸入硫酸铜溶液中,一段时间后,观察到
铝片表面有红色物质析出,并有气泡产生,经检验气体为氢气。
①写出生成红色物质的化学方程式:______________________________。?
②硫酸铜溶液中的阳离子有____________(填离子符号)。?
(4)原子簇是若干个原子的聚集体,有望开发成新材料。某铝原子簇由13个铝原
子构成,其最外层电子数的总和为40时相对稳定。写出该稳定铝原子簇的微粒
符号:_______。(铝原子的结构示意图为 )?
2Al+3CuSO4====Al2(SO4)3+3Cu
Cu2+和H+
14.(2020·滨州邹平模拟)某化学兴趣小组利用如图所示装置进行实验,来研究工业炼铁的化学原理,试按要求填空:
(1)硬质玻璃管中观察到的现象是_________________,写出一氧化碳和氧化铁
反应的化学方程式___________________________。?
(2)实验中首先通入一氧化碳的目的是__________________________________
___________。?
(3)装置中导管末端加一点燃的酒精灯的目的是__________________________。?
红色变为黑色
3CO+Fe2O3 2Fe+3CO2
排尽空气,防止一氧化碳混有空气加
热时爆炸
处理尾气,防止污染环境
高温
====
命题点一 金属活动性顺序的判断及应用
【典例1】(2020·青岛中考)某同学为验证镁、铁、铜、银的金属活动性顺序,
设计了下图所示的四个实验(金属片均已打磨,且其形状大小相同;实验①②③
所用盐酸的溶质质量分数和体积均相同)。下列分析不正确的是 ( )
A.对比实验①②反应的剧烈程度,能判断出镁和铁的金属活动性强弱
B.分析实验②④的现象,能判断出铁、铜、银的金属活动性强弱
C.分析实验④的现象,能判断出铜和银的金属活动性强弱
D.分析四个实验的现象,能判断出镁、铁、铜、银的金属活动性顺序
考点研磨·提升审题力
B
【方法点拨】判断金属活动性顺序的方法
(1)金属与氧气的反应:金属与氧气反应越剧烈,说明金属活动性越强;
(2)金属与酸的反应:金属与盐酸、稀硫酸反应越剧烈,说明金属活动性越强;
(3)金属与盐溶液的反应:金属能与盐溶液反应,说明该金属的活动性比盐中的金属活动性强。
(4)金属活动性顺序表中:金属位置越靠前,活动性越强;
(5)在自然界的存在形式:以化合物形式存在的金属比以单质形式存在的金属活动性强。
【典例2】(2020·葫芦岛中考)将一定质量的Zn放入Cu(NO3)2和AgNO3的混合溶
液中,充分反应后过滤,得到滤渣和滤液,下列说法错误的是 ( )
世纪金榜导学号
A.滤渣中只含有Ag时,滤液一定呈蓝色
B.滤渣中含有Cu和Ag时,滤液一定呈无色
C.滤渣中含有Zn时,滤液中的溶质只有Zn(NO3)2
D.滤渣中含有Cu时,滤液中的溶质一定没有AgNO3
B
【题组过关】
1.(2020·湘西州中考)将甲、乙两种金属片分别放入CuSO4溶液中,甲表面析出
金属Cu,乙表面没有发生反应,据此判断,三种金属的活动性顺序是( )
A.甲>铜>乙 B.铜>甲>乙
C.乙>铜>甲 D.甲>乙>铜
A
2.(2020·广元中考)向硝酸银和硝酸铜的混合溶液中加入一定量的锌粉,充分
反应后过滤,得到滤渣和滤液,再向滤渣中加入稀盐酸,有气泡产生,下列说法正
确的是 ( )
A.滤液可能呈蓝色
B.向滤液中加入稀盐酸无明显现象
C.滤渣中只有Ag、Cu
D.滤液中的阳离子有Ag+、Cu2+、Zn2+
B
3.(2020·聊城冠县模拟)某化工厂的废液中主要含有硝酸银、硝酸铜。取一定
量的该废液样品,加入镁粉和铜粉,充分反应后过滤,得到滤液和滤渣。请填写
下列空格: 世纪金榜导学号
(1)若滤渣中有镁粉,则滤渣中除镁粉外还含有___________(填写化学式,下
同)。?
(2)若滤渣中有铜粉,则滤液中的溶质一定含有____________,可能含有
____________。?
Cu、Ag
Mg(NO3)2
Cu(NO3)2
(3)若滤渣中没有铜粉,则滤液中的溶质一定含有_____________________,可能
含有_________。?
(4)反应后得到滤液的质量_________(填“小于”“大于”或“等于”)反应前
所取废液样品的质量。?
Mg(NO3)2、Cu(NO3)2
AgNO3
小于
命题点二 金属与酸反应的图象分析
【典例3】(2020·济宁中考)在两只烧杯中分别放入相同质量的镁、锌两种金
属,然后向两只烧杯中分别倒入相同质量、相同质量分数的稀硫酸,反应产生氢
气的质量与消耗硫酸的质量关系如图。综合以上信息得到以下结论,合理的是
世纪金榜导学号( )
A.从图象可以看出,金属镁比金属锌的活动性强
B.若两种金属都有剩余,二者得到的氢气质量相同
C.若硫酸有剩余,二者得到氢气的质量相同
D.若两种金属完全溶解,二者消耗硫酸的质量相同
B
【方法点拨】活泼金属与盐酸(或稀硫酸)反应的坐标图象分析方法
1.等质氢图:
两种金属反应产生的氢气质量相同,如图所示反映两种情况:
(1)酸不足,金属过量,产生的氢气质量由酸的质量决定。
(2)酸足量,投放的两种金属与酸反应产生氢气的质量恰好完
全相同,如6.5 g锌和5.6 g铁分别投入足量的盐酸中反应产生
的氢气质量相同。
2.等质等价金属图:
如等质量的镁、铁、锌与足量的酸反应生成的金属离子都
是+2价,产生氢气的速率和质量不同,如图所示反映两种情
况:
(1)金属越活泼,图示反应物的线越陡,如Mg线比Zn线陡,Zn
线比Fe线陡。
(2)金属的相对原子质量越小,与酸反应产生的氢气越多,曲线的拐点越高。可简单概括为:越陡越活,越高越小。
3.等质不等价金属图:
铝、镁、锌与酸反应生成金属离子的化合价分别为+3、
+2、+2,如图所示反映出等质不等价金属与酸反应不仅
速率不同而且产生氢气的质量与金属化合价有关。可
用下式计算氢气质量:m(H2)= 。
【题组过关】
1.(2020·丽水中考)取一定质量的锌粒和铜片于同一敞口容器中,再逐渐加入
稀硫酸。加入稀硫酸的质量与有关量的变化关系图正确的是 ( )
C
2.(2020·烟台福山区模拟)现有等质量甲、乙、丙三种金属,分别放入三份溶
质质量分数相同的足量稀硫酸中,生成氢气的质量与反应时间的关系如图所示
(已知甲、乙、丙在生成物中化合价均为+2价)。则下列说法中不正确的是
世纪金榜导学号( )
A.生成氢气的质量:甲>乙>丙
B.相对原子质量:乙>丙>甲
C.金属活动性:乙>甲>丙
D.消耗硫酸的质量:甲>乙>丙
B
3.(2020·襄阳中考)向质量均为m的锌粉和铁粉中分别滴加100 g相同质量分数
的稀硫酸,反应过程中产生气体的质量与所加稀硫酸的质量关系如图所示,下列
叙述正确的是 ( )
A.反应后均得到无色溶液
B.反应结束后两种金属均有剩余
C.折线b表示的是铁和稀硫酸反应的情况
D.反应结束后所得溶液的质量相等
C
实验突破·强化探究力
实验一 金属活动性顺序的探究
1.实验方案
判断依据
实验设计
判断方法
方
案
1
金属与氧气反应
点燃或加热金属
反应越剧烈则活动性越强
方
案
2
金属能否与酸反应
将金属放入相同
浓度的酸溶液中
能反应则金属位于金属活动性顺序中氢前;不能反应则位于氢后
判断依据
实验设计
判断方法
方
案
3
金属与酸溶
液反应速率
的大小
取相同质量的金
属放入相同浓
度的酸溶液中
反应速率大的金属更活泼
方
案
4
金属与另一金属的盐溶液能否反应
将金属放入另
一种金属的盐溶
液中
若A能置换出B,则A的活动性比B的强;若不能置换,则B的活动性比A的强
2.试剂的选择
(1)将要验证的金属按活动性顺序排出。
(2)若发现有两种金属位于H的前面,则直接选择运用金属与酸(盐酸或稀硫酸)的反应原理进行验证;
(3)若用三种试剂验证三种金属的活动性顺序,可采取以下两种方案:
①“两端金属中间盐”,即选择活动性位于中间的金属的可溶性盐溶液和位于两侧的金属单质;
②“中间金属两端盐”,即选择活动性位于中间的金属单质放入位于两侧的金属盐溶液中。
3.实验注意事项
(1)实验前必须打磨金属表面,除去表面氧化层或污物。
(2)做金属与酸反应的实验时一般用稀盐酸或稀硫酸,不用硝酸和浓硫酸。
(3)金属与盐溶液反应,盐必须可溶于水。
(4)并不是所有排在前面的金属都能把排在后面的金属从盐溶液中置换出来,如K、Ca、Na。
【典例】(2020·岳阳中考)验证铝、铜、银的金属活动性强弱,小明设计了以
下四组实验,下列说法不正确的是 ( )
A.通过①②实验,可以证明金属活动性Al>Cu
B.通过①②③实验,可以证明金属活动性Al>Cu>Ag
C.若要用实验④证明金属活动性Al>Cu,X可以为Al,Y为CuSO4溶液
D.若要用实验④证明金属活动性Cu>Ag,X可以为Cu,Y为AgNO3溶液
B
实验二 一氧化碳还原氧化铁的实验探究
1.实验原理
在高温条件下,用还原剂CO将铁从铁矿石中还原出来。发生反应的化学方程式
为___________________________。?
2.实验装置
3CO+Fe2O3 2Fe+3CO2
高温
====
3.实验步骤:
序号
步骤
目的
1
点燃装置末端的酒精灯
防止未参与反应的CO排放到空气中造成空气污染
2
先通入CO再点燃酒精喷灯
排尽装置中的空气,防止CO和空气混合物受热爆炸
3
实验结束后先熄灭酒精喷灯,后停止通CO
防止生成的铁在高温下重新被氧化
4
待玻璃管冷却后再熄灭酒精灯
CO作保护气使装置冷却,防止未参与反应的CO排放到空气中造成空气污染
4.实验现象
玻璃管中的红棕色固体变为_________;试管内澄清石灰水___________;导管
口产生_____________。?
5.实验事项
一氧化碳有毒,实验装置中必须有尾气处理装置(点燃或用气球收集)。
黑色
变浑浊
蓝色火焰
【典例】(2020·株洲中考)下图为一氧化碳还原氧化铁示意图。
(1)写出试管b中涉及的主要反应的化学方程式
___________________________。?
(2)c处操作的目的为______________________________________。?
CO2+Ca(OH)2====CaCO3↓+H2O
尾气处理,防止未反应的CO进入空气中
【变式题1】(改用微型实验装置)(2020·苏州中考)利用如图所示实验装置模
拟工业炼铁。下列说法正确的是 ( )
A.实验时应先点燃酒精灯后通CO
B.充分加热,a处固体由黑色变为红色
C.b处可用澄清石灰水检验生成的CO2
D.可用NaOH溶液吸收尾气中的CO
C
【变式题2】(改变尾气处理装置)(2019·湘潭中考)钢铁厂会利用焦炭产生的
还原性气体来炼铁,某同学用此原理按如图装置进行实验。下列说法正确的
是 世纪金榜导学号( )
A.该实验不需要增加尾气处理装置
B.该实验应先通入一段时间的CO验纯后再加热
C.NaOH溶液可以检验气体产物
D.反应结束后,含有未反应的Fe2O3固体,可以采用加入盐酸的方法来提纯铁
B
【方法点拨】一氧化碳还原氧化铁的实验需注意“一通、二点、三灭、四停、五处理”:
“一通”先通一氧化碳;“二点”后点燃酒精喷灯加热;“三灭”实验完毕后,先熄灭酒精喷灯;“四停”等到玻璃管冷却至室温时再停止通一氧化碳;“五处理”处理尾气,防止CO污染环境。
本课结束
核心知识·建构脉络图
【主干回顾】
一、金属材料
1.金属材料的分类
主干回顾·厚积知识力
2.金属的物理性质
颜色
状态
(常温下)
其他
共性
银白色
固体
良好的导电性、导热性、延展性
特性
铜呈紫红色、金为黄色
汞为液态
不同金属差异较大
3.合金
概念
在金属中加热熔化某些_________或___________,形成的
具有金属特性的物质?
性能
一般比组成它的纯金属的熔点_______,硬度_______,机
械性能好?
常见的
合金
铁和钢(其区别在于___________不同),铝合金、钛合金等?
金属
非金属
低
大
含碳量
【微点拨】 (1)合金一定是混合物,可由多种金属和金属或非金属熔合而成,该过程没有生成新物质,属于物理变化。
(2)合金中一定有金属存在,但不一定都是金属与金属熔合而成,还有可能是金属与非金属熔合而成。
4.金属矿物及其冶炼
(1)常见的矿石。
矿石名称
赤铁矿
磁铁矿
菱铁矿
黄铁矿
铝土矿
主要成分
_____
_____
FeCO3
FeS2
_____
Fe2O3
Fe3O4
Al2O3
(2)铁的冶炼。
工业炼铁原理:化学方程式:___________________________。?
(3)还原反应:___________________________的反应。?
(4)铝的冶炼:工业上采用电解法冶炼铝,反应方程式为2Al2O3 4Al+3O2↑
3CO+Fe2O3 2Fe+3CO2
含氧化合物中的氧被夺去
高温
====
通电
====
二、金属的化学性质
1.与氧气反应
(1)规律:金属+氧气→_______________。?
(2)常见金属与氧气反应的比较。
反应条件
金属
现象
化学方程式
常温下
能反应
镁
打磨过的镁在空气中表面逐渐变暗
__________________?
铝
打磨过的铝在空气中表面逐渐变暗
___________________?
金属氧化物
2Mg+O2====2MgO
4Al+3O2====2Al2O3
反应条件
金属
现象
化学方程式
点燃或加
热时反应
铁
在氧气中点燃后能剧烈燃
烧,_____________,_____
___________,放出大量的热?
_______________
_______?
铜
在空气中加热时,表面会生成黑色物质
__________________?
高温
不反应
金
即使在高温条件下,
也不与氧气反应
火星四射
生成
黑色固体
3Fe+2O2
Fe3O4
2Cu+O2 2CuO
点燃
====
△
====
【微思考】 铝制品和黄金制品都耐腐蚀,其原理是否相同?
提示:不相同。铝制品耐腐蚀是因为铝与氧气反应时,生成一层致密的氧化铝保护膜,黄金制品耐腐蚀是因为金的化学性质稳定,不与氧气反应。 ?
2.与稀盐酸、稀硫酸反应
(1)规律:金属+酸→____________。?
(2)反应发生的条件:排在金属活动性顺序中_________的金属与_________发生
反应。?
盐+氢气
氢前
稀酸
(3)反应现象及化学方程式。
金
属
现象
反应的化学方程式
(稀盐酸/稀硫酸)
镁
剧烈反应,产生大量气泡,溶液仍为无色
_________________________、?
_________________________?
锌
反应比较剧烈,产生大量气泡,溶液仍为无色
_____________________、
_____________________
铁
反应缓慢,有气泡生成,溶液颜色由_______
逐渐变为_________
_____________________、
_____________________
铜
无现象(不反应)
Mg+2HCl====MgCl2+H2↑
Mg+H2SO4====MgSO4+H2↑
Zn+2HCl====ZnCl2+H2↑
Zn+H2SO4====ZnSO4+H2↑
Fe+2HCl====FeCl2+H2↑
Fe+H2SO4====FeSO4+H2↑
无色
浅绿色
【微点拨】 (1)金属与酸反应都产生气泡,放出热量。
(2)越活泼的金属越容易与盐酸或稀硫酸反应。
(3)金属与酸反应后,溶液质量均增加。
(4)置换反应。
①定义:由一种_________和一种___________反应,生成另一种_________和
另一种___________的反应。?
②形式:A+BC====B+AC。
③特点:“一换一”,即一种单质从一种化合物中置换出另一种单质。注意:置
换反应过程一定存在化合价的变化。
单质
化合物
单质
化合物
【微点拨】 (1)有单质和化合物参加的反应不一定是置换反应,如CH4+2O2
CO2+2H2O。
(2)有单质和化合物生成的反应不一定是置换反应,如CO+CuO Cu+CO2。
3.与盐溶液反应
(1)规律:金属+盐→________________。?
(2)反应发生的条件。
①必须是_____________置换_______________。(K、Ca、Na除外)?
②反应中的盐必须___________。?
新盐+新金属
活泼金属
不活泼金属
溶于水
(3)常见金属与盐的反应。
反应物
现象
化学方程式
铁与硫酸铜溶液
铁丝表面覆盖一层紫红色的物质,
溶液由蓝色逐渐变为_________
色?
_______________
__________?
铝与硫酸铜溶液
铝丝表面覆盖一层紫红色的物质,
溶液由_______色逐渐变为_______
色?
________________
_______________
铜与硝酸银溶液
铜丝表面覆盖一层_________色的
物质,溶液由_______色逐渐变为
_______色?
_______________
______________
浅绿
Fe+CuSO4====
Cu+FeSO4
蓝
无
2Al+3CuSO4====
Al2(SO4)3+3Cu ?
银白
无
蓝
Cu+2AgNO3====
Cu(NO3)2+2Ag ?
【微点拨】 铁单质与酸或盐溶液发生置换反应时,生成的化合物中铁元素为+2价,读作亚铁,溶液呈浅绿色。
三、金属活动性顺序
1.金属活动性顺序
2.意义:
在金属活动性顺序里:
(1)金属的位置越靠前,它的活动性_________。?
(2)位于_______前面的金属能置换出酸中的_______。(3)_____________的金
属能把_____________的金属从它们的盐溶液里置换出来(K、Ca、Na除外)。
越强
氢
氢
位于前面
位于后面
3.应用:
四、钢铁的锈蚀与防护
1.钢铁锈蚀的条件
钢铁的锈蚀是铁与空气中的_________、___________等物质发生化学反应的
结果。?
2.减缓钢铁锈蚀的方法:
(1)保持钢铁制品表面的_______________。?
(2)在金属表面覆盖保护层,镀上一层___________________。?
(3)改变金属的_______________(制成合金)。?
3.回收利用废旧金属的意义:回收利用废旧金属,既保护环境,又能节约资源和
能源。
氧气
水蒸气
清洁、干燥
不易锈蚀的金属
组成和结构
【核心反应】
请以铁(Fe)为中心,按照思路盘点并规范书写化学方程式。
①_______________________
②_____________________________________________________
③___________________________
④_______________________________________________________________
⑤____________________________?
3Fe+2O2 Fe3O4 ?
Fe +H2SO4====FeSO4+ H2↑、Fe+ 2HCl====FeCl2+ H2↑ ?
Fe+ CuSO4====FeSO4+ Cu ?
Fe2O3+ 6HCl====2FeCl3+ 3H2O、Fe2O3 +3H2SO4====Fe2(SO4)3+ 3H2O ?
3CO+ Fe2O3 2Fe +3CO2
点燃
====
高温
====
【自我测评】
1.(2020·河南中考)金属材料在生产,生活中使用广泛。下列金属的用途利用
了金属导电性的是 ( )
A.铜制电线 B.铁制铁锅
C.金制项链 D.铝制饮料罐
2.(2020·淄博博山月考)下列物质中,属于合金的是 ( )
A.赤铁矿 B.水银
C.四氧化三铁 D.不锈钢
A
D
3.下列四种金属中,能与稀硫酸反应放出H2的是 ( )
A.Cu B.Ag
C.Zn D.Hg
4.(2020·台州中考)铁在海水中容易被锈蚀、通常在轮船的吃水线以下焊接比
铁更活泼的金属块,用于保护铁质船壳。该金属块的材料可以是 ( )
A.金 B.银
C.铜 D.锌
C
D
5.(2020·湘潭中考)我国第一艘国产航母“山东舰”在制造的过程中使用了大
量的金属材料。下列有关金属材料的说法错误的是 ( )
A.合金的硬度一般比组成它们的纯金属更高
B.钢铁是使用最多的金属材料
C.金属在常温下都是固体
D.大多数金属为电和热的优良导体
C
6.(2020·济宁曲阜模拟)如图所示反应,有关说法错误的是 ( )
A.铝丝需要砂纸打磨
B.溶液由蓝色变为无色
C.金属活动性强弱:Al>Cu
D.反应的化学方程式为Al+CuSO4====Cu+AlSO4
D
7.按如图装置进行实验,一周后发现铁钉锈蚀最严重的位置是 ( )
A.a处 B.b处
C.c处 D.三处同样严重
B
8.下面对金属的利用,不是由金属活动性决定的是 ( )
A.用焊锡焊接金属
B.用铁回收含银废液中的银
C.古代金银制品能保存至今
D.用锌与稀硫酸反应制取氢气
A
9.(2020·济南天桥区模拟)下列关于铁、锌、铜三种金属及其合金的说法不正
确的是 ( )
A.铁在潮湿的空气中易生锈
B.可以用铁桶盛放硫酸铜溶液
C.可以用稀硫酸鉴别锌与铜的金属活动性强弱
D.黄铜(铜与锌的合金)的硬度大于纯铜
B
10.下列描述与事实不符的是 ( )
A.将铁钉放在硫酸铜溶液中,铁钉上有红色固体附着,溶液的颜色不变
B.氢气在空气中燃烧时放出大量的热,火焰呈淡蓝色
C.铁丝在氧气中剧烈燃烧,火星四射,生成四氧化三铁
D.镁与稀盐酸反应有无色、无味气体产生,放出热量
A
11.(2020·淄博期末)某些化学小组设计了验证Fe、Cu、Ag的金属活动性顺序
的四种方案,各个方案选用的试剂如下,其中不可行的是 世纪金榜导学号( )
A.Fe、CuSO4溶液、Ag
B.FeCl2溶液、Cu、AgNO3溶液
C.Ag、CuSO4溶液、FeSO4溶液
D.Fe、Cu、AgNO3溶液、盐酸
C
12.(2019·镇江中考)合金是重要的金属材料。
(1)Mg、Al按一定比例熔合后冷却可得到储氢合金材料。该过程属于_________
(选填“物理”或“化学”)变化。?
(2)图中能表示锡铅合金的是______(选填“a”“b”或“c”)?
物理
a
13.(2020·苏州中考)铝是大自然赐予人类的宝物,是现代文明不可缺少的物
质基础。 世纪金榜导学号
(1)人类冶炼和使用金属铝的时间较晚。可能是因为______(填字母)。?
a.地壳中铝元素含量少
b.冶炼铝的技术要求高
(2)用铝锂合金制造“神舟号”航天飞船的一些部件,主要是利用其强度高、耐
腐蚀和___________________(写一条)等性质。高温下,铝与Li2O反应可置换出金
属锂,写出该反应的化学方程式:____________________________。?
b
密度小(质轻等)
2Al+3Li2O 6Li+Al2O3
高温
====
(3)用砂纸去除铝片表面的氧化膜,将其浸入硫酸铜溶液中,一段时间后,观察到
铝片表面有红色物质析出,并有气泡产生,经检验气体为氢气。
①写出生成红色物质的化学方程式:______________________________。?
②硫酸铜溶液中的阳离子有____________(填离子符号)。?
(4)原子簇是若干个原子的聚集体,有望开发成新材料。某铝原子簇由13个铝原
子构成,其最外层电子数的总和为40时相对稳定。写出该稳定铝原子簇的微粒
符号:_______。(铝原子的结构示意图为 )?
2Al+3CuSO4====Al2(SO4)3+3Cu
Cu2+和H+
14.(2020·滨州邹平模拟)某化学兴趣小组利用如图所示装置进行实验,来研究工业炼铁的化学原理,试按要求填空:
(1)硬质玻璃管中观察到的现象是_________________,写出一氧化碳和氧化铁
反应的化学方程式___________________________。?
(2)实验中首先通入一氧化碳的目的是__________________________________
___________。?
(3)装置中导管末端加一点燃的酒精灯的目的是__________________________。?
红色变为黑色
3CO+Fe2O3 2Fe+3CO2
排尽空气,防止一氧化碳混有空气加
热时爆炸
处理尾气,防止污染环境
高温
====
命题点一 金属活动性顺序的判断及应用
【典例1】(2020·青岛中考)某同学为验证镁、铁、铜、银的金属活动性顺序,
设计了下图所示的四个实验(金属片均已打磨,且其形状大小相同;实验①②③
所用盐酸的溶质质量分数和体积均相同)。下列分析不正确的是 ( )
A.对比实验①②反应的剧烈程度,能判断出镁和铁的金属活动性强弱
B.分析实验②④的现象,能判断出铁、铜、银的金属活动性强弱
C.分析实验④的现象,能判断出铜和银的金属活动性强弱
D.分析四个实验的现象,能判断出镁、铁、铜、银的金属活动性顺序
考点研磨·提升审题力
B
【方法点拨】判断金属活动性顺序的方法
(1)金属与氧气的反应:金属与氧气反应越剧烈,说明金属活动性越强;
(2)金属与酸的反应:金属与盐酸、稀硫酸反应越剧烈,说明金属活动性越强;
(3)金属与盐溶液的反应:金属能与盐溶液反应,说明该金属的活动性比盐中的金属活动性强。
(4)金属活动性顺序表中:金属位置越靠前,活动性越强;
(5)在自然界的存在形式:以化合物形式存在的金属比以单质形式存在的金属活动性强。
【典例2】(2020·葫芦岛中考)将一定质量的Zn放入Cu(NO3)2和AgNO3的混合溶
液中,充分反应后过滤,得到滤渣和滤液,下列说法错误的是 ( )
世纪金榜导学号
A.滤渣中只含有Ag时,滤液一定呈蓝色
B.滤渣中含有Cu和Ag时,滤液一定呈无色
C.滤渣中含有Zn时,滤液中的溶质只有Zn(NO3)2
D.滤渣中含有Cu时,滤液中的溶质一定没有AgNO3
B
【题组过关】
1.(2020·湘西州中考)将甲、乙两种金属片分别放入CuSO4溶液中,甲表面析出
金属Cu,乙表面没有发生反应,据此判断,三种金属的活动性顺序是( )
A.甲>铜>乙 B.铜>甲>乙
C.乙>铜>甲 D.甲>乙>铜
A
2.(2020·广元中考)向硝酸银和硝酸铜的混合溶液中加入一定量的锌粉,充分
反应后过滤,得到滤渣和滤液,再向滤渣中加入稀盐酸,有气泡产生,下列说法正
确的是 ( )
A.滤液可能呈蓝色
B.向滤液中加入稀盐酸无明显现象
C.滤渣中只有Ag、Cu
D.滤液中的阳离子有Ag+、Cu2+、Zn2+
B
3.(2020·聊城冠县模拟)某化工厂的废液中主要含有硝酸银、硝酸铜。取一定
量的该废液样品,加入镁粉和铜粉,充分反应后过滤,得到滤液和滤渣。请填写
下列空格: 世纪金榜导学号
(1)若滤渣中有镁粉,则滤渣中除镁粉外还含有___________(填写化学式,下
同)。?
(2)若滤渣中有铜粉,则滤液中的溶质一定含有____________,可能含有
____________。?
Cu、Ag
Mg(NO3)2
Cu(NO3)2
(3)若滤渣中没有铜粉,则滤液中的溶质一定含有_____________________,可能
含有_________。?
(4)反应后得到滤液的质量_________(填“小于”“大于”或“等于”)反应前
所取废液样品的质量。?
Mg(NO3)2、Cu(NO3)2
AgNO3
小于
命题点二 金属与酸反应的图象分析
【典例3】(2020·济宁中考)在两只烧杯中分别放入相同质量的镁、锌两种金
属,然后向两只烧杯中分别倒入相同质量、相同质量分数的稀硫酸,反应产生氢
气的质量与消耗硫酸的质量关系如图。综合以上信息得到以下结论,合理的是
世纪金榜导学号( )
A.从图象可以看出,金属镁比金属锌的活动性强
B.若两种金属都有剩余,二者得到的氢气质量相同
C.若硫酸有剩余,二者得到氢气的质量相同
D.若两种金属完全溶解,二者消耗硫酸的质量相同
B
【方法点拨】活泼金属与盐酸(或稀硫酸)反应的坐标图象分析方法
1.等质氢图:
两种金属反应产生的氢气质量相同,如图所示反映两种情况:
(1)酸不足,金属过量,产生的氢气质量由酸的质量决定。
(2)酸足量,投放的两种金属与酸反应产生氢气的质量恰好完
全相同,如6.5 g锌和5.6 g铁分别投入足量的盐酸中反应产生
的氢气质量相同。
2.等质等价金属图:
如等质量的镁、铁、锌与足量的酸反应生成的金属离子都
是+2价,产生氢气的速率和质量不同,如图所示反映两种情
况:
(1)金属越活泼,图示反应物的线越陡,如Mg线比Zn线陡,Zn
线比Fe线陡。
(2)金属的相对原子质量越小,与酸反应产生的氢气越多,曲线的拐点越高。可简单概括为:越陡越活,越高越小。
3.等质不等价金属图:
铝、镁、锌与酸反应生成金属离子的化合价分别为+3、
+2、+2,如图所示反映出等质不等价金属与酸反应不仅
速率不同而且产生氢气的质量与金属化合价有关。可
用下式计算氢气质量:m(H2)= 。
【题组过关】
1.(2020·丽水中考)取一定质量的锌粒和铜片于同一敞口容器中,再逐渐加入
稀硫酸。加入稀硫酸的质量与有关量的变化关系图正确的是 ( )
C
2.(2020·烟台福山区模拟)现有等质量甲、乙、丙三种金属,分别放入三份溶
质质量分数相同的足量稀硫酸中,生成氢气的质量与反应时间的关系如图所示
(已知甲、乙、丙在生成物中化合价均为+2价)。则下列说法中不正确的是
世纪金榜导学号( )
A.生成氢气的质量:甲>乙>丙
B.相对原子质量:乙>丙>甲
C.金属活动性:乙>甲>丙
D.消耗硫酸的质量:甲>乙>丙
B
3.(2020·襄阳中考)向质量均为m的锌粉和铁粉中分别滴加100 g相同质量分数
的稀硫酸,反应过程中产生气体的质量与所加稀硫酸的质量关系如图所示,下列
叙述正确的是 ( )
A.反应后均得到无色溶液
B.反应结束后两种金属均有剩余
C.折线b表示的是铁和稀硫酸反应的情况
D.反应结束后所得溶液的质量相等
C
实验突破·强化探究力
实验一 金属活动性顺序的探究
1.实验方案
判断依据
实验设计
判断方法
方
案
1
金属与氧气反应
点燃或加热金属
反应越剧烈则活动性越强
方
案
2
金属能否与酸反应
将金属放入相同
浓度的酸溶液中
能反应则金属位于金属活动性顺序中氢前;不能反应则位于氢后
判断依据
实验设计
判断方法
方
案
3
金属与酸溶
液反应速率
的大小
取相同质量的金
属放入相同浓
度的酸溶液中
反应速率大的金属更活泼
方
案
4
金属与另一金属的盐溶液能否反应
将金属放入另
一种金属的盐溶
液中
若A能置换出B,则A的活动性比B的强;若不能置换,则B的活动性比A的强
2.试剂的选择
(1)将要验证的金属按活动性顺序排出。
(2)若发现有两种金属位于H的前面,则直接选择运用金属与酸(盐酸或稀硫酸)的反应原理进行验证;
(3)若用三种试剂验证三种金属的活动性顺序,可采取以下两种方案:
①“两端金属中间盐”,即选择活动性位于中间的金属的可溶性盐溶液和位于两侧的金属单质;
②“中间金属两端盐”,即选择活动性位于中间的金属单质放入位于两侧的金属盐溶液中。
3.实验注意事项
(1)实验前必须打磨金属表面,除去表面氧化层或污物。
(2)做金属与酸反应的实验时一般用稀盐酸或稀硫酸,不用硝酸和浓硫酸。
(3)金属与盐溶液反应,盐必须可溶于水。
(4)并不是所有排在前面的金属都能把排在后面的金属从盐溶液中置换出来,如K、Ca、Na。
【典例】(2020·岳阳中考)验证铝、铜、银的金属活动性强弱,小明设计了以
下四组实验,下列说法不正确的是 ( )
A.通过①②实验,可以证明金属活动性Al>Cu
B.通过①②③实验,可以证明金属活动性Al>Cu>Ag
C.若要用实验④证明金属活动性Al>Cu,X可以为Al,Y为CuSO4溶液
D.若要用实验④证明金属活动性Cu>Ag,X可以为Cu,Y为AgNO3溶液
B
实验二 一氧化碳还原氧化铁的实验探究
1.实验原理
在高温条件下,用还原剂CO将铁从铁矿石中还原出来。发生反应的化学方程式
为___________________________。?
2.实验装置
3CO+Fe2O3 2Fe+3CO2
高温
====
3.实验步骤:
序号
步骤
目的
1
点燃装置末端的酒精灯
防止未参与反应的CO排放到空气中造成空气污染
2
先通入CO再点燃酒精喷灯
排尽装置中的空气,防止CO和空气混合物受热爆炸
3
实验结束后先熄灭酒精喷灯,后停止通CO
防止生成的铁在高温下重新被氧化
4
待玻璃管冷却后再熄灭酒精灯
CO作保护气使装置冷却,防止未参与反应的CO排放到空气中造成空气污染
4.实验现象
玻璃管中的红棕色固体变为_________;试管内澄清石灰水___________;导管
口产生_____________。?
5.实验事项
一氧化碳有毒,实验装置中必须有尾气处理装置(点燃或用气球收集)。
黑色
变浑浊
蓝色火焰
【典例】(2020·株洲中考)下图为一氧化碳还原氧化铁示意图。
(1)写出试管b中涉及的主要反应的化学方程式
___________________________。?
(2)c处操作的目的为______________________________________。?
CO2+Ca(OH)2====CaCO3↓+H2O
尾气处理,防止未反应的CO进入空气中
【变式题1】(改用微型实验装置)(2020·苏州中考)利用如图所示实验装置模
拟工业炼铁。下列说法正确的是 ( )
A.实验时应先点燃酒精灯后通CO
B.充分加热,a处固体由黑色变为红色
C.b处可用澄清石灰水检验生成的CO2
D.可用NaOH溶液吸收尾气中的CO
C
【变式题2】(改变尾气处理装置)(2019·湘潭中考)钢铁厂会利用焦炭产生的
还原性气体来炼铁,某同学用此原理按如图装置进行实验。下列说法正确的
是 世纪金榜导学号( )
A.该实验不需要增加尾气处理装置
B.该实验应先通入一段时间的CO验纯后再加热
C.NaOH溶液可以检验气体产物
D.反应结束后,含有未反应的Fe2O3固体,可以采用加入盐酸的方法来提纯铁
B
【方法点拨】一氧化碳还原氧化铁的实验需注意“一通、二点、三灭、四停、五处理”:
“一通”先通一氧化碳;“二点”后点燃酒精喷灯加热;“三灭”实验完毕后,先熄灭酒精喷灯;“四停”等到玻璃管冷却至室温时再停止通一氧化碳;“五处理”处理尾气,防止CO污染环境。
本课结束
同课章节目录
- 第七单元 常见的酸和碱
- 第一节 酸及其性质
- 第二节 碱及其性质
- 第三节 溶液的酸碱性
- 第四节 酸碱中和反应
- 到实验室去:探究酸和碱的化学性质
- 第八单元 海水中的化学
- 第一节 海洋化学资源
- 第二节 海水“晒盐“
- 第三节 海水“制碱“
- 到实验室去:粗盐中难溶性杂质的去除
- 第九单元 金属
- 第一节 常见的金属材料
- 第二节 金属的化学性质
- 第三节 钢铁的锈蚀与防护
- 到实验室去 探究金属的性质
- 第十单元 化学与健康
- 第一节 食物中的有机物
- 第二节 化学元素与人体健康
- 第三节 远离有毒物质
- 第十一单元 化学与社会发展
- 第一节 化学与能源开发
- 第二节 化学与材料研制
- 第三节 化学与农业生产
- 第四节 化学与环境保护
