粤教版九上化学 4.3 质量守恒定律 课件(ppt共20张 )
文档属性
| 名称 | 粤教版九上化学 4.3 质量守恒定律 课件(ppt共20张 ) |  | |
| 格式 | ppt | ||
| 文件大小 | 865.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 粤教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-11-05 08:41:50 | ||
图片预览








文档简介
质量守恒定律
什么是化学变化?
化学变化最主要的特征是有新物质生成,同时还伴随着能量的释放和吸收,有时还会有颜色变化,或生成沉淀,或放出气体等现象。
提出问题:
当物质发生化学变化生成新物质时,反应物的质量与生成物的质量总和相比较,存在什么样的关系?
火柴燃烧只剩下灰烬;酒精燃烧连灰烬都没有留下;生锈的铁钉质量比未生锈时的质量大……
参加化学反应的各物质的质量总和( )反应后生成的各物质的质量总和
大于
小于
等于
实验一:白磷燃烧前后质量的测定
(1)在备好的锥形瓶中放一小块白磷
(2)称量锥形瓶及瓶内物质的总质量
(3)点燃白磷,观察实验现象
(4)称量锥形瓶及瓶内物质的总质量(冷却)
(5)比较反应前后物质总质量的变化
剧烈燃烧,放热,产生大量白烟(气球先膨胀后缩小)
质量不变
总质量
总质量
=
1、 将几根铁钉与烧杯中的硫酸铜溶液一起放在托盘天平上,共同称量。
2、将铁钉放入硫酸铜溶液中(砝码不用取下),静置1-2分钟,注意实验现象并观察天平是否平衡。
实验二:铁和硫酸铜溶液反应前后质量的测定
天平平衡、质量相等
实验现象:铁钉表面产生红色物质,溶液颜色 逐渐变浅(由蓝色变为浅绿色)
总质量
总质量
=
质量守恒定律的定义
参加化学反应的各物质的质量总和等于反应后生成的各物质的质量总和。(宏观描述p31 )
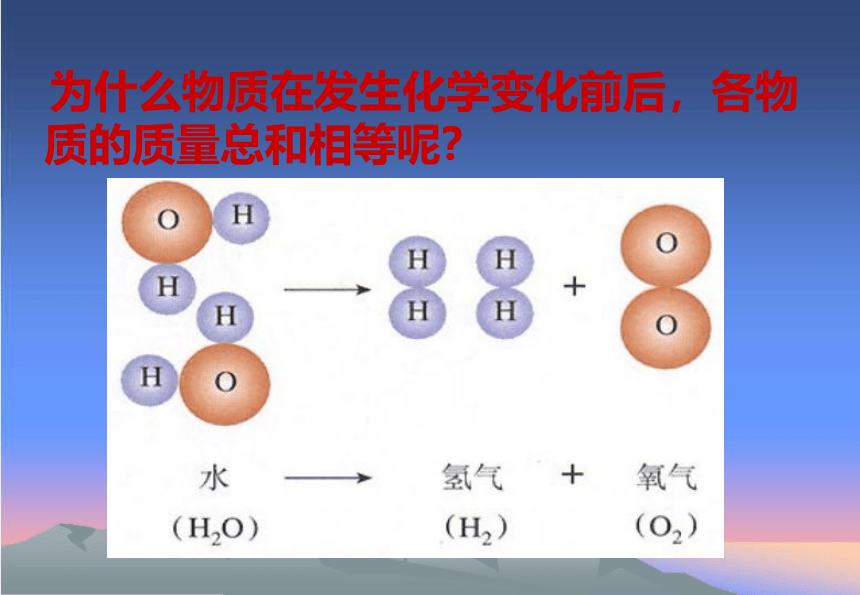
为什么物质在发生化学变化前后,各物质的质量总和相等呢?
分 子
破裂
原 子
聚集成
新物质
新分子
重新组合
破裂
重新组合
聚集成
H2
O2
H2O
质量守恒定律的微观解释(p93)
化学反应前后,原子的种类没有改变、原子的数目没有增减、原子的质量也没有改变。
资料链接:质量守恒定律的发现
波义耳的实验(1673年)
拉瓦锡的实验(1774年)
实验三:盐酸与碳酸钠粉末反应前 后质量的测定
(1)将盛有盐酸的小试管放入装有
碳酸钠粉末的烧杯中
(2)称量烧杯及烧杯内物质的总质量
(3)将试管内的溶液倒入烧杯(试管仍留在烧杯中),
使二者反应,观察实验现象
(4)称量烧杯及烧杯内物质的总质量
(5)比较反应前后物质总质量的变化
碳酸钠粉末逐渐消失,有气泡产生
天平指针向右偏,失去平衡
1、
2、
总质量
总质量
=
总质量
总质量
=
3、HCl + CaCO3 CaCl2+ H2O + CO2
(原因? 如何改进实验装置?)
质量守恒定律的应用
1、蜡烛的燃烧
(火柴的燃烧、
酒精的燃烧)
2、镁条的燃烧(P93)
(生锈的铁钉质量比未生锈时的质量大 )
3、加热铜丝,观察是否保持平衡
随堂练习:
1 24.5克氯酸钾与5克二氧化锰混合共热,待完全反应后,冷却称量剩余固体物质19.9克,则生成氧气_____克.
2 水冷却结成冰,总质量没有改变,由此说明:此变化符合质量守恒定律。此说法对吗?
9.6
.
3、某物质在干燥的空气中燃烧后的产物是一氧化碳、二氧化碳和水,由此推断,该物质的组成中一定含有的元素是( )
A.碳、氢元素
B.碳、氧元素
C.氧、氢元素
D.碳、氧、氢元素
A
课堂小结
1、通过实验探究从宏观角度得出并验 证了质量守恒定律;
2、用分子和原子的有关知识从微观角 度分析了质量守恒的原因;
3、应用质量守恒定律解决生活中遇到的问题。
在2400 多年前,古希腊哲学家德谟克利特在一首诗中表达了物质不灭的观点:“无中不能生有,任何存在的东西也不会消失。看起来万物是死了,但实则犹生:正如一场春雨落地,霎时失去踪影;可是草木把它吸收,长成花叶果实,——依然欣欣向荣。”
什么是化学变化?
化学变化最主要的特征是有新物质生成,同时还伴随着能量的释放和吸收,有时还会有颜色变化,或生成沉淀,或放出气体等现象。
提出问题:
当物质发生化学变化生成新物质时,反应物的质量与生成物的质量总和相比较,存在什么样的关系?
火柴燃烧只剩下灰烬;酒精燃烧连灰烬都没有留下;生锈的铁钉质量比未生锈时的质量大……
参加化学反应的各物质的质量总和( )反应后生成的各物质的质量总和
大于
小于
等于
实验一:白磷燃烧前后质量的测定
(1)在备好的锥形瓶中放一小块白磷
(2)称量锥形瓶及瓶内物质的总质量
(3)点燃白磷,观察实验现象
(4)称量锥形瓶及瓶内物质的总质量(冷却)
(5)比较反应前后物质总质量的变化
剧烈燃烧,放热,产生大量白烟(气球先膨胀后缩小)
质量不变
总质量
总质量
=
1、 将几根铁钉与烧杯中的硫酸铜溶液一起放在托盘天平上,共同称量。
2、将铁钉放入硫酸铜溶液中(砝码不用取下),静置1-2分钟,注意实验现象并观察天平是否平衡。
实验二:铁和硫酸铜溶液反应前后质量的测定
天平平衡、质量相等
实验现象:铁钉表面产生红色物质,溶液颜色 逐渐变浅(由蓝色变为浅绿色)
总质量
总质量
=
质量守恒定律的定义
参加化学反应的各物质的质量总和等于反应后生成的各物质的质量总和。(宏观描述p31 )
为什么物质在发生化学变化前后,各物质的质量总和相等呢?
分 子
破裂
原 子
聚集成
新物质
新分子
重新组合
破裂
重新组合
聚集成
H2
O2
H2O
质量守恒定律的微观解释(p93)
化学反应前后,原子的种类没有改变、原子的数目没有增减、原子的质量也没有改变。
资料链接:质量守恒定律的发现
波义耳的实验(1673年)
拉瓦锡的实验(1774年)
实验三:盐酸与碳酸钠粉末反应前 后质量的测定
(1)将盛有盐酸的小试管放入装有
碳酸钠粉末的烧杯中
(2)称量烧杯及烧杯内物质的总质量
(3)将试管内的溶液倒入烧杯(试管仍留在烧杯中),
使二者反应,观察实验现象
(4)称量烧杯及烧杯内物质的总质量
(5)比较反应前后物质总质量的变化
碳酸钠粉末逐渐消失,有气泡产生
天平指针向右偏,失去平衡
1、
2、
总质量
总质量
=
总质量
总质量
=
3、HCl + CaCO3 CaCl2+ H2O + CO2
(原因? 如何改进实验装置?)
质量守恒定律的应用
1、蜡烛的燃烧
(火柴的燃烧、
酒精的燃烧)
2、镁条的燃烧(P93)
(生锈的铁钉质量比未生锈时的质量大 )
3、加热铜丝,观察是否保持平衡
随堂练习:
1 24.5克氯酸钾与5克二氧化锰混合共热,待完全反应后,冷却称量剩余固体物质19.9克,则生成氧气_____克.
2 水冷却结成冰,总质量没有改变,由此说明:此变化符合质量守恒定律。此说法对吗?
9.6
.
3、某物质在干燥的空气中燃烧后的产物是一氧化碳、二氧化碳和水,由此推断,该物质的组成中一定含有的元素是( )
A.碳、氢元素
B.碳、氧元素
C.氧、氢元素
D.碳、氧、氢元素
A
课堂小结
1、通过实验探究从宏观角度得出并验 证了质量守恒定律;
2、用分子和原子的有关知识从微观角 度分析了质量守恒的原因;
3、应用质量守恒定律解决生活中遇到的问题。
在2400 多年前,古希腊哲学家德谟克利特在一首诗中表达了物质不灭的观点:“无中不能生有,任何存在的东西也不会消失。看起来万物是死了,但实则犹生:正如一场春雨落地,霎时失去踪影;可是草木把它吸收,长成花叶果实,——依然欣欣向荣。”
同课章节目录
- 第一章 大家都来学化学
- 1.1 身边的化学
- 1.2 化学实验室之旅
- 1.3 物质的变化
- 1.4 物质性质的探究
- 第二章 空气、物质的构成
- 2.1 空气的成分
- 2.2 构成物质的微粒(Ⅰ)——分子
- 2.3 构成物质的微粒(Ⅱ)——原子和离子
- 2.4 辨别物质的元素组成
- 第三章 维持生命之气——氧气
- 3.1 氧气的性质和用途
- 3.2 制取氧气
- 3.3 燃烧条件与灭火原理
- 3.4 物质构成的表示式
- 第四章 生命之源——水
- 4.1 我们的水资源
- 4.2 水的组成
- 4.3 质量守恒定律
- 4.4 化学方程式
- 第五章 燃料
- 5.1 洁净的燃料——氢气
- 5.2 组成燃料的主要元素——碳
- 5.3 二氧化碳的性质和制法
- 5.4 古生物的“遗产”——化石燃料
