人教版选修五第二章 烃和卤代烃复习课件
文档属性
| 名称 | 人教版选修五第二章 烃和卤代烃复习课件 |

|
|
| 格式 | rar | ||
| 文件大小 | 539.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2011-10-16 00:00:00 | ||
图片预览





文档简介
(共42张PPT)
复习课
烃和卤代烃
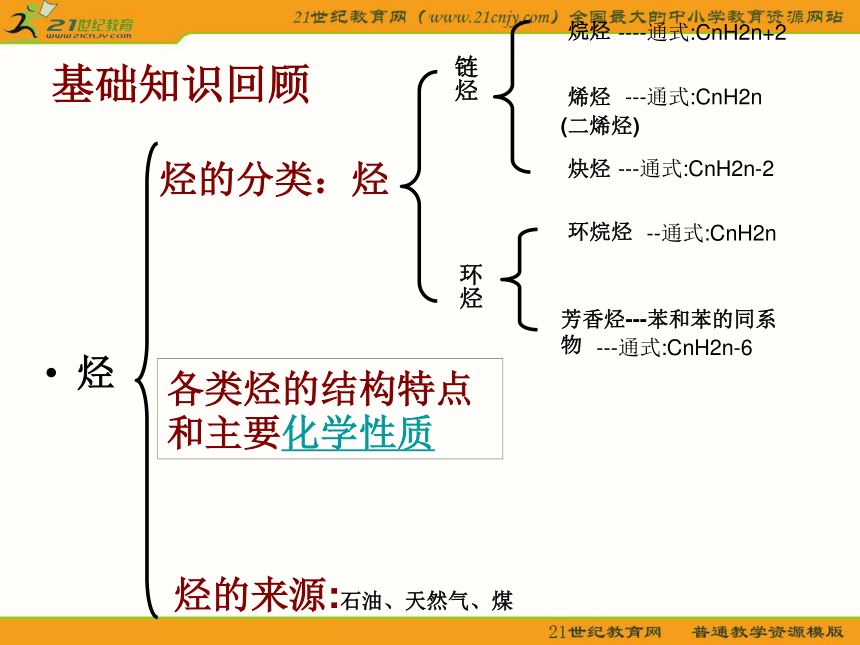
基础知识回顾
烃
烃的分类:烃
链烃
环烃
芳香烃---苯和苯的同系物
环烷烃
烯烃
炔烃
烷烃
各类烃的结构特点和主要化学性质
---通式:CnH2n-6
--通式:CnH2n
---通式:CnH2n-2
----通式:CnH2n+2
---通式:CnH2n
(二烯烃)
烃的来源:石油、天然气、煤
一、烃的重要性质:
二、有机化学的主要反应类型
三、有关实验
四:几点注意:
五、卤代烃的性质
1、烃的物理性质:
①密度:所有烃的密度都比水小
②状态:常温下,碳原子数小于等于4的气态
③熔沸点:碳原子数越多,熔、沸点越高 ;
碳原子数相同,支链越多,熔沸点越低;
④含碳量规律:
烷烃<烯烃<炔烃<苯的同系物
烷烃(CnH2n+2):随n值增大,含碳量增大
烯烃(CnH2n) :n值增大,碳的含量为定值;
炔烃(CnH2n-2) :随n值增大,含碳量减小
苯及其同系物:(CnH2n-6):随n值增大含碳量减小
一、烃的重要性质:
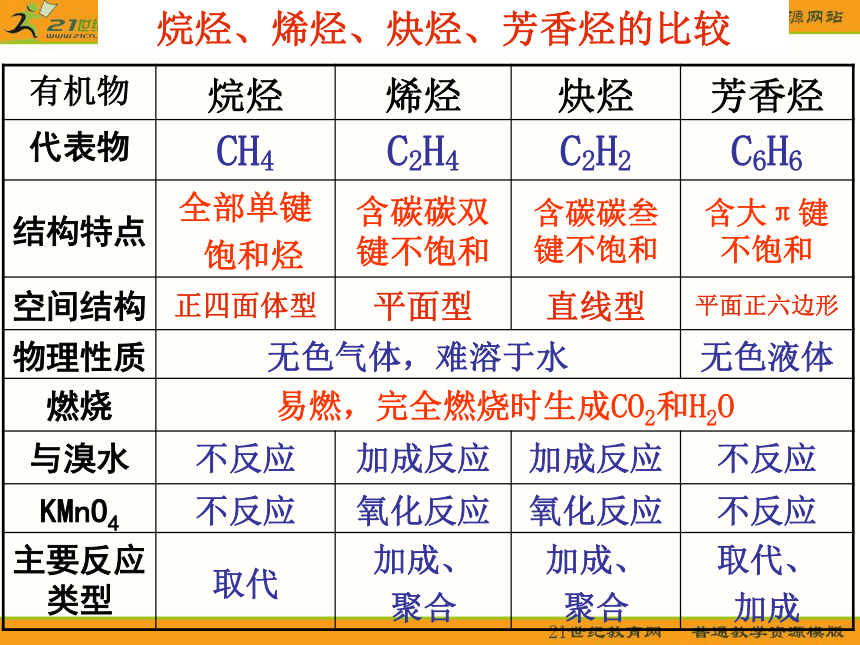
有机物 烷烃 烯烃 炔烃 芳香烃
代表物 CH4 C2H4 C2H2 C6H6
结构特点 全部单键
饱和烃 含碳碳双键不饱和 含碳碳叁键不饱和 含大π键不饱和
空间结构 正四面体型 平面型 直线型 平面正六边形
物理性质 无色气体,难溶于水 无色液体
燃烧 易燃,完全燃烧时生成CO2和H2O
与溴水 不反应 加成反应 加成反应 不反应
KMnO4 不反应 氧化反应 氧化反应 不反应
主要反应类型 取代 加成、
聚合 加成、
聚合 取代、
加成
烷烃、烯烃、炔烃、芳香烃的比较
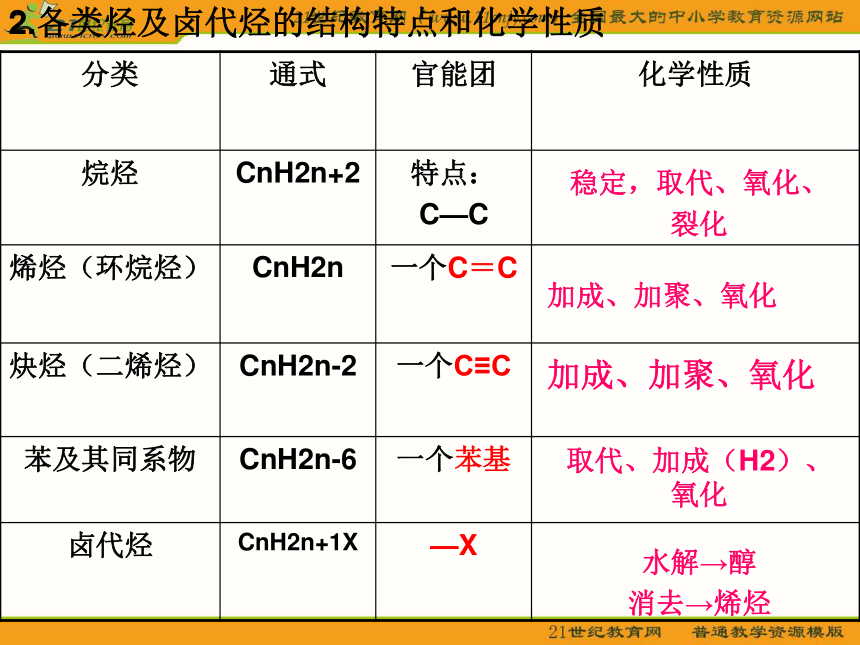
分类 通式 官能团 化学性质
烷烃 CnH2n+2 特点:
C—C
烯烃(环烷烃) CnH2n 一个C=C
炔烃(二烯烃) CnH2n-2 一个C≡C
苯及其同系物 CnH2n-6 一个苯基
卤代烃 CnH2n+1X —X
2.各类烃及卤代烃的结构特点和化学性质
稳定,取代、氧化、
裂化
加成、加聚、氧化
加成、加聚、氧化
取代、加成(H2)、
氧化
水解→醇
消去→烯烃
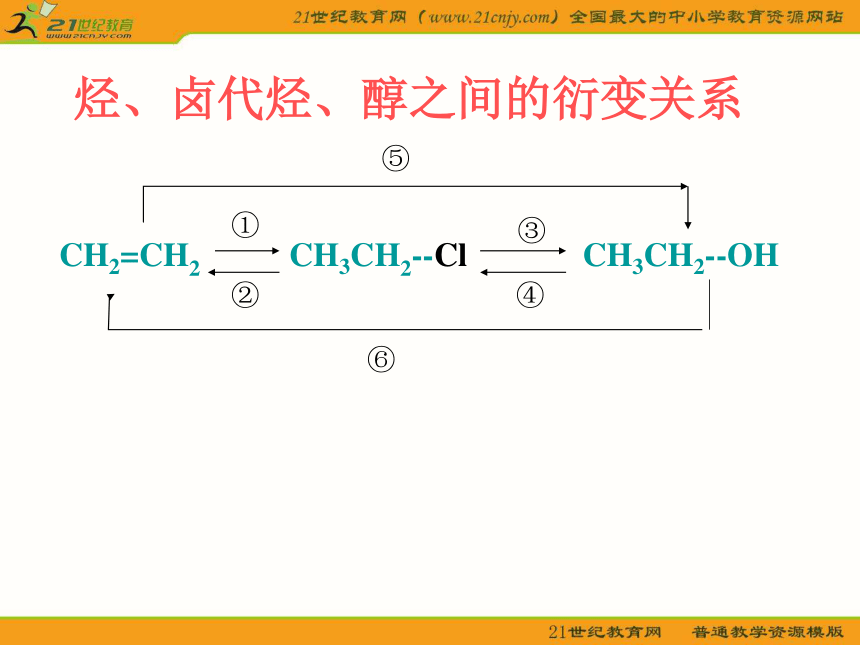
烃、卤代烃、醇之间的衍变关系
CH2=CH2 CH3CH2--Cl CH3CH2--OH
⑥
①
②
③
④
⑤
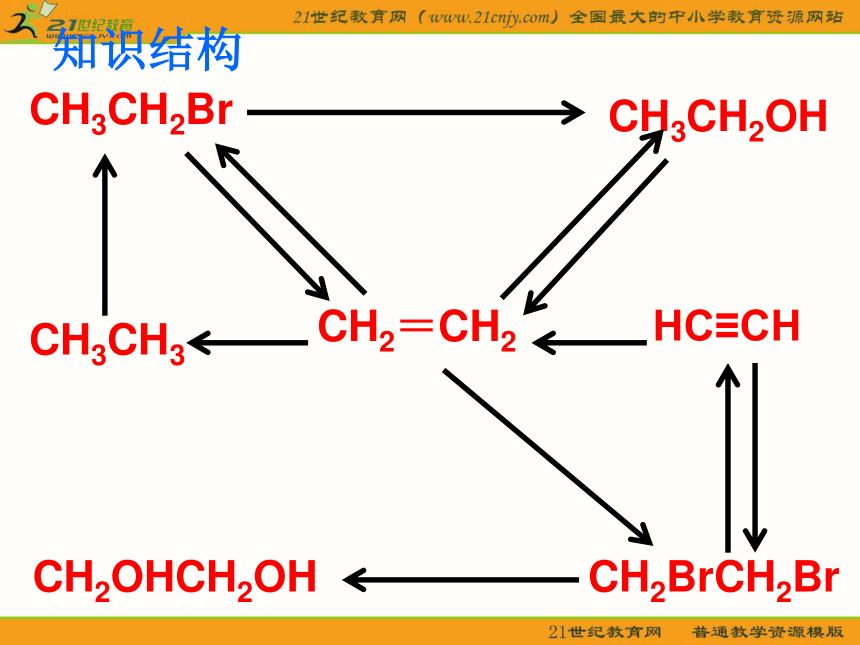
知识结构
CH3CH2Br
CH3CH2OH
CH3CH3
HC≡CH
CH2=CH2
CH2BrCH2Br
CH2OHCH2OH
二、有机化学的主要反应类型
1、取代反应 2、加成反应
3、消去反应 4、氧化反应
5、还原反应 6、聚合反应
7、酯化反应 8、水解反应
9、裂化反应
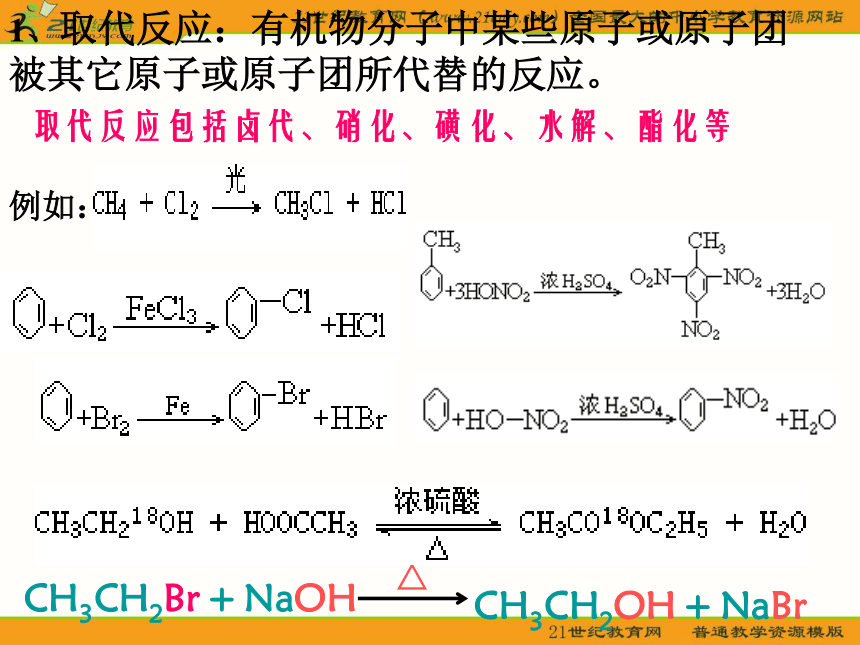
1、取代反应:有机物分子中某些原子或原子团
被其它原子或原子团所代替的反应。
取代反应包括卤代、硝化、磺化、水解、酯化等
例如:
CH3CH2Br + NaOH
CH3CH2OH + NaBr
△
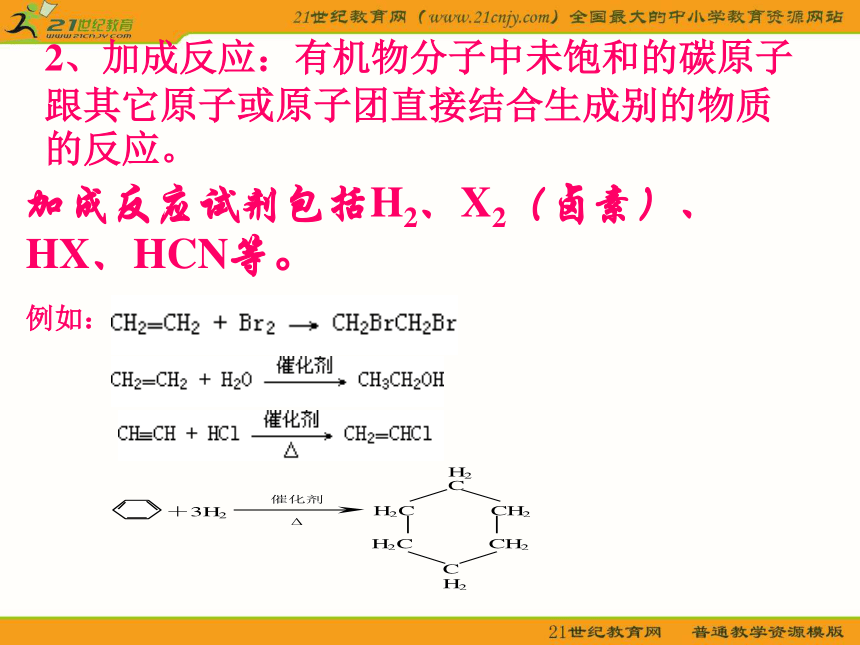
2、加成反应:有机物分子中未饱和的碳原子跟其它原子或原子团直接结合生成别的物质的反应。
加成反应试剂包括H2、X2(卤素)、HX、HCN等。
例如:
3、消去反应:有机物在一定条件下,从一个分子中脱去一个小分子(如:H2O、HX、NH3等)生成不饱和化合物的反应(消去小分子)。
C2H5Br + NaOH CH2=CH2 + NaBr +H2O
4、氧化反应:有机物得氧或失氢的反应。
5、还原反应:有机物加氢或去氧的反应。
加聚反应:通过加成反应聚合成高分子化合物的反应(加成聚合)。主要为含双键的单体聚合。
6、聚合反应:单体间通过缩合反应生成高分子化合物,同时生成小分子(H2O、NH3、HX等)的反应。
7、酯化反应(属于取代反应):酸(有机羧酸、无机含氧酸)与醇作用生成酯和水的反应。
8、水解反应:有机物在一定条件下跟水作用
生成两种或多种物质的反应。
水解反应包括卤代烃水解、酯水解、糖(除单糖外)水解、蛋白质水解等。
9、裂化反应:在一定温度下,把相对分子质量大、沸点高的长链烃断裂为相对分子质量小、沸点低的短链烃的反应。
(1)甲烷的制备;
(2)乙烯的制备;
(3)乙炔的制备;
三、有关实验
(一)几种有机气体的制备
甲烷的实验室制法:
1.药品:无水醋酸钠(CH3COONa)和碱石灰;
2.发生和收集装置:
使用“固+固
气
”型的物质制备发生装置.
(与实验室制氧气,氨气的装置相同)
由于甲烷不溶于水,可用排水法收集.
3.碱石灰的作用:反应物,干燥
乙烯的实验室制法:
1. 发生装置及收集方法:
(1).选用“液+液 气”的物质制备装置.(与实验室制氯气,氯化氢的装置相同)
(2)用排水法收集.
2.实验注意事项:
(1).V(乙醇)/V(浓硫酸)=1:3;
(2)烧瓶中加入啐瓷片防止爆沸;
(3)迅速升温至170 0c.
乙炔的实验室制法:
1.发生装置:“固+液 气”的制取装置;
2.收集方法:排水法;
3.注意事项:
(1)可用饱和食盐水代替水,以得到平稳气流.
(2)不能使用启普发生器,
(3)产物气体中因含有AsH3,PH3而有特殊气味.
(二)、几个重要实验
1.制溴苯
2.制硝基苯
3.溴乙烷的取代
4.溴乙烷的消去
1.制溴苯
2.制硝基苯
3 溴乙烷水解
条件:与氢氧化钠水溶液共热:
你认为哪一套装置更好?它的优点有哪些?
方程式?
思考
1)这反应属于哪一反应类型?
2)该反应较缓慢,若既要加快反应速率又要提高乙醇产量,可采取什么措施?
3)为什么要加入稀硝酸酸化溶液?
取代反应
采取加热和加NaOH的方法,原因是水解吸热,NaOH与HBr反应,减小HBr的浓度,使水解正向移动。
中和过量的NaOH溶液,防止生成Ag2O暗褐色沉淀,影响Br-检验。
①C2H5Br
②C2H5Br
AgNO3溶液
AgNO3溶液
取上层清液硝 酸 酸 化
思考
4)如何判断CH3CH2Br是否完全水解?
5)如何判断CH3CH2Br已发生水解?
√
待溶液分层后,用滴管吸取少量上层清液,移入另一盛稀硝酸的试管中,然后滴入2~3滴硝酸银溶液,如有淡黄色沉淀出现,则证明含有溴元素。
看反应后的溶液是否出现分层,如分层,则没有完全水解
4.溴乙烷消去反应:
C2H5Br与NaOH的醇溶液共热实验的注意事项:
1.反应物:
2.反应条件:
3.反应方程式
4.产物检验
溴乙烷+氢氧化钠的醇溶液;
共热
CH2=CH2+Br2→CH2BrCH2Br
KMnO4 褪色
CH2=CH2
将产生的气体通入溴水或酸性高锰酸钾溶液中,二者均褪色。
CH2-CH2+NaOH CH2=CH2 +NaBr+H2O
H Br
醇
Δ
问题与思考
如何减少乙醇的挥发?
如何排除乙醇对乙烯检验的干扰?
实验装置应如何改进?
长玻璃导管(冷凝回流)
1.乙醇易溶于水,将产生的气体通过盛水的洗气瓶,然后再通入酸性高锰酸钾溶液。
2.溴的四氯化碳溶液
对比:
比较溴乙烷的取代反应和消去反应,体会反应条件对化学反应的影响。
取代反应 消去反应
反应物
反应条件
生成物
结论
CH3CH2Br
CH3CH2Br
NaOH水溶液,加热
NaOH醇溶液,加热
CH3CH2OH、NaBr
CH2=CH2、NaBr、H2O
溴乙烷在不同的条件下发生不同类型的反应
四:几点注意:
1.关于溴乙烷的取代反应:同一碳原子上的多卤代烃水解得到的产物一般不是醇。
☆发生消去反应的条件:
①烃中碳原子数≥2
②邻碳有氢才消去(即接卤素原子的碳邻近的碳原子上有氢原子)
③反应条件:强碱和醇溶液中加热。
3.饱和卤代烃和芳香卤代烃不被酸性高锰酸钾溶液氧化!
2.关于溴乙烷的消去反应:
4、卤代烃中卤素原子的检验:
卤代烃
NaOH水溶液
过量HNO3
AgNO3溶液
有沉淀产生
说明有卤素原子
白色
淡黄色
黄色
五、卤代烃的性质
1、物理性质
1).常温下,卤代烃中除一氯甲烷、氯乙烷、氯乙烯 等少数为气体外,其余为液体或固体.
(2).互为同系物的卤代烃,如一氯代烷的物理性质变化规律是:随着碳原子数(式量)增加,其熔、沸点和密度也增大.(且沸点和熔点大于相应的烃)
(3).难溶于水,易溶于有机溶剂.除脂肪烃的一氟代物、一氯代物等部分卤代烃外,液态卤代烃的密度一般比水大.密度一般随烃基中碳原子数增加而减小.
如图所示是检验1,2—二氯乙烷的某性质实验的装置。
(1)按如图所示,连接好仪器后,首先应进行的操作是
______ ___ __ 。
(2)在试管A里加入2mL
1,2—二氯乙烷和5mL
10% NaOH的乙醇溶液,再向
试管里加入几小块碎瓷片。加入
碎瓷片的作用是
_____。
(3)用水浴加热试管A里的混合物(其主要生成物仍为卤代烃),
试管A中发生反应的化学方程式是______________________,
其反应类型是_____。
(4)为检验产生的气体,可在试管B中盛放____________,
现象是____________________;向反应后试管A中的溶液里
加入足量的稀硝酸,再加入几滴AgNO3溶液,现象是______
________________。
检查装置气密性
防止暴沸
消去反应
溴水
溶液褪色
产生白色沉淀
复习课
烃和卤代烃
基础知识回顾
烃
烃的分类:烃
链烃
环烃
芳香烃---苯和苯的同系物
环烷烃
烯烃
炔烃
烷烃
各类烃的结构特点和主要化学性质
---通式:CnH2n-6
--通式:CnH2n
---通式:CnH2n-2
----通式:CnH2n+2
---通式:CnH2n
(二烯烃)
烃的来源:石油、天然气、煤
一、烃的重要性质:
二、有机化学的主要反应类型
三、有关实验
四:几点注意:
五、卤代烃的性质
1、烃的物理性质:
①密度:所有烃的密度都比水小
②状态:常温下,碳原子数小于等于4的气态
③熔沸点:碳原子数越多,熔、沸点越高 ;
碳原子数相同,支链越多,熔沸点越低;
④含碳量规律:
烷烃<烯烃<炔烃<苯的同系物
烷烃(CnH2n+2):随n值增大,含碳量增大
烯烃(CnH2n) :n值增大,碳的含量为定值;
炔烃(CnH2n-2) :随n值增大,含碳量减小
苯及其同系物:(CnH2n-6):随n值增大含碳量减小
一、烃的重要性质:
有机物 烷烃 烯烃 炔烃 芳香烃
代表物 CH4 C2H4 C2H2 C6H6
结构特点 全部单键
饱和烃 含碳碳双键不饱和 含碳碳叁键不饱和 含大π键不饱和
空间结构 正四面体型 平面型 直线型 平面正六边形
物理性质 无色气体,难溶于水 无色液体
燃烧 易燃,完全燃烧时生成CO2和H2O
与溴水 不反应 加成反应 加成反应 不反应
KMnO4 不反应 氧化反应 氧化反应 不反应
主要反应类型 取代 加成、
聚合 加成、
聚合 取代、
加成
烷烃、烯烃、炔烃、芳香烃的比较
分类 通式 官能团 化学性质
烷烃 CnH2n+2 特点:
C—C
烯烃(环烷烃) CnH2n 一个C=C
炔烃(二烯烃) CnH2n-2 一个C≡C
苯及其同系物 CnH2n-6 一个苯基
卤代烃 CnH2n+1X —X
2.各类烃及卤代烃的结构特点和化学性质
稳定,取代、氧化、
裂化
加成、加聚、氧化
加成、加聚、氧化
取代、加成(H2)、
氧化
水解→醇
消去→烯烃
烃、卤代烃、醇之间的衍变关系
CH2=CH2 CH3CH2--Cl CH3CH2--OH
⑥
①
②
③
④
⑤
知识结构
CH3CH2Br
CH3CH2OH
CH3CH3
HC≡CH
CH2=CH2
CH2BrCH2Br
CH2OHCH2OH
二、有机化学的主要反应类型
1、取代反应 2、加成反应
3、消去反应 4、氧化反应
5、还原反应 6、聚合反应
7、酯化反应 8、水解反应
9、裂化反应
1、取代反应:有机物分子中某些原子或原子团
被其它原子或原子团所代替的反应。
取代反应包括卤代、硝化、磺化、水解、酯化等
例如:
CH3CH2Br + NaOH
CH3CH2OH + NaBr
△
2、加成反应:有机物分子中未饱和的碳原子跟其它原子或原子团直接结合生成别的物质的反应。
加成反应试剂包括H2、X2(卤素)、HX、HCN等。
例如:
3、消去反应:有机物在一定条件下,从一个分子中脱去一个小分子(如:H2O、HX、NH3等)生成不饱和化合物的反应(消去小分子)。
C2H5Br + NaOH CH2=CH2 + NaBr +H2O
4、氧化反应:有机物得氧或失氢的反应。
5、还原反应:有机物加氢或去氧的反应。
加聚反应:通过加成反应聚合成高分子化合物的反应(加成聚合)。主要为含双键的单体聚合。
6、聚合反应:单体间通过缩合反应生成高分子化合物,同时生成小分子(H2O、NH3、HX等)的反应。
7、酯化反应(属于取代反应):酸(有机羧酸、无机含氧酸)与醇作用生成酯和水的反应。
8、水解反应:有机物在一定条件下跟水作用
生成两种或多种物质的反应。
水解反应包括卤代烃水解、酯水解、糖(除单糖外)水解、蛋白质水解等。
9、裂化反应:在一定温度下,把相对分子质量大、沸点高的长链烃断裂为相对分子质量小、沸点低的短链烃的反应。
(1)甲烷的制备;
(2)乙烯的制备;
(3)乙炔的制备;
三、有关实验
(一)几种有机气体的制备
甲烷的实验室制法:
1.药品:无水醋酸钠(CH3COONa)和碱石灰;
2.发生和收集装置:
使用“固+固
气
”型的物质制备发生装置.
(与实验室制氧气,氨气的装置相同)
由于甲烷不溶于水,可用排水法收集.
3.碱石灰的作用:反应物,干燥
乙烯的实验室制法:
1. 发生装置及收集方法:
(1).选用“液+液 气”的物质制备装置.(与实验室制氯气,氯化氢的装置相同)
(2)用排水法收集.
2.实验注意事项:
(1).V(乙醇)/V(浓硫酸)=1:3;
(2)烧瓶中加入啐瓷片防止爆沸;
(3)迅速升温至170 0c.
乙炔的实验室制法:
1.发生装置:“固+液 气”的制取装置;
2.收集方法:排水法;
3.注意事项:
(1)可用饱和食盐水代替水,以得到平稳气流.
(2)不能使用启普发生器,
(3)产物气体中因含有AsH3,PH3而有特殊气味.
(二)、几个重要实验
1.制溴苯
2.制硝基苯
3.溴乙烷的取代
4.溴乙烷的消去
1.制溴苯
2.制硝基苯
3 溴乙烷水解
条件:与氢氧化钠水溶液共热:
你认为哪一套装置更好?它的优点有哪些?
方程式?
思考
1)这反应属于哪一反应类型?
2)该反应较缓慢,若既要加快反应速率又要提高乙醇产量,可采取什么措施?
3)为什么要加入稀硝酸酸化溶液?
取代反应
采取加热和加NaOH的方法,原因是水解吸热,NaOH与HBr反应,减小HBr的浓度,使水解正向移动。
中和过量的NaOH溶液,防止生成Ag2O暗褐色沉淀,影响Br-检验。
①C2H5Br
②C2H5Br
AgNO3溶液
AgNO3溶液
取上层清液硝 酸 酸 化
思考
4)如何判断CH3CH2Br是否完全水解?
5)如何判断CH3CH2Br已发生水解?
√
待溶液分层后,用滴管吸取少量上层清液,移入另一盛稀硝酸的试管中,然后滴入2~3滴硝酸银溶液,如有淡黄色沉淀出现,则证明含有溴元素。
看反应后的溶液是否出现分层,如分层,则没有完全水解
4.溴乙烷消去反应:
C2H5Br与NaOH的醇溶液共热实验的注意事项:
1.反应物:
2.反应条件:
3.反应方程式
4.产物检验
溴乙烷+氢氧化钠的醇溶液;
共热
CH2=CH2+Br2→CH2BrCH2Br
KMnO4 褪色
CH2=CH2
将产生的气体通入溴水或酸性高锰酸钾溶液中,二者均褪色。
CH2-CH2+NaOH CH2=CH2 +NaBr+H2O
H Br
醇
Δ
问题与思考
如何减少乙醇的挥发?
如何排除乙醇对乙烯检验的干扰?
实验装置应如何改进?
长玻璃导管(冷凝回流)
1.乙醇易溶于水,将产生的气体通过盛水的洗气瓶,然后再通入酸性高锰酸钾溶液。
2.溴的四氯化碳溶液
对比:
比较溴乙烷的取代反应和消去反应,体会反应条件对化学反应的影响。
取代反应 消去反应
反应物
反应条件
生成物
结论
CH3CH2Br
CH3CH2Br
NaOH水溶液,加热
NaOH醇溶液,加热
CH3CH2OH、NaBr
CH2=CH2、NaBr、H2O
溴乙烷在不同的条件下发生不同类型的反应
四:几点注意:
1.关于溴乙烷的取代反应:同一碳原子上的多卤代烃水解得到的产物一般不是醇。
☆发生消去反应的条件:
①烃中碳原子数≥2
②邻碳有氢才消去(即接卤素原子的碳邻近的碳原子上有氢原子)
③反应条件:强碱和醇溶液中加热。
3.饱和卤代烃和芳香卤代烃不被酸性高锰酸钾溶液氧化!
2.关于溴乙烷的消去反应:
4、卤代烃中卤素原子的检验:
卤代烃
NaOH水溶液
过量HNO3
AgNO3溶液
有沉淀产生
说明有卤素原子
白色
淡黄色
黄色
五、卤代烃的性质
1、物理性质
1).常温下,卤代烃中除一氯甲烷、氯乙烷、氯乙烯 等少数为气体外,其余为液体或固体.
(2).互为同系物的卤代烃,如一氯代烷的物理性质变化规律是:随着碳原子数(式量)增加,其熔、沸点和密度也增大.(且沸点和熔点大于相应的烃)
(3).难溶于水,易溶于有机溶剂.除脂肪烃的一氟代物、一氯代物等部分卤代烃外,液态卤代烃的密度一般比水大.密度一般随烃基中碳原子数增加而减小.
如图所示是检验1,2—二氯乙烷的某性质实验的装置。
(1)按如图所示,连接好仪器后,首先应进行的操作是
______ ___ __ 。
(2)在试管A里加入2mL
1,2—二氯乙烷和5mL
10% NaOH的乙醇溶液,再向
试管里加入几小块碎瓷片。加入
碎瓷片的作用是
_____。
(3)用水浴加热试管A里的混合物(其主要生成物仍为卤代烃),
试管A中发生反应的化学方程式是______________________,
其反应类型是_____。
(4)为检验产生的气体,可在试管B中盛放____________,
现象是____________________;向反应后试管A中的溶液里
加入足量的稀硝酸,再加入几滴AgNO3溶液,现象是______
________________。
检查装置气密性
防止暴沸
消去反应
溴水
溶液褪色
产生白色沉淀
