2.5-2.6 物质的转换 材料的利用与发展 同步练习(含答案)
文档属性
| 名称 | 2.5-2.6 物质的转换 材料的利用与发展 同步练习(含答案) |  | |
| 格式 | doc | ||
| 文件大小 | 225.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 浙教版 | ||
| 科目 | 科学 | ||
| 更新时间 | 2020-11-04 16:40:35 | ||
图片预览

文档简介
2.5-2.6同步训练
一.选择题
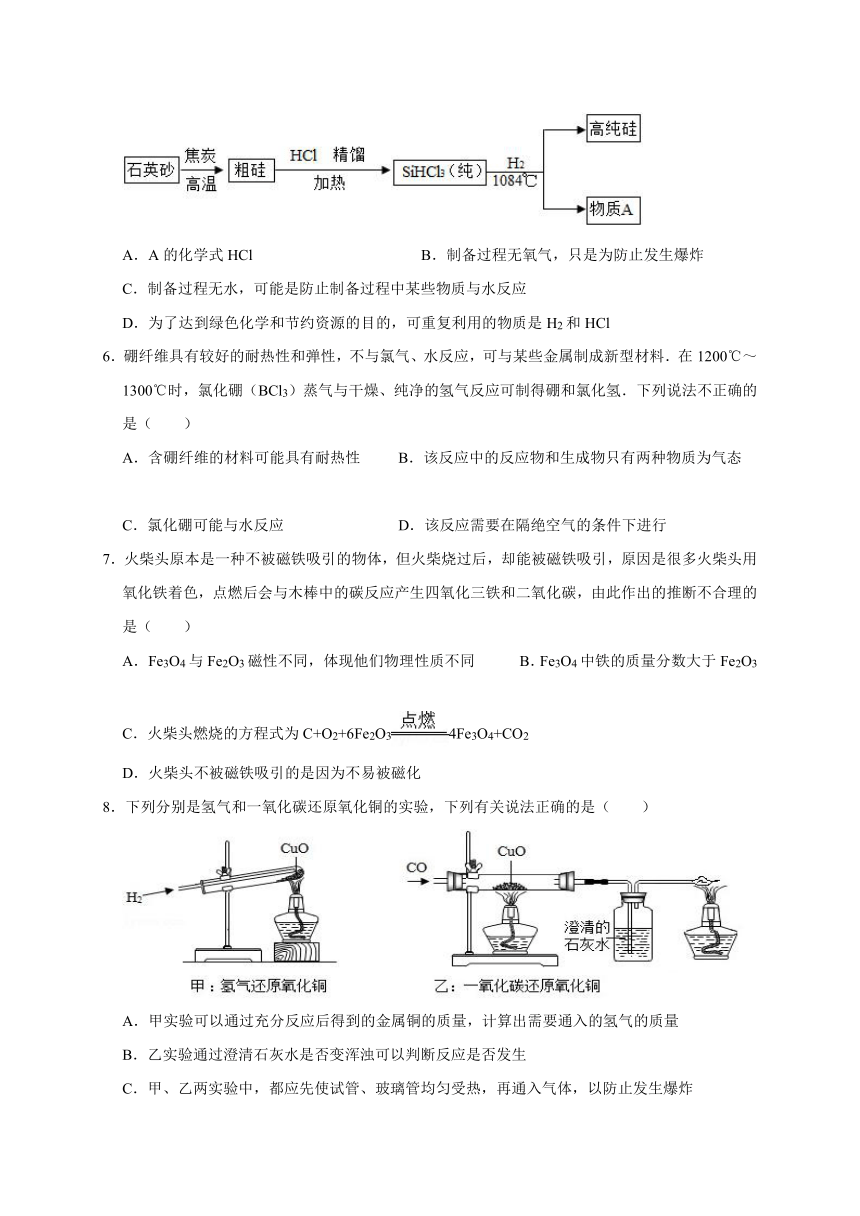
1.用同一种基本反应类型,经过两步反应,不能实现的转化是( )
A.S→H2SO3 B.Fe→Fe(OH)3
C.H2CO3→O2 D.K2CO3→Ba(NO3)2
2.三种物质间只通过一步反应就能实现如箭头所指方向的转化,下列符合要求的组合是( )
A.①② B.①③ C.②③ D.①②③
3.为实现二氧化碳的绿色利用,科学家用固碳酶作催化剂设计了如下转化过程。下列说法正确的是( )
A.反应①的化学方程式为CO2+C=CO B.固碳酶在反应前后化学性质发生变化
C.X的化学式为CH2 D.该过程实现了无机物向有机物的转化
4.某化工厂按如下步骤进行生产:
(1)以煤为燃料煅烧石灰石;(2)用饱和Na2CO3溶液充分吸收(1)中产生的CO2气体(Na2CO3+CO2+H2O=2NaHCO3;(3)使(1)中产生的CaO与水反应;(4)熟石灰与碳酸钠溶液反应.该厂生产过程中所涉及的物质有①石灰石;②碳酸钠;③碳酸氢钠;④烧碱;⑤二氧化碳;⑥熟石灰( )
A.起始原料是①③ B.起始原料是②⑥
C.最终产品是⑤⑥ D.最终产品是③④
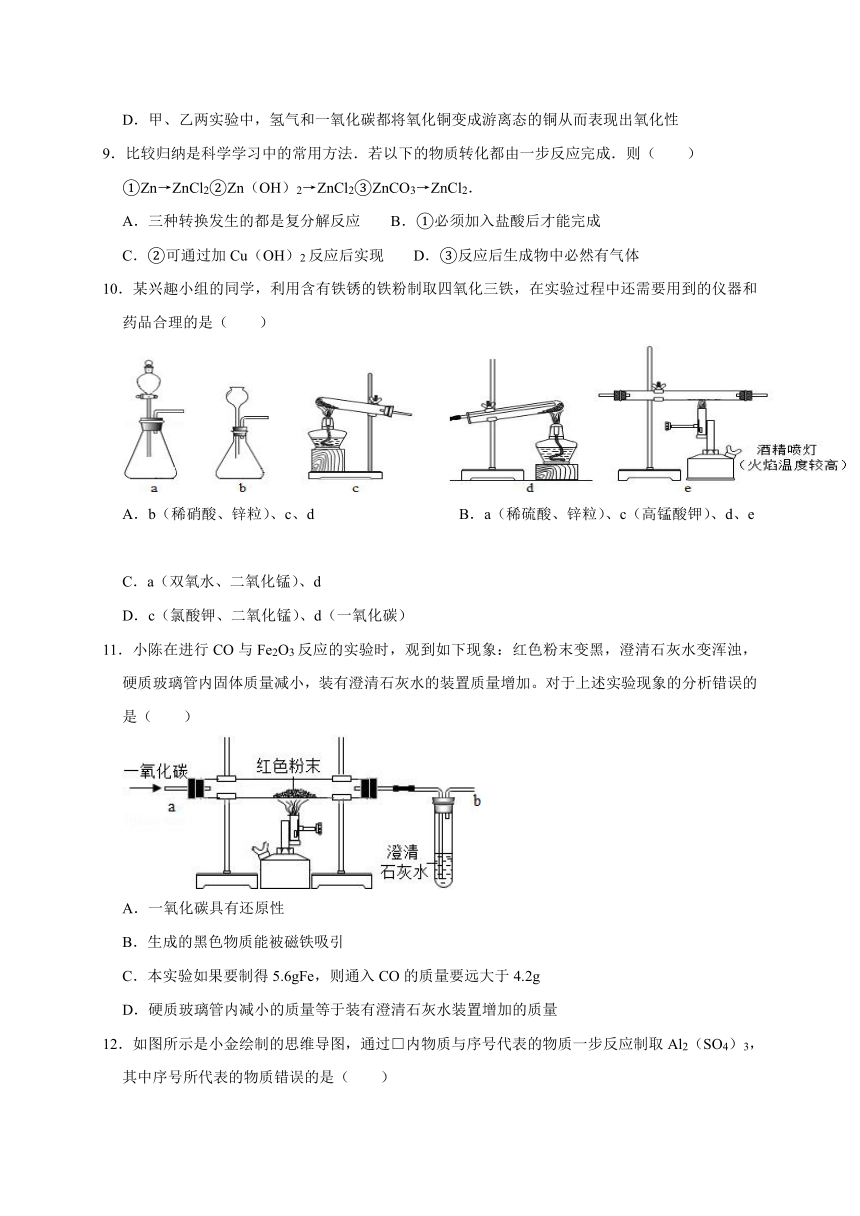
5.硅(Si)是太阳能电池和电除芯片不可缺少的材料,利用石英沙(主要成分为二氧化硅)生产高纯硅的流程示意图如下,整个制备过程必须达到无水、无氧气.下列说法中,不正确的是( )
A.A的化学式HCl B.制备过程无氧气,只是为防止发生爆炸
C.制备过程无水,可能是防止制备过程中某些物质与水反应
D.为了达到绿色化学和节约资源的目的,可重复利用的物质是H2和HCl
6.硼纤维具有较好的耐热性和弹性,不与氯气、水反应,可与某些金属制成新型材料.在1200℃~1300℃时,氯化硼(BCl3)蒸气与干燥、纯净的氢气反应可制得硼和氯化氢.下列说法不正确的是( )
A.含硼纤维的材料可能具有耐热性 B.该反应中的反应物和生成物只有两种物质为气态
C.氯化硼可能与水反应 D.该反应需要在隔绝空气的条件下进行
7.火柴头原本是一种不被磁铁吸引的物体,但火柴烧过后,却能被磁铁吸引,原因是很多火柴头用氧化铁着色,点燃后会与木棒中的碳反应产生四氧化三铁和二氧化碳,由此作出的推断不合理的是( )
A.Fe3O4与Fe2O3磁性不同,体现他们物理性质不同 B.Fe3O4中铁的质量分数大于Fe2O3
C.火柴头燃烧的方程式为C+O2+6Fe2O34Fe3O4+CO2
D.火柴头不被磁铁吸引的是因为不易被磁化
8.下列分别是氢气和一氧化碳还原氧化铜的实验,下列有关说法正确的是( )
A.甲实验可以通过充分反应后得到的金属铜的质量,计算出需要通入的氢气的质量
B.乙实验通过澄清石灰水是否变浑浊可以判断反应是否发生
C.甲、乙两实验中,都应先使试管、玻璃管均匀受热,再通入气体,以防止发生爆炸
D.甲、乙两实验中,氢气和一氧化碳都将氧化铜变成游离态的铜从而表现出氧化性
9.比较归纳是科学学习中的常用方法.若以下的物质转化都由一步反应完成.则( )
①Zn→ZnCl2②Zn(OH)2→ZnCl2③ZnCO3→ZnCl2.
A.三种转换发生的都是复分解反应 B.①必须加入盐酸后才能完成
C.②可通过加Cu(OH)2反应后实现 D.③反应后生成物中必然有气体
10.某兴趣小组的同学,利用含有铁锈的铁粉制取四氧化三铁,在实验过程中还需要用到的仪器和药品合理的是( )
A.b(稀硝酸、锌粒)、c、d B.a(稀硫酸、锌粒)、c(高锰酸钾)、d、e
C.a(双氧水、二氧化锰)、d
D.c(氯酸钾、二氧化锰)、d(一氧化碳)
11.小陈在进行CO与Fe2O3反应的实验时,观到如下现象:红色粉末变黑,澄清石灰水变浑浊,硬质玻璃管内固体质量减小,装有澄清石灰水的装置质量增加。对于上述实验现象的分析错误的是( )
A.一氧化碳具有还原性
B.生成的黑色物质能被磁铁吸引
C.本实验如果要制得5.6gFe,则通入CO的质量要远大于4.2g
D.硬质玻璃管内减小的质量等于装有澄清石灰水装置增加的质量
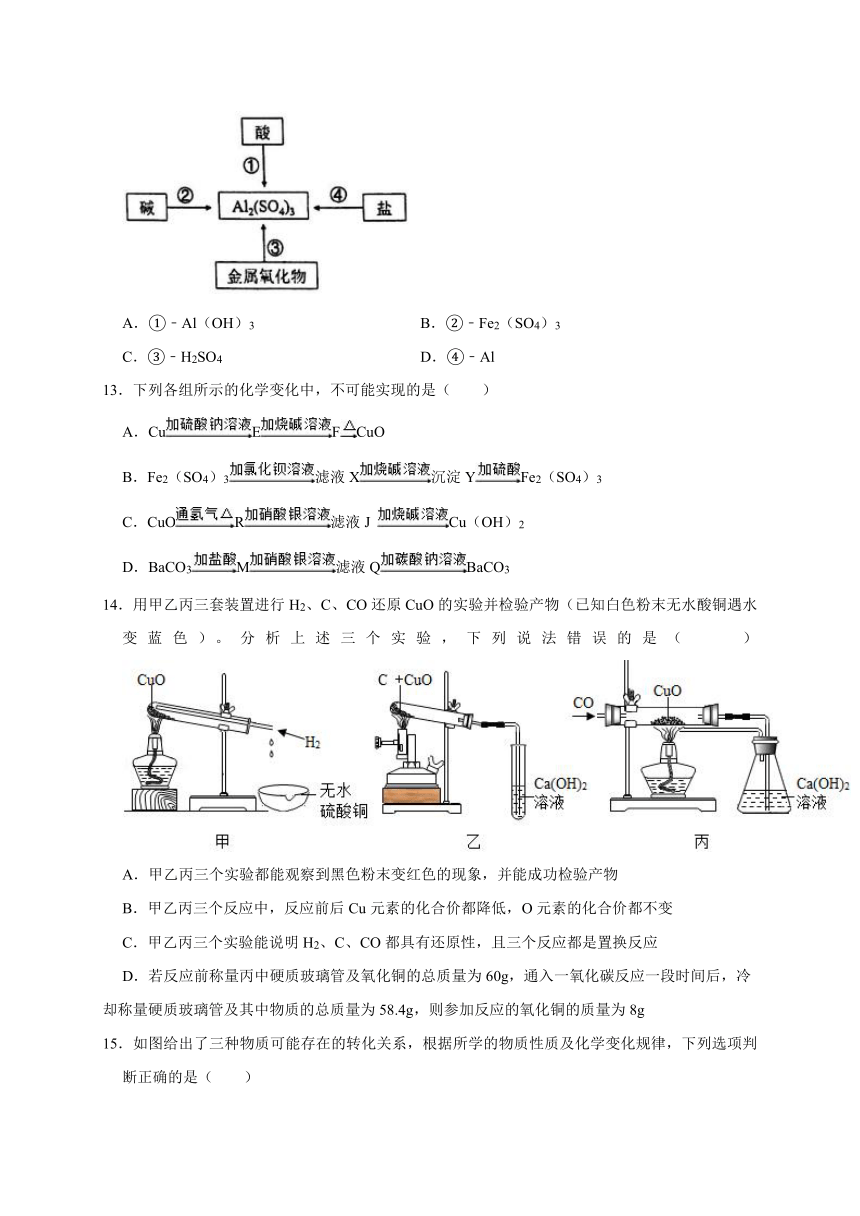
12.如图所示是小金绘制的思维导图,通过□内物质与序号代表的物质一步反应制取Al2(SO4)3,其中序号所代表的物质错误的是( )
A.①﹣Al(OH)3 B.②﹣Fe2(SO4)3
C.③﹣H2SO4 D.④﹣Al
13.下列各组所示的化学变化中,不可能实现的是( )
A.CuEFCuO
B.Fe2(SO4)3滤液X沉淀YFe2(SO4)3
C.CuOR滤液J Cu(OH)2
D.BaCO3M滤液QBaCO3
14.用甲乙丙三套装置进行H2、C、CO还原CuO的实验并检验产物(已知白色粉末无水酸铜遇水变蓝色)。分析上述三个实验,下列说法错误的是( )
A.甲乙丙三个实验都能观察到黑色粉末变红色的现象,并能成功检验产物
B.甲乙丙三个反应中,反应前后Cu元素的化合价都降低,O元素的化合价都不变
C.甲乙丙三个实验能说明H2、C、CO都具有还原性,且三个反应都是置换反应
D.若反应前称量丙中硬质玻璃管及氧化铜的总质量为60g,通入一氧化碳反应一段时间后,冷却称量硬质玻璃管及其中物质的总质量为58.4g,则参加反应的氧化铜的质量为8g
15.如图给出了三种物质可能存在的转化关系,根据所学的物质性质及化学变化规律,下列选项判断正确的是( )
A.三种物质彼此间均能一步实现转化
B.实现①转化,可加入碳酸溶液
C.实现④转化,只能加稀盐酸
D.实现⑥转化,可加入熟石灰
二.填空题
16.芯片是“智能家电的核心部件,他是以高纯度单只硅为材料制成的,制取高纯度硅的化学方程式为:①SiO2+2C═Si+2CO ②Si+2Cl2═SiCl4③SiCl4+2H2═Si+4HCl(反应条件未标出)。
(1)整个过程当中一共需要加入 种物质。
(2)反应①需要在高温条件下发生,除了温度外还可以通过 (具体操作)加快反应速率,在反应物中 体现了氧化性。
17.医用消毒酒精为75%的乙醇溶液,化工生产中可用A(主要成分的化学式为C8H18)作原料,经以下流程制取乙醇:
(1)步骤①的转化属于 (选填“化学”或“物理”)变化。
(2)步骤②是乙烯和含两种元素的化合物B发生化合反应,则B中所含元素是 。
18.某工业废水含有大量的硫酸亚铁、少量硫酸铜和污泥。为了从工业废水中制备硫酸亚铁晶体(FeSO4?7H2O)并回收铜,小乐设计了如图所示方案,已知硫酸亚铁晶体受热易分解。
(1)步骤②和步骤③加入的药品依次为 。
(2)写出步骤④的操作 。
三.实验探究题
19.亚硝酸钠是实验室常用的试剂,实验室一般用亚硝酸钠溶液与氯化铵溶液反应来制取N2.N2的化学性质十分稳定,但在一定条件下能与H2部分化合生成NH3.如图为制取少量NH3的装置(制取H2的装置已略去):
(1)请写出图中仪器B名称: 。
(2)写出C装置的硬质试管中发生反应的化学方程式: 。
(3)结合本实验装置,证明确实有NH3生成的简单方法以及实验现象 。
(4)归纳与演绎是重要的科学方法,也是常用的学习方法。我们已经学过实验室制取气体的反应原理、制取与收集方法。请你归纳出实验室制取气体反应的共同点: (填序号)。
①需要加热 ②使用催化剂 ③没有气体参加反应 ④原料为纯净物 ⑤只生成一种气体
20.焦亚硫酸钠(Na2S2O5)是一种常用的食品抗氧化剂,小金模仿化工生产,用如图装置来制取Na2S2O5。
已知:A中发生的反应为:
H2SO4(浓)+Na2SO3═Na2SO4+SO2↑+H2O
B中发生的反应为:Na2SO3+SO2═Na2S2O5
(1)图中盛放焦亚硫酸钠的仪器名称是 ;
(2)写出C中漏斗作用 ;
(3)在实验过程中,若滴加浓硫酸过快,会出现什么后果? 。
(4)该实验开始滴加浓硫酸时,应先除尽装置内的空气,若忘记这一操作,新制取的Na2S2O5产品中会混有Na2SO4杂质,请分析原因 。
21.世界环保联盟建设全面禁止用氯气(常温下是一种黄绿色有毒气体)对饮用水消毒,推广使用安全、高效杀菌消毒剂ClO2.ClO2是一种黄绿色,有刺激性气味的气体,冷却至11.0℃以下时变成红色液体,易溶于水,见光易分解,易与碱(比如氢氧化钠溶液)反应,杀菌、漂白能力均优于氯气。
(1)请写出ClO2的化学性质 。(写出一点即可)
(2)目前通常采用氯酸钠(NaClO3)与浓盐酸反应制取ClO2(Kestiog法),反应的化学方程式为:2NaClO3+4HCl═2ClO2+Cl2↑+2H2O+2NaCl;我国最近研究成功用氯气和亚氯酸钠(NaClO2)反应制取ClO2,该反应的化学方程式为Cl2+2NaClO2═2ClO2+2NaCl,此法与Kestiog法相比,其优点是 。
(3)某实验小组用如图所示装置探究用潮湿的KClO3与草酸在60℃时反应制取ClO2获得成功。在装置中,A为ClO2的发生装置,B为ClO2收集装置,C为尾气吸收装置。请分析回答:
①为了收集到液态ClO2,装置A、装置B应控制的温度分别是 、 。
②C的烧杯中可以盛放的液体及作用是 。
四.计算题
22.科学家尝试通过多种途径减少CO2的排放,或将CO2转化为有用的物质。其中一种途径是利用NaOH溶液来“捕捉”CO2,并将CO2储存或利用,反应流程如图所示。
(1)反应分离室中分离物质的操作是 。
(2)上述反应流程中,可循环利用的物质是 。
(3)若反应分离室中有溶质质量分数为10.6%的Na2CO3溶液100千克,求完全反应后,理论上可生成CaCO3的质量(要求根据化学方程式计算)。
参考答案
选择题
1.B; 2.D; 3.D; 4.D; 5.D; 6.B; 7.C; 8.B; 9.D; 10.B; 11.D; 12.B; 13.A; 14.C; 15.D;
二.填空题
16.4;将二氧化硅和碳粉碎;SiO2;17.化学;氢元素、氧元素; 18.过量的铁粉、适量的稀硫酸;低温蒸发;
三.实验探究题
19.广口瓶;N2+3H22NH3;向D试管中滴加酚酞试液,溶液变红色;③⑤; 20.集气瓶;防止NaOH溶液倒吸进入B中;生成的二氧化硫气体过快,来不及与B中的亚硫酸钠进一步反应生成Na2S2O5;Na2S2O5会被空气中的氧气氧化成Na2SO4;
21.见光易分解;应后没有Cl2生成,便于分离,不污染环境;60℃;低于11.0℃;氢氧化钠溶液或氢氧化钾溶液或水,吸收二氧化氯;
五.计算题
22.过滤;NaOH和CaO;10kg
一.选择题
1.用同一种基本反应类型,经过两步反应,不能实现的转化是( )
A.S→H2SO3 B.Fe→Fe(OH)3
C.H2CO3→O2 D.K2CO3→Ba(NO3)2
2.三种物质间只通过一步反应就能实现如箭头所指方向的转化,下列符合要求的组合是( )
A.①② B.①③ C.②③ D.①②③
3.为实现二氧化碳的绿色利用,科学家用固碳酶作催化剂设计了如下转化过程。下列说法正确的是( )
A.反应①的化学方程式为CO2+C=CO B.固碳酶在反应前后化学性质发生变化
C.X的化学式为CH2 D.该过程实现了无机物向有机物的转化
4.某化工厂按如下步骤进行生产:
(1)以煤为燃料煅烧石灰石;(2)用饱和Na2CO3溶液充分吸收(1)中产生的CO2气体(Na2CO3+CO2+H2O=2NaHCO3;(3)使(1)中产生的CaO与水反应;(4)熟石灰与碳酸钠溶液反应.该厂生产过程中所涉及的物质有①石灰石;②碳酸钠;③碳酸氢钠;④烧碱;⑤二氧化碳;⑥熟石灰( )
A.起始原料是①③ B.起始原料是②⑥
C.最终产品是⑤⑥ D.最终产品是③④
5.硅(Si)是太阳能电池和电除芯片不可缺少的材料,利用石英沙(主要成分为二氧化硅)生产高纯硅的流程示意图如下,整个制备过程必须达到无水、无氧气.下列说法中,不正确的是( )
A.A的化学式HCl B.制备过程无氧气,只是为防止发生爆炸
C.制备过程无水,可能是防止制备过程中某些物质与水反应
D.为了达到绿色化学和节约资源的目的,可重复利用的物质是H2和HCl
6.硼纤维具有较好的耐热性和弹性,不与氯气、水反应,可与某些金属制成新型材料.在1200℃~1300℃时,氯化硼(BCl3)蒸气与干燥、纯净的氢气反应可制得硼和氯化氢.下列说法不正确的是( )
A.含硼纤维的材料可能具有耐热性 B.该反应中的反应物和生成物只有两种物质为气态
C.氯化硼可能与水反应 D.该反应需要在隔绝空气的条件下进行
7.火柴头原本是一种不被磁铁吸引的物体,但火柴烧过后,却能被磁铁吸引,原因是很多火柴头用氧化铁着色,点燃后会与木棒中的碳反应产生四氧化三铁和二氧化碳,由此作出的推断不合理的是( )
A.Fe3O4与Fe2O3磁性不同,体现他们物理性质不同 B.Fe3O4中铁的质量分数大于Fe2O3
C.火柴头燃烧的方程式为C+O2+6Fe2O34Fe3O4+CO2
D.火柴头不被磁铁吸引的是因为不易被磁化
8.下列分别是氢气和一氧化碳还原氧化铜的实验,下列有关说法正确的是( )
A.甲实验可以通过充分反应后得到的金属铜的质量,计算出需要通入的氢气的质量
B.乙实验通过澄清石灰水是否变浑浊可以判断反应是否发生
C.甲、乙两实验中,都应先使试管、玻璃管均匀受热,再通入气体,以防止发生爆炸
D.甲、乙两实验中,氢气和一氧化碳都将氧化铜变成游离态的铜从而表现出氧化性
9.比较归纳是科学学习中的常用方法.若以下的物质转化都由一步反应完成.则( )
①Zn→ZnCl2②Zn(OH)2→ZnCl2③ZnCO3→ZnCl2.
A.三种转换发生的都是复分解反应 B.①必须加入盐酸后才能完成
C.②可通过加Cu(OH)2反应后实现 D.③反应后生成物中必然有气体
10.某兴趣小组的同学,利用含有铁锈的铁粉制取四氧化三铁,在实验过程中还需要用到的仪器和药品合理的是( )
A.b(稀硝酸、锌粒)、c、d B.a(稀硫酸、锌粒)、c(高锰酸钾)、d、e
C.a(双氧水、二氧化锰)、d
D.c(氯酸钾、二氧化锰)、d(一氧化碳)
11.小陈在进行CO与Fe2O3反应的实验时,观到如下现象:红色粉末变黑,澄清石灰水变浑浊,硬质玻璃管内固体质量减小,装有澄清石灰水的装置质量增加。对于上述实验现象的分析错误的是( )
A.一氧化碳具有还原性
B.生成的黑色物质能被磁铁吸引
C.本实验如果要制得5.6gFe,则通入CO的质量要远大于4.2g
D.硬质玻璃管内减小的质量等于装有澄清石灰水装置增加的质量
12.如图所示是小金绘制的思维导图,通过□内物质与序号代表的物质一步反应制取Al2(SO4)3,其中序号所代表的物质错误的是( )
A.①﹣Al(OH)3 B.②﹣Fe2(SO4)3
C.③﹣H2SO4 D.④﹣Al
13.下列各组所示的化学变化中,不可能实现的是( )
A.CuEFCuO
B.Fe2(SO4)3滤液X沉淀YFe2(SO4)3
C.CuOR滤液J Cu(OH)2
D.BaCO3M滤液QBaCO3
14.用甲乙丙三套装置进行H2、C、CO还原CuO的实验并检验产物(已知白色粉末无水酸铜遇水变蓝色)。分析上述三个实验,下列说法错误的是( )
A.甲乙丙三个实验都能观察到黑色粉末变红色的现象,并能成功检验产物
B.甲乙丙三个反应中,反应前后Cu元素的化合价都降低,O元素的化合价都不变
C.甲乙丙三个实验能说明H2、C、CO都具有还原性,且三个反应都是置换反应
D.若反应前称量丙中硬质玻璃管及氧化铜的总质量为60g,通入一氧化碳反应一段时间后,冷却称量硬质玻璃管及其中物质的总质量为58.4g,则参加反应的氧化铜的质量为8g
15.如图给出了三种物质可能存在的转化关系,根据所学的物质性质及化学变化规律,下列选项判断正确的是( )
A.三种物质彼此间均能一步实现转化
B.实现①转化,可加入碳酸溶液
C.实现④转化,只能加稀盐酸
D.实现⑥转化,可加入熟石灰
二.填空题
16.芯片是“智能家电的核心部件,他是以高纯度单只硅为材料制成的,制取高纯度硅的化学方程式为:①SiO2+2C═Si+2CO ②Si+2Cl2═SiCl4③SiCl4+2H2═Si+4HCl(反应条件未标出)。
(1)整个过程当中一共需要加入 种物质。
(2)反应①需要在高温条件下发生,除了温度外还可以通过 (具体操作)加快反应速率,在反应物中 体现了氧化性。
17.医用消毒酒精为75%的乙醇溶液,化工生产中可用A(主要成分的化学式为C8H18)作原料,经以下流程制取乙醇:
(1)步骤①的转化属于 (选填“化学”或“物理”)变化。
(2)步骤②是乙烯和含两种元素的化合物B发生化合反应,则B中所含元素是 。
18.某工业废水含有大量的硫酸亚铁、少量硫酸铜和污泥。为了从工业废水中制备硫酸亚铁晶体(FeSO4?7H2O)并回收铜,小乐设计了如图所示方案,已知硫酸亚铁晶体受热易分解。
(1)步骤②和步骤③加入的药品依次为 。
(2)写出步骤④的操作 。
三.实验探究题
19.亚硝酸钠是实验室常用的试剂,实验室一般用亚硝酸钠溶液与氯化铵溶液反应来制取N2.N2的化学性质十分稳定,但在一定条件下能与H2部分化合生成NH3.如图为制取少量NH3的装置(制取H2的装置已略去):
(1)请写出图中仪器B名称: 。
(2)写出C装置的硬质试管中发生反应的化学方程式: 。
(3)结合本实验装置,证明确实有NH3生成的简单方法以及实验现象 。
(4)归纳与演绎是重要的科学方法,也是常用的学习方法。我们已经学过实验室制取气体的反应原理、制取与收集方法。请你归纳出实验室制取气体反应的共同点: (填序号)。
①需要加热 ②使用催化剂 ③没有气体参加反应 ④原料为纯净物 ⑤只生成一种气体
20.焦亚硫酸钠(Na2S2O5)是一种常用的食品抗氧化剂,小金模仿化工生产,用如图装置来制取Na2S2O5。
已知:A中发生的反应为:
H2SO4(浓)+Na2SO3═Na2SO4+SO2↑+H2O
B中发生的反应为:Na2SO3+SO2═Na2S2O5
(1)图中盛放焦亚硫酸钠的仪器名称是 ;
(2)写出C中漏斗作用 ;
(3)在实验过程中,若滴加浓硫酸过快,会出现什么后果? 。
(4)该实验开始滴加浓硫酸时,应先除尽装置内的空气,若忘记这一操作,新制取的Na2S2O5产品中会混有Na2SO4杂质,请分析原因 。
21.世界环保联盟建设全面禁止用氯气(常温下是一种黄绿色有毒气体)对饮用水消毒,推广使用安全、高效杀菌消毒剂ClO2.ClO2是一种黄绿色,有刺激性气味的气体,冷却至11.0℃以下时变成红色液体,易溶于水,见光易分解,易与碱(比如氢氧化钠溶液)反应,杀菌、漂白能力均优于氯气。
(1)请写出ClO2的化学性质 。(写出一点即可)
(2)目前通常采用氯酸钠(NaClO3)与浓盐酸反应制取ClO2(Kestiog法),反应的化学方程式为:2NaClO3+4HCl═2ClO2+Cl2↑+2H2O+2NaCl;我国最近研究成功用氯气和亚氯酸钠(NaClO2)反应制取ClO2,该反应的化学方程式为Cl2+2NaClO2═2ClO2+2NaCl,此法与Kestiog法相比,其优点是 。
(3)某实验小组用如图所示装置探究用潮湿的KClO3与草酸在60℃时反应制取ClO2获得成功。在装置中,A为ClO2的发生装置,B为ClO2收集装置,C为尾气吸收装置。请分析回答:
①为了收集到液态ClO2,装置A、装置B应控制的温度分别是 、 。
②C的烧杯中可以盛放的液体及作用是 。
四.计算题
22.科学家尝试通过多种途径减少CO2的排放,或将CO2转化为有用的物质。其中一种途径是利用NaOH溶液来“捕捉”CO2,并将CO2储存或利用,反应流程如图所示。
(1)反应分离室中分离物质的操作是 。
(2)上述反应流程中,可循环利用的物质是 。
(3)若反应分离室中有溶质质量分数为10.6%的Na2CO3溶液100千克,求完全反应后,理论上可生成CaCO3的质量(要求根据化学方程式计算)。
参考答案
选择题
1.B; 2.D; 3.D; 4.D; 5.D; 6.B; 7.C; 8.B; 9.D; 10.B; 11.D; 12.B; 13.A; 14.C; 15.D;
二.填空题
16.4;将二氧化硅和碳粉碎;SiO2;17.化学;氢元素、氧元素; 18.过量的铁粉、适量的稀硫酸;低温蒸发;
三.实验探究题
19.广口瓶;N2+3H22NH3;向D试管中滴加酚酞试液,溶液变红色;③⑤; 20.集气瓶;防止NaOH溶液倒吸进入B中;生成的二氧化硫气体过快,来不及与B中的亚硫酸钠进一步反应生成Na2S2O5;Na2S2O5会被空气中的氧气氧化成Na2SO4;
21.见光易分解;应后没有Cl2生成,便于分离,不污染环境;60℃;低于11.0℃;氢氧化钠溶液或氢氧化钾溶液或水,吸收二氧化氯;
五.计算题
22.过滤;NaOH和CaO;10kg
同课章节目录
- 第1章 物质及其变化
- 第1节 物质的变化
- 第2节 物质的酸碱性
- 第3节 常见的酸
- 第4节 常见的碱
- 第5节 酸和碱之间发生的反应
- 第6节 几种重要的盐
- 第2章 物质转化与材料利用
- 第1节 金属材料
- 第2节 金属的化学性质
- 第3节 有机物和有机合成材料
- 第4节 物质的分类
- 第5节 物质的转化
- 第6节 材料的利用与发展
- 第3章 能量的转化与守恒
- 第1节 能量及其形式
- 第2节 机械能
- 第3节 能量转化的量度
- 第4节 简单机械
- 第5节 物体的内能
- 第6节 电能
- 第7节 核能
- 第8节 能量的转化与守恒
- 第4章 代谢与平衡
- 第1节 食物与营养
- 第2节 食物的消化与吸收
- 第3节 体内物质的运输
- 第4节 能量的获得
- 第5节 体内物质的动态平衡
- 研究性学习课题
- 一 当地酸雨情况以及对农作物和建筑物的影响
- 二 金属对社会发展的作用
- 三 寻找自行车中的杠杆
- 四 怎样防治龋齿
