四川省阆中市川绵外国语学校2020-2021学年高二上学期期中考试化学试题
文档属性
| 名称 | 四川省阆中市川绵外国语学校2020-2021学年高二上学期期中考试化学试题 |  | |
| 格式 | doc | ||
| 文件大小 | 384.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-11-05 07:53:14 | ||
图片预览


文档简介
川绵外国语学校2020年秋高2019级期中教学质量检测
化学试题
可能用到的相对原子质量:
H-1 O-16 Na-23 Mg-24 Al-27 Cl-35.5 Fe-56 Cu-64
第Ⅰ卷 选择题(每小题5分,共50分)
1.下列说法或有关化学用语的表达正确的是
A.在基态多电子原子中,p轨道电子能量一定高于s轨道电子能量
B.基态Fe原子的外围电子排布图为
C.因氧元素电负性比氮元素大,故氧原子第一电离能比氮原子第一电离能大
D.根据原子核外电子排布的特点,Cu在元素周期表中位于s区
2.下列说法正确的是
A.将过量的氨水加入到CuSO4溶液中,最终得到蓝色沉淀
B.电子排布式(22Ti)1s22s22p63s23p10违反了洪特规则
C.由于氢键的作用,H2O的稳定性强于H2S
D.双键中一定有一个σ键和一个π键,三键中一定有一个σ键和两个π键
3.下列说法中正确的是
A.分子中键能越大,键长越长,则分子越稳定
B.元素周期表中的第ⅠA族和第ⅦA族元素的原子间可能形成共价键
C.水分子可表示为H—O—H,分子中键角为180°
D.电子从较高能量的激发态跃迁到较低能量的激发态或基态时,将吸收能量
4.具有下列电子层结构的原子,其对应元素一定属于同一周期的是
A.两种原子的电子层上全部都是s电子
B.3p能级上只有一个空轨道的原子和3p能级上只有一个未成对电子的原子
C.最外层电子排布为2s22p6的原子和最外层电子排布为2s22p6的离子
D.原子核外M层上的s能级和p能级都填满了电子,而d轨道上尚未有电子的两种
原子
5.下表是第三周期部分元素基态原子的逐级电离能[单位:eV(电子伏特)]数据:
元素 甲 乙 丙 丁
I1/eV 5.7 7.7 13.0 15.7
I2/eV 47.4 15.1 23.9 27.6
I3/eV 71.8 80.3 40.0 40.7
下列说法正确的是
A.乙常见的化合价是+1价 B.甲的金属性比乙强
C.丁一定是金属元素 D.丙不可能是非金属元素
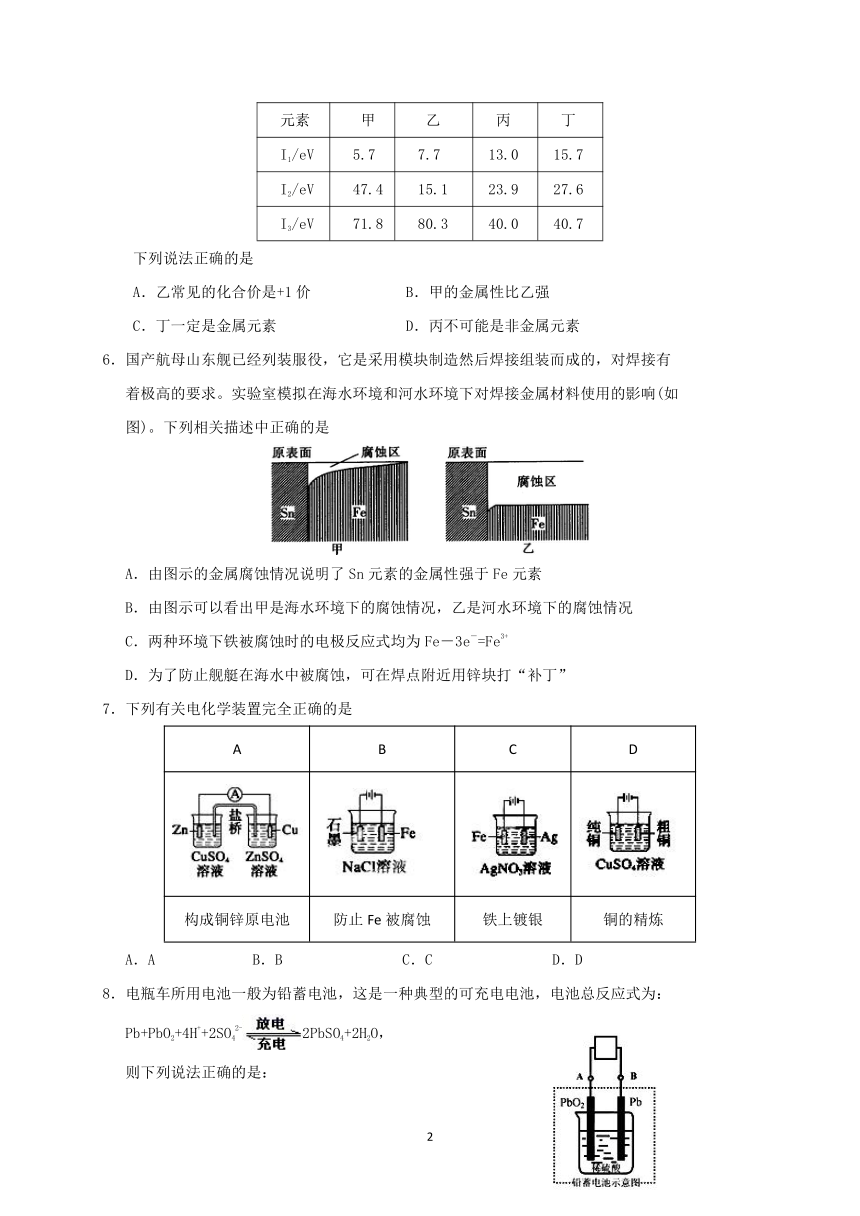
6.国产航母山东舰已经列装服役,它是采用模块制造然后焊接组装而成的,对焊接有
着极高的要求。实验室模拟在海水环境和河水环境下对焊接金属材料使用的影响(如
图)。下列相关描述中正确的是
A.由图示的金属腐蚀情况说明了Sn元素的金属性强于Fe元素
B.由图示可以看出甲是海水环境下的腐蚀情况,乙是河水环境下的腐蚀情况
C.两种环境下铁被腐蚀时的电极反应式均为Fe-3e-=Fe3+
D.为了防止舰艇在海水中被腐蚀,可在焊点附近用锌块打“补丁”
7.下列有关电化学装置完全正确的是
A B C D
构成铜锌原电池 防止Fe被腐蚀 铁上镀银 铜的精炼
A.A B.B C.C D.D
8.电瓶车所用电池一般为铅蓄电池,这是一种典型的可充电电池,电池总反应式为:
Pb+PbO2+4H++2SO42-2PbSO4+2H2O,
则下列说法正确的是:
A.放电时:电子流动方向由A经导线流向B
B.放电时:正极反应是Pb-2e-+SO42-PbSO4
C.充电时:铅蓄电池的负极应与充电器电源的正极相连
D.充电时:阳极反应是PbSO4-2e-+2H2OPbO2+SO42-+4H+
9.用下图所示装置除去含CN-、Cl-废水中的CN-时,阳极产生
的ClO-将CN-氧化为两种无污染的气体,若控制溶液PH为9~10时,下列说法不正确
的是
A.用石墨作阳极,铁作阴极
B.阳极的电极反应式为:Cl- + 2OH--2e-= ClO- + H2O
C.阴极的电极反应式为:2H2O + 2e- = H2↑ + 2OH-
D.除去CN-的反应:2CN-+ 5ClO- + 2H+ = N2↑ + 2CO2↑ + 5Cl-+ H2O
10.利用双离子交换膜电解法可以从含硝酸铵的工业废水中生产硝酸和氨,原理如图所
示。下列叙述不正确的是
A.N室中硝酸溶液浓度a% B.a、c为阳离子交换膜,b为
阴离子交换膜
C.M、N室分别产生氢气和氧气
D.产品室发生的反应为+OH-
= NH3↑+H2O
第II卷 非选择题(共50分)
11.周期表前四周期的元素a、b、c、d、e,f原子序数依次增大.a的核外电子总数与
其周期数相同,b的价电子层中的未成对电子有3个,c的最外层电子数为其内层电
子数的3倍,d与c同族;e的外围电子排布式为3d64s2 ,f的最外层只有一个电子,
但次外层有18个电子.回答下列问题:
(1) a、d、e、f各元素分别是_________、 _______、 _______、 _______。
(2) b、c、d中第一电离能由大到小的顺序是:_______________(填元素符号),f的
价层电子轨道示意图为_________________________________, f的焰色反应为亮
绿色,请用原子结构的知识解释原因_________ __________,预测电离能I4(e)
_______ I4(f)的大小(填大于、小于、等于)。
(3) a和b、c、d形成的二元共价化合物有很多种,其中有一分子呈三角锥形,该
分子的中心原子的杂化方式为__________;
(4) f2+能与NH3、H2O、Cl-等形成配位数为4的配合物。
①[f(NH3)4]2+中存在的化学键类型有________(填序号)。
A.配位键 B.极性共价键 C.非极性共价键 D.离子键
②写出[f(NH3)4]2+的结构式 ____________ 。(只标出配位键)
12.新型储氢材料是开发利用氢能的重要研究方向。
(1)Ti(BH4)3是一种储氢材料,可由TiCl4和LiBH4反应制得。
①基态Cl原子中,电子占据的最高能层符号为________,该能层具有的原子轨道
数为____。
② LiBH4由Li+和BH4-构成,BH4-的立体结构是____,Li、B、H元素的电负性由大
到小排列顺序为_________。
(2)金属氢化物是具有良好发展前景的储氢材料。
①LiH中,离子半径:Li+_________H-(填“>”、“=”或“<”)。
②某储氢材料是短周期金属元素M的氢化物。M的部分电离能如下表所示:
I1/kJ·mol-1 I2/kJ·mol-1 I3/kJ·mol-1 I4/kJ·mol-1 I5/kJ·mol-1
738 1451 7733 10540 13630
M是_________(填元素符号)。
13.如图所示,某同学设计一个燃料
电池并探究氯碱工业原理和粗铜
的精炼原理,其中乙装置中X为
阳离子交换膜。
根据要求回答相关问题:
(1)通入氢气的电极为__________
(填“正极”或“负极”),正
极的电极反应式为________。
(2)石墨电极(C)为____________
(填“阳极”或“阴极”),铁电极的电极反应式为____________。
(3)反应一段时间后,乙装置中生成氢氧化钠主要在________区。(填“铁极”或
“石墨极”)
(4)如果粗铜中含有锌、银、金等杂质,丙装置中反应一段时间,硫酸铜溶液浓度将
____________(填“增大”“减小”或“不变”)。
(5)若在标准状况下,有2.24L氧气参加反应,则乙装置中(NaCl足量)C电极上生
成的气体的分子数为____________NA;丙装置中阴极析出铜的质量为
____________。
川绵外国语学校2020年秋高2019级期中教学质量检测
化学参考答案
1.B【详解】
A. 在基态多电子原子中,3p轨道电子能量比4s轨道电子能量低,A错误;
B. 基态Fe原子的外围电子排布式为3d64s2,3d轨道中,电子未充满,应遵循洪特规则,则外围电子排布图为,B正确;
C. 因为氮原子的最外层电子处于半充满的稳定状态,第一电离能出现反常,所以氧原子第一电离能比氮原子第一电离能小,C错误;
D.Cu的价电子排布式为3d104s1,所以Cu在元素周期表中位于ds区,D错误。
2.D【详解】
A.将过量的氨水加入到硫酸铜溶液中,硫酸铜溶液与过量氨水反应生成四氨合铜离子,得到深蓝色的溶液,反应的离子方程式为Cu2++4NH3·H2O═4H2O+[Cu(NH3)4]2+,故A错误;
B.根据泡利不相容原理知,3p轨道最多排6个电子,则22Ti的电子排布式1s22s22p63s23p10违反了泡利不相容原理,故B错误;
C.水的稳定性强于硫化氢与氧元素的非金属性强于硫元素有关,与氢键的作用无关,故C错误;
D.双键、三键中均只含1个σ键,其余为π键,所以双键中一定有一个σ键、一个π键,三键中一定有一个σ键、两个π键,故D正确;
3.B【详解】
A.分子中键能越大,键长越短,则分子越稳定,故A不符合题意;
B.元素周期表中的第ⅠA族包括氢元素和碱金属元素,第ⅦA族元素为卤族元素,若为氢原子和卤素原子间形成共价键,若为碱金属元素和卤素原子间易形成离子键,故B符合题意;
C.水分子中氧原子和氢原子各形成一对共价键,结构式可表示为H—O—H,水是V形分子,分子中键角为104.5?,故C不符合题意;
D.电子从较高能量的激发态跃迁到较低能量的激发态或基态时,将释放能量,故D不符合题意;
答案选B。
4.B【详解】
A.两种原子的电子层上全部都是s电子,均为1s或均为1s、2s电子,则为短周期一或二,不一定为同周期元素,如H与Li不同周期,故A不选;B.3p能级上只有一个空轨道的原子,为Si元素,3p能级上有一个未成对电子的原子为Na、Cl,均为第三周期元素,故B选;C.最外层电子排布式为2s22p6的原子为Ne,最外层电子排布式为2s22p6的离子为O或Na等,不一定为同周期元素,故C不选;D.原子核外M层上的s、p轨道都充满电子,而d轨道上没有电子,符合条件的原子的核外电子排布式有1s22s22p63s23p6为氩原子,1s22s22p63s23p64s1为钾原子,1s22s22p63s23p64s2为钙原子,不一定处于同一周期,故D不选;故答案为B。
5、 B
6.D【详解】
A.两图中被腐蚀的都是Fe,说明Fe是负极,Sn为正极,说明金属性,A错误;
B.从腐蚀程度来讲,乙明显比较严重,因海水中含有较多的盐分,腐蚀速率比河水快,故乙是海水环境下的腐蚀情况,甲是河水环境下的腐蚀情况,B错误;
C.铁被腐蚀时电极反应式应为 ,C错误;
D.金属性,用锌做补丁,Zn做负极被腐蚀,可以保护,D正确;
7.B【详解】
A.铜锌原电池中,Zn电极在ZnSO4溶液,Cu电极在CuSO4溶液,A错误;
B.在电解池中由于阳极材料是石墨,为惰性电极,Fe作阴极,被保护,故可以防止Fe被腐蚀氧化,B正确;
C.Fe为阳极,阳极发生反应Fe-2e-=Fe2+,Ag作阴极,阴极上发生反应Ag++e-=Ag,因此不能实现Fe上镀Ag,C错误;
D.铜在电解精炼时粗铜应该作阳极,精铜应该作阴极,D错误。
答案选B。
8.D【详解】
A.放电时,Pb为负极,PbO2为正极,电子从负极B流向正极A,选项A错误;
B.正极反应应是PbO2+4H++ SO42-+2e-=PbSO4+2H2O,选项B错误;
C.充电时,铅蓄电池的负极应与充电器电源负极相连,选项C错误;
D.充电时,阳极发生氧化反应,即PbSO4-2e-+2H2O===PbO2+SO+4H+,选项D正确;
9.D【详解】
A、根据电解的原理,铁作阳极时,铁失电子,参与反应,但根据题中信息,铁不参与反应,因此铁作阴极,故A说法正确;
B、根据信息,环境是碱性,利用ClO-氧化CN-,因此阳极反应式为Cl-+2OH--2e-=ClO-+H2O,故B说法正确;
C、根据电解原理,阴极上是阳离子放电,即2H++2e-=H2↑,故C说法正确;
D、CN-被ClO-氧化成两种无毒的气体,即为N2和CO2,环境是碱性,不能生成H+,故D说法错误。
10.B
【详解】
A.N室中石墨为阳极,阳极上水失电子生成O2和H+,电极反应式为:,生成氢离子,氢离子浓度增加,因此N室中硝酸溶液浓度a%B.由题干分析可知a、c为阴离子交换膜,b为阳离子交换膜,故B错误;
C.M、N室分别产生氢气和氧气,故C正确;
D.产品室发生的反应为+OH- = NH3+H2O,故D正确;
11.H S Fe Cu N>O>S 电子从高能级跃迁回低能级,以光的形式释放能量 大于 sp3 AB
【分析】
周期表前四周期的元素a、b、c、d、e原子序数依次增大,a的核外电子总数与其周期数相同,则a是H元素,c的最外层电子数为其内层电子数的3倍,所以C是O元素,d与c同族,则d是S元素,b的价电子层中的未成对电子有3个,且原子序数小于c,则b是N元素;e是Fe,f的最外层只有一个电子,但次外层有18个电子,则f是Cu元素。
12.M 9 正四面体 < H>B>Li Mg
【详解】(1)①Cl原子核外电子数为17,基态原子核外电子排布为1s22s22p63s23p5,由此可得基态Cl原子中电子占据的最高能层为第3能层,符号M,该能层有1个s轨道、3个p轨道、5个d轨道,共有9个原子轨道。
②BH4﹣中B原子价层电子数为4,B原子的杂化轨道类型是sp3杂化,且不含孤电子对,所以是正四面体构型。非金属的非金属性越强其电负性越大,非金属性最强的是H元素,其次是B元素,最小的是Li元素,所以Li、B、H元素的电负性由大到小排列顺序为H>B>Li。
(2)①核外电子排布相同的离子,核电荷数越大,离子半径越小。锂的质子数为3,氢的质子数为1,Li+、H﹣核外电子数都为2,所以半径Li+<H﹣。
②该元素的第Ⅲ电离能剧增,则该元素属于第ⅡA族,为Mg元素。
13.负极 O2+4e-+2H2O=4OH- 阳极 2H2O+2e-=2OH-+H2↑ 铁极 减小 0.2 12.8g
【分析】甲装置:为燃料电池,正极:O2+2H2O+4e-=4OH-,负极:H2-2e-+2OH-=2H2O,总反应:2H2+O2=2H2O;
乙装置:Fe电极与电源负极相连,为阴极,电极反应式:2H2O+2e-=2OH-+H2↑,C极为阳极,电极反应式为:2Cl--2e-=Cl2↑,总反应为:2H2O+2Cl-2OH-+H2↑+ Cl2↑;
丙装置:铜的电解精炼池,粗铜为阳极,电极反应式主要为:Cu-2e-=Cu2+,精铜为阴极,电极反应式为:Cu2++2e-=Cu,据此解答。
化学试题
可能用到的相对原子质量:
H-1 O-16 Na-23 Mg-24 Al-27 Cl-35.5 Fe-56 Cu-64
第Ⅰ卷 选择题(每小题5分,共50分)
1.下列说法或有关化学用语的表达正确的是
A.在基态多电子原子中,p轨道电子能量一定高于s轨道电子能量
B.基态Fe原子的外围电子排布图为
C.因氧元素电负性比氮元素大,故氧原子第一电离能比氮原子第一电离能大
D.根据原子核外电子排布的特点,Cu在元素周期表中位于s区
2.下列说法正确的是
A.将过量的氨水加入到CuSO4溶液中,最终得到蓝色沉淀
B.电子排布式(22Ti)1s22s22p63s23p10违反了洪特规则
C.由于氢键的作用,H2O的稳定性强于H2S
D.双键中一定有一个σ键和一个π键,三键中一定有一个σ键和两个π键
3.下列说法中正确的是
A.分子中键能越大,键长越长,则分子越稳定
B.元素周期表中的第ⅠA族和第ⅦA族元素的原子间可能形成共价键
C.水分子可表示为H—O—H,分子中键角为180°
D.电子从较高能量的激发态跃迁到较低能量的激发态或基态时,将吸收能量
4.具有下列电子层结构的原子,其对应元素一定属于同一周期的是
A.两种原子的电子层上全部都是s电子
B.3p能级上只有一个空轨道的原子和3p能级上只有一个未成对电子的原子
C.最外层电子排布为2s22p6的原子和最外层电子排布为2s22p6的离子
D.原子核外M层上的s能级和p能级都填满了电子,而d轨道上尚未有电子的两种
原子
5.下表是第三周期部分元素基态原子的逐级电离能[单位:eV(电子伏特)]数据:
元素 甲 乙 丙 丁
I1/eV 5.7 7.7 13.0 15.7
I2/eV 47.4 15.1 23.9 27.6
I3/eV 71.8 80.3 40.0 40.7
下列说法正确的是
A.乙常见的化合价是+1价 B.甲的金属性比乙强
C.丁一定是金属元素 D.丙不可能是非金属元素
6.国产航母山东舰已经列装服役,它是采用模块制造然后焊接组装而成的,对焊接有
着极高的要求。实验室模拟在海水环境和河水环境下对焊接金属材料使用的影响(如
图)。下列相关描述中正确的是
A.由图示的金属腐蚀情况说明了Sn元素的金属性强于Fe元素
B.由图示可以看出甲是海水环境下的腐蚀情况,乙是河水环境下的腐蚀情况
C.两种环境下铁被腐蚀时的电极反应式均为Fe-3e-=Fe3+
D.为了防止舰艇在海水中被腐蚀,可在焊点附近用锌块打“补丁”
7.下列有关电化学装置完全正确的是
A B C D
构成铜锌原电池 防止Fe被腐蚀 铁上镀银 铜的精炼
A.A B.B C.C D.D
8.电瓶车所用电池一般为铅蓄电池,这是一种典型的可充电电池,电池总反应式为:
Pb+PbO2+4H++2SO42-2PbSO4+2H2O,
则下列说法正确的是:
A.放电时:电子流动方向由A经导线流向B
B.放电时:正极反应是Pb-2e-+SO42-PbSO4
C.充电时:铅蓄电池的负极应与充电器电源的正极相连
D.充电时:阳极反应是PbSO4-2e-+2H2OPbO2+SO42-+4H+
9.用下图所示装置除去含CN-、Cl-废水中的CN-时,阳极产生
的ClO-将CN-氧化为两种无污染的气体,若控制溶液PH为9~10时,下列说法不正确
的是
A.用石墨作阳极,铁作阴极
B.阳极的电极反应式为:Cl- + 2OH--2e-= ClO- + H2O
C.阴极的电极反应式为:2H2O + 2e- = H2↑ + 2OH-
D.除去CN-的反应:2CN-+ 5ClO- + 2H+ = N2↑ + 2CO2↑ + 5Cl-+ H2O
10.利用双离子交换膜电解法可以从含硝酸铵的工业废水中生产硝酸和氨,原理如图所
示。下列叙述不正确的是
A.N室中硝酸溶液浓度a%
阴离子交换膜
C.M、N室分别产生氢气和氧气
D.产品室发生的反应为+OH-
= NH3↑+H2O
第II卷 非选择题(共50分)
11.周期表前四周期的元素a、b、c、d、e,f原子序数依次增大.a的核外电子总数与
其周期数相同,b的价电子层中的未成对电子有3个,c的最外层电子数为其内层电
子数的3倍,d与c同族;e的外围电子排布式为3d64s2 ,f的最外层只有一个电子,
但次外层有18个电子.回答下列问题:
(1) a、d、e、f各元素分别是_________、 _______、 _______、 _______。
(2) b、c、d中第一电离能由大到小的顺序是:_______________(填元素符号),f的
价层电子轨道示意图为_________________________________, f的焰色反应为亮
绿色,请用原子结构的知识解释原因_________ __________,预测电离能I4(e)
_______ I4(f)的大小(填大于、小于、等于)。
(3) a和b、c、d形成的二元共价化合物有很多种,其中有一分子呈三角锥形,该
分子的中心原子的杂化方式为__________;
(4) f2+能与NH3、H2O、Cl-等形成配位数为4的配合物。
①[f(NH3)4]2+中存在的化学键类型有________(填序号)。
A.配位键 B.极性共价键 C.非极性共价键 D.离子键
②写出[f(NH3)4]2+的结构式 ____________ 。(只标出配位键)
12.新型储氢材料是开发利用氢能的重要研究方向。
(1)Ti(BH4)3是一种储氢材料,可由TiCl4和LiBH4反应制得。
①基态Cl原子中,电子占据的最高能层符号为________,该能层具有的原子轨道
数为____。
② LiBH4由Li+和BH4-构成,BH4-的立体结构是____,Li、B、H元素的电负性由大
到小排列顺序为_________。
(2)金属氢化物是具有良好发展前景的储氢材料。
①LiH中,离子半径:Li+_________H-(填“>”、“=”或“<”)。
②某储氢材料是短周期金属元素M的氢化物。M的部分电离能如下表所示:
I1/kJ·mol-1 I2/kJ·mol-1 I3/kJ·mol-1 I4/kJ·mol-1 I5/kJ·mol-1
738 1451 7733 10540 13630
M是_________(填元素符号)。
13.如图所示,某同学设计一个燃料
电池并探究氯碱工业原理和粗铜
的精炼原理,其中乙装置中X为
阳离子交换膜。
根据要求回答相关问题:
(1)通入氢气的电极为__________
(填“正极”或“负极”),正
极的电极反应式为________。
(2)石墨电极(C)为____________
(填“阳极”或“阴极”),铁电极的电极反应式为____________。
(3)反应一段时间后,乙装置中生成氢氧化钠主要在________区。(填“铁极”或
“石墨极”)
(4)如果粗铜中含有锌、银、金等杂质,丙装置中反应一段时间,硫酸铜溶液浓度将
____________(填“增大”“减小”或“不变”)。
(5)若在标准状况下,有2.24L氧气参加反应,则乙装置中(NaCl足量)C电极上生
成的气体的分子数为____________NA;丙装置中阴极析出铜的质量为
____________。
川绵外国语学校2020年秋高2019级期中教学质量检测
化学参考答案
1.B【详解】
A. 在基态多电子原子中,3p轨道电子能量比4s轨道电子能量低,A错误;
B. 基态Fe原子的外围电子排布式为3d64s2,3d轨道中,电子未充满,应遵循洪特规则,则外围电子排布图为,B正确;
C. 因为氮原子的最外层电子处于半充满的稳定状态,第一电离能出现反常,所以氧原子第一电离能比氮原子第一电离能小,C错误;
D.Cu的价电子排布式为3d104s1,所以Cu在元素周期表中位于ds区,D错误。
2.D【详解】
A.将过量的氨水加入到硫酸铜溶液中,硫酸铜溶液与过量氨水反应生成四氨合铜离子,得到深蓝色的溶液,反应的离子方程式为Cu2++4NH3·H2O═4H2O+[Cu(NH3)4]2+,故A错误;
B.根据泡利不相容原理知,3p轨道最多排6个电子,则22Ti的电子排布式1s22s22p63s23p10违反了泡利不相容原理,故B错误;
C.水的稳定性强于硫化氢与氧元素的非金属性强于硫元素有关,与氢键的作用无关,故C错误;
D.双键、三键中均只含1个σ键,其余为π键,所以双键中一定有一个σ键、一个π键,三键中一定有一个σ键、两个π键,故D正确;
3.B【详解】
A.分子中键能越大,键长越短,则分子越稳定,故A不符合题意;
B.元素周期表中的第ⅠA族包括氢元素和碱金属元素,第ⅦA族元素为卤族元素,若为氢原子和卤素原子间形成共价键,若为碱金属元素和卤素原子间易形成离子键,故B符合题意;
C.水分子中氧原子和氢原子各形成一对共价键,结构式可表示为H—O—H,水是V形分子,分子中键角为104.5?,故C不符合题意;
D.电子从较高能量的激发态跃迁到较低能量的激发态或基态时,将释放能量,故D不符合题意;
答案选B。
4.B【详解】
A.两种原子的电子层上全部都是s电子,均为1s或均为1s、2s电子,则为短周期一或二,不一定为同周期元素,如H与Li不同周期,故A不选;B.3p能级上只有一个空轨道的原子,为Si元素,3p能级上有一个未成对电子的原子为Na、Cl,均为第三周期元素,故B选;C.最外层电子排布式为2s22p6的原子为Ne,最外层电子排布式为2s22p6的离子为O或Na等,不一定为同周期元素,故C不选;D.原子核外M层上的s、p轨道都充满电子,而d轨道上没有电子,符合条件的原子的核外电子排布式有1s22s22p63s23p6为氩原子,1s22s22p63s23p64s1为钾原子,1s22s22p63s23p64s2为钙原子,不一定处于同一周期,故D不选;故答案为B。
5、 B
6.D【详解】
A.两图中被腐蚀的都是Fe,说明Fe是负极,Sn为正极,说明金属性,A错误;
B.从腐蚀程度来讲,乙明显比较严重,因海水中含有较多的盐分,腐蚀速率比河水快,故乙是海水环境下的腐蚀情况,甲是河水环境下的腐蚀情况,B错误;
C.铁被腐蚀时电极反应式应为 ,C错误;
D.金属性,用锌做补丁,Zn做负极被腐蚀,可以保护,D正确;
7.B【详解】
A.铜锌原电池中,Zn电极在ZnSO4溶液,Cu电极在CuSO4溶液,A错误;
B.在电解池中由于阳极材料是石墨,为惰性电极,Fe作阴极,被保护,故可以防止Fe被腐蚀氧化,B正确;
C.Fe为阳极,阳极发生反应Fe-2e-=Fe2+,Ag作阴极,阴极上发生反应Ag++e-=Ag,因此不能实现Fe上镀Ag,C错误;
D.铜在电解精炼时粗铜应该作阳极,精铜应该作阴极,D错误。
答案选B。
8.D【详解】
A.放电时,Pb为负极,PbO2为正极,电子从负极B流向正极A,选项A错误;
B.正极反应应是PbO2+4H++ SO42-+2e-=PbSO4+2H2O,选项B错误;
C.充电时,铅蓄电池的负极应与充电器电源负极相连,选项C错误;
D.充电时,阳极发生氧化反应,即PbSO4-2e-+2H2O===PbO2+SO+4H+,选项D正确;
9.D【详解】
A、根据电解的原理,铁作阳极时,铁失电子,参与反应,但根据题中信息,铁不参与反应,因此铁作阴极,故A说法正确;
B、根据信息,环境是碱性,利用ClO-氧化CN-,因此阳极反应式为Cl-+2OH--2e-=ClO-+H2O,故B说法正确;
C、根据电解原理,阴极上是阳离子放电,即2H++2e-=H2↑,故C说法正确;
D、CN-被ClO-氧化成两种无毒的气体,即为N2和CO2,环境是碱性,不能生成H+,故D说法错误。
10.B
【详解】
A.N室中石墨为阳极,阳极上水失电子生成O2和H+,电极反应式为:,生成氢离子,氢离子浓度增加,因此N室中硝酸溶液浓度a%
C.M、N室分别产生氢气和氧气,故C正确;
D.产品室发生的反应为+OH- = NH3+H2O,故D正确;
11.H S Fe Cu N>O>S 电子从高能级跃迁回低能级,以光的形式释放能量 大于 sp3 AB
【分析】
周期表前四周期的元素a、b、c、d、e原子序数依次增大,a的核外电子总数与其周期数相同,则a是H元素,c的最外层电子数为其内层电子数的3倍,所以C是O元素,d与c同族,则d是S元素,b的价电子层中的未成对电子有3个,且原子序数小于c,则b是N元素;e是Fe,f的最外层只有一个电子,但次外层有18个电子,则f是Cu元素。
12.M 9 正四面体 < H>B>Li Mg
【详解】(1)①Cl原子核外电子数为17,基态原子核外电子排布为1s22s22p63s23p5,由此可得基态Cl原子中电子占据的最高能层为第3能层,符号M,该能层有1个s轨道、3个p轨道、5个d轨道,共有9个原子轨道。
②BH4﹣中B原子价层电子数为4,B原子的杂化轨道类型是sp3杂化,且不含孤电子对,所以是正四面体构型。非金属的非金属性越强其电负性越大,非金属性最强的是H元素,其次是B元素,最小的是Li元素,所以Li、B、H元素的电负性由大到小排列顺序为H>B>Li。
(2)①核外电子排布相同的离子,核电荷数越大,离子半径越小。锂的质子数为3,氢的质子数为1,Li+、H﹣核外电子数都为2,所以半径Li+<H﹣。
②该元素的第Ⅲ电离能剧增,则该元素属于第ⅡA族,为Mg元素。
13.负极 O2+4e-+2H2O=4OH- 阳极 2H2O+2e-=2OH-+H2↑ 铁极 减小 0.2 12.8g
【分析】甲装置:为燃料电池,正极:O2+2H2O+4e-=4OH-,负极:H2-2e-+2OH-=2H2O,总反应:2H2+O2=2H2O;
乙装置:Fe电极与电源负极相连,为阴极,电极反应式:2H2O+2e-=2OH-+H2↑,C极为阳极,电极反应式为:2Cl--2e-=Cl2↑,总反应为:2H2O+2Cl-2OH-+H2↑+ Cl2↑;
丙装置:铜的电解精炼池,粗铜为阳极,电极反应式主要为:Cu-2e-=Cu2+,精铜为阴极,电极反应式为:Cu2++2e-=Cu,据此解答。
同课章节目录
