四川省仁寿华兴中学2020-2021学年高二上学期期中考试化学试题 Word版含答案
文档属性
| 名称 | 四川省仁寿华兴中学2020-2021学年高二上学期期中考试化学试题 Word版含答案 |  | |
| 格式 | doc | ||
| 文件大小 | 561.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-11-05 08:58:44 | ||
图片预览


文档简介
华兴中学2020-2021学年高二上学期期中考试
化学试题
可能用到的相对原子质量:H 1 C 12 O 16 N14 Fe 56 Cu 64 Zn 65
一、选择题:共7小题,每小题6分,共42分。在每小题只有一项是符合题目要求的。
1.下列说法或表示方法中正确的是
A.氢气的燃烧热为285.8 kJ·mol-1,则氢气燃烧的热化学方程式为2H2(g)+
O2(g)=2H2O(l) ΔH=-285.8 kJ·mol-1
B.等质量的硫蒸气和硫粉分别完全燃烧,后者放出的热量多
C.某密闭容器盛有0.1 mol N2和0.3 mol H2,在一定条件下充分反应,转移电子的数
目小于0.6×6.02×1023
D.已知中和热为57.3 kJ·mol-1,若将含0.5 mol H2SO4的浓硫酸溶液与含1 mol NaOH
的溶液混合,放出的热量要小于57.3 kJ
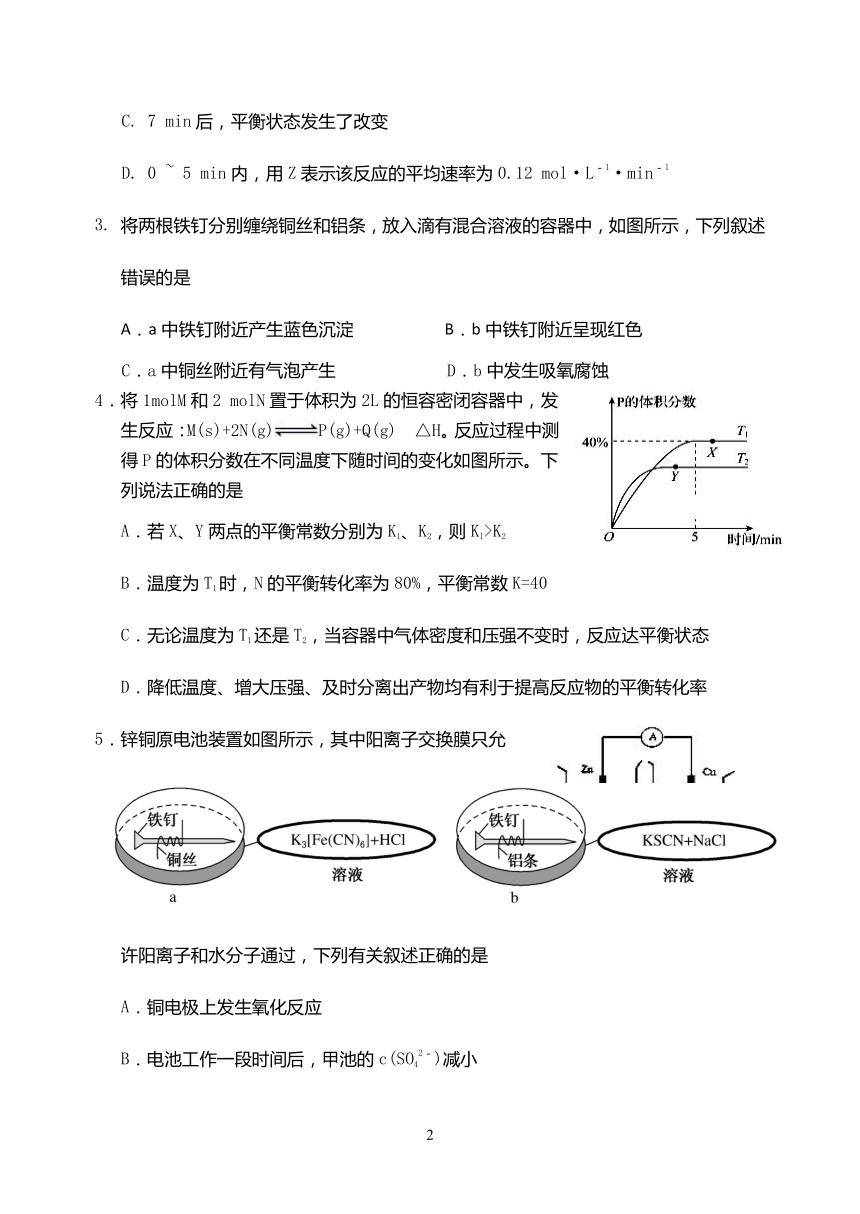
2.一定温度下,在 2L恒容的密闭容器中发生某
一反应,该反应中的 X、Y、Z三种气体的物
质的量随时间的变化如右图所示,则下列有关
描述错误的是
A. 该反应可表示为:X(g)+2Y(g)2Z(g)
B. 5 min达到平衡时,X的转化率为60%
C. 7 min后,平衡状态发生了改变
D. 0 ~ 5 min内,用Z表示该反应的平均速率为0.12 mol·L-1·min-1
3. 将两根铁钉分别缠绕铜丝和铝条,放入滴有混合溶液的容器中,如图所示,下列叙述
错误的是
A.a中铁钉附近产生蓝色沉淀 B.b中铁钉附近呈现红色
C.a中铜丝附近有气泡产生 D.b中发生吸氧腐蚀
4.将1molM和2 molN置于体积为2L的恒容密闭容器中,发
生反应:M(s)+2N(g)P(g)+Q(g) △H。反应过程中测
得P的体积分数在不同温度下随时间的变化如图所示。下
列说法正确的是
A.若X、Y两点的平衡常数分别为K1、K2,则K1>K2
B.温度为T1时,N的平衡转化率为80%,平衡常数K=40
C.无论温度为T1还是T2,当容器中气体密度和压强不变时,反应达平衡状态
D.降低温度、增大压强、及时分离出产物均有利于提高反应物的平衡转化率
5.锌铜原电池装置如图所示,其中阳离子交换膜只允
许阳离子和水分子通过,下列有关叙述正确的是
A.铜电极上发生氧化反应
B.电池工作一段时间后,甲池的c(SO42-)减小
C.电池工作一段时间后,乙池溶液的总质量增加
D.阴阳离子离子分别通过交换膜向负极和正极移
动,保持溶液中电荷平衡
6.下列说法正确的是
A.相同温度时,1mol/L氨水与0.5mol/L氨水中,c(OH-)之比是2:1
B.Na2S溶液中存在这样的水解平衡:S2- + 2H20 H2S +2OH-
C.实验室保存FeCl3溶液同时加入少量盐酸,加热TiCl4溶液制备TiO2都与盐的水
解有关
D.常温下,将pH=2的醋酸和pH=12的NaOH等体积混合,溶液呈碱性
7.以酚酞为指示剂,用0.1000 mol·L?1的NaOH溶液滴定20.00 mL未知浓度的二元酸
H2A溶液。已知H2A第一步可完全电离,溶液中,pH、分布系数随滴加NaOH溶液体
积的变化关系如下图所示。[比如A2?的分布系数:
]
下列叙述正确的是
曲线①代表,曲线②代表
H2A溶液的浓度为0.2000 mol·L?1
HA?的电离常数Ka=1.0×10?2
D.滴定终点时,溶液中
二、填空题
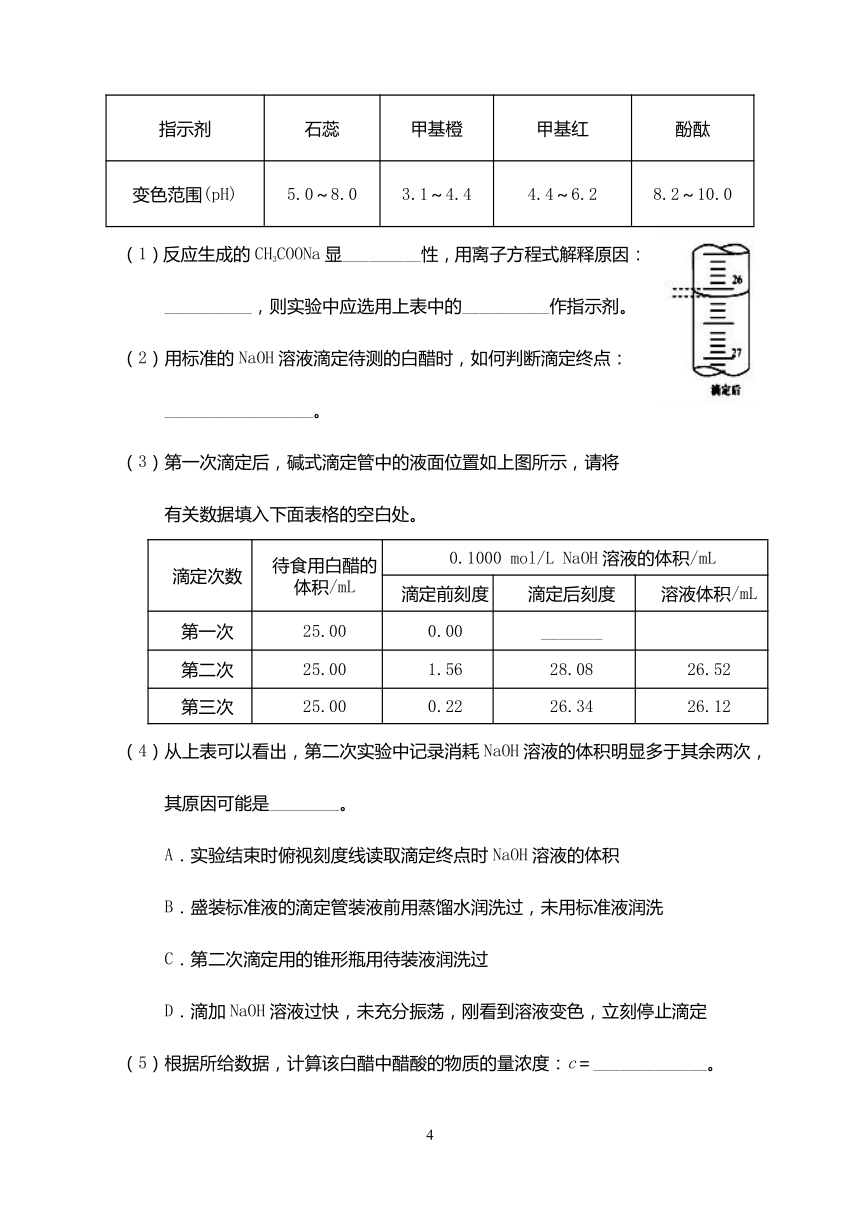
8.(每空2分,共14分)某化学实验小组想要了解市场上所售食用白醋(主要是醋酸的
水溶液)的准确浓度,现从市场上买来一瓶某品牌食用白醋,用实验室标准NaOH溶
液对其进行滴定。下表是4种常见指示剂的变色范围:
指示剂 石蕊 甲基橙 甲基红 酚酞
变色范围(pH) 5.0~8.0 3.1~4.4 4.4~6.2 8.2~10.0
(1)反应生成的CH3COONa显_________性,用离子方程式解释原因:
__________,则实验中应选用上表中的__________作指示剂。
(2)用标准的NaOH溶液滴定待测的白醋时,如何判断滴定终点:
_________________。
(3)第一次滴定后,碱式滴定管中的液面位置如上图所示,请将
有关数据填入下面表格的空白处。
滴定次数 待食用白醋的体积/mL 0.1000 mol/L NaOH溶液的体积/mL
滴定前刻度 滴定后刻度 溶液体积/mL
第一次 25.00 0.00 _______
第二次 25.00 1.56 28.08 26.52
第三次 25.00 0.22 26.34 26.12
(4)从上表可以看出,第二次实验中记录消耗NaOH溶液的体积明显多于其余两次,
其原因可能是________。
A.实验结束时俯视刻度线读取滴定终点时NaOH溶液的体积
B.盛装标准液的滴定管装液前用蒸馏水润洗过,未用标准液润洗
C.第二次滴定用的锥形瓶用待装液润洗过
D.滴加NaOH溶液过快,未充分振荡,刚看到溶液变色,立刻停止滴定
(5)根据所给数据,计算该白醋中醋酸的物质的量浓度:c=_____________。
9.(每空2分,共12分)二氧化硫与氧气反应生成三氧化硫是工业制硫酸的重要反应之一。
(1)将0.050molSO2(g)和0.030molO2(g)放入容积为1L的密闭容器中,反应
2SO2(g)+O2(g)2SO3(g)在一定条件下经20分钟达到平衡,测得c(SO3)=
0.040mol/L。
①从反应开始到达到平衡,用SO2表示的平均反应速率为________________
②从平衡角度分析采用过量O2的目的是___________;
③已知:K(300℃)>K(350℃),该反应是______(选
填“吸”或“放”)热反应。若 反应温度升高,
SO2的转化率将_______(填“增大”、“减小”或
“不变”)。
(2)某温度下,SO2的平衡转化率(α)与体系总压强(P)
的关系如图所示。平衡状态由A变到B时,平衡常数
K(A)_______K(B)(填“>”、“<”或“=”,下同)。
计算该温度下A点的Kp=________________(以平衡分压代替平衡浓度,各物质
的P(分压)=P(总)×物质的量分数)。
10.(每空2分,共16分)某校化学活动社团做了如下探究实验:实验一:测定1 mol/L
的硫酸与锌粒和锌粉反应的速率,设计如
下图1装置:
(1)装置图1中放有硫酸的仪器名称是
______。
(2)按照图1装置实验时,限定了两次
实验时间均为10 min,还需要测定
的另一个数据是 ________。
图Ⅰ 图2
(3)若将图Ⅰ装置中的气体收集装置改为图2,实验完毕待冷却后,该生准备读取滴
定管上液面所在处的刻度数,发现滴定管中液面高于干燥管中液面,应首先采取的
操作是________。
实验二:利用H2C2O4溶液和酸性KMnO4溶液之间的反应来探究外界条件改变对化
学反应速率的影响。实验如下:
序号 温度/K 0.02mol·L-1KMnO4 0.1mol·L-1H2C2O4 H2O 溶液颜色褪至无色时所需时间/s
V/mL V/mL V/mL
A 293 2 5 3 t1
B 293 2 3 5 8
C 313 2 3 5 t2
(1)写出相应反应的离子方程式___________。
(2)通过实验A、B可探究______(填外部因素)的改变对反应速率的影响,通过实验
_____可探究温度变化对化学反应速率的影响。
(3)利用实验B中数据计算,用KMnO4的浓度变化表示的反应速率为v(KMnO4)=____。
(4)实验中发现:反应一段时间后该反应速率会加快,造成此种变化的原因是反应
体系中的某种粒子对与之间的反应有某种特殊的作用,则该作
用是_______.
11.(每空2分,16分)氮元素的氢化物和氧化物在工业生产广泛应用,回答下列问题:
(1)肼 N2H4(l)可作为火箭发动机的燃料,与氧化剂 N2O4(g)反应生成N2 和水蒸气。
已知:① N2(g) + 2O2(g) === N2O4(g) ΔH1= -19.5 kJ/mol
② N2H4(l) + O2(g) === N2(g) + 2H2O(g) ΔH2= -534.2 kJ/mol
写出N2H4(l)和 N2O4(g)反应的热化学方程式 ;
(2)肼—N2O4 燃料电池是一种碱性电池, 如图是一种新
型燃料电池装置,其总反应方程式为N2H4+O2=N2+
2H2O,通入N2H4(肼)的一极是电池的____(填“正
极”或“负极”),该电极的电极反应式为______。
(3)在上述燃料电池中,若完全消耗16 g N2H4,则理论
上外电路中转移电子的物质的量为
_________mol,电池工作一段时间后
电解质溶液的pH________(填“增
大”“减小”或“不变”)
(4)在电化学中,离子交换膜扮演了非常重
要的角色,其中阴(阳)离子交换膜只
允许阴(阳)离子通过的特性,往往有
很多新奇的应用。用图一装置电解Na2SO4溶液,和为外电源的正负极。m为
_______子交换膜(填“阳”或“阴”)。D口产品的化学式是_______(H2O和气
体除外),整个装置中的总反应方程式为________________。
华兴中学2020-2021学年高二上学期期中考试
化学参考答案
注意事项:
可能用到的相对原子质量:H 1 C 12 O 16 N14 Fe 56 Cu 64 Zn 65 Ag 108
一、选择题:本题共8小题,每小题5分,共40分。在每小题给出的四个选项中,只有一项是符合题目要求的。(每空6分,共42分)
1-7 C D B A C C C
(每空2分,共58分)
8.碱性 CH3COO-+H2OCH3COOH+OH- 酚酞 滴入最后一滴NaOH溶液时,锥形瓶中溶液由无色变为红色,且半分钟内不褪色26.10 BC 0.1044 mol/L
9.0.002mol/(L?min) 提高二氧化硫的转化率 放 减小 = 960
10.分液漏斗 收集到气体的体积 待气体恢复至室温后,调节滴定管的高度使得两侧液面相平 5H2C2O4+2MnO4-+6H+=2Mn2++10CO2↑+8H2O 浓度 B、C 5×10-4 mol/(L·s) 催化作用
11. 2N2H4(l) + N2O4(g) === 3N2(g) + 4H2O(g) ΔH= -1048.9 kJ/mol
负极 N2H4+4OH――4e-=N2+4H2O 2 减小 阴 NaOH
2Na2SO4 +4H2O4NaOH + 2H2SO4 +2H2↑+O2↑ (写2H2O2H2↑ + O2 ↑ 给1分)。
1
化学试题
可能用到的相对原子质量:H 1 C 12 O 16 N14 Fe 56 Cu 64 Zn 65
一、选择题:共7小题,每小题6分,共42分。在每小题只有一项是符合题目要求的。
1.下列说法或表示方法中正确的是
A.氢气的燃烧热为285.8 kJ·mol-1,则氢气燃烧的热化学方程式为2H2(g)+
O2(g)=2H2O(l) ΔH=-285.8 kJ·mol-1
B.等质量的硫蒸气和硫粉分别完全燃烧,后者放出的热量多
C.某密闭容器盛有0.1 mol N2和0.3 mol H2,在一定条件下充分反应,转移电子的数
目小于0.6×6.02×1023
D.已知中和热为57.3 kJ·mol-1,若将含0.5 mol H2SO4的浓硫酸溶液与含1 mol NaOH
的溶液混合,放出的热量要小于57.3 kJ
2.一定温度下,在 2L恒容的密闭容器中发生某
一反应,该反应中的 X、Y、Z三种气体的物
质的量随时间的变化如右图所示,则下列有关
描述错误的是
A. 该反应可表示为:X(g)+2Y(g)2Z(g)
B. 5 min达到平衡时,X的转化率为60%
C. 7 min后,平衡状态发生了改变
D. 0 ~ 5 min内,用Z表示该反应的平均速率为0.12 mol·L-1·min-1
3. 将两根铁钉分别缠绕铜丝和铝条,放入滴有混合溶液的容器中,如图所示,下列叙述
错误的是
A.a中铁钉附近产生蓝色沉淀 B.b中铁钉附近呈现红色
C.a中铜丝附近有气泡产生 D.b中发生吸氧腐蚀
4.将1molM和2 molN置于体积为2L的恒容密闭容器中,发
生反应:M(s)+2N(g)P(g)+Q(g) △H。反应过程中测
得P的体积分数在不同温度下随时间的变化如图所示。下
列说法正确的是
A.若X、Y两点的平衡常数分别为K1、K2,则K1>K2
B.温度为T1时,N的平衡转化率为80%,平衡常数K=40
C.无论温度为T1还是T2,当容器中气体密度和压强不变时,反应达平衡状态
D.降低温度、增大压强、及时分离出产物均有利于提高反应物的平衡转化率
5.锌铜原电池装置如图所示,其中阳离子交换膜只允
许阳离子和水分子通过,下列有关叙述正确的是
A.铜电极上发生氧化反应
B.电池工作一段时间后,甲池的c(SO42-)减小
C.电池工作一段时间后,乙池溶液的总质量增加
D.阴阳离子离子分别通过交换膜向负极和正极移
动,保持溶液中电荷平衡
6.下列说法正确的是
A.相同温度时,1mol/L氨水与0.5mol/L氨水中,c(OH-)之比是2:1
B.Na2S溶液中存在这样的水解平衡:S2- + 2H20 H2S +2OH-
C.实验室保存FeCl3溶液同时加入少量盐酸,加热TiCl4溶液制备TiO2都与盐的水
解有关
D.常温下,将pH=2的醋酸和pH=12的NaOH等体积混合,溶液呈碱性
7.以酚酞为指示剂,用0.1000 mol·L?1的NaOH溶液滴定20.00 mL未知浓度的二元酸
H2A溶液。已知H2A第一步可完全电离,溶液中,pH、分布系数随滴加NaOH溶液体
积的变化关系如下图所示。[比如A2?的分布系数:
]
下列叙述正确的是
曲线①代表,曲线②代表
H2A溶液的浓度为0.2000 mol·L?1
HA?的电离常数Ka=1.0×10?2
D.滴定终点时,溶液中
二、填空题
8.(每空2分,共14分)某化学实验小组想要了解市场上所售食用白醋(主要是醋酸的
水溶液)的准确浓度,现从市场上买来一瓶某品牌食用白醋,用实验室标准NaOH溶
液对其进行滴定。下表是4种常见指示剂的变色范围:
指示剂 石蕊 甲基橙 甲基红 酚酞
变色范围(pH) 5.0~8.0 3.1~4.4 4.4~6.2 8.2~10.0
(1)反应生成的CH3COONa显_________性,用离子方程式解释原因:
__________,则实验中应选用上表中的__________作指示剂。
(2)用标准的NaOH溶液滴定待测的白醋时,如何判断滴定终点:
_________________。
(3)第一次滴定后,碱式滴定管中的液面位置如上图所示,请将
有关数据填入下面表格的空白处。
滴定次数 待食用白醋的体积/mL 0.1000 mol/L NaOH溶液的体积/mL
滴定前刻度 滴定后刻度 溶液体积/mL
第一次 25.00 0.00 _______
第二次 25.00 1.56 28.08 26.52
第三次 25.00 0.22 26.34 26.12
(4)从上表可以看出,第二次实验中记录消耗NaOH溶液的体积明显多于其余两次,
其原因可能是________。
A.实验结束时俯视刻度线读取滴定终点时NaOH溶液的体积
B.盛装标准液的滴定管装液前用蒸馏水润洗过,未用标准液润洗
C.第二次滴定用的锥形瓶用待装液润洗过
D.滴加NaOH溶液过快,未充分振荡,刚看到溶液变色,立刻停止滴定
(5)根据所给数据,计算该白醋中醋酸的物质的量浓度:c=_____________。
9.(每空2分,共12分)二氧化硫与氧气反应生成三氧化硫是工业制硫酸的重要反应之一。
(1)将0.050molSO2(g)和0.030molO2(g)放入容积为1L的密闭容器中,反应
2SO2(g)+O2(g)2SO3(g)在一定条件下经20分钟达到平衡,测得c(SO3)=
0.040mol/L。
①从反应开始到达到平衡,用SO2表示的平均反应速率为________________
②从平衡角度分析采用过量O2的目的是___________;
③已知:K(300℃)>K(350℃),该反应是______(选
填“吸”或“放”)热反应。若 反应温度升高,
SO2的转化率将_______(填“增大”、“减小”或
“不变”)。
(2)某温度下,SO2的平衡转化率(α)与体系总压强(P)
的关系如图所示。平衡状态由A变到B时,平衡常数
K(A)_______K(B)(填“>”、“<”或“=”,下同)。
计算该温度下A点的Kp=________________(以平衡分压代替平衡浓度,各物质
的P(分压)=P(总)×物质的量分数)。
10.(每空2分,共16分)某校化学活动社团做了如下探究实验:实验一:测定1 mol/L
的硫酸与锌粒和锌粉反应的速率,设计如
下图1装置:
(1)装置图1中放有硫酸的仪器名称是
______。
(2)按照图1装置实验时,限定了两次
实验时间均为10 min,还需要测定
的另一个数据是 ________。
图Ⅰ 图2
(3)若将图Ⅰ装置中的气体收集装置改为图2,实验完毕待冷却后,该生准备读取滴
定管上液面所在处的刻度数,发现滴定管中液面高于干燥管中液面,应首先采取的
操作是________。
实验二:利用H2C2O4溶液和酸性KMnO4溶液之间的反应来探究外界条件改变对化
学反应速率的影响。实验如下:
序号 温度/K 0.02mol·L-1KMnO4 0.1mol·L-1H2C2O4 H2O 溶液颜色褪至无色时所需时间/s
V/mL V/mL V/mL
A 293 2 5 3 t1
B 293 2 3 5 8
C 313 2 3 5 t2
(1)写出相应反应的离子方程式___________。
(2)通过实验A、B可探究______(填外部因素)的改变对反应速率的影响,通过实验
_____可探究温度变化对化学反应速率的影响。
(3)利用实验B中数据计算,用KMnO4的浓度变化表示的反应速率为v(KMnO4)=____。
(4)实验中发现:反应一段时间后该反应速率会加快,造成此种变化的原因是反应
体系中的某种粒子对与之间的反应有某种特殊的作用,则该作
用是_______.
11.(每空2分,16分)氮元素的氢化物和氧化物在工业生产广泛应用,回答下列问题:
(1)肼 N2H4(l)可作为火箭发动机的燃料,与氧化剂 N2O4(g)反应生成N2 和水蒸气。
已知:① N2(g) + 2O2(g) === N2O4(g) ΔH1= -19.5 kJ/mol
② N2H4(l) + O2(g) === N2(g) + 2H2O(g) ΔH2= -534.2 kJ/mol
写出N2H4(l)和 N2O4(g)反应的热化学方程式 ;
(2)肼—N2O4 燃料电池是一种碱性电池, 如图是一种新
型燃料电池装置,其总反应方程式为N2H4+O2=N2+
2H2O,通入N2H4(肼)的一极是电池的____(填“正
极”或“负极”),该电极的电极反应式为______。
(3)在上述燃料电池中,若完全消耗16 g N2H4,则理论
上外电路中转移电子的物质的量为
_________mol,电池工作一段时间后
电解质溶液的pH________(填“增
大”“减小”或“不变”)
(4)在电化学中,离子交换膜扮演了非常重
要的角色,其中阴(阳)离子交换膜只
允许阴(阳)离子通过的特性,往往有
很多新奇的应用。用图一装置电解Na2SO4溶液,和为外电源的正负极。m为
_______子交换膜(填“阳”或“阴”)。D口产品的化学式是_______(H2O和气
体除外),整个装置中的总反应方程式为________________。
华兴中学2020-2021学年高二上学期期中考试
化学参考答案
注意事项:
可能用到的相对原子质量:H 1 C 12 O 16 N14 Fe 56 Cu 64 Zn 65 Ag 108
一、选择题:本题共8小题,每小题5分,共40分。在每小题给出的四个选项中,只有一项是符合题目要求的。(每空6分,共42分)
1-7 C D B A C C C
(每空2分,共58分)
8.碱性 CH3COO-+H2OCH3COOH+OH- 酚酞 滴入最后一滴NaOH溶液时,锥形瓶中溶液由无色变为红色,且半分钟内不褪色26.10 BC 0.1044 mol/L
9.0.002mol/(L?min) 提高二氧化硫的转化率 放 减小 = 960
10.分液漏斗 收集到气体的体积 待气体恢复至室温后,调节滴定管的高度使得两侧液面相平 5H2C2O4+2MnO4-+6H+=2Mn2++10CO2↑+8H2O 浓度 B、C 5×10-4 mol/(L·s) 催化作用
11. 2N2H4(l) + N2O4(g) === 3N2(g) + 4H2O(g) ΔH= -1048.9 kJ/mol
负极 N2H4+4OH――4e-=N2+4H2O 2 减小 阴 NaOH
2Na2SO4 +4H2O4NaOH + 2H2SO4 +2H2↑+O2↑ (写2H2O2H2↑ + O2 ↑ 给1分)。
1
同课章节目录
