人教版九年级化学下册8.2《金属的化学性质》(23张ppt)
文档属性
| 名称 | 人教版九年级化学下册8.2《金属的化学性质》(23张ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 231.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-11-05 20:07:41 | ||
图片预览






文档简介
第八章 金属和金属材料
课题2 金属的化学性质
课堂导入
你有没有发现,日常生活中使用的铝制品的表面总是光亮的。为什么铝制品不易生锈呢?
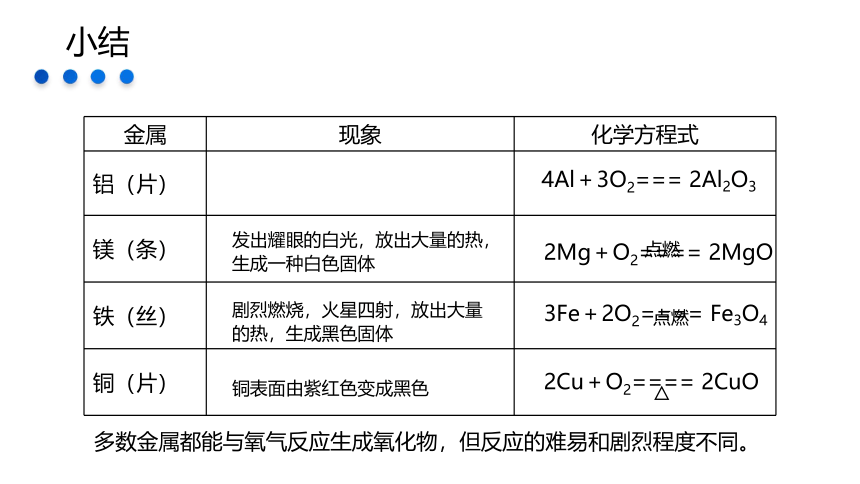
{69C7853C-536D-4A76-A0AE-DD22124D55A5}金属
现象
化学方程式
铝(片)
镁(条)
铁(丝)
铜(片)
发出耀眼的白光,放出大量的热,生成一种白色固体
剧烈燃烧,火星四射,放出大量的热,生成黑色固体
铜表面由紫红色变成黑色
多数金属都能与氧气反应生成氧化物,但反应的难易和剧烈程度不同。
2Mg+O2==== 2MgO
点燃
3Fe+2O2==== Fe3O4
点燃
2Cu+O2==== 2CuO
△
4Al+3O2=== 2Al2O3
小结
4.铜在加热时能与氧气反应
5.金高温也不与氧气反应
紫红色的铜表面逐渐变成黑色
2Cu+O2 2CuO
△
“真金不怕火炼”
一、金属与氧气的反应
判断金属活动性的方法之一:
根据金属与氧气反应的难易程度或者反应现象的剧烈程度判断
金属与氧气反应的难易和剧烈程度首先与金属本身的性质有关,其次还与金属粉碎的程度、与氧气的接触面积、氧气的浓度、温度等因素有关。
镁、铝比较活泼,铁、铜次之,金最不活泼。
一、金属与氧气的反应
为什么用旧了的铝锅会变得暗淡无光?
铝很容易跟氧气反应,生成一层致密而坚固的氧化铝薄膜。
这层薄膜可以阻止内部的铝跟氧气接触,从而对铝制品起到保护作用。
4Al +3O2 = 2Al2O3
一、金属与氧气的反应
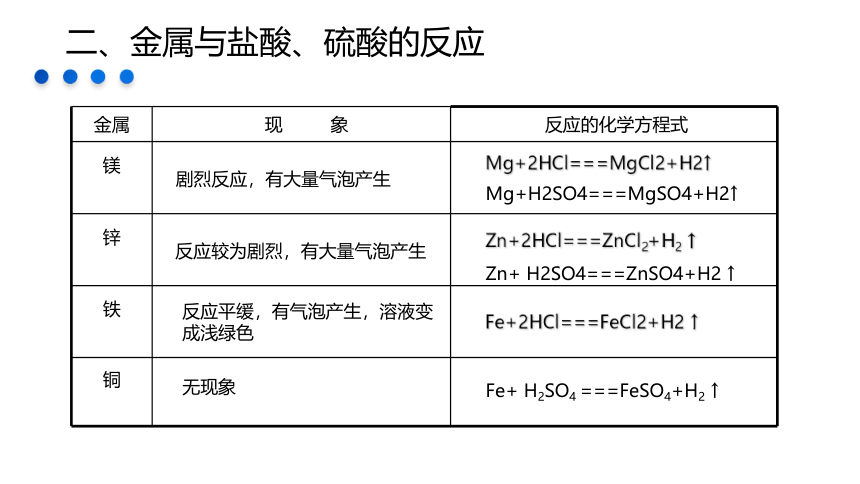
金属
现 象
反应的化学方程式
镁
锌
铁
铜
剧烈反应,有大量气泡产生
反应较为剧烈,有大量气泡产生
反应平缓,有气泡产生,溶液变成浅绿色
Mg+H2SO4===MgSO4+H2↑
Zn+ H2SO4===ZnSO4+H2 ↑
Fe+ H2SO4 ===FeSO4+H2 ↑
Mg+2HCl===MgCl2+H2↑
Zn+2HCl===ZnCl2+H2 ↑
Fe+2HCl===FeCl2+H2 ↑
无现象
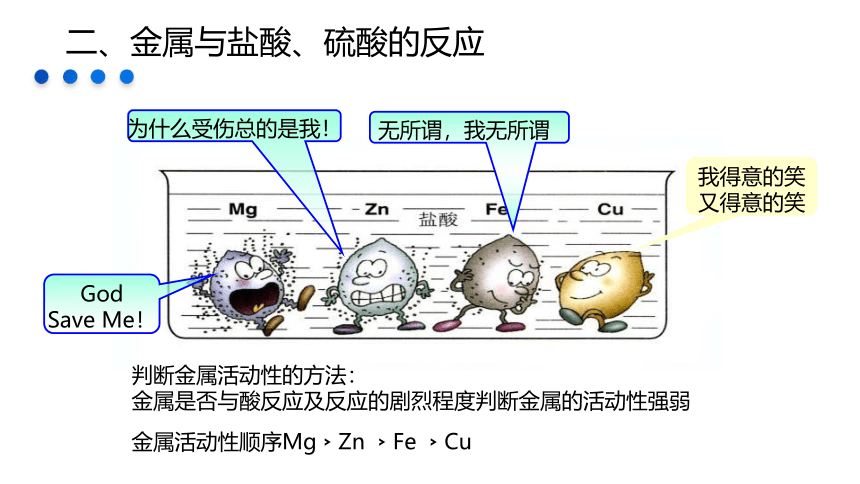
二、金属与盐酸、硫酸的反应
God Save Me!
为什么受伤总的是我!
我得意的笑又得意的笑
无所谓,我无所谓
判断金属活动性的方法:
金属是否与酸反应及反应的剧烈程度判断金属的活动性强弱
金属活动性顺序Mg﹥Zn ﹥Fe ﹥Cu
二、金属与盐酸、硫酸的反应
一般情况下,能与稀盐酸或稀硫酸反应的金属,其活动性较 ,不反应的较 ; 反应越剧烈的越 ,越缓慢的越 .
得出判断金属活动性的方法二:
强
强
弱
弱
二、金属与盐酸、硫酸的反应
从反应物和生成物的物质类别的角度分析,这些反应都有什么共同点?
Mg + 2HCl = MgCl2 + H2
Mg + H2SO4 = MgSO4 + H2
Zn + 2HCl = ZnCl2 + H2
Zn +H2SO4 = ZnSO4 +H2
Fe + 2HCl = FeCl2 + H2
单质
化合物
单质
化合物
置换反应
典型例题
置换反应:一种单质跟一种化合物反应生成另一种单质和另一种化合物的反应。
判断 1、反应前后均为两种物质
方法 2、反应前后均为一种单质和一种化合物
置换反应:
(A、B是单质)
三、置换反应
基本反应类型
特点
形式
多生一
单质 + --
+ .
复分解反应
后学
化合反应
分解反应
置换反应
一生多
化合物
新单质
新化合物
A + B +… == AB
AB == A + B +…
A + BC == B + AC
三、置换反应
葛洪是我国晋代著名的炼丹家,一次葛洪之妻鲍姑用铁勺盛曾青(硫酸铜溶液),几天后,葛洪拿起铁勺便用,奇妙的现象出现了:铁勺变成了“铜勺”,金光闪闪。葛洪的徒弟高兴得跳了起来:“点石成金了!”
Fe+CuSO4=FeSO4+Cu
铁表面覆盖一层红色固体,溶液由蓝色逐渐变为浅绿色
四、金属与化合物溶液反应
{073A0DAA-6AF3-43AB-8588-CEC1D06C72B9}实验操作
现象
化学方程式
铝丝浸入硫酸铜溶液
铜丝浸入硝酸银溶液
铜丝浸入硫酸铝溶液
不反应
铝丝表面覆盖一层红色的固体,溶液由蓝色变为无色
铜丝表面覆盖一层银白色的固体,溶液由无色变为蓝色
2Al+3CuSO4=
Al2(SO4)3+3Cu
Cu+2AgNO3=
Cu(NO3)2+2Ag
四、金属与化合物溶液反应
讨论
1、上述能发生反应的化学方程式的特点 是什么?它们属于哪种反应类型?
2、通过上述实验,你能得出铝、铜、银 的金属活动性顺序吗?
2Al+3CuSO4=Al2(SO4)3+3Cu
Cu+2AgNO3=Cu(NO3)2+2Ag
Al Cu Ag
置换反应
金属活动性:Al>Cu>Ag
四、金属与化合物溶液反应
在金属活动性顺序中,金属的位置越靠前,该金属的活动性越强;反之,越弱。
K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au
金属活动性逐渐减弱
四、金属与化合物溶液反应
二、金属活动性顺序的应用
应用一:位于氢前面的金属能置换出盐酸、稀硫酸中的氢;反之,不能。
K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au
金属活动性逐渐减弱
注意:与金属反应生成氢气的速率与金属活动性顺序有关,金属的位置越靠前,反应速率越快。
四、金属与化合物溶液反应
应用二:位于前面的金属能把位于后面的金属从它们化合物的溶液里置换出来;反之,不能。
注意:
1、金属化合物必须是可溶的,且必须为溶液;
2、由于钾、钙、钠过于活泼,不能从其后金属化合物的溶液中置换出金属。
例如:把金属钠放入硫酸铜溶液中,会发生如下反应:
2Na+2H2O=2NaOH+H2↑ 2NaOH+CuSO4=Cu(OH)2↓+Na2SO4
四、金属与化合物溶液反应
1.金属的化学性质;
(1)大多数金属能与O2反应;
(2)大多数金属能与稀HCl或稀H2SO4反应;
(3)部分金属能与金属化合物的溶液反应。
2、置换反应
特点: 单质+化合物 → 新单质+新化合物
3、常见金属的活动性顺序
K Ca Na Mg Al, Zn Fe Sn Pb (H) , Cu Hg Ag Pt Au
课堂小结
1·下列金属中,金属活动性最弱的是( )
A.金 B.银
C.铜 D.铁
2·将一枚洁净的铁钉浸入稀硫酸中,下列叙述中正确的是( )
①铁钉表面产生气泡;②液体由无色逐渐变为浅绿色;
③铁钉的质量减轻;④液体的质量减轻
A.②③ B.①②④ C.①②③ D.①②③④
A
C
典型例题
3·为验证Zn、Cu、Ag三种金属的活动性顺序,可选用的试剂( )
A.CuSO4溶液 B.稀盐酸
C.AgNO3溶液 D.ZnSO4溶液
4·下列金属中,不能从CuSO4溶液中置换出Cu的是( )
A.Fe B.Zn
C.Mg D.Ag
A
D
典型例题
5·同学们到实验室去进行“探究金属的性质”实验。将锌粉和铁粉的混合物加入到盛有一定量硝酸银溶液的烧杯中,充分反应后过滤,得到滤渣和滤液。请你填空。
(1)若将所得滤渣放入稀盐酸中,有气泡产生,则
①滤液里一定含有 __ __ _(填写化学式,下同),可能含有_____ ;
②滤渣中一定含有__ ___ ,可能含有_____。
(2)若反应后所得滤液呈无色,则滤渣中一定含有_ _ _ _ _ (填写化学式)。
(3)反应后所得滤液的溶质质量分数_____(选填“大于”、“等于”或“小于”)原硝酸银溶液的溶质质量分数。
Zn(NO3)2
Fe(NO3)2
Ag、Fe
Zn
Ag、Fe、Zn
小于
典型例题
感谢各位的聆听
课题2 金属的化学性质
课堂导入
你有没有发现,日常生活中使用的铝制品的表面总是光亮的。为什么铝制品不易生锈呢?
{69C7853C-536D-4A76-A0AE-DD22124D55A5}金属
现象
化学方程式
铝(片)
镁(条)
铁(丝)
铜(片)
发出耀眼的白光,放出大量的热,生成一种白色固体
剧烈燃烧,火星四射,放出大量的热,生成黑色固体
铜表面由紫红色变成黑色
多数金属都能与氧气反应生成氧化物,但反应的难易和剧烈程度不同。
2Mg+O2==== 2MgO
点燃
3Fe+2O2==== Fe3O4
点燃
2Cu+O2==== 2CuO
△
4Al+3O2=== 2Al2O3
小结
4.铜在加热时能与氧气反应
5.金高温也不与氧气反应
紫红色的铜表面逐渐变成黑色
2Cu+O2 2CuO
△
“真金不怕火炼”
一、金属与氧气的反应
判断金属活动性的方法之一:
根据金属与氧气反应的难易程度或者反应现象的剧烈程度判断
金属与氧气反应的难易和剧烈程度首先与金属本身的性质有关,其次还与金属粉碎的程度、与氧气的接触面积、氧气的浓度、温度等因素有关。
镁、铝比较活泼,铁、铜次之,金最不活泼。
一、金属与氧气的反应
为什么用旧了的铝锅会变得暗淡无光?
铝很容易跟氧气反应,生成一层致密而坚固的氧化铝薄膜。
这层薄膜可以阻止内部的铝跟氧气接触,从而对铝制品起到保护作用。
4Al +3O2 = 2Al2O3
一、金属与氧气的反应
金属
现 象
反应的化学方程式
镁
锌
铁
铜
剧烈反应,有大量气泡产生
反应较为剧烈,有大量气泡产生
反应平缓,有气泡产生,溶液变成浅绿色
Mg+H2SO4===MgSO4+H2↑
Zn+ H2SO4===ZnSO4+H2 ↑
Fe+ H2SO4 ===FeSO4+H2 ↑
Mg+2HCl===MgCl2+H2↑
Zn+2HCl===ZnCl2+H2 ↑
Fe+2HCl===FeCl2+H2 ↑
无现象
二、金属与盐酸、硫酸的反应
God Save Me!
为什么受伤总的是我!
我得意的笑又得意的笑
无所谓,我无所谓
判断金属活动性的方法:
金属是否与酸反应及反应的剧烈程度判断金属的活动性强弱
金属活动性顺序Mg﹥Zn ﹥Fe ﹥Cu
二、金属与盐酸、硫酸的反应
一般情况下,能与稀盐酸或稀硫酸反应的金属,其活动性较 ,不反应的较 ; 反应越剧烈的越 ,越缓慢的越 .
得出判断金属活动性的方法二:
强
强
弱
弱
二、金属与盐酸、硫酸的反应
从反应物和生成物的物质类别的角度分析,这些反应都有什么共同点?
Mg + 2HCl = MgCl2 + H2
Mg + H2SO4 = MgSO4 + H2
Zn + 2HCl = ZnCl2 + H2
Zn +H2SO4 = ZnSO4 +H2
Fe + 2HCl = FeCl2 + H2
单质
化合物
单质
化合物
置换反应
典型例题
置换反应:一种单质跟一种化合物反应生成另一种单质和另一种化合物的反应。
判断 1、反应前后均为两种物质
方法 2、反应前后均为一种单质和一种化合物
置换反应:
(A、B是单质)
三、置换反应
基本反应类型
特点
形式
多生一
单质 + --
+ .
复分解反应
后学
化合反应
分解反应
置换反应
一生多
化合物
新单质
新化合物
A + B +… == AB
AB == A + B +…
A + BC == B + AC
三、置换反应
葛洪是我国晋代著名的炼丹家,一次葛洪之妻鲍姑用铁勺盛曾青(硫酸铜溶液),几天后,葛洪拿起铁勺便用,奇妙的现象出现了:铁勺变成了“铜勺”,金光闪闪。葛洪的徒弟高兴得跳了起来:“点石成金了!”
Fe+CuSO4=FeSO4+Cu
铁表面覆盖一层红色固体,溶液由蓝色逐渐变为浅绿色
四、金属与化合物溶液反应
{073A0DAA-6AF3-43AB-8588-CEC1D06C72B9}实验操作
现象
化学方程式
铝丝浸入硫酸铜溶液
铜丝浸入硝酸银溶液
铜丝浸入硫酸铝溶液
不反应
铝丝表面覆盖一层红色的固体,溶液由蓝色变为无色
铜丝表面覆盖一层银白色的固体,溶液由无色变为蓝色
2Al+3CuSO4=
Al2(SO4)3+3Cu
Cu+2AgNO3=
Cu(NO3)2+2Ag
四、金属与化合物溶液反应
讨论
1、上述能发生反应的化学方程式的特点 是什么?它们属于哪种反应类型?
2、通过上述实验,你能得出铝、铜、银 的金属活动性顺序吗?
2Al+3CuSO4=Al2(SO4)3+3Cu
Cu+2AgNO3=Cu(NO3)2+2Ag
Al Cu Ag
置换反应
金属活动性:Al>Cu>Ag
四、金属与化合物溶液反应
在金属活动性顺序中,金属的位置越靠前,该金属的活动性越强;反之,越弱。
K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au
金属活动性逐渐减弱
四、金属与化合物溶液反应
二、金属活动性顺序的应用
应用一:位于氢前面的金属能置换出盐酸、稀硫酸中的氢;反之,不能。
K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au
金属活动性逐渐减弱
注意:与金属反应生成氢气的速率与金属活动性顺序有关,金属的位置越靠前,反应速率越快。
四、金属与化合物溶液反应
应用二:位于前面的金属能把位于后面的金属从它们化合物的溶液里置换出来;反之,不能。
注意:
1、金属化合物必须是可溶的,且必须为溶液;
2、由于钾、钙、钠过于活泼,不能从其后金属化合物的溶液中置换出金属。
例如:把金属钠放入硫酸铜溶液中,会发生如下反应:
2Na+2H2O=2NaOH+H2↑ 2NaOH+CuSO4=Cu(OH)2↓+Na2SO4
四、金属与化合物溶液反应
1.金属的化学性质;
(1)大多数金属能与O2反应;
(2)大多数金属能与稀HCl或稀H2SO4反应;
(3)部分金属能与金属化合物的溶液反应。
2、置换反应
特点: 单质+化合物 → 新单质+新化合物
3、常见金属的活动性顺序
K Ca Na Mg Al, Zn Fe Sn Pb (H) , Cu Hg Ag Pt Au
课堂小结
1·下列金属中,金属活动性最弱的是( )
A.金 B.银
C.铜 D.铁
2·将一枚洁净的铁钉浸入稀硫酸中,下列叙述中正确的是( )
①铁钉表面产生气泡;②液体由无色逐渐变为浅绿色;
③铁钉的质量减轻;④液体的质量减轻
A.②③ B.①②④ C.①②③ D.①②③④
A
C
典型例题
3·为验证Zn、Cu、Ag三种金属的活动性顺序,可选用的试剂( )
A.CuSO4溶液 B.稀盐酸
C.AgNO3溶液 D.ZnSO4溶液
4·下列金属中,不能从CuSO4溶液中置换出Cu的是( )
A.Fe B.Zn
C.Mg D.Ag
A
D
典型例题
5·同学们到实验室去进行“探究金属的性质”实验。将锌粉和铁粉的混合物加入到盛有一定量硝酸银溶液的烧杯中,充分反应后过滤,得到滤渣和滤液。请你填空。
(1)若将所得滤渣放入稀盐酸中,有气泡产生,则
①滤液里一定含有 __ __ _(填写化学式,下同),可能含有_____ ;
②滤渣中一定含有__ ___ ,可能含有_____。
(2)若反应后所得滤液呈无色,则滤渣中一定含有_ _ _ _ _ (填写化学式)。
(3)反应后所得滤液的溶质质量分数_____(选填“大于”、“等于”或“小于”)原硝酸银溶液的溶质质量分数。
Zn(NO3)2
Fe(NO3)2
Ag、Fe
Zn
Ag、Fe、Zn
小于
典型例题
感谢各位的聆听
同课章节目录
