人教版选修5高中化学第一节:脂肪烃(40张PPT)
文档属性
| 名称 | 人教版选修5高中化学第一节:脂肪烃(40张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 470.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-11-05 00:00:00 | ||
图片预览










文档简介
(共41张PPT)
链烃
脂环烃
环,不含苯环!
脂肪烃
(烷烃、烯烃、炔烃……)
一、烷烃的物理性质
1、物态
常温常压下,四个碳原子以内的脂烃为气体;
C5~C16的烷烃、C5~C18的烯烃、C5~C17的炔烃、C5~C11的环烷烃为液体;高级脂烃为固体。
2、沸点(b.p.)
同系列的烃化合物的沸点随分子中碳原子数的增加而升高。
同碳数的环烷烃比相应的烷烃的沸点高。同碳数的炔烃比相应的烯烃和烷烃的沸点高。
在碳原子数目相同的烷烃异构体中,直链烷烃的沸点较高,支链烷烃的沸点较低,支链越多,沸点越低。
3、熔点(m.p.)
同系列的烃化合物的熔点基本上也是随分子中碳原子数目的增加而升高。
4、相对密度
同系列的烃化合物,随分子中碳原子数目增加而逐渐增大。其相对密度都小于1,比水轻。
5、溶解度
根据“相似相溶”
的经验规则,脂烃分子没有极性或极性很弱,因此难溶于水,易溶于有机溶剂。
1、由沸点数据:甲烷-146℃,乙烷-89℃,丁烷-0.5℃,戊烷36℃,可以判断丙烷的沸点可能是(
)
A.高于-0.5℃
B.约是+30℃
C.约是-40℃
D.低于-89℃
√
练习
3、下列液体混合物可以用分液的方法分离的是(
)
A.苯和溴苯
B.汽油和辛烷
C.己烷和水
D.戊烷和庚烷
√
2、下列烷烃沸点最高的是(
)
A.CH3CH2CH3
B.CH3CH2CH2CH3
C.CH3(CH2)3CH3
D.(CH3)2CHCH2CH3
√
二、
烷烃的结构
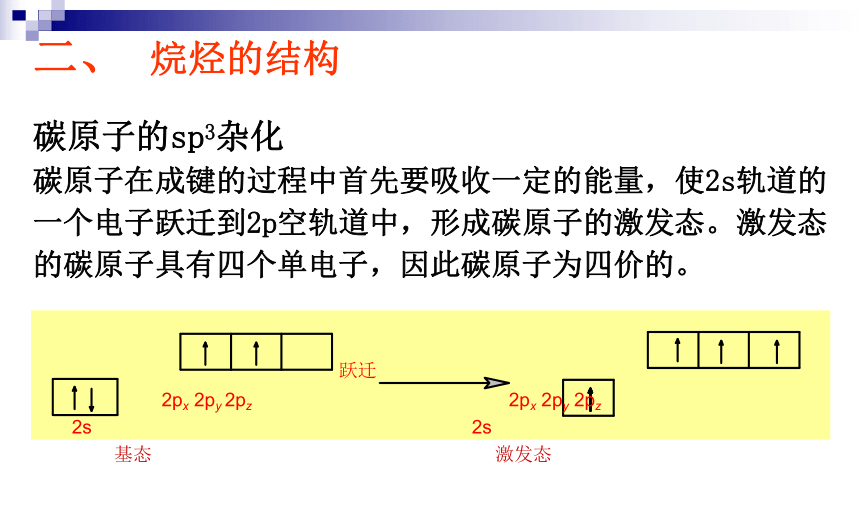
碳原子的sp3杂化
碳原子在成键的过程中首先要吸收一定的能量,使2s轨道的一个电子跃迁到2p空轨道中,形成碳原子的激发态。激发态的碳原子具有四个单电子,因此碳原子为四价的。
跃迁
2px
2py
2pz
2px
2py
2pz
2s
2s
基态
激发态
甲烷分子为一正四面体结构,碳原子居于正四面体的中心,和碳原子相连的四个氢原子,居于四面体的四个角(如下图),四个碳氢键键长都为0.110nm,H-C-H键角都是109.5°。
构造式
结构式
由烷烃分子式和构造式可以看出,碳原子和氢原子之间的数量关系是一定的。烷烃的通式为CnH2n+2
像烷烃分子这样,通式相同、结构相似、在组成上相差一个或多个CH2基团系列化合物叫做同系物。同系物一般具有相似的化学性质。
分子中的碳原子以单键相互连接,其余价键与氢原子结合的链烃叫做饱和链烃--烷烃。
有机化学中,分子式相同但结构不同的化合物互称为同分异构体,这种现象就叫做同分异构现象。
烷烃同分异构主要考虑碳链异构(核心考察思维有序性)。
某个碳原子上连接的四个基团均不相同,该碳具有手性。
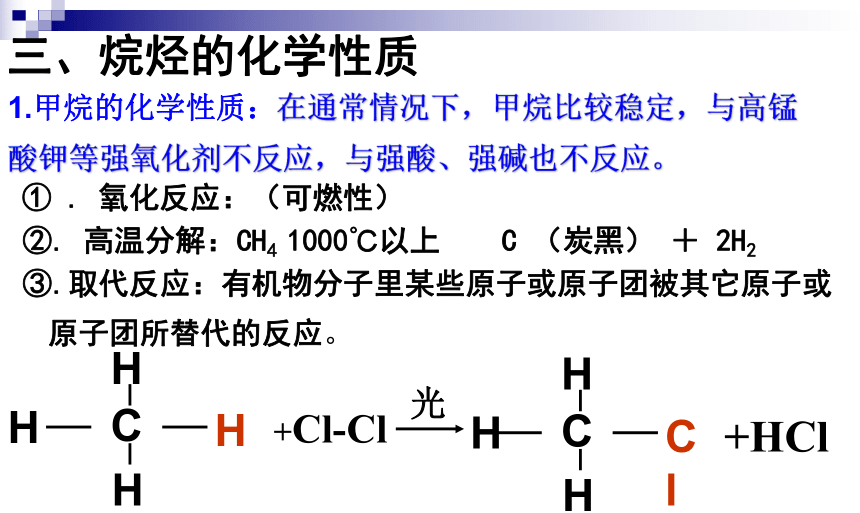
1.甲烷的化学性质:在通常情况下,甲烷比较稳定,与高锰酸钾等强氧化剂不反应,与强酸、强碱也不反应。
①
.
氧化反应:(可燃性)
②.
高温分解:CH4
1000℃以上
C
(炭黑)
+
2H2
三、烷烃的化学性质
③.取代反应:有机物分子里某些原子或原子团被其它原子或原子团所替代的反应。
C
H
H
H
H
+Cl-Cl
C
H
Cl
H
H
+HCl
光
2.烷烃的化学性质
稳定,不跟强酸、强碱及强氧化剂反应,不能使酸性KMnO4溶液或溴水褪色。
(1)
氧化反应(写出反应的通式)
(2)取代反应
(烷烃的特征反应)
在光照条件下进行,产物更复杂。例如:
思考:1mol丁烷最多能和几molCl2发生取代反应?
会生成7种产物。
烷烃分子中有多少个H就可以发生多少步取代。
10mol
收集一试管甲烷与氯气的混合气体,倒扣于水槽中,用强光照射,观察现象。
试管内壁上出现油状液滴;
水位沿试管上升;
气体黄绿色变浅。
产生的现象是:
在光照条件下,甲烷与氯气发生了化学反应——取代反应
烷烃、环烷烃能与卤素在高温或光照条件下发生取代反应。
X2的反应活性:
F2>Cl2>Br2>I2
其中氟代反应太剧烈,难以控制;而碘代反应太慢,难以进行,实
际上广为应用的是氯代和溴代反应。
在高温绝氧下使烷烃分子发生裂解的过程称为裂化。
一般分解为小分子烷烃和小分子烯烃
3.裂化反应
高温分解:CH4
1000℃以上
C
(炭黑)
+
2H2
练习
4、关于烷烃性质的叙述,错误的是(
)。
A.能使酸性高锰酸钾溶液褪色
B.都能燃烧
C.通常情况下跟酸、碱和氧化剂都不反应
D.都能发生取代反应
√
1.乙烯的结构
杂化轨道理论认为,乙烯分子中的碳原子在成键时发生了sp2杂化,即碳原子的2s轨道和两个2p轨道重新组合分配,组成了三个完全相同的sp2杂化轨道,还剩余一个未参与杂化的2p轨道。
碳原子的sp2杂化过程如下:
四、烯烃的化学性质
sp2杂化特点:?
a).
杂化轨道成分:1/3s轨道和2/3p轨道;
b).
成键能力较sp3杂化轨道弱,但较未杂化轨道强;
c).
杂化轨道呈平面三角形,夹角120°
未杂化的2p轨道垂直于这一平面。
π键:成键原子的p轨道平行侧面重叠形成的共价键叫做π键,该成键电子称为π电子
乙烯分子中的所有原子均在一个平面上
键能(KJ/mol)
键长(pm)
乙烯分子中的碳碳双键
610
134
乙烷分子中碳碳单键
345
154
平行的P轨道,侧面重叠,形成一个π键
(1)氧化反应
①燃烧
②与酸性KMnO4溶液反应:能使酸性KMnO4溶液褪色。
(2)加成反应
(3)加聚反应
2.乙烯的性质
均为断裂π键,保留σ键
3.
烯烃的物理性质
烯烃在常温下、常压下的状态、沸点和熔点都和烷烃相似。烯烃的相对密度都小于1。烯烃几乎不溶于水,但可溶于非极性溶剂,如戊烷、四氯化碳和乙醚等。
(1)加成反应
(可与H2、X2、HX、H2O加成)
定量关系:n(C=C):n(H2、X2、HX、H2O)=1:1
有机物分子中不饱和键(双键或三键)两端的碳原子与其他的原子或原子团直接结合生成新的化合物的反应
烯烃在铂、钯或镍等金属催化剂存在下,可以与氢加成而生成烷烃。
1mol含双键的某脂肪烃与H2完全反应,消耗3molH2
,则1
分子该烃中的双键数目最多为?
4.
烯烃的化学性质
在有机化学中,通常把加氧或脱氢的反应统称为氧化反应。
(2)
氧化反应
H
3
丙
酮
1
M
P
a
,
9
0
~
1
2
0
℃
P
d
C
l
2
-
C
u
C
l
2
O
2
+
环
氧
乙
烷
A
g
O
2
+
2
5
0
℃
C
H
2
C
H
2
O
C
H
2
C
H
2
C
H
3
C
H
C
H
2
C
H
3
C
C
O
烯烃和炔烃可以被高锰酸钾氧化,氧化产物视烃的结构和反应条件的差异而不同。反应后高锰酸钾溶液的紫色褪去是鉴别碳碳双键的常用方法之一。
(3)
聚合反应(加聚反应)
含有双键或叁键的化合物以及含有双官能团或多官能团的化合物在合适的条件下(催化剂、引发剂、温度等)发生加成或缩合等反应,使两个分子、叁个分子或多个分子结合成一个分子的反应称为聚合反应。
烷烃和烯烃的比较:
代表物
分子结
构特点
特征反应
空间结
构特点
CH4
C2H4
C-C
单键
C=C
双键
取代反应
加成反应
正四面体型
键角109?28?
平面结构
键角约为120?
1、烯烃的同分异构现象:
C=C位置异构
碳链异构
官能团异构
顺反异构
五、烯烃的顺反异构
产生顺反异构体的条件
(1)分子内存在着阻碍自由旋转的因素:
如C=C
;
(2
)每个双键碳原子上所连接的两个原子或基团必须不相同,如:
C=C
a
f
d
b
a
?
b
d
?
f
???
由于双键中的π键限制了σ键的自由旋转,使得两个甲基和两个氢原子在空间有两种不同的排列方式。
产生的原因
顺式视黄醛
反式视黄醛
光
H
H
C
H
O
H
H
C
H
O
练习、指出下列化合物那些有顺反异构?
(1)
H2C=CHCH2CH3
(2)
CH3CH=CHCH3
(3
)(CH3)2C=CHCH3
六、二烯烃的化学性质
二烯烃含有两个π键,由于分子中的极性交替现象,与1mol卤素或卤化氢进行加成反应时,得到1,2-和1,4-两种加成产物。
二烯烃的加成
二烯烃与含C=C或C≡C的不饱和化合物发生1,4-加成,生成环状化合物的反应叫做双烯合成反应
双烯合成
在催化剂存在下,二烯烃可以聚合为高分子化合物。
聚合反应
七、炔烃的结构
1.乙炔分子式为C2H2,构造式为CH≡CH。键角为180°,乙炔分子中的两个碳原子和两个氢原子在同一条直线上,乙炔为直线型分子。
乙炔分子中的π键
碳的sp杂化
杂化轨道理论认为,乙炔分子中的每个碳原子,各以一个2s轨道和一个2p轨道进行sp杂化,组成了两个完全相同的sp杂化轨道,每个碳原子还剩余两个未参与杂化的2p轨道。杂化过程如下
2.
炔烃的物理性质
炔烃的物理性质和烷烃、烯烃相似。低级的炔烃在常温常压下是气体,但沸点比相同原子数的烯烃略高些。随着碳原子数的增多,它们的沸点也升高。炔烃不溶于水,但易溶于极性小的有机溶剂,如石油醚、苯、乙醚、四氯化碳等。
3.
炔烃的化学性质
炔烃催化加氢,生成烯烃。进一步加氢生成烷烃。
(1)加成反应
炔烃在酸性水溶液中加水,先生成烯醇(为加成反应),后者立刻转变为更稳定的羰基化合物。
2、氧化反应
炔烃和氧化剂反应,往往可以使叁键断裂,最后得到完全氧化的产物-羧酸或二氧化碳。例如:
链烃
脂环烃
环,不含苯环!
脂肪烃
(烷烃、烯烃、炔烃……)
一、烷烃的物理性质
1、物态
常温常压下,四个碳原子以内的脂烃为气体;
C5~C16的烷烃、C5~C18的烯烃、C5~C17的炔烃、C5~C11的环烷烃为液体;高级脂烃为固体。
2、沸点(b.p.)
同系列的烃化合物的沸点随分子中碳原子数的增加而升高。
同碳数的环烷烃比相应的烷烃的沸点高。同碳数的炔烃比相应的烯烃和烷烃的沸点高。
在碳原子数目相同的烷烃异构体中,直链烷烃的沸点较高,支链烷烃的沸点较低,支链越多,沸点越低。
3、熔点(m.p.)
同系列的烃化合物的熔点基本上也是随分子中碳原子数目的增加而升高。
4、相对密度
同系列的烃化合物,随分子中碳原子数目增加而逐渐增大。其相对密度都小于1,比水轻。
5、溶解度
根据“相似相溶”
的经验规则,脂烃分子没有极性或极性很弱,因此难溶于水,易溶于有机溶剂。
1、由沸点数据:甲烷-146℃,乙烷-89℃,丁烷-0.5℃,戊烷36℃,可以判断丙烷的沸点可能是(
)
A.高于-0.5℃
B.约是+30℃
C.约是-40℃
D.低于-89℃
√
练习
3、下列液体混合物可以用分液的方法分离的是(
)
A.苯和溴苯
B.汽油和辛烷
C.己烷和水
D.戊烷和庚烷
√
2、下列烷烃沸点最高的是(
)
A.CH3CH2CH3
B.CH3CH2CH2CH3
C.CH3(CH2)3CH3
D.(CH3)2CHCH2CH3
√
二、
烷烃的结构
碳原子的sp3杂化
碳原子在成键的过程中首先要吸收一定的能量,使2s轨道的一个电子跃迁到2p空轨道中,形成碳原子的激发态。激发态的碳原子具有四个单电子,因此碳原子为四价的。
跃迁
2px
2py
2pz
2px
2py
2pz
2s
2s
基态
激发态
甲烷分子为一正四面体结构,碳原子居于正四面体的中心,和碳原子相连的四个氢原子,居于四面体的四个角(如下图),四个碳氢键键长都为0.110nm,H-C-H键角都是109.5°。
构造式
结构式
由烷烃分子式和构造式可以看出,碳原子和氢原子之间的数量关系是一定的。烷烃的通式为CnH2n+2
像烷烃分子这样,通式相同、结构相似、在组成上相差一个或多个CH2基团系列化合物叫做同系物。同系物一般具有相似的化学性质。
分子中的碳原子以单键相互连接,其余价键与氢原子结合的链烃叫做饱和链烃--烷烃。
有机化学中,分子式相同但结构不同的化合物互称为同分异构体,这种现象就叫做同分异构现象。
烷烃同分异构主要考虑碳链异构(核心考察思维有序性)。
某个碳原子上连接的四个基团均不相同,该碳具有手性。
1.甲烷的化学性质:在通常情况下,甲烷比较稳定,与高锰酸钾等强氧化剂不反应,与强酸、强碱也不反应。
①
.
氧化反应:(可燃性)
②.
高温分解:CH4
1000℃以上
C
(炭黑)
+
2H2
三、烷烃的化学性质
③.取代反应:有机物分子里某些原子或原子团被其它原子或原子团所替代的反应。
C
H
H
H
H
+Cl-Cl
C
H
Cl
H
H
+HCl
光
2.烷烃的化学性质
稳定,不跟强酸、强碱及强氧化剂反应,不能使酸性KMnO4溶液或溴水褪色。
(1)
氧化反应(写出反应的通式)
(2)取代反应
(烷烃的特征反应)
在光照条件下进行,产物更复杂。例如:
思考:1mol丁烷最多能和几molCl2发生取代反应?
会生成7种产物。
烷烃分子中有多少个H就可以发生多少步取代。
10mol
收集一试管甲烷与氯气的混合气体,倒扣于水槽中,用强光照射,观察现象。
试管内壁上出现油状液滴;
水位沿试管上升;
气体黄绿色变浅。
产生的现象是:
在光照条件下,甲烷与氯气发生了化学反应——取代反应
烷烃、环烷烃能与卤素在高温或光照条件下发生取代反应。
X2的反应活性:
F2>Cl2>Br2>I2
其中氟代反应太剧烈,难以控制;而碘代反应太慢,难以进行,实
际上广为应用的是氯代和溴代反应。
在高温绝氧下使烷烃分子发生裂解的过程称为裂化。
一般分解为小分子烷烃和小分子烯烃
3.裂化反应
高温分解:CH4
1000℃以上
C
(炭黑)
+
2H2
练习
4、关于烷烃性质的叙述,错误的是(
)。
A.能使酸性高锰酸钾溶液褪色
B.都能燃烧
C.通常情况下跟酸、碱和氧化剂都不反应
D.都能发生取代反应
√
1.乙烯的结构
杂化轨道理论认为,乙烯分子中的碳原子在成键时发生了sp2杂化,即碳原子的2s轨道和两个2p轨道重新组合分配,组成了三个完全相同的sp2杂化轨道,还剩余一个未参与杂化的2p轨道。
碳原子的sp2杂化过程如下:
四、烯烃的化学性质
sp2杂化特点:?
a).
杂化轨道成分:1/3s轨道和2/3p轨道;
b).
成键能力较sp3杂化轨道弱,但较未杂化轨道强;
c).
杂化轨道呈平面三角形,夹角120°
未杂化的2p轨道垂直于这一平面。
π键:成键原子的p轨道平行侧面重叠形成的共价键叫做π键,该成键电子称为π电子
乙烯分子中的所有原子均在一个平面上
键能(KJ/mol)
键长(pm)
乙烯分子中的碳碳双键
610
134
乙烷分子中碳碳单键
345
154
平行的P轨道,侧面重叠,形成一个π键
(1)氧化反应
①燃烧
②与酸性KMnO4溶液反应:能使酸性KMnO4溶液褪色。
(2)加成反应
(3)加聚反应
2.乙烯的性质
均为断裂π键,保留σ键
3.
烯烃的物理性质
烯烃在常温下、常压下的状态、沸点和熔点都和烷烃相似。烯烃的相对密度都小于1。烯烃几乎不溶于水,但可溶于非极性溶剂,如戊烷、四氯化碳和乙醚等。
(1)加成反应
(可与H2、X2、HX、H2O加成)
定量关系:n(C=C):n(H2、X2、HX、H2O)=1:1
有机物分子中不饱和键(双键或三键)两端的碳原子与其他的原子或原子团直接结合生成新的化合物的反应
烯烃在铂、钯或镍等金属催化剂存在下,可以与氢加成而生成烷烃。
1mol含双键的某脂肪烃与H2完全反应,消耗3molH2
,则1
分子该烃中的双键数目最多为?
4.
烯烃的化学性质
在有机化学中,通常把加氧或脱氢的反应统称为氧化反应。
(2)
氧化反应
H
3
丙
酮
1
M
P
a
,
9
0
~
1
2
0
℃
P
d
C
l
2
-
C
u
C
l
2
O
2
+
环
氧
乙
烷
A
g
O
2
+
2
5
0
℃
C
H
2
C
H
2
O
C
H
2
C
H
2
C
H
3
C
H
C
H
2
C
H
3
C
C
O
烯烃和炔烃可以被高锰酸钾氧化,氧化产物视烃的结构和反应条件的差异而不同。反应后高锰酸钾溶液的紫色褪去是鉴别碳碳双键的常用方法之一。
(3)
聚合反应(加聚反应)
含有双键或叁键的化合物以及含有双官能团或多官能团的化合物在合适的条件下(催化剂、引发剂、温度等)发生加成或缩合等反应,使两个分子、叁个分子或多个分子结合成一个分子的反应称为聚合反应。
烷烃和烯烃的比较:
代表物
分子结
构特点
特征反应
空间结
构特点
CH4
C2H4
C-C
单键
C=C
双键
取代反应
加成反应
正四面体型
键角109?28?
平面结构
键角约为120?
1、烯烃的同分异构现象:
C=C位置异构
碳链异构
官能团异构
顺反异构
五、烯烃的顺反异构
产生顺反异构体的条件
(1)分子内存在着阻碍自由旋转的因素:
如C=C
;
(2
)每个双键碳原子上所连接的两个原子或基团必须不相同,如:
C=C
a
f
d
b
a
?
b
d
?
f
???
由于双键中的π键限制了σ键的自由旋转,使得两个甲基和两个氢原子在空间有两种不同的排列方式。
产生的原因
顺式视黄醛
反式视黄醛
光
H
H
C
H
O
H
H
C
H
O
练习、指出下列化合物那些有顺反异构?
(1)
H2C=CHCH2CH3
(2)
CH3CH=CHCH3
(3
)(CH3)2C=CHCH3
六、二烯烃的化学性质
二烯烃含有两个π键,由于分子中的极性交替现象,与1mol卤素或卤化氢进行加成反应时,得到1,2-和1,4-两种加成产物。
二烯烃的加成
二烯烃与含C=C或C≡C的不饱和化合物发生1,4-加成,生成环状化合物的反应叫做双烯合成反应
双烯合成
在催化剂存在下,二烯烃可以聚合为高分子化合物。
聚合反应
七、炔烃的结构
1.乙炔分子式为C2H2,构造式为CH≡CH。键角为180°,乙炔分子中的两个碳原子和两个氢原子在同一条直线上,乙炔为直线型分子。
乙炔分子中的π键
碳的sp杂化
杂化轨道理论认为,乙炔分子中的每个碳原子,各以一个2s轨道和一个2p轨道进行sp杂化,组成了两个完全相同的sp杂化轨道,每个碳原子还剩余两个未参与杂化的2p轨道。杂化过程如下
2.
炔烃的物理性质
炔烃的物理性质和烷烃、烯烃相似。低级的炔烃在常温常压下是气体,但沸点比相同原子数的烯烃略高些。随着碳原子数的增多,它们的沸点也升高。炔烃不溶于水,但易溶于极性小的有机溶剂,如石油醚、苯、乙醚、四氯化碳等。
3.
炔烃的化学性质
炔烃催化加氢,生成烯烃。进一步加氢生成烷烃。
(1)加成反应
炔烃在酸性水溶液中加水,先生成烯醇(为加成反应),后者立刻转变为更稳定的羰基化合物。
2、氧化反应
炔烃和氧化剂反应,往往可以使叁键断裂,最后得到完全氧化的产物-羧酸或二氧化碳。例如:
