人教版选修四高中化学第二章第二节《影响 化学反应速率的因素》(33张PPT)
文档属性
| 名称 | 人教版选修四高中化学第二章第二节《影响 化学反应速率的因素》(33张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 877.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-11-05 00:00:00 | ||
图片预览









文档简介
(共33张PPT)
第二节
影响化学反应速率的因素
第二章
化学反应速率和化学平衡
回忆:化学反应的碰撞理论:
⑴、化学反应的实质是:
旧的化学键断裂,新的化学键形成
⑵、化学反应发生的先决条件:
反应物分子相互接触和碰撞
注意:反应物分子之间的碰撞次数很大,但并不是每一次碰撞均可发生化学反应。
在化学上,把能够发生化学反应的碰撞叫有效碰撞;不能发生化学反应的碰撞叫无效碰撞;有效碰撞次数越多,反应速率越快。
力量不够
取向不好
好球!有效碰撞
反应物分子要具有什么条件才能发生有效碰撞?
①、有足够的能量使旧键断裂
②、碰撞时要有合理的取向
⑶、在化学上,把能够发生有效碰撞的分子叫活化分子,特点是:
①、活化分子具有较高的能量,能量不足的分子获取能量后才能变成活化分子
②、在温度不变时,对某一个反应来说,活化分子在反应物中所占的百分数是恒定的,且与温度呈正比。
活化分子百分数:
(活化分子数/反应物分子数)×100%
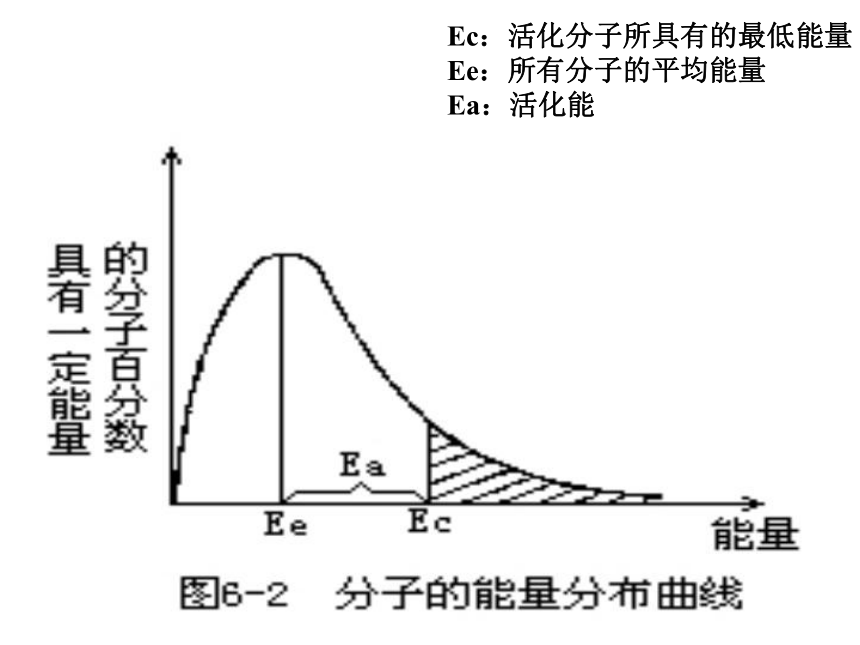
Ec:活化分子所具有的最低能量
Ee:所有分子的平均能量
Ea:活化能
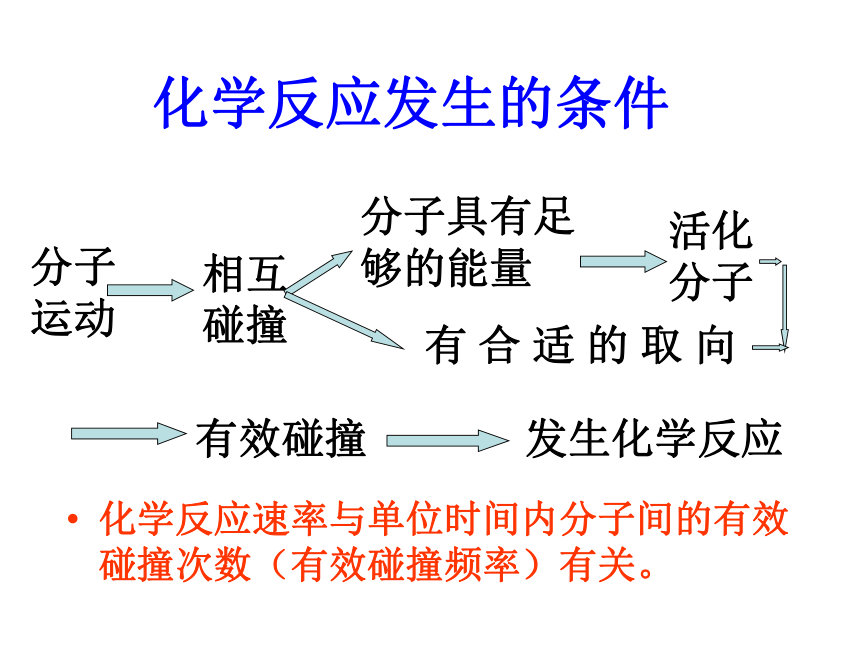
分子运动
相互碰撞
分子具有足够的能量
活化分子
有
合
适
的
取
向
有效碰撞
发生化学反应
化学反应发生的条件
化学反应速率与单位时间内分子间的有效碰撞次数(有效碰撞频率)有关。
思考:
浓度、压强、温度、催化剂的变化对有效碰撞的频率有何影响?
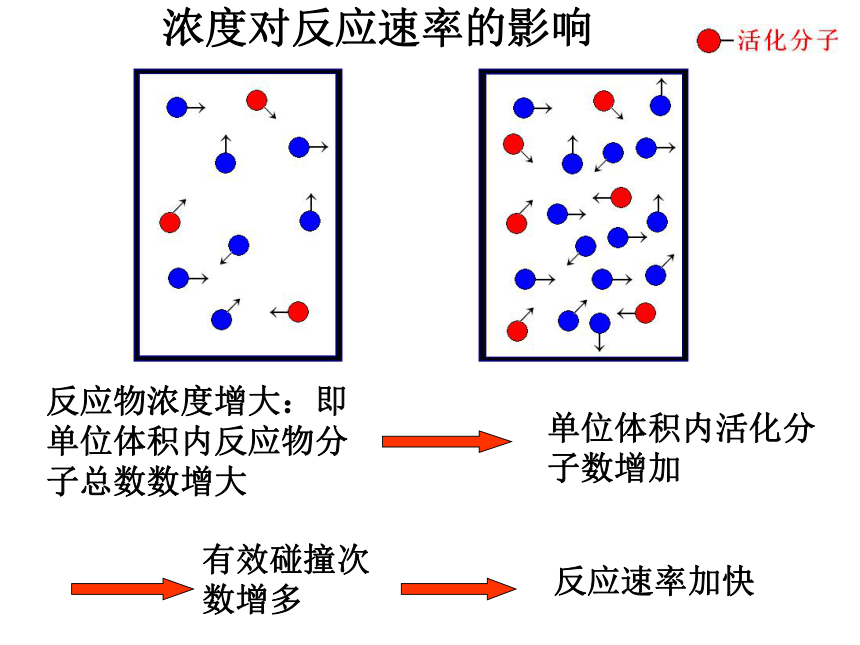
浓度对反应速率的影响
反应物浓度增大:即单位体积内反应物分子总数数增大
单位体积内活化分子数增加
有效碰撞次数增多
反应速率加快
1、浓度对化学反应速率的影响。
原因:在其他条件不变时,对某一反应来说,活化分子百分数是一定的,即单位体积内的活化分子数与反应物的浓度成正比。所以当反应物的浓度增大时,单位体积内的分子数增多,活化分子数也相应的增多,反应速率也必然增大。
规律:其他条件不变时,增大反应物的浓度,可以增大反应速率;减小反应物的浓度,可以减小化学反应的速率。
注意:a、此规律只适用于气体或溶液的反应,对于纯固体或液体的反应物,一般情况下其浓度是常数,因此改变它们的量不会改变化学反应速率。
b、气体或溶液浓度的改变与反应速率的关系并不是一概如此,若随着浓度的改变,物质的本质发生了变化,那么反应速率的含义也不同了。如:硫酸与铁的反应
例.对于在一个密闭容器中进行的可逆反应:
C(s)+
O2
=
CO2
(g)
下列说法中错误的是(
)
A将碳块粉碎成粉末可以加快化学反应速率
B增大氧气的量可以加快化学反应速率
C增大压强可以加快化学反应速率
D增加碳的量可以加快化学反应速率
D
压强对反应速率的影响
结论:增大压强,相当于增大反应物浓度,反应速率加快。
注意:a、压强影响,只适用于讨论有气体参加的反应,当然并不一定全部是气体。
b、压强影响反应速率,必须伴随有压强改变时体积的改变现象。否则,压强的变化并没有作用到反应的体系上。即压强变则体积变,实际是浓度的变化。若容器的体积不变,因为各气体的浓度没有变,则速率不变。
[讨论]如果反应物是固体、液体或溶液时,改变压强对它们又有什么影响?
适用范围:
仅适用于反应体系中有气体物质的反应。
小结:惰性气体对反应速率的影响
(1)如果保持恒温恒容,加入惰性气体后,反应物的浓度
,因此对反应速率
。
(2)如果恒温恒压,加入惰性气体后,反应体系体积
,反应物的浓度
,因此反应速率会
。
不变
不变
减小
增大
减小
例2.反应C(s)+H2O(g)=CO(g)+H2(g)在一可变容积的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是(
)
A.增加C的量
B.将容器的体积缩小一半
C.保持体积不变,充入N2使体系压强增大
D.保持压强不变,充入N2使容器体积变大
E.保持压强不变,充入CO使容器体积变大
AC
例3.对于反应∶N2+O2
2NO,在密闭容器中进行,下列条件能加快反应速率的是
(
)
A、缩小体积使压强增大;
B、体积不变充入氮气使压强增大;
C、体积不变充入惰性气体;
D、使总压强不变,充入惰性气体。
AB
温度对反应速率的影响
升高温度
活化分子的百分比增大(分子运动速率加快,碰撞频率增加)
有效碰撞次数增多
反应速率加快
3、温度对化学反应速率的影响。
原因:(1)浓度一定时,升高温度,分子的能量增加,从而增加了活化分子的数量,反应速率增大。
(2)温度升高,使分子运动的速度加快,单位时间内反应物分子间的碰撞次数增加,反应速率也会相应的加快。前者是主要原因。
规律:其他条件不变时,升高温度,可以增大反应速率,降低温度,可以减慢反应速率。
注意:a、温度对化学反应速率的影响对放热反应和吸热反应都适用。
Ec:活化分子所具有的最低能量
Ee:所有分子的平均能量
Ea:活化能
催化剂对化学反应速率的影响
使用催化剂
降低活化能
催化剂对化学反应速率的影响
使用催化剂
降低活化能
活化分子的百分比增大
活化分子的数目增多
有效碰撞次数增多
化学反应速率加快
4、催化剂对化学反应速率的影响。
原因:在其他条件不变时,使用催化剂可以大大降低反应所需要的能量,会使更多的反应物分子成为活化分子,大大增加活化分子百分数,因而使反应速率加快。
规律:催化剂可以改变化学反应的速率。
小结:影响化学反应速率的外因
影响
外因
单位体积内
有效碰撞次数
化学反应速率
分子总数
活化分子数
活化分子百分数
增大反应物浓度
增大压强
升高温度
使用催化剂
增加
增加
不变
增加
加快
增加
增加
不变
增加
加快
不变
增加
增加
增加
加快
不变
增加
增加
增加
加快
例4.NO和
CO都是汽车尾气中的物质,它们能很缓慢地反应生成CO2
和
N2
,对此反应有关的叙述中不正确的是(
)
A、降低温度能加快化学反应速率;
B、使用适当催化剂可以加快化学反应速率;
C、增大一氧化氮的量可以加快化学反应速率;
D改变压强对化学反应速率没有影响。
AD
练习:1.用3克块状大理石与30毫升3摩/升盐酸反应制取CO2气体,若要增大反应速率,可采取的措施是①再加入30毫升3摩/升盐酸
②改用30毫升6摩/升盐酸
③改用3克粉末状大理石
④适当升高温度
A.①②④
B.②③④
C.①③④ D.
①②③
答案:B
2.对于反应:2SO2+O2
2SO3,当其他条件不变时,只改变一个反应条件,将生成SO3的反应速率的变化填入空格里(填写“增大”“减小”“不变”)
编
号
改变的条件
生成SO3的速率
①
升高温度
?
②
降低温度
③
增大O2的浓度
?
④
V2O5作催化剂
?
⑤
压缩体积
增大
减小
增大
增大
增大
3.下列关于催化剂的说法,正确的是
A.催化剂能使不起反应的物质发生反应
B.催化剂在化学反应前后,化学性质和质量都不变
C.催化剂能改变化学反应速率
D.任何化学反应,都需要催化剂
答案:BC
4.下列说法正确的是(
)
A、一定条件下,增大反应物的量会加快化学反应速率。
B、增大压强,肯定会加快化学反应速率。
C、活化分子间所发生的碰撞为有效碰撞。
D、能够发生有效碰撞的分子叫活化分子。
D
5.在C(固)+CO2(气)=2CO(气)
的反应中。现采取下列措施:
(1)增大压强
;(2)增加碳的量
(3)通入CO2;(4)恒容下充入N2;
(5)恒压下充入N2
哪些措施能够使反应速率增大?为什么?
答案:(1)(3)
6.对于在溶液间进行的反应,对反应速率影响最小的因素是(
)
A、温度
B、浓度
C、压强
D、催化剂
7.下列条件的变化,是因为降低反应所需的能量而增加单位体积内的反应物活化分子百分数致使反应速率加快的是(
)
A、增大浓度
B、增大压强
C、升高温度
D、使用催化剂
C
D
8.
设NO+CO2
NO2+CO(正反应吸热)反应速率为v1;N2+3H2
2NH3
(正反应放热)反应速率为v2。对于前述反应,当温度升高时,v1和v2变化情况为(
)
A、同时增大
B、
同时减小
C、
v1减少,v2增大
D、
v1增大,v2减小
A
再
见
细节决定成败
第二节
影响化学反应速率的因素
第二章
化学反应速率和化学平衡
回忆:化学反应的碰撞理论:
⑴、化学反应的实质是:
旧的化学键断裂,新的化学键形成
⑵、化学反应发生的先决条件:
反应物分子相互接触和碰撞
注意:反应物分子之间的碰撞次数很大,但并不是每一次碰撞均可发生化学反应。
在化学上,把能够发生化学反应的碰撞叫有效碰撞;不能发生化学反应的碰撞叫无效碰撞;有效碰撞次数越多,反应速率越快。
力量不够
取向不好
好球!有效碰撞
反应物分子要具有什么条件才能发生有效碰撞?
①、有足够的能量使旧键断裂
②、碰撞时要有合理的取向
⑶、在化学上,把能够发生有效碰撞的分子叫活化分子,特点是:
①、活化分子具有较高的能量,能量不足的分子获取能量后才能变成活化分子
②、在温度不变时,对某一个反应来说,活化分子在反应物中所占的百分数是恒定的,且与温度呈正比。
活化分子百分数:
(活化分子数/反应物分子数)×100%
Ec:活化分子所具有的最低能量
Ee:所有分子的平均能量
Ea:活化能
分子运动
相互碰撞
分子具有足够的能量
活化分子
有
合
适
的
取
向
有效碰撞
发生化学反应
化学反应发生的条件
化学反应速率与单位时间内分子间的有效碰撞次数(有效碰撞频率)有关。
思考:
浓度、压强、温度、催化剂的变化对有效碰撞的频率有何影响?
浓度对反应速率的影响
反应物浓度增大:即单位体积内反应物分子总数数增大
单位体积内活化分子数增加
有效碰撞次数增多
反应速率加快
1、浓度对化学反应速率的影响。
原因:在其他条件不变时,对某一反应来说,活化分子百分数是一定的,即单位体积内的活化分子数与反应物的浓度成正比。所以当反应物的浓度增大时,单位体积内的分子数增多,活化分子数也相应的增多,反应速率也必然增大。
规律:其他条件不变时,增大反应物的浓度,可以增大反应速率;减小反应物的浓度,可以减小化学反应的速率。
注意:a、此规律只适用于气体或溶液的反应,对于纯固体或液体的反应物,一般情况下其浓度是常数,因此改变它们的量不会改变化学反应速率。
b、气体或溶液浓度的改变与反应速率的关系并不是一概如此,若随着浓度的改变,物质的本质发生了变化,那么反应速率的含义也不同了。如:硫酸与铁的反应
例.对于在一个密闭容器中进行的可逆反应:
C(s)+
O2
=
CO2
(g)
下列说法中错误的是(
)
A将碳块粉碎成粉末可以加快化学反应速率
B增大氧气的量可以加快化学反应速率
C增大压强可以加快化学反应速率
D增加碳的量可以加快化学反应速率
D
压强对反应速率的影响
结论:增大压强,相当于增大反应物浓度,反应速率加快。
注意:a、压强影响,只适用于讨论有气体参加的反应,当然并不一定全部是气体。
b、压强影响反应速率,必须伴随有压强改变时体积的改变现象。否则,压强的变化并没有作用到反应的体系上。即压强变则体积变,实际是浓度的变化。若容器的体积不变,因为各气体的浓度没有变,则速率不变。
[讨论]如果反应物是固体、液体或溶液时,改变压强对它们又有什么影响?
适用范围:
仅适用于反应体系中有气体物质的反应。
小结:惰性气体对反应速率的影响
(1)如果保持恒温恒容,加入惰性气体后,反应物的浓度
,因此对反应速率
。
(2)如果恒温恒压,加入惰性气体后,反应体系体积
,反应物的浓度
,因此反应速率会
。
不变
不变
减小
增大
减小
例2.反应C(s)+H2O(g)=CO(g)+H2(g)在一可变容积的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是(
)
A.增加C的量
B.将容器的体积缩小一半
C.保持体积不变,充入N2使体系压强增大
D.保持压强不变,充入N2使容器体积变大
E.保持压强不变,充入CO使容器体积变大
AC
例3.对于反应∶N2+O2
2NO,在密闭容器中进行,下列条件能加快反应速率的是
(
)
A、缩小体积使压强增大;
B、体积不变充入氮气使压强增大;
C、体积不变充入惰性气体;
D、使总压强不变,充入惰性气体。
AB
温度对反应速率的影响
升高温度
活化分子的百分比增大(分子运动速率加快,碰撞频率增加)
有效碰撞次数增多
反应速率加快
3、温度对化学反应速率的影响。
原因:(1)浓度一定时,升高温度,分子的能量增加,从而增加了活化分子的数量,反应速率增大。
(2)温度升高,使分子运动的速度加快,单位时间内反应物分子间的碰撞次数增加,反应速率也会相应的加快。前者是主要原因。
规律:其他条件不变时,升高温度,可以增大反应速率,降低温度,可以减慢反应速率。
注意:a、温度对化学反应速率的影响对放热反应和吸热反应都适用。
Ec:活化分子所具有的最低能量
Ee:所有分子的平均能量
Ea:活化能
催化剂对化学反应速率的影响
使用催化剂
降低活化能
催化剂对化学反应速率的影响
使用催化剂
降低活化能
活化分子的百分比增大
活化分子的数目增多
有效碰撞次数增多
化学反应速率加快
4、催化剂对化学反应速率的影响。
原因:在其他条件不变时,使用催化剂可以大大降低反应所需要的能量,会使更多的反应物分子成为活化分子,大大增加活化分子百分数,因而使反应速率加快。
规律:催化剂可以改变化学反应的速率。
小结:影响化学反应速率的外因
影响
外因
单位体积内
有效碰撞次数
化学反应速率
分子总数
活化分子数
活化分子百分数
增大反应物浓度
增大压强
升高温度
使用催化剂
增加
增加
不变
增加
加快
增加
增加
不变
增加
加快
不变
增加
增加
增加
加快
不变
增加
增加
增加
加快
例4.NO和
CO都是汽车尾气中的物质,它们能很缓慢地反应生成CO2
和
N2
,对此反应有关的叙述中不正确的是(
)
A、降低温度能加快化学反应速率;
B、使用适当催化剂可以加快化学反应速率;
C、增大一氧化氮的量可以加快化学反应速率;
D改变压强对化学反应速率没有影响。
AD
练习:1.用3克块状大理石与30毫升3摩/升盐酸反应制取CO2气体,若要增大反应速率,可采取的措施是①再加入30毫升3摩/升盐酸
②改用30毫升6摩/升盐酸
③改用3克粉末状大理石
④适当升高温度
A.①②④
B.②③④
C.①③④ D.
①②③
答案:B
2.对于反应:2SO2+O2
2SO3,当其他条件不变时,只改变一个反应条件,将生成SO3的反应速率的变化填入空格里(填写“增大”“减小”“不变”)
编
号
改变的条件
生成SO3的速率
①
升高温度
?
②
降低温度
③
增大O2的浓度
?
④
V2O5作催化剂
?
⑤
压缩体积
增大
减小
增大
增大
增大
3.下列关于催化剂的说法,正确的是
A.催化剂能使不起反应的物质发生反应
B.催化剂在化学反应前后,化学性质和质量都不变
C.催化剂能改变化学反应速率
D.任何化学反应,都需要催化剂
答案:BC
4.下列说法正确的是(
)
A、一定条件下,增大反应物的量会加快化学反应速率。
B、增大压强,肯定会加快化学反应速率。
C、活化分子间所发生的碰撞为有效碰撞。
D、能够发生有效碰撞的分子叫活化分子。
D
5.在C(固)+CO2(气)=2CO(气)
的反应中。现采取下列措施:
(1)增大压强
;(2)增加碳的量
(3)通入CO2;(4)恒容下充入N2;
(5)恒压下充入N2
哪些措施能够使反应速率增大?为什么?
答案:(1)(3)
6.对于在溶液间进行的反应,对反应速率影响最小的因素是(
)
A、温度
B、浓度
C、压强
D、催化剂
7.下列条件的变化,是因为降低反应所需的能量而增加单位体积内的反应物活化分子百分数致使反应速率加快的是(
)
A、增大浓度
B、增大压强
C、升高温度
D、使用催化剂
C
D
8.
设NO+CO2
NO2+CO(正反应吸热)反应速率为v1;N2+3H2
2NH3
(正反应放热)反应速率为v2。对于前述反应,当温度升高时,v1和v2变化情况为(
)
A、同时增大
B、
同时减小
C、
v1减少,v2增大
D、
v1增大,v2减小
A
再
见
细节决定成败
