粤教版九上化学 2.3 构成物质的微粒(2)原子和离子 课件 (30张PPT)
文档属性
| 名称 | 粤教版九上化学 2.3 构成物质的微粒(2)原子和离子 课件 (30张PPT) |  | |
| 格式 | ppt | ||
| 文件大小 | 1.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 粤教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-11-05 21:20:12 | ||
图片预览






文档简介
1、什么是分子?
2、分子有什么特性?
3、分子能不能再分?
4、分子是由什么构成的?
实例:加热氧化汞的反应。
结论:
1、在化学变化中分子可以分解原子;
2、有的物质可由原子直接构成;
3、化学变化中原子本身没有发生变化。
已知“碳-13(13C)”是指原子核内含有6个质子、7个中子的碳原子,则“3He”所指的氦原子核内有 个质子、 中子,核外有 电子。
三、相对原子质量
四、原子结构的表示法—原子结构示意图
三、相对原子质量
三、相对原子质量
五、离子的形成
五、离子的形成
1、分子是构成物质的一种微粒,它是保持物质化学性质的一种粒子。
2、分子特性:分子在不断运动;分子间有间隔;分子的质量和体积都很小。
3、分子在化学变化中可分为原子。
4、分子是由原子构成的。
加热
氧化汞 汞+氧气
HgO Hg O2
思考:
1、上述反应中氧化汞分子发生怎样的变化?构成氧化汞分子的原子发生了怎样的变化?
2、反应生成的氧气和汞分别有什么粒子构成?
Hg
O
Hg
O
Hg
O
Hg
O
O
O
Hg
Hg
图中共有
个氧化汞分子。
2
图中共有
个汞原子, 个氧原子。
2
2
由很多的汞原子直接构成了汞。
两个氧原子结合成一个氧分子,很多个氧分子构成了氧气。
氧化汞分解示意图
1、原子构成分子,原子也可以直接构成物质;
2、在化学变化中分子分解为原子,原子重新组合成新的分子或构成新物质;
原子是化学变化中的最小粒子。
一个分子由相应的一个原子构成。
稀有气体
水蒸气(H2O)
二氧化碳(CO2)
氧气(O2)
氮气(N2)
构成分子的原子
构成物质的分子
空气中的物质
氮分子
氧分子
二氧化碳分子
水分子
每个分子由两个氮原子构成
每个分子由两个氧原子构成
每个分子由一个碳原子和两个氧原子构成
每个分子由一个氧原子和两个氢原子构成
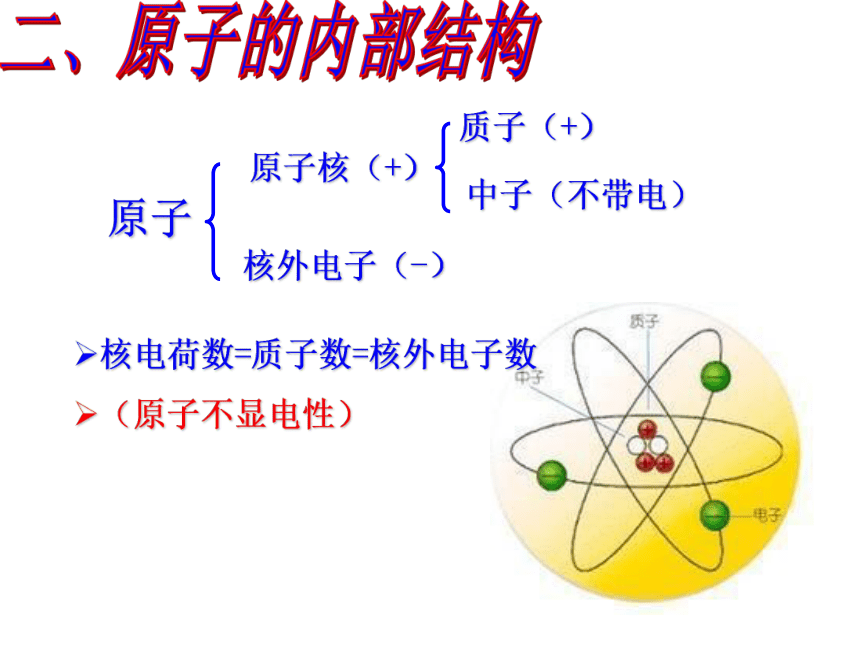
原子
原子核(+)
核外电子(-)
质子(+)
中子(不带电)
26
30
26
铁
17
18
17
氯
11
12
11
钠
8
8
8
氧
7
7
7
氮
6
6
6
碳
3
4
3
锂
2
2
2
氦
1
0
1
氢
中子数
质子数
核外电子数
原子核
原子
质子数=核外电子数
(核电荷数)
原子
原子核(+)
核外电子(-)
质子(+)
中子(不带电)
核电荷数=质子数=核外电子数
(原子不显电性)
2
1
2
1、构成分子的微粒,也是构成物质的一种粒子;
2、在化学变化中分子分解为原子,原子重新组合成新的分子或构成新物质;
即:原子是化学变化中的最小粒子。
原子
原子核(+)
核外电子(-)
质子(+)
中子(不带电)
核电荷数=质子数=核外电子数
(即:原子不显电性)
水(H2O)
二氧化碳(CO2)
氧气(O2)
氢气(H2)
构成分子的原子
构成物质的分子
物质名称
氢分子
氧分子
二氧化碳分子
水分子
2个氢原子构成1个氢分子
2个氧原子构成1个氧分子
1个碳原子和2个氧原子构成1个二氧化碳分子
1个氧原子和2个氢原子构成1个水分子
说一说构成下列物质的分子以及构成该分子的原子
1、定义:以碳-12(质子数、中子数各6个)原子质量的1/12为标准,其他原子质量与其的比值,称为该原子的相对原子质量。
2、计算公式:相对原子质量=
1个该原子的质量
(1个碳-12原子质量)×
1
12
1
12
1个该原子的质量
1.993×10-26kg×
=
1个该原子的质量
1.661×10-27kg
=
9.288×10-26kg
铁原子
2.324×10-26kg
氮原子
2.657×10-27kg
氧原子
1.993×10-26kg
碳原子
1.674×10-27kg
氢原子
相对原子质量
原子的质量
原子名称
请参照以上公式和示例计算下列原子的相对原子质量
1.674×10-27kg
1.661×10-27kg
≈1
1.993×10-26kg
1.661×10-27kg
=12
2.657×10-26kg
1.661×10-27kg
≈16
9.288×10-26kg
1.661×10-27kg
≈56
2.324×10-26kg
1.661×10-27kg
≈14
2
+8
6
(此时是最外电子层)
原子核
第一电子层
第二电子层
电子层上的电子数
核电荷数(质子数)
氧原子
讨论归纳:
1、你发现原子核外电子排布有什么规律 ?
2、稀有气体、金属、非金属原子最外层的电子数目各有什么特点?
金属元素
非金属元素
稀有气体元素
一般<4
一般≥4
=8或2(He)
不稳定结构
不稳定结构
稳定结构
A、第 一 层 上 最 多 排 2 个 电 子;
B、第 二 层 上 最 多 排 8 个 电 子;
C、最 外 层 上 最 多 排 8 个 电 子 。
金属元素
非金属元素
稀有气体元素
一般<4
一般≥4
=8或2(He)
不稳定结构
不稳定结构
稳定结构
A、第 一 层 上 最 多 排 2 个 电 子;
B、第 二 层 上 最 多 排 8 个 电 子;
C、最 外 层 上 最 多 排 8 个 电 子 。
1、定义:以碳-12(质子数、中子数各6个)原子质量的1/12为标准,其他原子质量与其的比值,称为该原子的相对原子质量。
2、计算公式:相对原子质量=
1个该原子的质量
(1个碳-12原子质量)×
1
12
四、原子结构的表示法—原子结构示意图
2
+8
6
(此时是最外电子层)
原子核
第一电子层
第二电子层
电子层上的电子数
核电荷数(质子数)
氧原子
1、定义:以碳-12(质子数、中子数各6个)原子质量的1/12为标准,其他原子质量与其的比值,称为该原子的相对原子质量。
2、计算公式:相对原子质量=
1个该原子的质量
(1个碳-12原子质量)×
1
12
=质子数+中子数
1、原子核外电子排布有什么规律?
2、原子核外电子排布与原子的化学性质有什么联系?
稀有气体元素原子最外层电子数=8或2(氦),化学性质稳定。
金属元素原子最外层电子数一般<4,化学性质不稳定;
非金属元素原子最外层电子数一般≥4,化学性质不稳定;
A、第 一 层 上 最 多 排 2 个 电 子;
B、第 二 层 上 最 多 排 8 个 电 子;
C、最 外 层 上 最 多 排 8 个 电 子 。
原子的最外层电子数决定它的化学性质是否稳定。
+1
8
钠原子(Na)
氯原子(Cl)
钠离子(Na+)
氯离子(Cl-)
提出问题:不稳定的金属原子和非金属原子怎样才能变成稳定的结构呢?
钠原子(Na)失去1个电子后,变成带1个正电荷的钠离子(Na+)。
氯原子(Cl)得到1个电子,变成带1个负电荷的氯离子(Cl-)。
哈哈,现在我稳定啦!
呵呵,现在我也稳定啦!
金属原子
失去最外层电子
阳离子
非金属原子
得到电子
阴离子
现在我们牵手结合成了氯化钠
金属原子
失去最外层电子
阳离子
非金属原子
得到电子
阴离子
离子也是构成物质的一种微粒。
物质都是由微观粒子构成的;
构成物质的微粒有分子、原子、离子。
原 子
物 质
结 合
分子
构 成
直 接 构 成
得失电子
构 成
阴阳离子
2、分子有什么特性?
3、分子能不能再分?
4、分子是由什么构成的?
实例:加热氧化汞的反应。
结论:
1、在化学变化中分子可以分解原子;
2、有的物质可由原子直接构成;
3、化学变化中原子本身没有发生变化。
已知“碳-13(13C)”是指原子核内含有6个质子、7个中子的碳原子,则“3He”所指的氦原子核内有 个质子、 中子,核外有 电子。
三、相对原子质量
四、原子结构的表示法—原子结构示意图
三、相对原子质量
三、相对原子质量
五、离子的形成
五、离子的形成
1、分子是构成物质的一种微粒,它是保持物质化学性质的一种粒子。
2、分子特性:分子在不断运动;分子间有间隔;分子的质量和体积都很小。
3、分子在化学变化中可分为原子。
4、分子是由原子构成的。
加热
氧化汞 汞+氧气
HgO Hg O2
思考:
1、上述反应中氧化汞分子发生怎样的变化?构成氧化汞分子的原子发生了怎样的变化?
2、反应生成的氧气和汞分别有什么粒子构成?
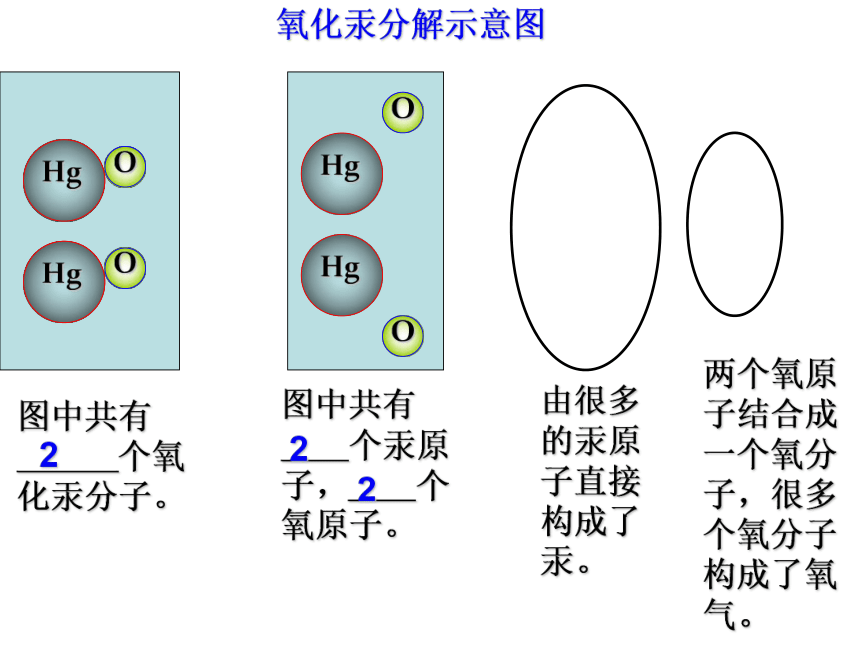
Hg
O
Hg
O
Hg
O
Hg
O
O
O
Hg
Hg
图中共有
个氧化汞分子。
2
图中共有
个汞原子, 个氧原子。
2
2
由很多的汞原子直接构成了汞。
两个氧原子结合成一个氧分子,很多个氧分子构成了氧气。
氧化汞分解示意图
1、原子构成分子,原子也可以直接构成物质;
2、在化学变化中分子分解为原子,原子重新组合成新的分子或构成新物质;
原子是化学变化中的最小粒子。
一个分子由相应的一个原子构成。
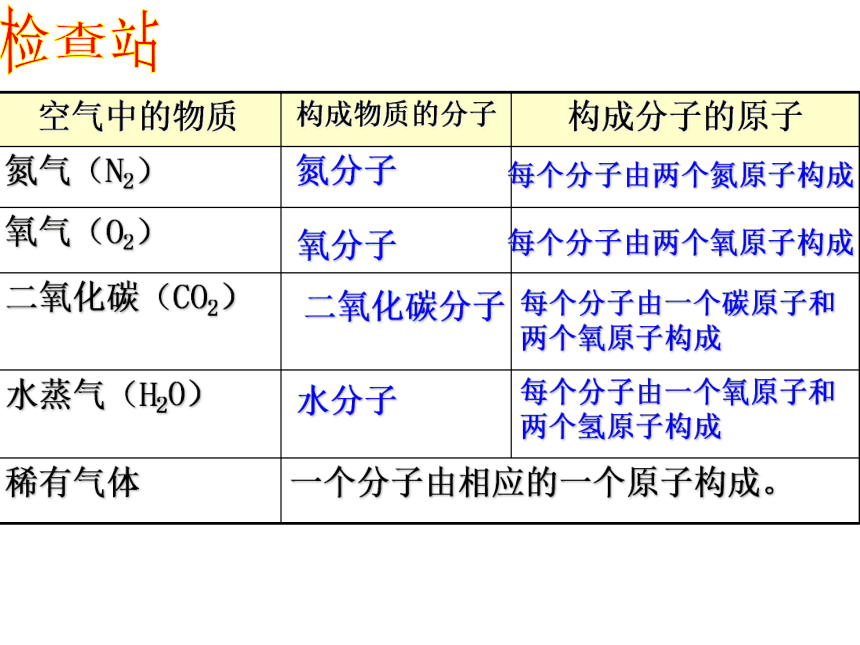
稀有气体
水蒸气(H2O)
二氧化碳(CO2)
氧气(O2)
氮气(N2)
构成分子的原子
构成物质的分子
空气中的物质
氮分子
氧分子
二氧化碳分子
水分子
每个分子由两个氮原子构成
每个分子由两个氧原子构成
每个分子由一个碳原子和两个氧原子构成
每个分子由一个氧原子和两个氢原子构成
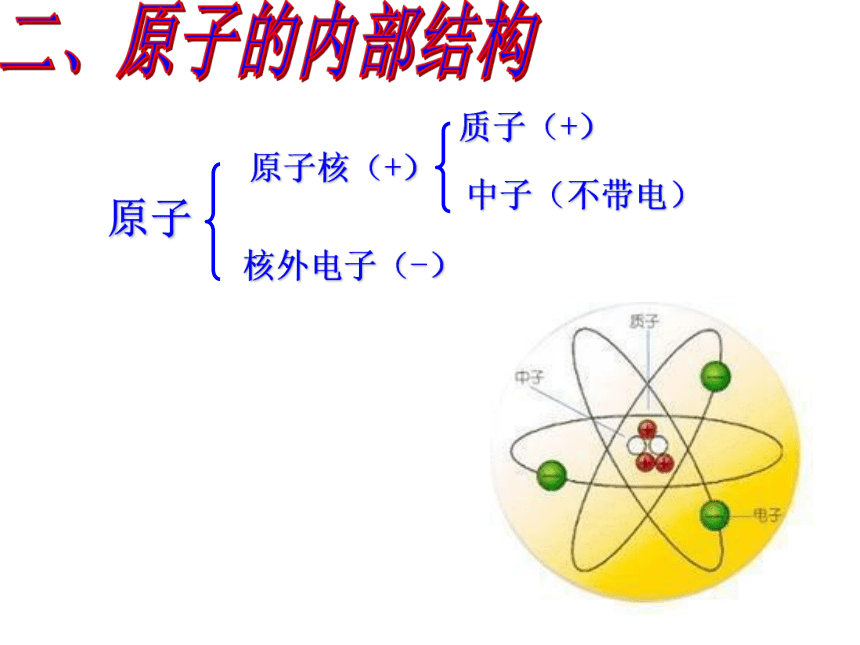
原子
原子核(+)
核外电子(-)
质子(+)
中子(不带电)
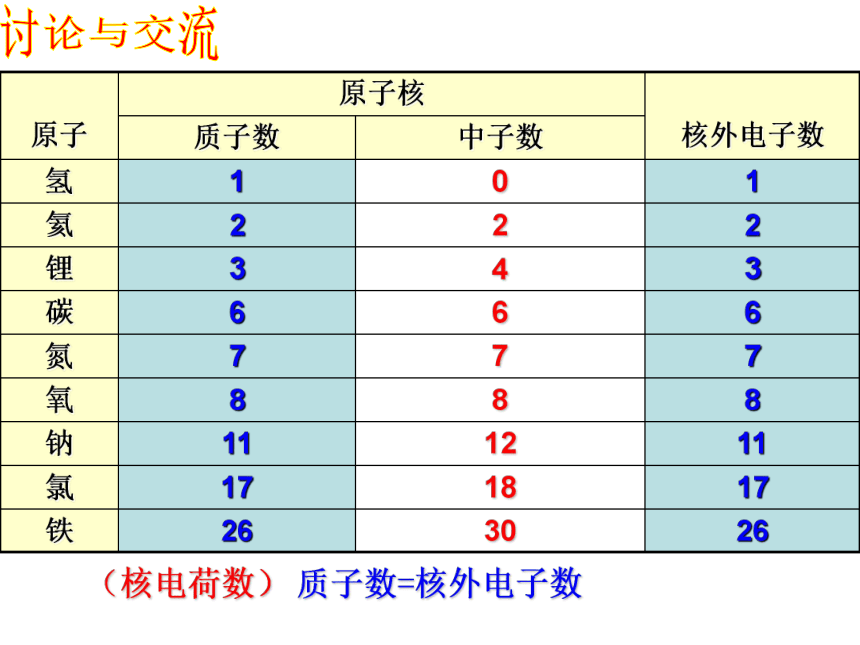
26
30
26
铁
17
18
17
氯
11
12
11
钠
8
8
8
氧
7
7
7
氮
6
6
6
碳
3
4
3
锂
2
2
2
氦
1
0
1
氢
中子数
质子数
核外电子数
原子核
原子
质子数=核外电子数
(核电荷数)
原子
原子核(+)
核外电子(-)
质子(+)
中子(不带电)
核电荷数=质子数=核外电子数
(原子不显电性)
2
1
2
1、构成分子的微粒,也是构成物质的一种粒子;
2、在化学变化中分子分解为原子,原子重新组合成新的分子或构成新物质;
即:原子是化学变化中的最小粒子。
原子
原子核(+)
核外电子(-)
质子(+)
中子(不带电)
核电荷数=质子数=核外电子数
(即:原子不显电性)
水(H2O)
二氧化碳(CO2)
氧气(O2)
氢气(H2)
构成分子的原子
构成物质的分子
物质名称
氢分子
氧分子
二氧化碳分子
水分子
2个氢原子构成1个氢分子
2个氧原子构成1个氧分子
1个碳原子和2个氧原子构成1个二氧化碳分子
1个氧原子和2个氢原子构成1个水分子
说一说构成下列物质的分子以及构成该分子的原子
1、定义:以碳-12(质子数、中子数各6个)原子质量的1/12为标准,其他原子质量与其的比值,称为该原子的相对原子质量。
2、计算公式:相对原子质量=
1个该原子的质量
(1个碳-12原子质量)×
1
12
1
12
1个该原子的质量
1.993×10-26kg×
=
1个该原子的质量
1.661×10-27kg
=
9.288×10-26kg
铁原子
2.324×10-26kg
氮原子
2.657×10-27kg
氧原子
1.993×10-26kg
碳原子
1.674×10-27kg
氢原子
相对原子质量
原子的质量
原子名称
请参照以上公式和示例计算下列原子的相对原子质量
1.674×10-27kg
1.661×10-27kg
≈1
1.993×10-26kg
1.661×10-27kg
=12
2.657×10-26kg
1.661×10-27kg
≈16
9.288×10-26kg
1.661×10-27kg
≈56
2.324×10-26kg
1.661×10-27kg
≈14
2
+8
6
(此时是最外电子层)
原子核
第一电子层
第二电子层
电子层上的电子数
核电荷数(质子数)
氧原子
讨论归纳:
1、你发现原子核外电子排布有什么规律 ?
2、稀有气体、金属、非金属原子最外层的电子数目各有什么特点?
金属元素
非金属元素
稀有气体元素
一般<4
一般≥4
=8或2(He)
不稳定结构
不稳定结构
稳定结构
A、第 一 层 上 最 多 排 2 个 电 子;
B、第 二 层 上 最 多 排 8 个 电 子;
C、最 外 层 上 最 多 排 8 个 电 子 。
金属元素
非金属元素
稀有气体元素
一般<4
一般≥4
=8或2(He)
不稳定结构
不稳定结构
稳定结构
A、第 一 层 上 最 多 排 2 个 电 子;
B、第 二 层 上 最 多 排 8 个 电 子;
C、最 外 层 上 最 多 排 8 个 电 子 。
1、定义:以碳-12(质子数、中子数各6个)原子质量的1/12为标准,其他原子质量与其的比值,称为该原子的相对原子质量。
2、计算公式:相对原子质量=
1个该原子的质量
(1个碳-12原子质量)×
1
12
四、原子结构的表示法—原子结构示意图
2
+8
6
(此时是最外电子层)
原子核
第一电子层
第二电子层
电子层上的电子数
核电荷数(质子数)
氧原子
1、定义:以碳-12(质子数、中子数各6个)原子质量的1/12为标准,其他原子质量与其的比值,称为该原子的相对原子质量。
2、计算公式:相对原子质量=
1个该原子的质量
(1个碳-12原子质量)×
1
12
=质子数+中子数
1、原子核外电子排布有什么规律?
2、原子核外电子排布与原子的化学性质有什么联系?
稀有气体元素原子最外层电子数=8或2(氦),化学性质稳定。
金属元素原子最外层电子数一般<4,化学性质不稳定;
非金属元素原子最外层电子数一般≥4,化学性质不稳定;
A、第 一 层 上 最 多 排 2 个 电 子;
B、第 二 层 上 最 多 排 8 个 电 子;
C、最 外 层 上 最 多 排 8 个 电 子 。
原子的最外层电子数决定它的化学性质是否稳定。
+1
8
钠原子(Na)
氯原子(Cl)
钠离子(Na+)
氯离子(Cl-)
提出问题:不稳定的金属原子和非金属原子怎样才能变成稳定的结构呢?
钠原子(Na)失去1个电子后,变成带1个正电荷的钠离子(Na+)。
氯原子(Cl)得到1个电子,变成带1个负电荷的氯离子(Cl-)。
哈哈,现在我稳定啦!
呵呵,现在我也稳定啦!
金属原子
失去最外层电子
阳离子
非金属原子
得到电子
阴离子
现在我们牵手结合成了氯化钠
金属原子
失去最外层电子
阳离子
非金属原子
得到电子
阴离子
离子也是构成物质的一种微粒。
物质都是由微观粒子构成的;
构成物质的微粒有分子、原子、离子。
原 子
物 质
结 合
分子
构 成
直 接 构 成
得失电子
构 成
阴阳离子
同课章节目录
- 第一章 大家都来学化学
- 1.1 身边的化学
- 1.2 化学实验室之旅
- 1.3 物质的变化
- 1.4 物质性质的探究
- 第二章 空气、物质的构成
- 2.1 空气的成分
- 2.2 构成物质的微粒(Ⅰ)——分子
- 2.3 构成物质的微粒(Ⅱ)——原子和离子
- 2.4 辨别物质的元素组成
- 第三章 维持生命之气——氧气
- 3.1 氧气的性质和用途
- 3.2 制取氧气
- 3.3 燃烧条件与灭火原理
- 3.4 物质构成的表示式
- 第四章 生命之源——水
- 4.1 我们的水资源
- 4.2 水的组成
- 4.3 质量守恒定律
- 4.4 化学方程式
- 第五章 燃料
- 5.1 洁净的燃料——氢气
- 5.2 组成燃料的主要元素——碳
- 5.3 二氧化碳的性质和制法
- 5.4 古生物的“遗产”——化石燃料
