1-3人类对原子结构的认识
图片预览







文档简介
(共33张PPT)
专题一:化学家眼中的物质世界
1.3:人类对原子结构的认识
1.3.1:原子结构模型的演变
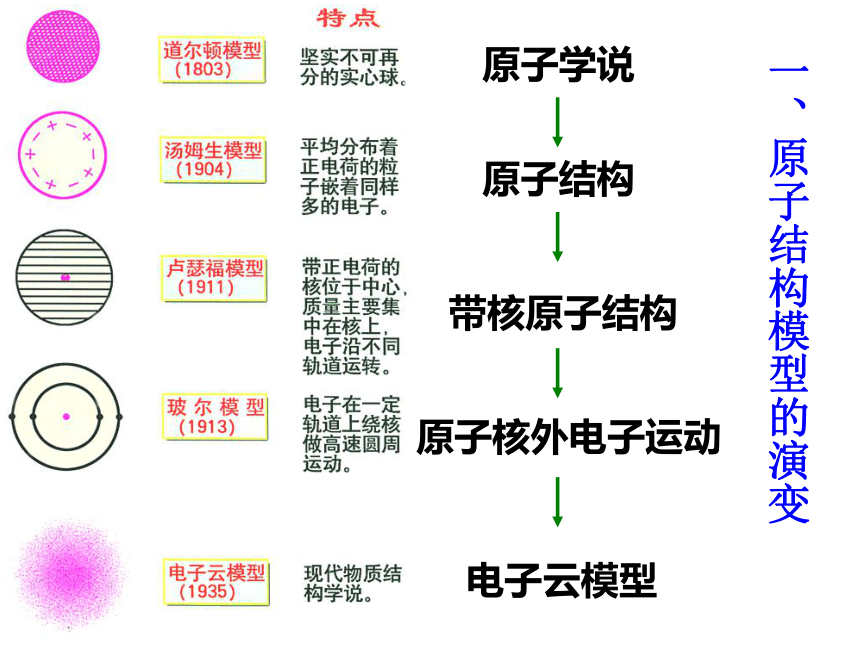
公元前5世纪,希腊哲学家德谟克利特等人认为 :万物是由大量的不可分的微粒构成的,即原子
一、原子结构模型的演变
原子学说
原子结构
带核原子结构
原子核外电子运动
电子云模型
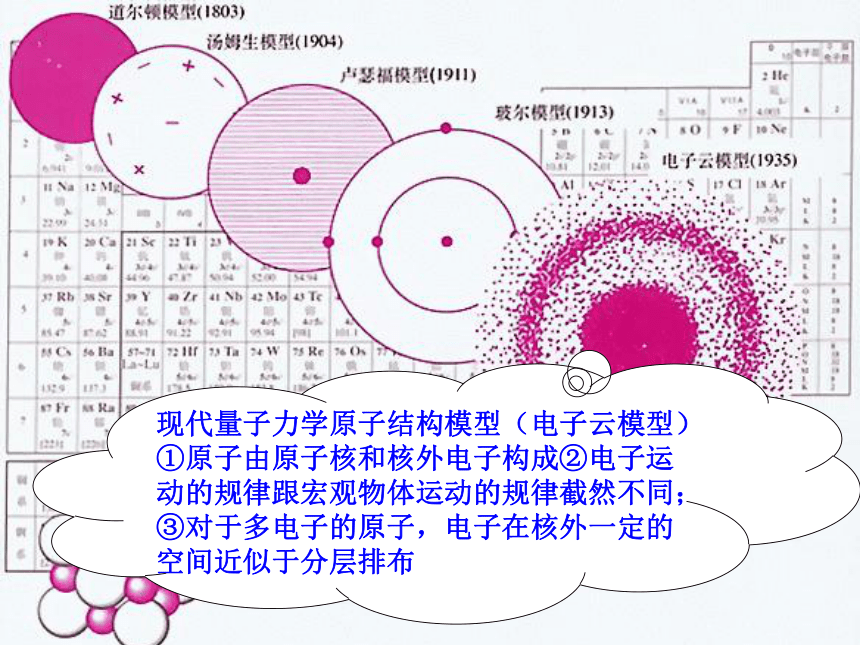
一、原子结构模型的演变
现代量子力学原子结构模型(电子云模型)①原子由原子核和核外电子构成②电子运动的规律跟宏观物体运动的规律截然不同;③对于多电子的原子,电子在核外一定的空间近似于分层排布
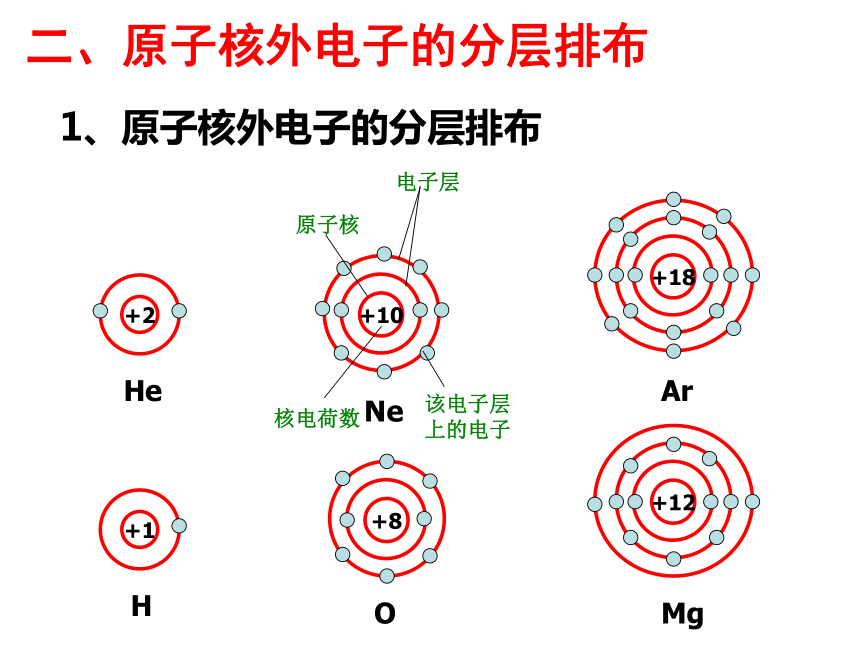
二、原子核外电子的分层排布
+2
He
+18
Ar
+10
Ne
该电子层上的电子
核电荷数
电子层
原子核
+1
H
+8
O
+12
Mg
1、原子核外电子的分层排布
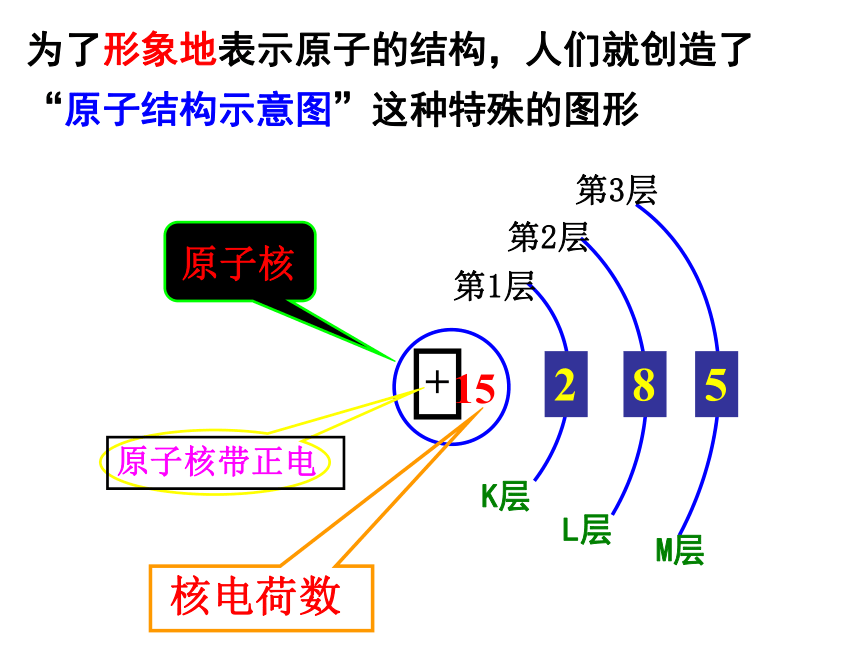
为了形象地表示原子的结构,人们就创造了“原子结构示意图”这种特殊的图形
+
15
第1层
第2层
第3层
K层
L层
M层
原子核
原子核带正电
核电荷数
2
8
5
电子层序数(n) 1 2 3 4 5 6 7
符号
能量大小
距核远近
K L M N O P Q
小 大
近 远
电子能量高在离核远的区域内运动,电子能量低在离核近的区域内运动 ,把原子核外分成七个运动区域,又叫电子层,分别用n=1、2、3、4、5、6、7…表示,分别称为K、L、M、N、O、P、Q…,n值越大,说明电子离核越远,能量也就越高
2、原子核外电子运动区域与电子能量的关系
3、原子核外电子排布规律
① 电子总是先排布在能量最低的电子层里, 然后由里往外,依次排在能量逐渐升高的电子层里(能量最低原理)先排K层,排满K层后再排L层,排满L层后再排M层,依此类推
②每个电子层最多只能容纳2n2个电子
③ 最外层最多只能容纳 8个电子(K层为最外层时不能超过2个);次外层最多只能容纳18个电子(K层为次外层时不能超过2个);倒数第三层最多只能容纳32个电子
4、原子结构与元素性质的关系
(结构决定性质)
(1)稳定结构:最外电子层上为8(只有一个电子层时为2)个电子
(如He、Ne、Ar等)
(2)不稳定结构:原子容易失去电子转化或容易得到电子转化最外电子层上为8(只有一个电子层时为2)个电子的稳定结构
(如,失去:Na、Mg、Al 得到:F、O、Cl)
+12
2
8
2
失去电子
+12
2
8
Mg
Mg2+
+8
2
6
+8
2
8
得到电子
O
O2-
1、活泼金属元素的原子容易失去最外层上的电子变为带正电荷的阳离子,阳离子所带正电荷的数目等于原子失去的电子的数目
Mg
Mg2+
-2e-
(带2个单位正电荷)
2、活泼非金属元素的原子容易得到电子变为带负电荷的阴离子,阴离子所带负电荷的数目等于原子得到的电子的数目
(带2个单位负电荷)
O
O2-
+2e-
氧化镁的形成
宏观:氧气和金属镁反应生成氧化镁,氧化镁是氧元素与镁元素相结合的产物
微观:每个Mg失去2个电子形成与Ne一样的稳定电子层结构的Mg2+,每个O得到2个电子形成与Ne一样的稳定电子层结构的O2-,带正电荷的Mg2+与带负电荷的O2-相互发生电性作用,形成稳定的MgO。如下图
2Mg+O2==2MgO
点燃
⒈金属单质Na、Mg能分别与非金属单质O2、Cl2反应生成氧化物和氯化物,请写出这些氧化物和氯化物的化学式
元素 化合价 原子最外层电子数目 失去(或得到)电子的数目
Na
Mg 2
O 6
Cl -1
⒉根据Na、Mg、O、Cl原子在反应中失去或得到电子的数目和该原子的最外层电子数目,推断其氧化物和氯化物中元素的化合价,将结果填入下表:
一些元素的原子得失电子的情况
Na2O、 Na2O2 、MgO、NaCl、MgCl2
①最外层电子数﹤4时,容易失去电子
(化合价=+失去的电子数目)
原子
②最外层电子数﹥4时,容易得到电子
(化合价=最外层电子数-8)
关系:元素化合价在数值上等于原子失去或得到的电子数目(失为正,得为负)
练习
1、写出氮、氖、镁、钾的原子结构示意图
2、写出钠、硫、钙离子的离子结构示意图
专题一:化学家眼中的物质世界
1.3:人类对原子结构的认识
1.3.2:认识原子核
1、原子是构成物质的一种
微粒,原子是否可以再分?
如果原子可以再分,它是由哪些更小的
微粒构成的呢?
2、相对原子质量定义为“某原子的质量与C-12原子质量的1/12的比”。C-12原子指的是什么原子?
阅读表1-7,质子、中子、电子的电性和电量怎样?比较三种粒子的质量大小、带电荷的情况。什么是相对质量?
收集材料:结合初中所学的有关原子结构的初步知识填写下表:
构成原子的微粒 电子 原子核
质子 中子
电性和电量/C
0
质量/kg 9.109×10-31 1.673×10-27 1.675×10-27
相对质量 1/1836 1.007 1.008
负电荷 1.602×10-19
正电荷
1.602×10-19
原子
原子核
核外电子
质子
中子
(带正电)
(带负电)
不显
电性
一、原子的构成
1 、构成原子的微粒之间的数量关系
一个质子带一个单位正电荷
一个电子带一个单位负电荷
不带电
原子核体积非常小,电子在“空旷、辽阔”的核外空间高速运动.电子运动的空间范围即为原子的体积.原子核直径约是原子的万分之一,体积约几千亿分之一.
原子 质子数(Z) 中子数(N) 质子数+中子数(A)
相对原子质量
F 10 18.998(19)
Na 12 22.989(23)
Al 14 26.982(27)
9
19
11
23
13
27
比较表格中的数据,你能得出什么结论?
Z 个
(A-Z)个
Z 个
原子核
核外电子
质子
中子
原子
X
A
Z
☆质量数(A)= 质子数(Z)+ 中子数(N)
如果忽略电子的质量,将原子核内所有的质子和中子的相对质量取近似整数值加起来,所得的数值,我们称之为质量数
2、质量数
X
A
Z
——元素符号
质量数 ——
核电荷数 ——
(核内质子数)
☆核电荷数=核内质子数=核外电子数=原子序数
含义:代表一个质量数为A、质子数为Z的原子
阳离子:核电荷数=核内质子数>核外电子数
核电荷数=核内电子数+电荷数
阴离子:核电荷数=核内质子数<核外电子数
核电荷数=核内电子数-电荷数
3、电性关系
☆原子符号
O
8
16
2
2—
-2
离子电荷
原子个数
质量数
质子数
化合价
数字的位置不同,所表示的意义就不同.
a、元素符号(X)
左上角写上质量数
左下角写上质子数
原子符号 X
b、
原子质量(m)
12C (m) 1/12
= 相对原子质量 (数值上等于摩尔质量 (g/mol)) ≈质量数
c、原子与对应离子比较,电子数不等,质子数、中子、质量、相对原子质量、质量数仍相等
Cl
17
35
-
质量数
质子数
微粒
氯原子
硫离子
钠离子
35
17
中子数
电子数
23
12
32
35
45
18
18
17
10
16
16
80
11
35
Br
80
35
微粒
质子数
中子数
质量数
学 名
俗 称
1
1
1
1
1
0
2
3
2
氕
氘
氚
重氢
超重氢
H
1
1
H
2
1
H
3
1
试比较三种原子的异同,指出它们之间的关系
质子数相同
中子数不同,质量数不同
属同种元素
不同种原子
质子数相同而中子数不同的同一元素的原子互称同位素
(D)
(T)
氢
(H)
元素:具有相同质子数的同一类原子的总称
同位素:质子数相同而中子数不同的核素互称
6 C ,
13
6 C ,
12
6 C
14
8 O ,
16
8 O ,
17
8 O
18
核素:具有一定质子数和一定中子数的一种原子
C、O、Na
17 Cl
35
6 C
12
8 O
16
同 位 素
许多元素都有同位素, 目前发现112种元素,
同位素却有1800 余种
几
个
实
例
1H
1
6C
12
1H
2
1H
3
92U
234
氢有三种同位素:
氘和氚是制造氢弹的材料
铀有三种同位素:
92U
235
92U
238
铀235 是制造原子弹的材料和核反应堆的燃料
碳有三种同位素:
6C
13
6C
14
碳12 作为原子量及阿伏加德罗常数的标准
碳14 在考古学中测定生物死亡年代
1、据报道,上海某医院正在研究用放射性的一种碘 治疗肿瘤。该碘原子的核内的中子数与核外电子数之差是
I
125
53
A、72 B、19 C、53 D、125
B
2、某二价阴离子,核外有18个电子,质量数为32,则其中子数为
A、12 B、14 C、16 D、18
C
1、下列叙述正确的是 ( )
(A)质子数相同的微粒之间一定互为同位素
(B)已发现的元素有112种,因此有112种原子
(C)属于同位素的原子一定为同种元素
(D)水(H2O)和重水(D2O)互称同位素
不一定,如HF、H2O、NH3、CH4等分子质子数相同
大多数元素均有同位素,原子数目远远超过112种
正确,因属于同位素的原子的质子数相同
同位素指的是原子之间关系,不是分子之间的关系
C
2、和Na+具有相同质子数和电子数的微粒是
A、NH4+ B、F- C、H2O D、NH3
某粒子用 表示,下列关于该粒子的叙述
正确的是
A、所含质子数=A-n
B、所含中子数=A-Z
C、所含电子数=Z+n
D、质量数=Z+A
A
Z
Rn+
A
B
练习
练习
4、某元素 Rn- 核外有 x 个电子,该元素的某种原子的质量数为 A,求原子里的中子数
阴离子Rn-核外有 x 个电子
则原子的核外电子数为 x - n
核内的质子数也为 x - n
A
B
C
D
核内的中子数N = A -(x – n )
= A - x + n
5、元素B的核电荷数为Z。已知Bn-和Am+有相同的核外电子数,则A元素的原子序数为多少(用Z、n、m 表示)
练习
核内中子数为N 的R2+离子,质量数为A,则n g 它的氧化物中所含质子的物质的量是多少?
计
算
R 原子的质子数为 A-N
氧化物RO 的摩尔质量为 (A + 16)g/mol
氧化物RO 的质子数为 (A-N+8)
n g RO 所含质子的物质的量为
n
(A +16)
(A-N+8)mol
专题一:化学家眼中的物质世界
1.3:人类对原子结构的认识
1.3.1:原子结构模型的演变
公元前5世纪,希腊哲学家德谟克利特等人认为 :万物是由大量的不可分的微粒构成的,即原子
一、原子结构模型的演变
原子学说
原子结构
带核原子结构
原子核外电子运动
电子云模型
一、原子结构模型的演变
现代量子力学原子结构模型(电子云模型)①原子由原子核和核外电子构成②电子运动的规律跟宏观物体运动的规律截然不同;③对于多电子的原子,电子在核外一定的空间近似于分层排布
二、原子核外电子的分层排布
+2
He
+18
Ar
+10
Ne
该电子层上的电子
核电荷数
电子层
原子核
+1
H
+8
O
+12
Mg
1、原子核外电子的分层排布
为了形象地表示原子的结构,人们就创造了“原子结构示意图”这种特殊的图形
+
15
第1层
第2层
第3层
K层
L层
M层
原子核
原子核带正电
核电荷数
2
8
5
电子层序数(n) 1 2 3 4 5 6 7
符号
能量大小
距核远近
K L M N O P Q
小 大
近 远
电子能量高在离核远的区域内运动,电子能量低在离核近的区域内运动 ,把原子核外分成七个运动区域,又叫电子层,分别用n=1、2、3、4、5、6、7…表示,分别称为K、L、M、N、O、P、Q…,n值越大,说明电子离核越远,能量也就越高
2、原子核外电子运动区域与电子能量的关系
3、原子核外电子排布规律
① 电子总是先排布在能量最低的电子层里, 然后由里往外,依次排在能量逐渐升高的电子层里(能量最低原理)先排K层,排满K层后再排L层,排满L层后再排M层,依此类推
②每个电子层最多只能容纳2n2个电子
③ 最外层最多只能容纳 8个电子(K层为最外层时不能超过2个);次外层最多只能容纳18个电子(K层为次外层时不能超过2个);倒数第三层最多只能容纳32个电子
4、原子结构与元素性质的关系
(结构决定性质)
(1)稳定结构:最外电子层上为8(只有一个电子层时为2)个电子
(如He、Ne、Ar等)
(2)不稳定结构:原子容易失去电子转化或容易得到电子转化最外电子层上为8(只有一个电子层时为2)个电子的稳定结构
(如,失去:Na、Mg、Al 得到:F、O、Cl)
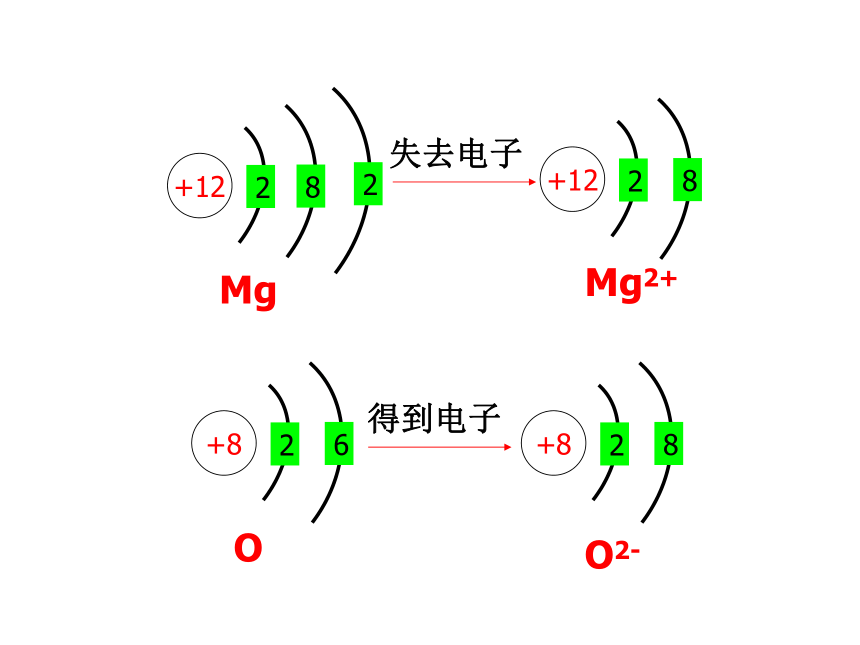
+12
2
8
2
失去电子
+12
2
8
Mg
Mg2+
+8
2
6
+8
2
8
得到电子
O
O2-
1、活泼金属元素的原子容易失去最外层上的电子变为带正电荷的阳离子,阳离子所带正电荷的数目等于原子失去的电子的数目
Mg
Mg2+
-2e-
(带2个单位正电荷)
2、活泼非金属元素的原子容易得到电子变为带负电荷的阴离子,阴离子所带负电荷的数目等于原子得到的电子的数目
(带2个单位负电荷)
O
O2-
+2e-
氧化镁的形成
宏观:氧气和金属镁反应生成氧化镁,氧化镁是氧元素与镁元素相结合的产物
微观:每个Mg失去2个电子形成与Ne一样的稳定电子层结构的Mg2+,每个O得到2个电子形成与Ne一样的稳定电子层结构的O2-,带正电荷的Mg2+与带负电荷的O2-相互发生电性作用,形成稳定的MgO。如下图
2Mg+O2==2MgO
点燃
⒈金属单质Na、Mg能分别与非金属单质O2、Cl2反应生成氧化物和氯化物,请写出这些氧化物和氯化物的化学式
元素 化合价 原子最外层电子数目 失去(或得到)电子的数目
Na
Mg 2
O 6
Cl -1
⒉根据Na、Mg、O、Cl原子在反应中失去或得到电子的数目和该原子的最外层电子数目,推断其氧化物和氯化物中元素的化合价,将结果填入下表:
一些元素的原子得失电子的情况
Na2O、 Na2O2 、MgO、NaCl、MgCl2
①最外层电子数﹤4时,容易失去电子
(化合价=+失去的电子数目)
原子
②最外层电子数﹥4时,容易得到电子
(化合价=最外层电子数-8)
关系:元素化合价在数值上等于原子失去或得到的电子数目(失为正,得为负)
练习
1、写出氮、氖、镁、钾的原子结构示意图
2、写出钠、硫、钙离子的离子结构示意图
专题一:化学家眼中的物质世界
1.3:人类对原子结构的认识
1.3.2:认识原子核
1、原子是构成物质的一种
微粒,原子是否可以再分?
如果原子可以再分,它是由哪些更小的
微粒构成的呢?
2、相对原子质量定义为“某原子的质量与C-12原子质量的1/12的比”。C-12原子指的是什么原子?
阅读表1-7,质子、中子、电子的电性和电量怎样?比较三种粒子的质量大小、带电荷的情况。什么是相对质量?
收集材料:结合初中所学的有关原子结构的初步知识填写下表:
构成原子的微粒 电子 原子核
质子 中子
电性和电量/C
0
质量/kg 9.109×10-31 1.673×10-27 1.675×10-27
相对质量 1/1836 1.007 1.008
负电荷 1.602×10-19
正电荷
1.602×10-19
原子
原子核
核外电子
质子
中子
(带正电)
(带负电)
不显
电性
一、原子的构成
1 、构成原子的微粒之间的数量关系
一个质子带一个单位正电荷
一个电子带一个单位负电荷
不带电
原子核体积非常小,电子在“空旷、辽阔”的核外空间高速运动.电子运动的空间范围即为原子的体积.原子核直径约是原子的万分之一,体积约几千亿分之一.
原子 质子数(Z) 中子数(N) 质子数+中子数(A)
相对原子质量
F 10 18.998(19)
Na 12 22.989(23)
Al 14 26.982(27)
9
19
11
23
13
27
比较表格中的数据,你能得出什么结论?
Z 个
(A-Z)个
Z 个
原子核
核外电子
质子
中子
原子
X
A
Z
☆质量数(A)= 质子数(Z)+ 中子数(N)
如果忽略电子的质量,将原子核内所有的质子和中子的相对质量取近似整数值加起来,所得的数值,我们称之为质量数
2、质量数
X
A
Z
——元素符号
质量数 ——
核电荷数 ——
(核内质子数)
☆核电荷数=核内质子数=核外电子数=原子序数
含义:代表一个质量数为A、质子数为Z的原子
阳离子:核电荷数=核内质子数>核外电子数
核电荷数=核内电子数+电荷数
阴离子:核电荷数=核内质子数<核外电子数
核电荷数=核内电子数-电荷数
3、电性关系
☆原子符号
O
8
16
2
2—
-2
离子电荷
原子个数
质量数
质子数
化合价
数字的位置不同,所表示的意义就不同.
a、元素符号(X)
左上角写上质量数
左下角写上质子数
原子符号 X
b、
原子质量(m)
12C (m) 1/12
= 相对原子质量 (数值上等于摩尔质量 (g/mol)) ≈质量数
c、原子与对应离子比较,电子数不等,质子数、中子、质量、相对原子质量、质量数仍相等
Cl
17
35
-
质量数
质子数
微粒
氯原子
硫离子
钠离子
35
17
中子数
电子数
23
12
32
35
45
18
18
17
10
16
16
80
11
35
Br
80
35
微粒
质子数
中子数
质量数
学 名
俗 称
1
1
1
1
1
0
2
3
2
氕
氘
氚
重氢
超重氢
H
1
1
H
2
1
H
3
1
试比较三种原子的异同,指出它们之间的关系
质子数相同
中子数不同,质量数不同
属同种元素
不同种原子
质子数相同而中子数不同的同一元素的原子互称同位素
(D)
(T)
氢
(H)
元素:具有相同质子数的同一类原子的总称
同位素:质子数相同而中子数不同的核素互称
6 C ,
13
6 C ,
12
6 C
14
8 O ,
16
8 O ,
17
8 O
18
核素:具有一定质子数和一定中子数的一种原子
C、O、Na
17 Cl
35
6 C
12
8 O
16
同 位 素
许多元素都有同位素, 目前发现112种元素,
同位素却有1800 余种
几
个
实
例
1H
1
6C
12
1H
2
1H
3
92U
234
氢有三种同位素:
氘和氚是制造氢弹的材料
铀有三种同位素:
92U
235
92U
238
铀235 是制造原子弹的材料和核反应堆的燃料
碳有三种同位素:
6C
13
6C
14
碳12 作为原子量及阿伏加德罗常数的标准
碳14 在考古学中测定生物死亡年代
1、据报道,上海某医院正在研究用放射性的一种碘 治疗肿瘤。该碘原子的核内的中子数与核外电子数之差是
I
125
53
A、72 B、19 C、53 D、125
B
2、某二价阴离子,核外有18个电子,质量数为32,则其中子数为
A、12 B、14 C、16 D、18
C
1、下列叙述正确的是 ( )
(A)质子数相同的微粒之间一定互为同位素
(B)已发现的元素有112种,因此有112种原子
(C)属于同位素的原子一定为同种元素
(D)水(H2O)和重水(D2O)互称同位素
不一定,如HF、H2O、NH3、CH4等分子质子数相同
大多数元素均有同位素,原子数目远远超过112种
正确,因属于同位素的原子的质子数相同
同位素指的是原子之间关系,不是分子之间的关系
C
2、和Na+具有相同质子数和电子数的微粒是
A、NH4+ B、F- C、H2O D、NH3
某粒子用 表示,下列关于该粒子的叙述
正确的是
A、所含质子数=A-n
B、所含中子数=A-Z
C、所含电子数=Z+n
D、质量数=Z+A
A
Z
Rn+
A
B
练习
练习
4、某元素 Rn- 核外有 x 个电子,该元素的某种原子的质量数为 A,求原子里的中子数
阴离子Rn-核外有 x 个电子
则原子的核外电子数为 x - n
核内的质子数也为 x - n
A
B
C
D
核内的中子数N = A -(x – n )
= A - x + n
5、元素B的核电荷数为Z。已知Bn-和Am+有相同的核外电子数,则A元素的原子序数为多少(用Z、n、m 表示)
练习
核内中子数为N 的R2+离子,质量数为A,则n g 它的氧化物中所含质子的物质的量是多少?
计
算
R 原子的质子数为 A-N
氧化物RO 的摩尔质量为 (A + 16)g/mol
氧化物RO 的质子数为 (A-N+8)
n g RO 所含质子的物质的量为
n
(A +16)
(A-N+8)mol
