河北省邯郸市联盟校2020-2021学年高二上学期期中考试化学试题
文档属性
| 名称 | 河北省邯郸市联盟校2020-2021学年高二上学期期中考试化学试题 |  | |
| 格式 | docx | ||
| 文件大小 | 483.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-11-06 14:23:51 | ||
图片预览


文档简介
河北省邯郸市联盟校2020-2021学年高二上学期期中考试
化学试题
考生注意:
1.本试卷分选择题和非选择题两部分。满分100分,考试时间90分钟。
2.考生作答时,请将答案答在答题卡上。选择题每小题选出答案后,用2B铅笔把答题卡上对应题目的答案标号涂黑;非选择题请用直径0.5毫米黑色墨水签字笔在答题卡上各题的答题区域内作答,超出答题区域书写的答案无效,在试题卷、草稿纸上作答无效。
3.本卷命题范围:苏教版选修④。
4.可能用到的相对原子质量:H1?
B11?
C12?
N14
?O16?
Na23?
S32
一、选择题:本题共10小题,每小题2分,共20分。在每小题列出的四个选项中,只有一项符合题目要求。
1.下列诗句或谚语中包含吸热反应过程的是
A.野火烧不尽,春风吹又生
B.春蚕到死丝方尽,蜡炬成灰泪始干
C.千锤万凿出深山,烈火焚烧若等闲
D.爆竹声中一-岁除,春风送暖人屠苏
2.已知反应4CO+?2NO2N2?+4CO2在不同条件下的化学反应速率如下,其中反应速率最快的是
A.?v(CO)=1.5?mol.·?L-1·min-1
B.?v(NO2)=0.7?mol·L-1·min-1
C.?u(N2)=0.4?mol·L-1·min-1
D.?v(CO2)=1.1?mol·L-1·min-1
3.已知:NO2(g)+?SO2(g)SO3(g)?+NO(g)。现将体积之比为1:2的NO2和SO2的混合气体置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是
A.混合气体总物质的量保持不变
B.混合气体密度保持不变
C.?NO2(g)和SO2(g)的体积比保持不变
D.每消耗1
molSO2,同时消耗0.5
molSO3(g)
4.下列说法或表示法正确的是
A.等量的硫蒸气和硫固体分别完全燃烧,后者放出热量多
B.由C(石墨,s)=C(金刚石,s)?△H=+119?kJ/mol可知,石墨比金刚石稳定
C.在稀溶液中:H+(aq)?+?OH-(aq)=H2O(l)
△H
=-?57.3?kJ/mol,.若将含0.5
mol的浓硫酸溶液与含1
molNaOH的溶液混合,放出的热量等于57.3kJ
D.在101?kPa时,2?g?H2完全燃烧生成液态水,放出285.?8?kJ热量,氢气燃烧的热化学方程式表示为2H2(g)+O2(g)=2H2O(l)?△H
=?+285.8
kJ·mol-1
5.氧化亚铜是一种重要的工业原料。已知1
g?C(s)燃烧生成一氧化碳放出9.2
kJ的热量,氧化亚铜与氧气反应的能量变化如图所示。下列有关判断正确的是
A.碳[C(s)]的燃烧热△H
=?-110.4
kJ·mol-1
B.氧化亚铜与氧气的反应为吸热反应
C.氧化亚铜与氧气反应的活化能为292?kJ·mol-1
D.?C(s)+2CuO(s)=Cu2O(s)+CO(g)?△H=?+35.6?kJ·mol-1
6.甲、乙两烧杯中溶液的体积均为20?mL,pH均为13,分别稀释至原体积的100倍后,甲、乙两烧杯中溶液pH的关系正确的是
A.甲<乙
B.甲=乙
C.甲>乙
D.不能确定
7.羟胺(NH2OH)在水溶液中的电离方程式为NH2OH+?H2O=NH3OH++OH-。常温下,向该溶液中加入NaOH固体,下列说法不正确的是
A.平衡常数K减小
B.?c(OH-)增大
C.平衡向左移动
D.?增大
8.对于xA(g)+yB(g)zC(g)+wD(g)的平衡体系,当升高温度时,体系的平均相对分子质量从26变成39,则下列说法正确的是
A.x+y>z+w,正反应是放热反应
B.?x+y>z+w,正反应是吸热反应
C.x+y<z+w,逆反应是放热反应
D.?x+y>z+w,逆反应是吸热反应
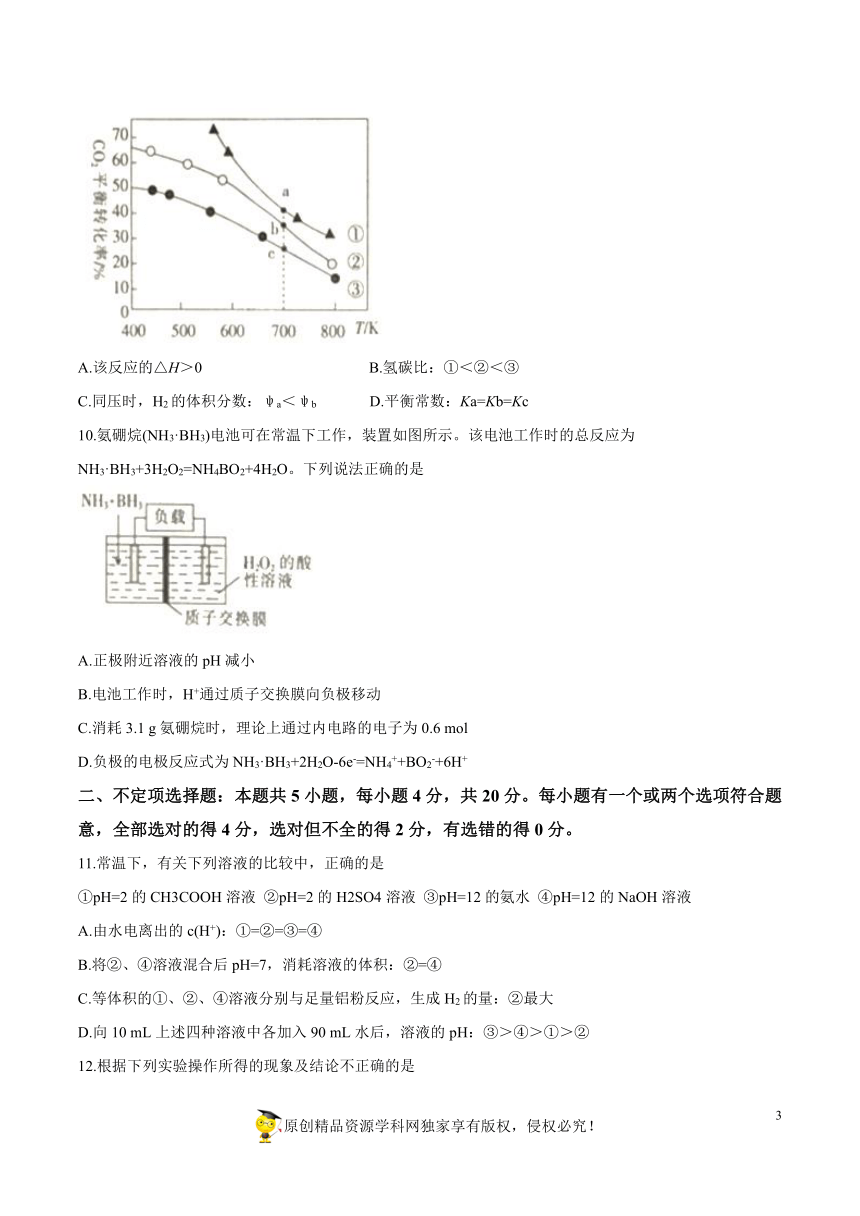
9.在恒容密闭容器中进行反应2CO2(g)?+6H2(g)C2H5OH(g)+3H2O(g)?△H。?在某压强下起始时按不同氢碳比[]投料(如图中曲线①②③),测得CO2的平衡转化率与温度的关系如图所示,下列有关说法正确的是
A.该反应的△H>0
B.氢碳比:①<②<③
C.同压时,H2的体积分数:ψa<ψb
D.平衡常数:Ka=Kb=Kc
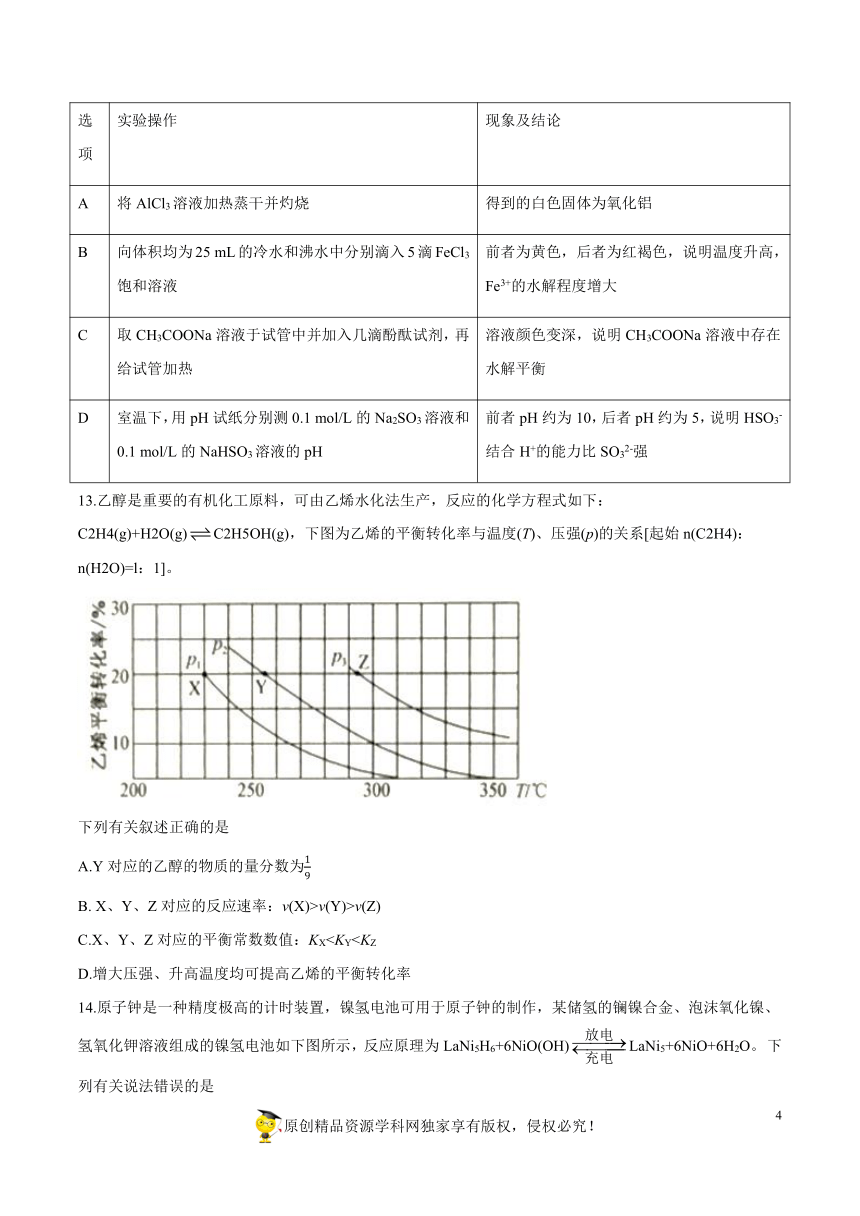
10.氨硼烷(NH3·BH3)电池可在常温下工作,装置如图所示。该电池工作时的总反应为NH3·BH3+3H2O2=NH4BO2+4H2O。下列说法正确的是
A.正极附近溶液的pH减小
B.电池工作时,H+通过质子交换膜向负极移动
C.消耗3.1?g氨硼烷时,理论上通过内电路的电子为0.6?mol
D.负极的电极反应式为NH3·BH3+2H2O-6e-=NH4++BO2-+6H+
二、不定项选择题:本题共5小题,每小题4分,共20分。每小题有一个或两个选项符合题意,全部选对的得4分,选对但不全的得2分,有选错的得0分。
11.常温下,有关下列溶液的比较中,正确的是
①pH=2的CH3COOH溶液
②pH=2的?H2SO4溶液
③pH=12?的氨水
④pH=12的NaOH溶液
A.由水电离出的c(H+):①=②=③=④
B.将②、④溶液混合后pH=7,消耗溶液的体积:②=④
C.等体积的①、②、④溶液分别与足量铝粉反应,生成H2的量:②最大
D.向10?mL上述四种溶液中各加入90?mL水后,溶液的pH:③>④>①>②
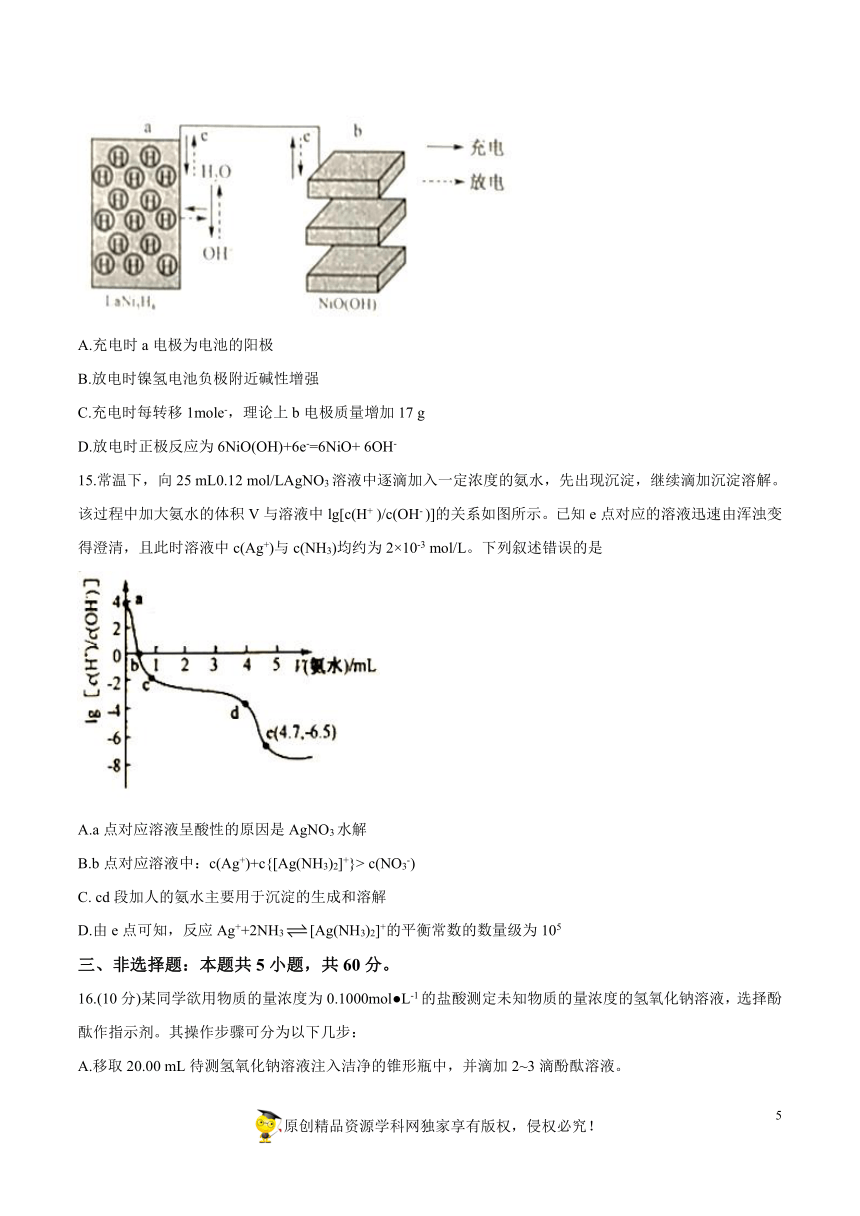
12.根据下列实验操作所得的现象及结论不正确的是
选项
实验操作
现象及结论
A
将AlCl3溶液加热蒸干并灼烧
得到的白色固体为氧化铝
B
向体积均为25?mL的冷水和沸水中分别滴入5滴FeCl3饱和溶液
前者为黄色,后者为红褐色,说明温度升高,Fe3+的水解程度增大
C
取CH3COONa溶液于试管中并加入几滴酚酞试剂,再给试管加热
溶液颜色变深,说明CH3COONa溶液中存在水解平衡
D
室温下,用pH试纸分别测0.1?mol/L的Na2SO3溶液和0.1?mol/L的NaHSO3溶液的pH
前者?pH约为10,后者pH约为5,说明HSO3-结合H+的能力比SO32-强
13.乙醇是重要的有机化工原料,可由乙烯水化法生产,反应的化学方程式如下:C2H4(g)+H2O(g)C2H5OH(g),下图为乙烯的平衡转化率与温度(T)、压强(p)的关系[起始n(C2H4):n(H2O)=l:1]。
下列有关叙述正确的是
A.Y对应的乙醇的物质的量分数为
B.?X、Y、Z对应的反应速率:v(X)>v(Y)>v(Z)
C.X、Y、Z对应的平衡常数数值:KXD.增大压强、升高温度均可提高乙烯的平衡转化率
14.原子钟是一种精度极高的计时装置,镍氢电池可用于原子钟的制作,某储氢的镧镍合金、泡沫氧化镍、氢氧化钾溶液组成的镍氢电池如下图所示,反应原理为LaNi5H6+6NiO(OH)LaNi5+6NiO+6H2O。?下列有关说法错误的是
A.充电时a电极为电池的阳极
B.放电时镍氢电池负极附近碱性增强
C.充电时每转移1mole-,理论上b电极质量增加17
g
D.放电时正极反应为6NiO(OH)+6e-=6NiO+?6OH-
15.常温下,向25
mL0.12
mol/LAgNO3溶液中逐滴加入一定浓度的氨水,先出现沉淀,继续滴加沉淀溶解。该过程中加大氨水的体积V与溶液中lg[c(H+?)/c(OH-?)]的关系如图所示。已知e点对应的溶液迅速由浑浊变得澄清,且此时溶液中c(Ag+)与c(NH3)均约为2×10-3
mol/L。下列叙述错误的是
A.a点对应溶液呈酸性的原因是AgNO3水解
B.b点对应溶液中:c(Ag+)+c{[Ag(NH3)2]+}>
c(NO3-)
C.?cd段加人的氨水主要用于沉淀的生成和溶解
D.由e点可知,反应Ag++2NH3[Ag(NH3)2]+的平衡常数的数量级为105
三、非选择题:本题共5小题,共60分。
16.(10分)某同学欲用物质的量浓度为0.1000mol●L-1的盐酸测定未知物质的量浓度的氢氧化钠溶液,选择酚酞作指示剂。其操作步骤可分为以下几步:
A.移取20.00
mL待测氢氧化钠溶液注入洁净的锥形瓶中,并滴加2~3滴酚酞溶液。
B.用标准溶液润洗滴定管2~3次。
C.把盛有标准溶液的酸式滴定管固定好,调节滴定管尖嘴使之充满溶液。
D.取标准盐酸注入酸式滴定管至“0”刻度以上2~3?cm处。
E.调节液面至“0”或“0”以下刻度,记下读数。
F.把锥形瓶放在滴定管的下面,用标准盐酸溶液滴定至终点,并记下滴定管液面的刻度。
请填写下列空白:
(1)正确的操作步骤的顺序是______________(填字母)。
(2)步骤B操作的目的是______________
。
(3)配制标准盐酸时,需要用的仪器有__________(填字母)。
a.容量瓶
b.托盘天平
c.量筒
d.酸式滴定管
e.烧杯
f.胶头滴管
g.玻璃棒
(4)下列操作中可能使所测氢氧化钠溶液的浓度数侑偏低的是_____________(填字母)。
a.开始实验时酸式滴定管尖嘴部分有气泡。在滴定过程中气泡消失
b.盛NaOH溶液的锥形瓶滴定前用NaOH溶液润洗2~3次
c.酸式滴定管在装液前未用标准盐酸润洗2~3次
d.读取盐酸体积时,开始仰视读数,滴定结束时俯视读数
e.滴定过程中,锥形瓶的振荡过于激烈,使少量溶液溅出
(5)若某次滴定结束时,酸式滴定管中的液面如图所示,则读数为___________mL。若仰视,会使读数偏____________
(填“大"或“小")。
(6)再结合下表数据,计算被测氢氧化钠溶液的物质的量浓度是_______mol/L。
滴定次数
待测溶液的体积/mL
标准酸体积
滴定前的刻度/mL
滴定后的刻度/mL
第一次
10.00
2.34
20.?39
第二次
10.00
3.?20
20.20
第三次
10.00
0.60
17.?80
17.(12)某可逆反应:2A(2)B(g)+D(g)在3种不同条件下进行,B和D的起始波度均为0,反应物A的浓度随反应时间的变化情况如下表:
实验序号
时间/min
浓度/mol·L-1
温度/℃
0
10
20
30
40
50
60
1
800
1.0
0.80
0.67
0.57
0.50
0.50
0.50
2
800
1.0
0.60
0.50
0.50
0.50
0.50
0.50
3
950
1.0
0.40
0.25
0.20
0.20
0.20
0.20
(1)实验1中,在10~20?min内,以物质A表示的平均反应速率为________mol·L-1·min-1,50?min时,v(正)________(填“<”“>”或“=”)v(逆)。
(2)0~20?min内,实验2比实验1的反应速率___________(填“快”或“慢”),其原因可能是__________。
(3)实验3比实验1的反应速率___________(填“快”或“慢”),其原因是___________________。
18.?(12分)电渗析法在物质制备过程中有广泛应用。以石墨为电极,利用三室式电渗析法制备高氯酸、亚氯酸的装置如图所示。
I.利用三室式电渗析法制备高氯酸(HClO4)。M为高氯酸钠溶液。
(1)出口B处得到的产品是______________。
(2)电解过程中,阳极区附近pH_________(填“增大”“减小”或“不变”)。
(3)若C1极收集到11.2?L(标准状况)气体,则获得高氯酸__________mol。
II.利用三室式电渗析法制备亚氯酸(HClO2)。M为NaClO2溶液。
(4)ClO2-迁移方向是____________。
(5)C2极的电极反应式为______________。
(6)该过程制备的亚氯酸中含有少量氯酸杂质,其主要原因是________________(用离子方程式表示)。(提示:HClO2是弱酸,HClO3是强酸)
19.(12分)下表是几种弱酸常温下的电离平衡常数:
化学式
HCOOH
HCN
H2CO3
H2S
电离平衡常数K
1.77×10-4
4.?9×10-10
K1=4.3×10-7
K2=9.1×10-11
K1=5.6×10-8
K2=1.1×10-12
(1)HCOOH、HCN、H2CO3、H2S的酸性由强到弱的顺序为_______________。
(2)请写出H2S的电离方程式:_______________________。
(3)下列四种离子结合H+能力最强的是__________(填字母)。
A.?HS-
B.?CO32-
C.?CN-
D.?HCOO-
(4)相同温度下pH相同的NaCN和HCOOK的两溶液中c(NaCN)________(填“>”“<”或“=”,下同)c(HCOOK),[c(Na+?)-c(CN-)]_______[c(K+)-c(HCOO-)]。
(5)在25?mL?0.1?mol/LNaOH溶液中逐滴加人0.2?mol/LHCOOH溶液,溶液的pH变化曲线如下图所示,请回答下列问题:
①若使加入的HCOOH恰好把NaOH溶液完全中和,则加入HCOOH溶液的体积为________。
②B点时溶液呈________(填“酸性”“碱性”或“中性”),此时溶液中含有的溶质有___________。
③在c点所得的混合溶液中,c(Na+)、c(HCOO-)、c(H+)、c(OH-)由大到小的顺序是__________。
20.(14分)
(1)25℃时,制备亚硝酰氯所涉及的热化学方程式和平衡常数如表:
热化学方程式
平衡常数
①
2NO2(g)+NaCl(s)NaNO3(s)+NOCl(g)?
△H1=a?kJ/mol
K1
②
4NO2(g)+2NaCl(s)2NaNO3(s)?+?2NO(g)?+Cl2(g)?△H2=b?kJ/mol
K2
③
2NO(g)+Cl2(g)2NOCl(g)?
△H3=
K3
则该温度下,△H3=_________?kJ/mol;K3=__________(用K1和K2表示)。
(2)25?℃时,在体积为2?L的恒容密闭容器中通入0.08?mol?NO和0.04?molCl2发生上述反应③,若反应开始与结束时温度相同,数字压强仪显示反应过程中压强(p)随时间(t)的变化如下图实线所示,则△H3
____(填“>"、“<"或“=”)0;若其他条件相同,仅改变某一条件,测得其压强随时间的变化如下图虚线所示,则改变的条件是__________________;在5
min时,再充入0.08
molNO和0.04
molCl2,则混合气体的平均相对分子质量将___________(填“增大”、“减小”或“不变”)。
(3)如下图是甲、乙两同学描绘上述反应③的平衡常数的对数值(lgK)与温度的变化关系图,其中正确的曲线是_____________(填“甲”或“乙”),a值为_______。25℃时测得反应③在某时刻,?NO(g)、Cl2(g).?NOCl(g)的浓度分别为0.8?mol/L、0.1?mol/L、0.3?mol/L,则此时v正_______(填“<”“>”或“=”)v逆。
(4)在300℃8MPa下,将CO2和H2按物质的量之比1:3通入一密闭容器中发生CO2(g)+3H2(g)CH3OH(g)+H2O(g)的反应,达到平衡时,测得CO2的平衡转化率为50%,则该反应条件下的平衡常数为Kp=_________________(用平衡分压代替平衡浓度计算,分压=总压×物质的分数)。
河北省邯郸市联盟校2020-2021学年高二上学期期中考试
化学试题参考答案
一、选择题:本题共10小题,每小题2分,共20分。在每小题列出的四个选项中,只有一项符合题目要求。
1---5:CCCBD
6---10:CABDD
二、不定项选择题:本题共5小题,每小题4分,共20分。每小题有一个或两个选项符合题意,全部选对的得4分,选对但不全的得2分,有选错的得0分。
11.AB
12.D
13.A
14.AB
15.BD
三、非选择题:本题共5小题,共60分。
16.
(1)BDCEAF(2分)
(2)洗去附着在滴定管内壁上的水,防止其将标准溶液稀释而引起误差(2分)
(3)acefg(1分)
(4)de(1分)
(5)19.12(答案在19.?10~19.20之间均可,1分);大(1?分)
(6)0.?1710(2分)
17.?(1)0.013(2分);=(2?分)
(2)快(2分);实验2?中使用了催化剂(2分)
(3)快(2分);实验3?中温度更高(2分)
18.?(1)NaOH(2分)
(2)减小(2分)
(3)2(2分)
(4)通过膜1向阳极区迁移(2分)
(5)2H2O+2e?-=2OH-?+H2↑(2分)
(6)O2?+2HClO2=2ClO2-+2H+(2分)
19.?(1)HCOOH>?H2CO3>?H2S>?HCN(1分)
(2)H2SHS-+H+、HS-S2-+H+?(2分)
(3)B(1分)
(4)<(1分);=(1分)
(5)①12.5?mL(1分);②中性(1?分);HCOOH、?HCOONa(2分);③c(HCOO-)>c(Na+?)>c(H+?)>c(OH-?)(2?分)
20.?(1)2a-b(2分);(1分)
(2)<(1分);加入催化剂(1分);增大(1分)
(3)乙(2分);2(2?分);>?(2?分)
(4)
(MPa)-2(2分)
原创精品资源独家享有版权,侵权必究!
化学试题
考生注意:
1.本试卷分选择题和非选择题两部分。满分100分,考试时间90分钟。
2.考生作答时,请将答案答在答题卡上。选择题每小题选出答案后,用2B铅笔把答题卡上对应题目的答案标号涂黑;非选择题请用直径0.5毫米黑色墨水签字笔在答题卡上各题的答题区域内作答,超出答题区域书写的答案无效,在试题卷、草稿纸上作答无效。
3.本卷命题范围:苏教版选修④。
4.可能用到的相对原子质量:H1?
B11?
C12?
N14
?O16?
Na23?
S32
一、选择题:本题共10小题,每小题2分,共20分。在每小题列出的四个选项中,只有一项符合题目要求。
1.下列诗句或谚语中包含吸热反应过程的是
A.野火烧不尽,春风吹又生
B.春蚕到死丝方尽,蜡炬成灰泪始干
C.千锤万凿出深山,烈火焚烧若等闲
D.爆竹声中一-岁除,春风送暖人屠苏
2.已知反应4CO+?2NO2N2?+4CO2在不同条件下的化学反应速率如下,其中反应速率最快的是
A.?v(CO)=1.5?mol.·?L-1·min-1
B.?v(NO2)=0.7?mol·L-1·min-1
C.?u(N2)=0.4?mol·L-1·min-1
D.?v(CO2)=1.1?mol·L-1·min-1
3.已知:NO2(g)+?SO2(g)SO3(g)?+NO(g)。现将体积之比为1:2的NO2和SO2的混合气体置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是
A.混合气体总物质的量保持不变
B.混合气体密度保持不变
C.?NO2(g)和SO2(g)的体积比保持不变
D.每消耗1
molSO2,同时消耗0.5
molSO3(g)
4.下列说法或表示法正确的是
A.等量的硫蒸气和硫固体分别完全燃烧,后者放出热量多
B.由C(石墨,s)=C(金刚石,s)?△H=+119?kJ/mol可知,石墨比金刚石稳定
C.在稀溶液中:H+(aq)?+?OH-(aq)=H2O(l)
△H
=-?57.3?kJ/mol,.若将含0.5
mol的浓硫酸溶液与含1
molNaOH的溶液混合,放出的热量等于57.3kJ
D.在101?kPa时,2?g?H2完全燃烧生成液态水,放出285.?8?kJ热量,氢气燃烧的热化学方程式表示为2H2(g)+O2(g)=2H2O(l)?△H
=?+285.8
kJ·mol-1
5.氧化亚铜是一种重要的工业原料。已知1
g?C(s)燃烧生成一氧化碳放出9.2
kJ的热量,氧化亚铜与氧气反应的能量变化如图所示。下列有关判断正确的是
A.碳[C(s)]的燃烧热△H
=?-110.4
kJ·mol-1
B.氧化亚铜与氧气的反应为吸热反应
C.氧化亚铜与氧气反应的活化能为292?kJ·mol-1
D.?C(s)+2CuO(s)=Cu2O(s)+CO(g)?△H=?+35.6?kJ·mol-1
6.甲、乙两烧杯中溶液的体积均为20?mL,pH均为13,分别稀释至原体积的100倍后,甲、乙两烧杯中溶液pH的关系正确的是
A.甲<乙
B.甲=乙
C.甲>乙
D.不能确定
7.羟胺(NH2OH)在水溶液中的电离方程式为NH2OH+?H2O=NH3OH++OH-。常温下,向该溶液中加入NaOH固体,下列说法不正确的是
A.平衡常数K减小
B.?c(OH-)增大
C.平衡向左移动
D.?增大
8.对于xA(g)+yB(g)zC(g)+wD(g)的平衡体系,当升高温度时,体系的平均相对分子质量从26变成39,则下列说法正确的是
A.x+y>z+w,正反应是放热反应
B.?x+y>z+w,正反应是吸热反应
C.x+y<z+w,逆反应是放热反应
D.?x+y>z+w,逆反应是吸热反应
9.在恒容密闭容器中进行反应2CO2(g)?+6H2(g)C2H5OH(g)+3H2O(g)?△H。?在某压强下起始时按不同氢碳比[]投料(如图中曲线①②③),测得CO2的平衡转化率与温度的关系如图所示,下列有关说法正确的是
A.该反应的△H>0
B.氢碳比:①<②<③
C.同压时,H2的体积分数:ψa<ψb
D.平衡常数:Ka=Kb=Kc
10.氨硼烷(NH3·BH3)电池可在常温下工作,装置如图所示。该电池工作时的总反应为NH3·BH3+3H2O2=NH4BO2+4H2O。下列说法正确的是
A.正极附近溶液的pH减小
B.电池工作时,H+通过质子交换膜向负极移动
C.消耗3.1?g氨硼烷时,理论上通过内电路的电子为0.6?mol
D.负极的电极反应式为NH3·BH3+2H2O-6e-=NH4++BO2-+6H+
二、不定项选择题:本题共5小题,每小题4分,共20分。每小题有一个或两个选项符合题意,全部选对的得4分,选对但不全的得2分,有选错的得0分。
11.常温下,有关下列溶液的比较中,正确的是
①pH=2的CH3COOH溶液
②pH=2的?H2SO4溶液
③pH=12?的氨水
④pH=12的NaOH溶液
A.由水电离出的c(H+):①=②=③=④
B.将②、④溶液混合后pH=7,消耗溶液的体积:②=④
C.等体积的①、②、④溶液分别与足量铝粉反应,生成H2的量:②最大
D.向10?mL上述四种溶液中各加入90?mL水后,溶液的pH:③>④>①>②
12.根据下列实验操作所得的现象及结论不正确的是
选项
实验操作
现象及结论
A
将AlCl3溶液加热蒸干并灼烧
得到的白色固体为氧化铝
B
向体积均为25?mL的冷水和沸水中分别滴入5滴FeCl3饱和溶液
前者为黄色,后者为红褐色,说明温度升高,Fe3+的水解程度增大
C
取CH3COONa溶液于试管中并加入几滴酚酞试剂,再给试管加热
溶液颜色变深,说明CH3COONa溶液中存在水解平衡
D
室温下,用pH试纸分别测0.1?mol/L的Na2SO3溶液和0.1?mol/L的NaHSO3溶液的pH
前者?pH约为10,后者pH约为5,说明HSO3-结合H+的能力比SO32-强
13.乙醇是重要的有机化工原料,可由乙烯水化法生产,反应的化学方程式如下:C2H4(g)+H2O(g)C2H5OH(g),下图为乙烯的平衡转化率与温度(T)、压强(p)的关系[起始n(C2H4):n(H2O)=l:1]。
下列有关叙述正确的是
A.Y对应的乙醇的物质的量分数为
B.?X、Y、Z对应的反应速率:v(X)>v(Y)>v(Z)
C.X、Y、Z对应的平衡常数数值:KX
14.原子钟是一种精度极高的计时装置,镍氢电池可用于原子钟的制作,某储氢的镧镍合金、泡沫氧化镍、氢氧化钾溶液组成的镍氢电池如下图所示,反应原理为LaNi5H6+6NiO(OH)LaNi5+6NiO+6H2O。?下列有关说法错误的是
A.充电时a电极为电池的阳极
B.放电时镍氢电池负极附近碱性增强
C.充电时每转移1mole-,理论上b电极质量增加17
g
D.放电时正极反应为6NiO(OH)+6e-=6NiO+?6OH-
15.常温下,向25
mL0.12
mol/LAgNO3溶液中逐滴加入一定浓度的氨水,先出现沉淀,继续滴加沉淀溶解。该过程中加大氨水的体积V与溶液中lg[c(H+?)/c(OH-?)]的关系如图所示。已知e点对应的溶液迅速由浑浊变得澄清,且此时溶液中c(Ag+)与c(NH3)均约为2×10-3
mol/L。下列叙述错误的是
A.a点对应溶液呈酸性的原因是AgNO3水解
B.b点对应溶液中:c(Ag+)+c{[Ag(NH3)2]+}>
c(NO3-)
C.?cd段加人的氨水主要用于沉淀的生成和溶解
D.由e点可知,反应Ag++2NH3[Ag(NH3)2]+的平衡常数的数量级为105
三、非选择题:本题共5小题,共60分。
16.(10分)某同学欲用物质的量浓度为0.1000mol●L-1的盐酸测定未知物质的量浓度的氢氧化钠溶液,选择酚酞作指示剂。其操作步骤可分为以下几步:
A.移取20.00
mL待测氢氧化钠溶液注入洁净的锥形瓶中,并滴加2~3滴酚酞溶液。
B.用标准溶液润洗滴定管2~3次。
C.把盛有标准溶液的酸式滴定管固定好,调节滴定管尖嘴使之充满溶液。
D.取标准盐酸注入酸式滴定管至“0”刻度以上2~3?cm处。
E.调节液面至“0”或“0”以下刻度,记下读数。
F.把锥形瓶放在滴定管的下面,用标准盐酸溶液滴定至终点,并记下滴定管液面的刻度。
请填写下列空白:
(1)正确的操作步骤的顺序是______________(填字母)。
(2)步骤B操作的目的是______________
。
(3)配制标准盐酸时,需要用的仪器有__________(填字母)。
a.容量瓶
b.托盘天平
c.量筒
d.酸式滴定管
e.烧杯
f.胶头滴管
g.玻璃棒
(4)下列操作中可能使所测氢氧化钠溶液的浓度数侑偏低的是_____________(填字母)。
a.开始实验时酸式滴定管尖嘴部分有气泡。在滴定过程中气泡消失
b.盛NaOH溶液的锥形瓶滴定前用NaOH溶液润洗2~3次
c.酸式滴定管在装液前未用标准盐酸润洗2~3次
d.读取盐酸体积时,开始仰视读数,滴定结束时俯视读数
e.滴定过程中,锥形瓶的振荡过于激烈,使少量溶液溅出
(5)若某次滴定结束时,酸式滴定管中的液面如图所示,则读数为___________mL。若仰视,会使读数偏____________
(填“大"或“小")。
(6)再结合下表数据,计算被测氢氧化钠溶液的物质的量浓度是_______mol/L。
滴定次数
待测溶液的体积/mL
标准酸体积
滴定前的刻度/mL
滴定后的刻度/mL
第一次
10.00
2.34
20.?39
第二次
10.00
3.?20
20.20
第三次
10.00
0.60
17.?80
17.(12)某可逆反应:2A(2)B(g)+D(g)在3种不同条件下进行,B和D的起始波度均为0,反应物A的浓度随反应时间的变化情况如下表:
实验序号
时间/min
浓度/mol·L-1
温度/℃
0
10
20
30
40
50
60
1
800
1.0
0.80
0.67
0.57
0.50
0.50
0.50
2
800
1.0
0.60
0.50
0.50
0.50
0.50
0.50
3
950
1.0
0.40
0.25
0.20
0.20
0.20
0.20
(1)实验1中,在10~20?min内,以物质A表示的平均反应速率为________mol·L-1·min-1,50?min时,v(正)________(填“<”“>”或“=”)v(逆)。
(2)0~20?min内,实验2比实验1的反应速率___________(填“快”或“慢”),其原因可能是__________。
(3)实验3比实验1的反应速率___________(填“快”或“慢”),其原因是___________________。
18.?(12分)电渗析法在物质制备过程中有广泛应用。以石墨为电极,利用三室式电渗析法制备高氯酸、亚氯酸的装置如图所示。
I.利用三室式电渗析法制备高氯酸(HClO4)。M为高氯酸钠溶液。
(1)出口B处得到的产品是______________。
(2)电解过程中,阳极区附近pH_________(填“增大”“减小”或“不变”)。
(3)若C1极收集到11.2?L(标准状况)气体,则获得高氯酸__________mol。
II.利用三室式电渗析法制备亚氯酸(HClO2)。M为NaClO2溶液。
(4)ClO2-迁移方向是____________。
(5)C2极的电极反应式为______________。
(6)该过程制备的亚氯酸中含有少量氯酸杂质,其主要原因是________________(用离子方程式表示)。(提示:HClO2是弱酸,HClO3是强酸)
19.(12分)下表是几种弱酸常温下的电离平衡常数:
化学式
HCOOH
HCN
H2CO3
H2S
电离平衡常数K
1.77×10-4
4.?9×10-10
K1=4.3×10-7
K2=9.1×10-11
K1=5.6×10-8
K2=1.1×10-12
(1)HCOOH、HCN、H2CO3、H2S的酸性由强到弱的顺序为_______________。
(2)请写出H2S的电离方程式:_______________________。
(3)下列四种离子结合H+能力最强的是__________(填字母)。
A.?HS-
B.?CO32-
C.?CN-
D.?HCOO-
(4)相同温度下pH相同的NaCN和HCOOK的两溶液中c(NaCN)________(填“>”“<”或“=”,下同)c(HCOOK),[c(Na+?)-c(CN-)]_______[c(K+)-c(HCOO-)]。
(5)在25?mL?0.1?mol/LNaOH溶液中逐滴加人0.2?mol/LHCOOH溶液,溶液的pH变化曲线如下图所示,请回答下列问题:
①若使加入的HCOOH恰好把NaOH溶液完全中和,则加入HCOOH溶液的体积为________。
②B点时溶液呈________(填“酸性”“碱性”或“中性”),此时溶液中含有的溶质有___________。
③在c点所得的混合溶液中,c(Na+)、c(HCOO-)、c(H+)、c(OH-)由大到小的顺序是__________。
20.(14分)
(1)25℃时,制备亚硝酰氯所涉及的热化学方程式和平衡常数如表:
热化学方程式
平衡常数
①
2NO2(g)+NaCl(s)NaNO3(s)+NOCl(g)?
△H1=a?kJ/mol
K1
②
4NO2(g)+2NaCl(s)2NaNO3(s)?+?2NO(g)?+Cl2(g)?△H2=b?kJ/mol
K2
③
2NO(g)+Cl2(g)2NOCl(g)?
△H3=
K3
则该温度下,△H3=_________?kJ/mol;K3=__________(用K1和K2表示)。
(2)25?℃时,在体积为2?L的恒容密闭容器中通入0.08?mol?NO和0.04?molCl2发生上述反应③,若反应开始与结束时温度相同,数字压强仪显示反应过程中压强(p)随时间(t)的变化如下图实线所示,则△H3
____(填“>"、“<"或“=”)0;若其他条件相同,仅改变某一条件,测得其压强随时间的变化如下图虚线所示,则改变的条件是__________________;在5
min时,再充入0.08
molNO和0.04
molCl2,则混合气体的平均相对分子质量将___________(填“增大”、“减小”或“不变”)。
(3)如下图是甲、乙两同学描绘上述反应③的平衡常数的对数值(lgK)与温度的变化关系图,其中正确的曲线是_____________(填“甲”或“乙”),a值为_______。25℃时测得反应③在某时刻,?NO(g)、Cl2(g).?NOCl(g)的浓度分别为0.8?mol/L、0.1?mol/L、0.3?mol/L,则此时v正_______(填“<”“>”或“=”)v逆。
(4)在300℃8MPa下,将CO2和H2按物质的量之比1:3通入一密闭容器中发生CO2(g)+3H2(g)CH3OH(g)+H2O(g)的反应,达到平衡时,测得CO2的平衡转化率为50%,则该反应条件下的平衡常数为Kp=_________________(用平衡分压代替平衡浓度计算,分压=总压×物质的分数)。
河北省邯郸市联盟校2020-2021学年高二上学期期中考试
化学试题参考答案
一、选择题:本题共10小题,每小题2分,共20分。在每小题列出的四个选项中,只有一项符合题目要求。
1---5:CCCBD
6---10:CABDD
二、不定项选择题:本题共5小题,每小题4分,共20分。每小题有一个或两个选项符合题意,全部选对的得4分,选对但不全的得2分,有选错的得0分。
11.AB
12.D
13.A
14.AB
15.BD
三、非选择题:本题共5小题,共60分。
16.
(1)BDCEAF(2分)
(2)洗去附着在滴定管内壁上的水,防止其将标准溶液稀释而引起误差(2分)
(3)acefg(1分)
(4)de(1分)
(5)19.12(答案在19.?10~19.20之间均可,1分);大(1?分)
(6)0.?1710(2分)
17.?(1)0.013(2分);=(2?分)
(2)快(2分);实验2?中使用了催化剂(2分)
(3)快(2分);实验3?中温度更高(2分)
18.?(1)NaOH(2分)
(2)减小(2分)
(3)2(2分)
(4)通过膜1向阳极区迁移(2分)
(5)2H2O+2e?-=2OH-?+H2↑(2分)
(6)O2?+2HClO2=2ClO2-+2H+(2分)
19.?(1)HCOOH>?H2CO3>?H2S>?HCN(1分)
(2)H2SHS-+H+、HS-S2-+H+?(2分)
(3)B(1分)
(4)<(1分);=(1分)
(5)①12.5?mL(1分);②中性(1?分);HCOOH、?HCOONa(2分);③c(HCOO-)>c(Na+?)>c(H+?)>c(OH-?)(2?分)
20.?(1)2a-b(2分);(1分)
(2)<(1分);加入催化剂(1分);增大(1分)
(3)乙(2分);2(2?分);>?(2?分)
(4)
(MPa)-2(2分)
原创精品资源独家享有版权,侵权必究!
同课章节目录
