钠及其化合物复习
图片预览




文档简介
(共23张PPT)
基本知识:
1.Na的化学性质:
Na与非金属反应:Na+O2=
常温:Na2O(白色)
点燃:Na2O2(淡黄色)
Na与水反应:现象及原因;
会分析氧化还原实质
Na与酸反应:比与水反应还激烈;当Na过量时,先与酸反应,再与水反应;
Na与盐溶液反应:
a与NaCl溶液反应
b 与NH4Cl溶液反应
C 与CuSO4溶液反应
注意:
Na在空气中的变化情况;
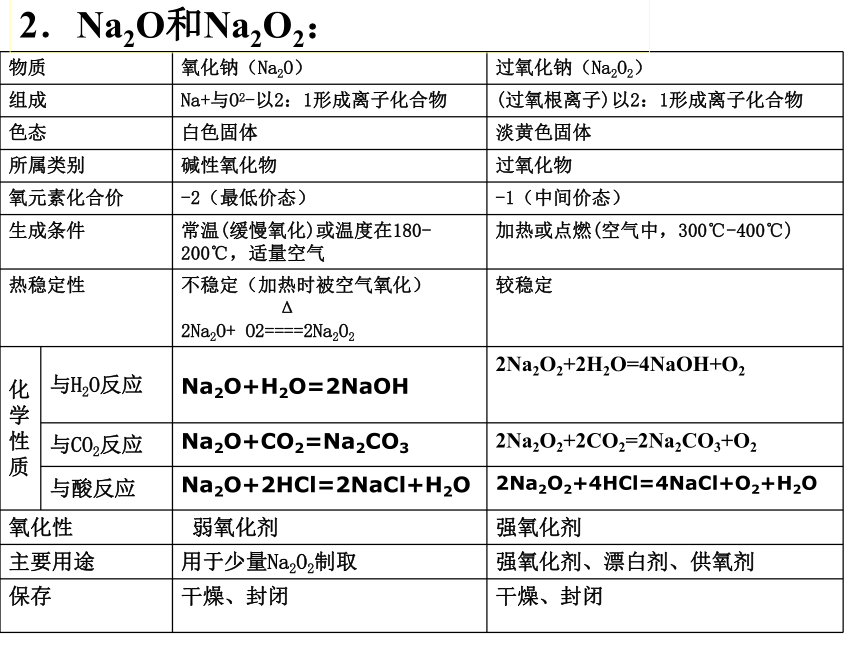
物质 氧化钠(Na2O) 过氧化钠(Na2O2)
组成 Na+与O2-以2:1形成离子化合物 (过氧根离子)以2:1形成离子化合物
色态 白色固体 淡黄色固体
所属类别 碱性氧化物 过氧化物
氧元素化合价 -2(最低价态) -1(中间价态)
生成条件 常温(缓慢氧化)或温度在180-200℃,适量空气 加热或点燃(空气中,300℃-400℃)
热稳定性 不稳定(加热时被空气氧化)
Δ
2Na2O+ O2====2Na2O2 较稳定
化
学
性质 与H2O反应 Na2O+H2O=2NaOH 2Na2O2+2H2O=4NaOH+O2
与CO2反应 Na2O+CO2=Na2CO3 2Na2O2+2CO2=2Na2CO3+O2
与酸反应 Na2O+2HCl=2NaCl+H2O 2Na2O2+4HCl=4NaCl+O2+H2O
氧化性 弱氧化剂 强氧化剂
主要用途 用于少量Na2O2制取 强氧化剂、漂白剂、供氧剂
保存 干燥、封闭 干燥、封闭
2.Na2O和Na2O2:
3.Na2CO3和NaHCO3
名称 Na2CO3 NaHCO3
俗名 纯碱、苏打 小苏打
色态 白色粉末 细小白色晶体
水溶性 易溶于水 溶于水
与碱反应 与NaOH不反应,但与Ca(OH)2
反应出沉淀;
Na2CO3+Ca(OH)2=CaCO3↓
+2NaOH HCO3—+OH—=CO32—+H2O;
Ca2++OH—+HCO3—=CaCO3↓+H2O;(碱足量)Ca2++2OH+2HCO3—=CaCO3↓+CO32—
+H2O;(碱不足量)
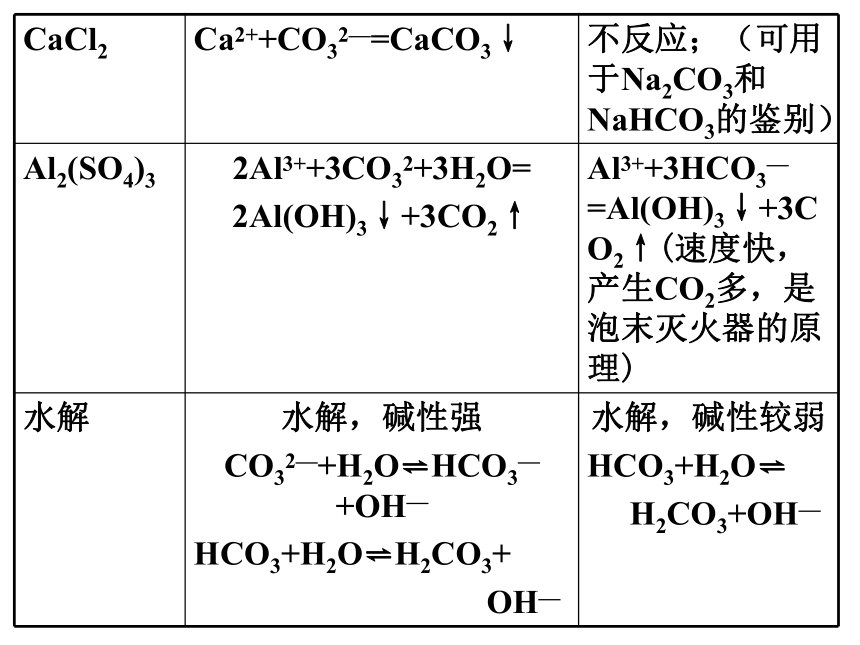
CaCl2 Ca2++CO32—=CaCO3↓ 不反应;(可用于Na2CO3和NaHCO3的鉴别)
Al2(SO4)3 2Al3++3CO32+3H2O=
2Al(OH)3↓+3CO2↑ Al3++3HCO3—=Al(OH)3↓+3CO2↑(速度快,产生CO2多,是泡末灭火器的原理)
水解 水解,碱性强
CO32—+H2O HCO3—+OH—
HCO3+H2O H2CO3+
OH— 水解,碱性较弱
HCO3+H2O
H2CO3+OH—
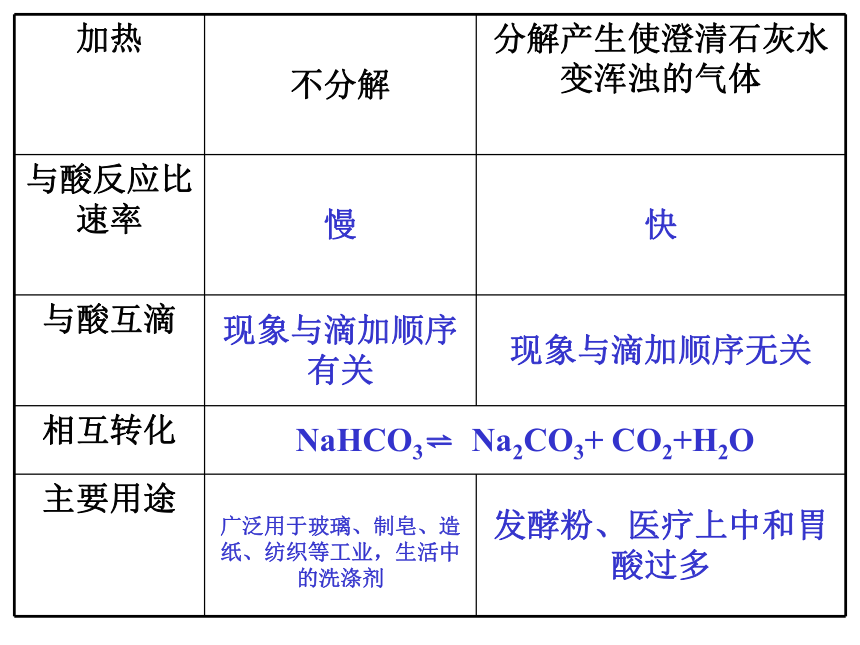
加热 不分解 分解产生使澄清石灰水变浑浊的气体
与酸反应比速率 慢 快
与酸互滴 现象与滴加顺序有关 现象与滴加顺序无关
相互转化 NaHCO3 Na2CO3+ CO2+H2O
主要用途 广泛用于玻璃、制皂、造纸、纺织等工业,生活中的洗涤剂 发酵粉、医疗上中和胃酸过多
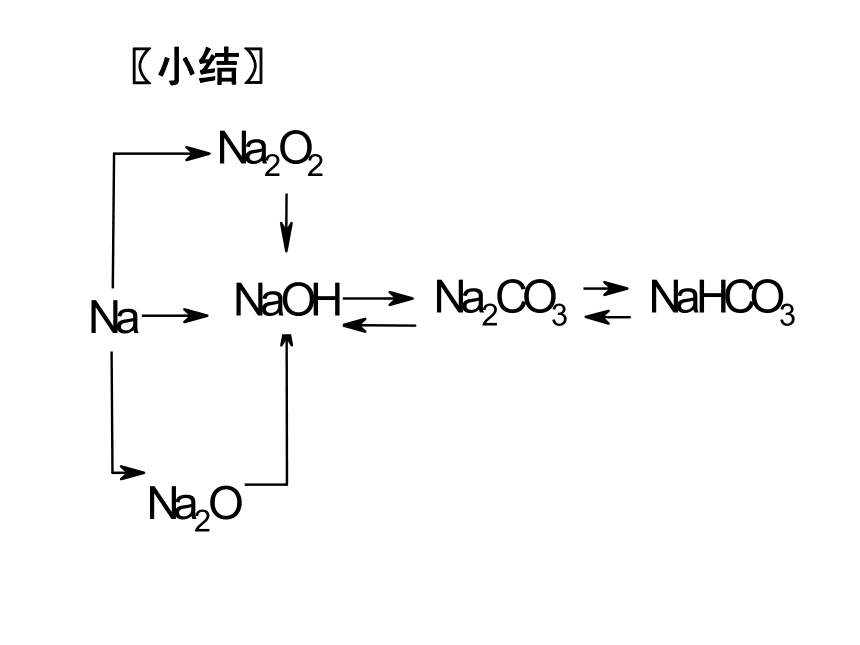
〖小结〗
难点点拨
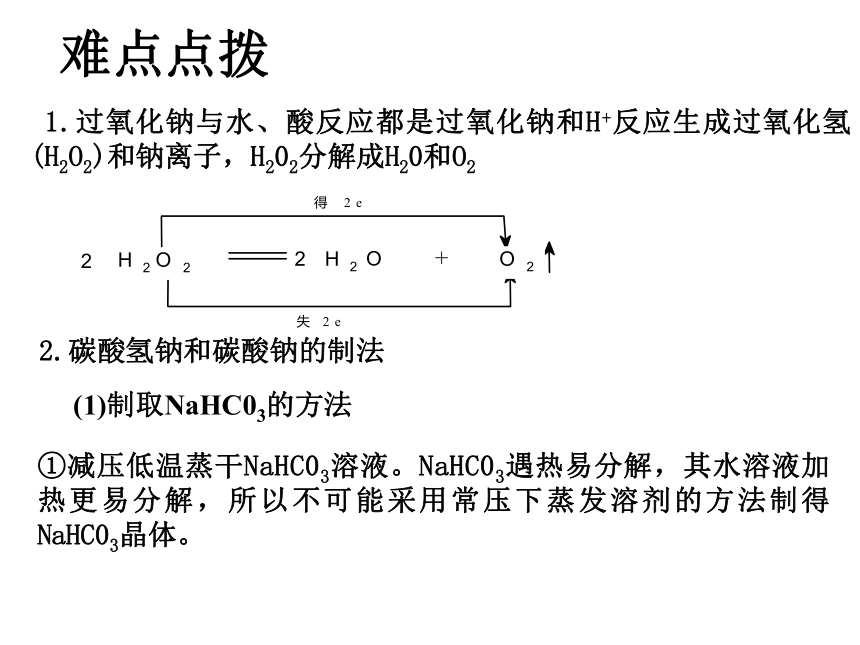
1.过氧化钠与水、酸反应都是过氧化钠和H+反应生成过氧化氢(H2O2)和钠离子,H202分解成H20和O2
2.碳酸氢钠和碳酸钠的制法
(1)制取NaHC03的方法
①减压低温蒸干NaHC03溶液。NaHC03遇热易分解,其水溶液加热更易分解,所以不可能采用常压下蒸发溶剂的方法制得NaHC03晶体。
②往饱和Na2CO3 溶液中通入C02,过滤得到晶体。
Na2C03+C02+H20=2NaHC03
(2)制取Na2C03的方法
往饱和食盐水中依次通人足量的NH3、C02(氨碱法),利用NaHC03的溶解性小于NH4HC03的溶解性原理,使NaHC03从溶液中析出
(依次通人C02、NH3至饱和行吗 ):
NH3+H20+C02=NH4HC03
NH4HCO3 +NaCl=NaHC03↓+NH4Cl
2NaHC03?= Na2CO3 +C02↑+H20
(制纯碱的工业方法)
高考考点精析
考点一 金属钠的化学性质
考点二 Na2O2的性质及有关计算
考点三 Na2CO3和NaHCO3
基础题:
取一小块金属钠,放在燃烧匙里加热,下列实验现象描述正确的是( )
①金属先熔化 ②在空气中燃烧,放出黄色火花 ③燃烧后得白色固体 ④燃烧时火焰为黄色 ⑤燃烧后生成浅黄色固体物质
A.②⑤ B.①②③
C.①④⑤ D.④⑤
C
为除去括号内的杂质,所选用的试剂或方法不正确的是( )
A.Na2CO3溶液(NaHCO3),选用适量NaOH溶液
B.NaHCO3溶液(Na2CO3),通入过量的CO2气体
C.Na2O2粉末(Na2O),将混合物在氧气中加热
D.Na2CO3溶液(Na2SO4),加入适量的Ba(OH)2溶液,过滤。
D
下列对于过氧化钠的叙述中,正确的是( )
A.过氧化钠能与酸反应生成盐和水,所以过氧化钠是碱性氧化物
B.将过量Na2O2投入紫色石蕊试液中,溶液变蓝
C.过氧化钠与水反应时,过氧化钠是氧化剂,水是还原剂
D.过氧化钠与二氧化碳反应时,过氧化钠既是氧化剂又是还原剂
D
苏打和小苏打有着广泛的应用。试从反应物用量角度说明在下列用途中选A(苏打)还是B(小苏打),并说明原因。
(1)做面条时防止面粉较长时间储存变酸味,常加入适量的面碱,选用_________,因为 ________________________________________________
(2)作为泡沫灭火器的药品,选用_________ ,因为
________________________________________________ ________________________________________________
中和等量的H+,Na2CO3比NaHCO3的用量少(质量比53∶84) 。
A
B
在酸用量一定时,用NaHCO3比Na2CO3产生的CO2多,且用量少(质量比为84∶106),生成 CO2的速率快 。
(3)用于洗涤餐具及实验室的玻璃仪器等,选用_________ ,因为________________________________________________ 。
(4)治疗胃酸过多时,选用_________ ,因为 ____________________________________________________________________。
要适量中和部分胃酸,若用苏打,碱性太强,腐蚀性强,不利于人体的健康
A
Na2CO3碱性强,洗涤效果好
B
有两个分别装有Na2CO3和NaHCO3固体的试剂瓶,因标签失落而无法区分。有4位同学为鉴别它们,分别设计了下列四种不同的方法,其中可行的是( )
A.分别取样配成溶液,再加入澄清石灰水,观察是否有沉淀生成
B.分别取样后,加入相同浓度和相同体积的稀盐酸,观察反应的快慢
C.分别取样加热,再检验是否有使澄清石灰水变浑浊的气体产生
D.分别取样配成溶液,在火焰上灼烧,观察火焰的颜色
C
思考题:
在一定条件下,将钠与氧气反应的生成物2.8 g溶于水,所得溶液恰好能被80 mL浓度为1.0 mol/L的HCl溶液中和,则生成物的成分是( )
A.Na2O B.Na2O2
C.Na2O和Na2O2 D.Na2O2和NaO2
C
D
25℃时,浓度均为0.2 mol/L的NaHCO3和Na2CO3溶液中,下列判断不正确的是( )
A.均存在电离平衡和水解平衡
B.存在的粒子种类相同
C.c(OH-)前者大于后者
D.分别加入NaOH固体,恢复到原温度,c(CO32-)均增大
C
提高题:
在一定温度下,向饱和的烧碱溶液中放入一定量的过氧化钠,充分反应后恢复到原温度,下列说法正确的是( )
A.溶液中Na+浓度增大,有O2放出
B.溶液的OH-浓度不变,有H2放出
C.溶液中Na+数目减小,有O2放出
D.溶液的OH-浓度增大,有O2放出
C
在呼吸面具和潜水艇中可用过氧化钠作为供氧剂。请选用适当的化学试剂和实验用品,用如图中的实验装置进行实验,证明过氧化钠可作供氧剂。
(1)A是制取CO2的装置。写出A中发生反应的化学方程式:
(2)填写表中空格:
仪器 加入试剂 加入该试剂的目的
B 饱和NaHCO3溶液
C
D
(3)写出过氧化钠与二氧化碳反应的化学方程式:_______。
(4)试管F中收集满气体后,下一步实验操作是:________。
解析:本实验的目的是证明Na2O2可作供氧剂,实际是证明Na2O2可以与人呼出的气体反应生成O2,那么就需要完成以下几个实验操作:
①制取CO2,②让CO2、H2O(模拟人呼出的气体)与Na2O2反应,③检验生成的气体是否是O2。制取CO2的反应原理为CaCO3+2HCl=CaCl2+CO2↑+H2O;进行第②步操作时要注意除去气体中混有的HCl气体,保证与Na2O2反应的只有CO2和H2O,一般用饱和NaHCO3溶液;验证生成的气体为O2的方法,一般考虑用带火星的木条,这就要求收集到的尽量是较纯净的O2,不能混有较多的CO2,否则木条不易复燃,所以收集前要吸收未反应的CO2,一般选用NaOH溶液。
答案:(1)CaCO3+2HCl=CaCl2+CO2↑+H2O
(2)
仪器 加入试剂 加入该试剂的目的
B 除去CO2气体中混入的HCl
C 过氧化钠 与CO2和水反应,产生O2
D NaOH溶液 吸收未反应的CO2气体
(3)2Na2O2+2CO2=2Na2CO3+O2
(4)把E中的导管移出水面,关闭分液漏斗活塞,用拇指堵住试管口,取出试管,立即把带火星的木条伸入试管内,若木条复燃,则证明试管中收集的气体是氧气
基本知识:
1.Na的化学性质:
Na与非金属反应:Na+O2=
常温:Na2O(白色)
点燃:Na2O2(淡黄色)
Na与水反应:现象及原因;
会分析氧化还原实质
Na与酸反应:比与水反应还激烈;当Na过量时,先与酸反应,再与水反应;
Na与盐溶液反应:
a与NaCl溶液反应
b 与NH4Cl溶液反应
C 与CuSO4溶液反应
注意:
Na在空气中的变化情况;
物质 氧化钠(Na2O) 过氧化钠(Na2O2)
组成 Na+与O2-以2:1形成离子化合物 (过氧根离子)以2:1形成离子化合物
色态 白色固体 淡黄色固体
所属类别 碱性氧化物 过氧化物
氧元素化合价 -2(最低价态) -1(中间价态)
生成条件 常温(缓慢氧化)或温度在180-200℃,适量空气 加热或点燃(空气中,300℃-400℃)
热稳定性 不稳定(加热时被空气氧化)
Δ
2Na2O+ O2====2Na2O2 较稳定
化
学
性质 与H2O反应 Na2O+H2O=2NaOH 2Na2O2+2H2O=4NaOH+O2
与CO2反应 Na2O+CO2=Na2CO3 2Na2O2+2CO2=2Na2CO3+O2
与酸反应 Na2O+2HCl=2NaCl+H2O 2Na2O2+4HCl=4NaCl+O2+H2O
氧化性 弱氧化剂 强氧化剂
主要用途 用于少量Na2O2制取 强氧化剂、漂白剂、供氧剂
保存 干燥、封闭 干燥、封闭
2.Na2O和Na2O2:
3.Na2CO3和NaHCO3
名称 Na2CO3 NaHCO3
俗名 纯碱、苏打 小苏打
色态 白色粉末 细小白色晶体
水溶性 易溶于水 溶于水
与碱反应 与NaOH不反应,但与Ca(OH)2
反应出沉淀;
Na2CO3+Ca(OH)2=CaCO3↓
+2NaOH HCO3—+OH—=CO32—+H2O;
Ca2++OH—+HCO3—=CaCO3↓+H2O;(碱足量)Ca2++2OH+2HCO3—=CaCO3↓+CO32—
+H2O;(碱不足量)
CaCl2 Ca2++CO32—=CaCO3↓ 不反应;(可用于Na2CO3和NaHCO3的鉴别)
Al2(SO4)3 2Al3++3CO32+3H2O=
2Al(OH)3↓+3CO2↑ Al3++3HCO3—=Al(OH)3↓+3CO2↑(速度快,产生CO2多,是泡末灭火器的原理)
水解 水解,碱性强
CO32—+H2O HCO3—+OH—
HCO3+H2O H2CO3+
OH— 水解,碱性较弱
HCO3+H2O
H2CO3+OH—
加热 不分解 分解产生使澄清石灰水变浑浊的气体
与酸反应比速率 慢 快
与酸互滴 现象与滴加顺序有关 现象与滴加顺序无关
相互转化 NaHCO3 Na2CO3+ CO2+H2O
主要用途 广泛用于玻璃、制皂、造纸、纺织等工业,生活中的洗涤剂 发酵粉、医疗上中和胃酸过多
〖小结〗
难点点拨
1.过氧化钠与水、酸反应都是过氧化钠和H+反应生成过氧化氢(H2O2)和钠离子,H202分解成H20和O2
2.碳酸氢钠和碳酸钠的制法
(1)制取NaHC03的方法
①减压低温蒸干NaHC03溶液。NaHC03遇热易分解,其水溶液加热更易分解,所以不可能采用常压下蒸发溶剂的方法制得NaHC03晶体。
②往饱和Na2CO3 溶液中通入C02,过滤得到晶体。
Na2C03+C02+H20=2NaHC03
(2)制取Na2C03的方法
往饱和食盐水中依次通人足量的NH3、C02(氨碱法),利用NaHC03的溶解性小于NH4HC03的溶解性原理,使NaHC03从溶液中析出
(依次通人C02、NH3至饱和行吗 ):
NH3+H20+C02=NH4HC03
NH4HCO3 +NaCl=NaHC03↓+NH4Cl
2NaHC03?= Na2CO3 +C02↑+H20
(制纯碱的工业方法)
高考考点精析
考点一 金属钠的化学性质
考点二 Na2O2的性质及有关计算
考点三 Na2CO3和NaHCO3
基础题:
取一小块金属钠,放在燃烧匙里加热,下列实验现象描述正确的是( )
①金属先熔化 ②在空气中燃烧,放出黄色火花 ③燃烧后得白色固体 ④燃烧时火焰为黄色 ⑤燃烧后生成浅黄色固体物质
A.②⑤ B.①②③
C.①④⑤ D.④⑤
C
为除去括号内的杂质,所选用的试剂或方法不正确的是( )
A.Na2CO3溶液(NaHCO3),选用适量NaOH溶液
B.NaHCO3溶液(Na2CO3),通入过量的CO2气体
C.Na2O2粉末(Na2O),将混合物在氧气中加热
D.Na2CO3溶液(Na2SO4),加入适量的Ba(OH)2溶液,过滤。
D
下列对于过氧化钠的叙述中,正确的是( )
A.过氧化钠能与酸反应生成盐和水,所以过氧化钠是碱性氧化物
B.将过量Na2O2投入紫色石蕊试液中,溶液变蓝
C.过氧化钠与水反应时,过氧化钠是氧化剂,水是还原剂
D.过氧化钠与二氧化碳反应时,过氧化钠既是氧化剂又是还原剂
D
苏打和小苏打有着广泛的应用。试从反应物用量角度说明在下列用途中选A(苏打)还是B(小苏打),并说明原因。
(1)做面条时防止面粉较长时间储存变酸味,常加入适量的面碱,选用_________,因为 ________________________________________________
(2)作为泡沫灭火器的药品,选用_________ ,因为
________________________________________________ ________________________________________________
中和等量的H+,Na2CO3比NaHCO3的用量少(质量比53∶84) 。
A
B
在酸用量一定时,用NaHCO3比Na2CO3产生的CO2多,且用量少(质量比为84∶106),生成 CO2的速率快 。
(3)用于洗涤餐具及实验室的玻璃仪器等,选用_________ ,因为________________________________________________ 。
(4)治疗胃酸过多时,选用_________ ,因为 ____________________________________________________________________。
要适量中和部分胃酸,若用苏打,碱性太强,腐蚀性强,不利于人体的健康
A
Na2CO3碱性强,洗涤效果好
B
有两个分别装有Na2CO3和NaHCO3固体的试剂瓶,因标签失落而无法区分。有4位同学为鉴别它们,分别设计了下列四种不同的方法,其中可行的是( )
A.分别取样配成溶液,再加入澄清石灰水,观察是否有沉淀生成
B.分别取样后,加入相同浓度和相同体积的稀盐酸,观察反应的快慢
C.分别取样加热,再检验是否有使澄清石灰水变浑浊的气体产生
D.分别取样配成溶液,在火焰上灼烧,观察火焰的颜色
C
思考题:
在一定条件下,将钠与氧气反应的生成物2.8 g溶于水,所得溶液恰好能被80 mL浓度为1.0 mol/L的HCl溶液中和,则生成物的成分是( )
A.Na2O B.Na2O2
C.Na2O和Na2O2 D.Na2O2和NaO2
C
D
25℃时,浓度均为0.2 mol/L的NaHCO3和Na2CO3溶液中,下列判断不正确的是( )
A.均存在电离平衡和水解平衡
B.存在的粒子种类相同
C.c(OH-)前者大于后者
D.分别加入NaOH固体,恢复到原温度,c(CO32-)均增大
C
提高题:
在一定温度下,向饱和的烧碱溶液中放入一定量的过氧化钠,充分反应后恢复到原温度,下列说法正确的是( )
A.溶液中Na+浓度增大,有O2放出
B.溶液的OH-浓度不变,有H2放出
C.溶液中Na+数目减小,有O2放出
D.溶液的OH-浓度增大,有O2放出
C
在呼吸面具和潜水艇中可用过氧化钠作为供氧剂。请选用适当的化学试剂和实验用品,用如图中的实验装置进行实验,证明过氧化钠可作供氧剂。
(1)A是制取CO2的装置。写出A中发生反应的化学方程式:
(2)填写表中空格:
仪器 加入试剂 加入该试剂的目的
B 饱和NaHCO3溶液
C
D
(3)写出过氧化钠与二氧化碳反应的化学方程式:_______。
(4)试管F中收集满气体后,下一步实验操作是:________。
解析:本实验的目的是证明Na2O2可作供氧剂,实际是证明Na2O2可以与人呼出的气体反应生成O2,那么就需要完成以下几个实验操作:
①制取CO2,②让CO2、H2O(模拟人呼出的气体)与Na2O2反应,③检验生成的气体是否是O2。制取CO2的反应原理为CaCO3+2HCl=CaCl2+CO2↑+H2O;进行第②步操作时要注意除去气体中混有的HCl气体,保证与Na2O2反应的只有CO2和H2O,一般用饱和NaHCO3溶液;验证生成的气体为O2的方法,一般考虑用带火星的木条,这就要求收集到的尽量是较纯净的O2,不能混有较多的CO2,否则木条不易复燃,所以收集前要吸收未反应的CO2,一般选用NaOH溶液。
答案:(1)CaCO3+2HCl=CaCl2+CO2↑+H2O
(2)
仪器 加入试剂 加入该试剂的目的
B 除去CO2气体中混入的HCl
C 过氧化钠 与CO2和水反应,产生O2
D NaOH溶液 吸收未反应的CO2气体
(3)2Na2O2+2CO2=2Na2CO3+O2
(4)把E中的导管移出水面,关闭分液漏斗活塞,用拇指堵住试管口,取出试管,立即把带火星的木条伸入试管内,若木条复燃,则证明试管中收集的气体是氧气
