人教版初中化学九上5.1 质量守恒定律 课件(ppt共18张)
文档属性
| 名称 | 人教版初中化学九上5.1 质量守恒定律 课件(ppt共18张) |  | |
| 格式 | ppt | ||
| 文件大小 | 737.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-11-09 08:28:05 | ||
图片预览




文档简介
课 题 1
质量守恒定律
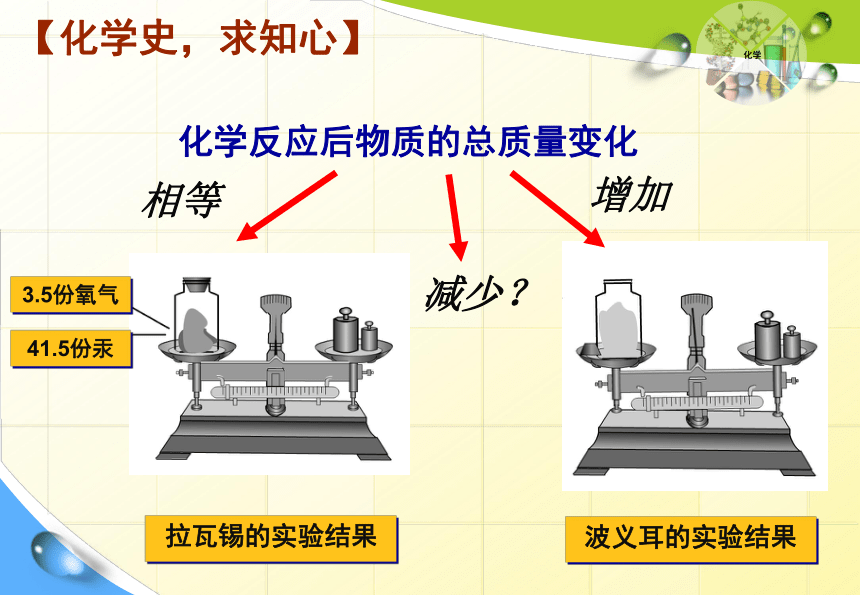
3.5份氧气
41.5份汞
化学反应后物质的总质量变化
减少?
相等
增加
波义耳的实验结果
拉瓦锡的实验结果
【化学史,求知心】
提供药品:
白磷、稀盐酸、碳酸钠粉末 、硫酸铜溶液、铁钉
实验原理:
1.铁+硫酸铜→铜+硫酸亚铁
2. 碳酸钠+盐酸→二氧化碳+氯化钠+水
3.白磷+氧气→五氧化二磷
4. ……
【寻足迹,探索旅】
小组合作设计方案,动手操作
探究化学反应前后物质总质量关系
1.提出问题:
探究化学反应前后物质总质量关系如何?
2.提出猜想:____________________________
3.设计实验:根据所提供药品确定好实验方案,小组讨论出
步骤并进行实验,记录实验现象及结论。
提供仪器和用品:天平、锥形瓶、烧杯、试管、气球、镊子、
药匙、滴管、胶塞、玻璃片、酒精灯等
方案名称
实验仪器
实验步骤
实验现象
实验结论
4.得出结论:________________________________
氧气
五氧化二磷
锥形瓶(及细沙)
单孔橡皮塞
(连气球和玻璃管)
氮气、稀有气体等
锥形瓶(及细沙)
单孔橡皮塞
(连气球和玻璃管)
氮气、稀有气体等
=
红磷
剩余的红磷
=
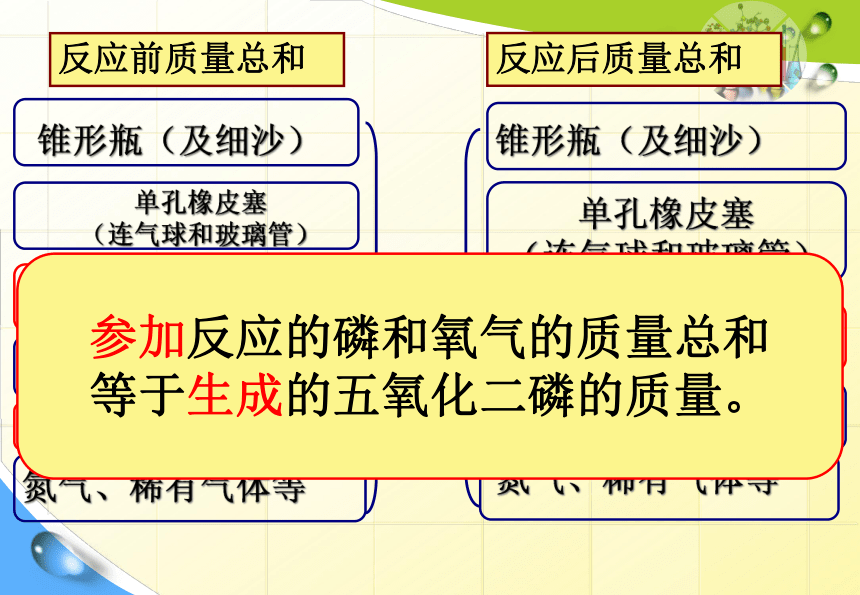
参加反应的红磷
反应前质量总和
反应后质量总和
剩余的红磷
=
参加反应的磷和氧气的质量总和
等于生成的五氧化二磷的质量。
参加化学反应的各物质的质量总和,等于反应后生成的各物质的质量总和。
质量守恒定律
【自由探索,合作归纳】
测定盐酸与碳酸钠反应前后质量的变化
反应原理
碳酸钠 + 盐酸 → 氯化钠 + 水 + 二氧化碳
反应后的质量变化——减少
实验结论
【揭示真相】
实验现象
碳酸钠固体逐渐减少,产生大量气泡。
实验反思
反应后烧杯里的物质的质量为什么减少?
若选择有气体参加或有气体生成的化学反应来证明质量守恒定律,则反应一定要在密闭容器内进行。
【揭开秘密】
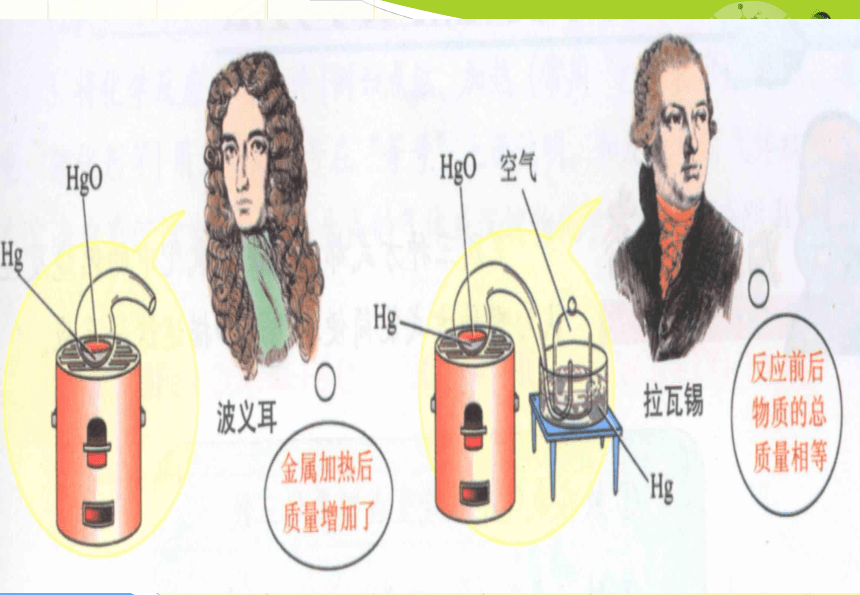
波义耳
根据质量守恒定律,参加反应的金属的质量和氧气的质量等于生成物的质量
所以生成物的质量大于金属的质量
氧化汞 → 汞 + 氧气
加热
【追根求源】
------质量守恒定律本质
HgO Hg O2
不 变;
原子质量
原子数目
原子种类
(微观)
物质质量
元素质量
元素种类
(宏观)
不 变;
【自我评价】
完成学案,汇报交流
【自我评价】
1、化学反应前后必定发生改变的是( )
A.分子种类 B.原子种类 C.原子质量 D.元素种类
2、下列说法符合质量守恒定律的是( )
A.10克冰融化成10克水
B.1L氢气和1L氧气反应生成2L水
C.只有固体、液体反应遵守质量守恒定律
D.铁在氧气中燃烧,生成四氧化三铁的质量等于参加反应的铁丝和氧气的质量之和
A
D
3、将a克高锰酸钾加热一段时间后,剩余固体质量为b克,则生成氧气的质量为多少?
4、32 g氧气和4 g氢气恰好完全反应,生成36 g水;则 32 g氧气和6 g氢气充分反应后生成的水是 ? g。
【自我评价】
根据质量守恒定律,反应前物质的总质量=反应后物质的总质量,所以氧气质量为(a-b)克
5、碳酸受热分解生成二氧化碳和水,由此可知,碳酸由什么元素组成?
6、 假如碳酸分解后生成的二氧化碳和水分子的个数比是1:1,则碳酸分子中碳、氢、氧的原子个数比为多少?
【自我评价】
7.根据质量守恒定律2XY2 +Y2===2Z,则Z的化学式是( )
A.XY B.XY2 C.X2Y D.XY3
D
8.A g的氯酸钾和B g的二氧化锰共热制取O2,完全
反应后剩余C g固体。则
⑴C-B A (填“﹤”、“﹥”或“=”);
⑵生成氧气 g;
⑶Ag氯酸钾中氧元素质量是 g。
﹤
A+B-C
A+B-C
【延伸思考】
拉瓦锡将45.0份质量的氧化汞加热分解,恰好得到41.5份质量的汞和3.5份质量的氧气。
问题:如果将45g氧化汞加热分解,能得到40g的汞和5g的氧气吗?为什么?
汞+氧气 氧化汞
加热
今天你有哪些收获?
你还有什么问题吗?
谢谢
质量守恒定律
3.5份氧气
41.5份汞
化学反应后物质的总质量变化
减少?
相等
增加
波义耳的实验结果
拉瓦锡的实验结果
【化学史,求知心】
提供药品:
白磷、稀盐酸、碳酸钠粉末 、硫酸铜溶液、铁钉
实验原理:
1.铁+硫酸铜→铜+硫酸亚铁
2. 碳酸钠+盐酸→二氧化碳+氯化钠+水
3.白磷+氧气→五氧化二磷
4. ……
【寻足迹,探索旅】
小组合作设计方案,动手操作
探究化学反应前后物质总质量关系
1.提出问题:
探究化学反应前后物质总质量关系如何?
2.提出猜想:____________________________
3.设计实验:根据所提供药品确定好实验方案,小组讨论出
步骤并进行实验,记录实验现象及结论。
提供仪器和用品:天平、锥形瓶、烧杯、试管、气球、镊子、
药匙、滴管、胶塞、玻璃片、酒精灯等
方案名称
实验仪器
实验步骤
实验现象
实验结论
4.得出结论:________________________________
氧气
五氧化二磷
锥形瓶(及细沙)
单孔橡皮塞
(连气球和玻璃管)
氮气、稀有气体等
锥形瓶(及细沙)
单孔橡皮塞
(连气球和玻璃管)
氮气、稀有气体等
=
红磷
剩余的红磷
=
参加反应的红磷
反应前质量总和
反应后质量总和
剩余的红磷
=
参加反应的磷和氧气的质量总和
等于生成的五氧化二磷的质量。
参加化学反应的各物质的质量总和,等于反应后生成的各物质的质量总和。
质量守恒定律
【自由探索,合作归纳】
测定盐酸与碳酸钠反应前后质量的变化
反应原理
碳酸钠 + 盐酸 → 氯化钠 + 水 + 二氧化碳
反应后的质量变化——减少
实验结论
【揭示真相】
实验现象
碳酸钠固体逐渐减少,产生大量气泡。
实验反思
反应后烧杯里的物质的质量为什么减少?
若选择有气体参加或有气体生成的化学反应来证明质量守恒定律,则反应一定要在密闭容器内进行。
【揭开秘密】
波义耳
根据质量守恒定律,参加反应的金属的质量和氧气的质量等于生成物的质量
所以生成物的质量大于金属的质量
氧化汞 → 汞 + 氧气
加热
【追根求源】
------质量守恒定律本质
HgO Hg O2
不 变;
原子质量
原子数目
原子种类
(微观)
物质质量
元素质量
元素种类
(宏观)
不 变;
【自我评价】
完成学案,汇报交流
【自我评价】
1、化学反应前后必定发生改变的是( )
A.分子种类 B.原子种类 C.原子质量 D.元素种类
2、下列说法符合质量守恒定律的是( )
A.10克冰融化成10克水
B.1L氢气和1L氧气反应生成2L水
C.只有固体、液体反应遵守质量守恒定律
D.铁在氧气中燃烧,生成四氧化三铁的质量等于参加反应的铁丝和氧气的质量之和
A
D
3、将a克高锰酸钾加热一段时间后,剩余固体质量为b克,则生成氧气的质量为多少?
4、32 g氧气和4 g氢气恰好完全反应,生成36 g水;则 32 g氧气和6 g氢气充分反应后生成的水是 ? g。
【自我评价】
根据质量守恒定律,反应前物质的总质量=反应后物质的总质量,所以氧气质量为(a-b)克
5、碳酸受热分解生成二氧化碳和水,由此可知,碳酸由什么元素组成?
6、 假如碳酸分解后生成的二氧化碳和水分子的个数比是1:1,则碳酸分子中碳、氢、氧的原子个数比为多少?
【自我评价】
7.根据质量守恒定律2XY2 +Y2===2Z,则Z的化学式是( )
A.XY B.XY2 C.X2Y D.XY3
D
8.A g的氯酸钾和B g的二氧化锰共热制取O2,完全
反应后剩余C g固体。则
⑴C-B A (填“﹤”、“﹥”或“=”);
⑵生成氧气 g;
⑶Ag氯酸钾中氧元素质量是 g。
﹤
A+B-C
A+B-C
【延伸思考】
拉瓦锡将45.0份质量的氧化汞加热分解,恰好得到41.5份质量的汞和3.5份质量的氧气。
问题:如果将45g氧化汞加热分解,能得到40g的汞和5g的氧气吗?为什么?
汞+氧气 氧化汞
加热
今天你有哪些收获?
你还有什么问题吗?
谢谢
同课章节目录
- 绪言 化学使世界变得更加绚丽多彩
- 第一单元 走进化学世界
- 课题1 物质的变化和性质
- 课题2 化学是一门以实验为基础的科学
- 课题3 走进化学实验室
- 第二单元 我们周围的空气
- 课题1 空气
- 课题2 氧气
- 课题3 制取氧气
- 实验活动1 氧气的实验室制取与性质
- 第三单元 物质构成的奥秘
- 课题1 分子和原子
- 课题2 原子的结构
- 课题3 元素
- 第四单元 自然界的水
- 课题1 爱护水资源
- 课题2 水的净化
- 课题3 水的组成
- 课题4 化学式与化合价
- 第五单元 化学方程式
- 课题 1 质量守恒定律
- 课题 2 如何正确书写化学方程式
- 课题 3 利用化学方程式的简单计算
- 第六单元 碳和碳的氧化物
- 课题1 金刚石、石墨和C60
- 课题2 二氧化碳制取的研究
- 课题3 二氧化碳和一氧化碳
- 实验活动2 二氧化碳的实验室制取与性质
- 第七单元 燃料及其利用
- 课题 1 燃烧和灭火
- 课题2 燃料的合理利用与开发
- 实验活动 3 燃烧的条件
