人教版九年级化学上册第五单元 化学方程式 课题3 根据化学方程式的简单计算(ppt共16张)
文档属性
| 名称 | 人教版九年级化学上册第五单元 化学方程式 课题3 根据化学方程式的简单计算(ppt共16张) |  | |
| 格式 | zip | ||
| 文件大小 | 514.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-11-09 08:29:29 | ||
图片预览





文档简介
(共16张PPT)
课
题
3
利用化学方程式的简单计算
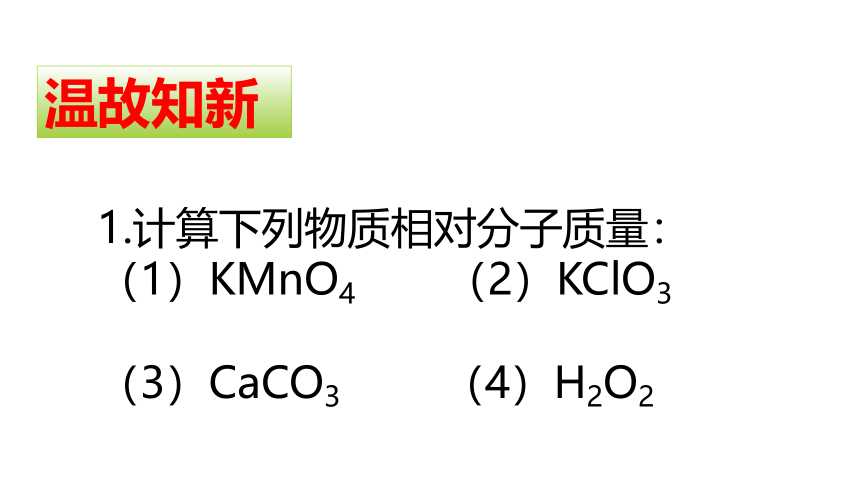
1.计算下列物质相对分子质量:
(1)KMnO4
(2)KClO3
(3)CaCO3
(4)H2O2
温故知新
2.写出氢气在氧气中燃烧的化学方程式,并标出各物质的质量比。
2×2
:
32
:
2
×18
2H2
+
O2
======
2
H2O
4
:
32
:
36
若:
4克
:
(
)克
:
(
)
克
点燃
若:(
)克
:
(
)克
:
36
克
若:(
)克
:
(
)克
:
18
克
科研卫生
农业
生产
工业
生产
药物的剂量能乱吃吗?
目前厂里只有含60吨氧化铁的铁矿石,能生产出56吨铁吗?需不需要进原料?
到底喷洒多少农药和化肥才能达到效果又不污染环境呢?
实验室
制取4.8克氧气需要多少克氯酸钾?
2KMnO4
K2MnO4
+
MnO2
+
O2↑
解:设加热分解6.32g高锰酸钾可以得到氧气的质量为x。
△
316
32
6.32g
x
316
6.32g
32
x
=
=
0.64g
答:加热分解6.32g高锰酸钾可以得到0.64g氧气。
【解题步骤】
⑴设未知量
⑵写化学方程式
⑶算相关物质的质量比
⑷标出已知量、未知量
⑸列比例式
⑹解出未知数
⑺写出简明答语
【书写格式】
x
例1.加热分解6.32
g高锰酸钾,可以得到多少克氧气?
例2.工业上高温煅烧石灰石(CaCO3)可制得生石灰(CaO)和二氧化碳,如果要制取11.2
t氧化钙,需要碳酸钙多少吨?
解:设需要碳酸钙的质量为x。
CaCO3
CaO+CO2↑
100
56
x
11.2t
=
解得x
=
20t
答:需要碳酸钙20t。
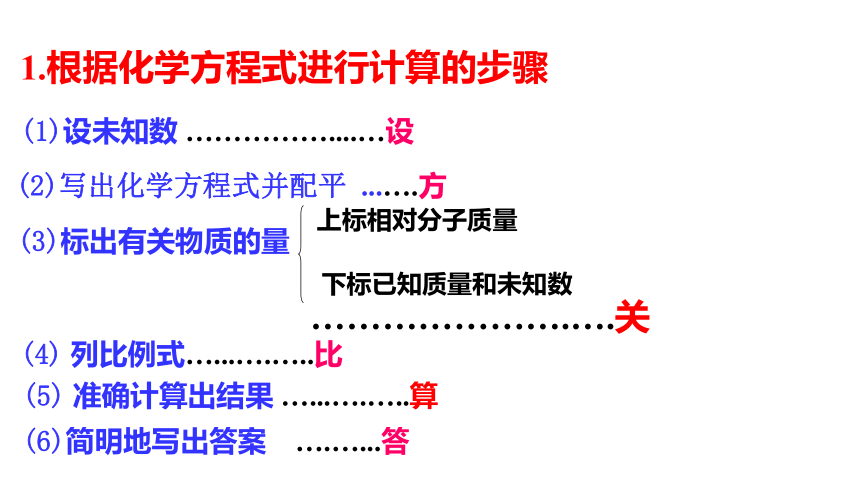
1.根据化学方程式进行计算的步骤
(1)设未知数
……………....…设
(2)写出化学方程式并配平
...….方
(3)标出有关物质的量
(4)
列比例式…...….…..比
(6)简明地写出答案
….…...答
………………….….关
上标相对分子质量
下标已知质量和未知数
(5)
准确计算出结果
…...….…..算
【三个要领】
(1)步骤要完整
(2)格式要规范
(3)得数要准确(一般保留两位小数)
【三个关键】
(1)准确书写化学方程式
(2)准确计算物质质量比
(3)代入量均指纯净物的质量
(不纯量需换算成纯量,体积换算成质量)
2.化学方程式计算的三个要领和三个关键。
2.取47.4g高锰酸钾,加热一段时间后停止,共收集到3.2g氧气。计算:
(1)参加反应的高锰酸钾的质量。
(2)剩余固体中氧元素的质量分数(结果保留到0.1%)。
1.火力发电厂用石灰石浆吸收废气中的二氧化硫,以防止污染环境,其反应的化学方程式为2SO2+2CaCO3+O2=2CaSO4+2CO2.若有1.6kg的氧气参与反应,能吸收二氧化硫的质量是多少?
课堂练习
3.实验室取68g过氧化氢溶液和2g二氧化锰混合制取氧气,充分反应后,称量剩余溶液和滤渣为68.4g。求:
(1)充分反应后,生成氧气的质量为
g。
(2)过氧化氢溶液中过氧化氢的质量。
4.高温煅烧贝壳(主要成分是碳酸钙)可以生成氧化钙和二氧化碳。现有10t贝壳煅烧后质量减少了2.2t,可制得氧化钙的质量是多少?(假设其它成分不参加反应)
5.同学们从山上采集到一种灰石石,他们取80g该样品进行燃烧实验(所含杂质在燃烧过程中不发生变化),测得反应后固体的质量(m)和反应时间(t)的关系如表的关系如
反应时间t/s
t0
t1
t2
t3
t4
t5
t6
反应后固体的质量m/g
80
75
70
66
62
58
58
请回答下列:
(1)当石灰石完全反应后,生成CO2的质量为
g.(2)求该石灰石中CaCO3的质量分数.
6.某实验小组的同学为了测定实验室中氯酸钾样品的纯度,取一定质量的该样品与1g二氧化锰混合,其总质量为6g.依次加热该混合物t1、t2、t3、t4时间后,分别冷却,称量剩余物的质量,记录的有关数据如表(样品中的杂质不参加反应):计算:
加热时间
t1
t2
t3
t4
剩余固体质量/g
4.24
4.16
4.08
4.08
(1)生成氧气的质量为
g;
(2)原样品中氯酸钾的质量分数.
3.
化学方程要配平,
需将纯量代方程;
关系式对关系量,
计算单位不能忘;
关系量间成比例,
解设比答要牢记。
记住哦!
①不认真审题,答非所问;
②元素符号或化学式写错;
③化学方程式没有配平;
④相对分子质量计算错误;
⑤单位使用错误;
⑥把不纯物质当成纯净物进行计算。
4.常见的错误:
①某物质的纯度=(纯净物的质量÷混合物的质量)×100%
②混合物的质量=纯净物的质量+杂质的质量
③质量=体积×密度,即m=pv
④单位换算:1L=1000mL=1000cm3;1t=1000kg,1kg=1000g,1g=1000mg。
5.常用的几个关系式:
根据化学方程式计算的步骤
设未知数………………………………………设
写化学方程式…………………………………方
找质量关系、已知量和未知量………………关
列比例式………………………………………比
解比例式,求未知数…………………………算
简明作答………………………………………答
课
堂
小
结
课
题
3
利用化学方程式的简单计算
1.计算下列物质相对分子质量:
(1)KMnO4
(2)KClO3
(3)CaCO3
(4)H2O2
温故知新
2.写出氢气在氧气中燃烧的化学方程式,并标出各物质的质量比。
2×2
:
32
:
2
×18
2H2
+
O2
======
2
H2O
4
:
32
:
36
若:
4克
:
(
)克
:
(
)
克
点燃
若:(
)克
:
(
)克
:
36
克
若:(
)克
:
(
)克
:
18
克
科研卫生
农业
生产
工业
生产
药物的剂量能乱吃吗?
目前厂里只有含60吨氧化铁的铁矿石,能生产出56吨铁吗?需不需要进原料?
到底喷洒多少农药和化肥才能达到效果又不污染环境呢?
实验室
制取4.8克氧气需要多少克氯酸钾?
2KMnO4
K2MnO4
+
MnO2
+
O2↑
解:设加热分解6.32g高锰酸钾可以得到氧气的质量为x。
△
316
32
6.32g
x
316
6.32g
32
x
=
=
0.64g
答:加热分解6.32g高锰酸钾可以得到0.64g氧气。
【解题步骤】
⑴设未知量
⑵写化学方程式
⑶算相关物质的质量比
⑷标出已知量、未知量
⑸列比例式
⑹解出未知数
⑺写出简明答语
【书写格式】
x
例1.加热分解6.32
g高锰酸钾,可以得到多少克氧气?
例2.工业上高温煅烧石灰石(CaCO3)可制得生石灰(CaO)和二氧化碳,如果要制取11.2
t氧化钙,需要碳酸钙多少吨?
解:设需要碳酸钙的质量为x。
CaCO3
CaO+CO2↑
100
56
x
11.2t
=
解得x
=
20t
答:需要碳酸钙20t。
1.根据化学方程式进行计算的步骤
(1)设未知数
……………....…设
(2)写出化学方程式并配平
...….方
(3)标出有关物质的量
(4)
列比例式…...….…..比
(6)简明地写出答案
….…...答
………………….….关
上标相对分子质量
下标已知质量和未知数
(5)
准确计算出结果
…...….…..算
【三个要领】
(1)步骤要完整
(2)格式要规范
(3)得数要准确(一般保留两位小数)
【三个关键】
(1)准确书写化学方程式
(2)准确计算物质质量比
(3)代入量均指纯净物的质量
(不纯量需换算成纯量,体积换算成质量)
2.化学方程式计算的三个要领和三个关键。
2.取47.4g高锰酸钾,加热一段时间后停止,共收集到3.2g氧气。计算:
(1)参加反应的高锰酸钾的质量。
(2)剩余固体中氧元素的质量分数(结果保留到0.1%)。
1.火力发电厂用石灰石浆吸收废气中的二氧化硫,以防止污染环境,其反应的化学方程式为2SO2+2CaCO3+O2=2CaSO4+2CO2.若有1.6kg的氧气参与反应,能吸收二氧化硫的质量是多少?
课堂练习
3.实验室取68g过氧化氢溶液和2g二氧化锰混合制取氧气,充分反应后,称量剩余溶液和滤渣为68.4g。求:
(1)充分反应后,生成氧气的质量为
g。
(2)过氧化氢溶液中过氧化氢的质量。
4.高温煅烧贝壳(主要成分是碳酸钙)可以生成氧化钙和二氧化碳。现有10t贝壳煅烧后质量减少了2.2t,可制得氧化钙的质量是多少?(假设其它成分不参加反应)
5.同学们从山上采集到一种灰石石,他们取80g该样品进行燃烧实验(所含杂质在燃烧过程中不发生变化),测得反应后固体的质量(m)和反应时间(t)的关系如表的关系如
反应时间t/s
t0
t1
t2
t3
t4
t5
t6
反应后固体的质量m/g
80
75
70
66
62
58
58
请回答下列:
(1)当石灰石完全反应后,生成CO2的质量为
g.(2)求该石灰石中CaCO3的质量分数.
6.某实验小组的同学为了测定实验室中氯酸钾样品的纯度,取一定质量的该样品与1g二氧化锰混合,其总质量为6g.依次加热该混合物t1、t2、t3、t4时间后,分别冷却,称量剩余物的质量,记录的有关数据如表(样品中的杂质不参加反应):计算:
加热时间
t1
t2
t3
t4
剩余固体质量/g
4.24
4.16
4.08
4.08
(1)生成氧气的质量为
g;
(2)原样品中氯酸钾的质量分数.
3.
化学方程要配平,
需将纯量代方程;
关系式对关系量,
计算单位不能忘;
关系量间成比例,
解设比答要牢记。
记住哦!
①不认真审题,答非所问;
②元素符号或化学式写错;
③化学方程式没有配平;
④相对分子质量计算错误;
⑤单位使用错误;
⑥把不纯物质当成纯净物进行计算。
4.常见的错误:
①某物质的纯度=(纯净物的质量÷混合物的质量)×100%
②混合物的质量=纯净物的质量+杂质的质量
③质量=体积×密度,即m=pv
④单位换算:1L=1000mL=1000cm3;1t=1000kg,1kg=1000g,1g=1000mg。
5.常用的几个关系式:
根据化学方程式计算的步骤
设未知数………………………………………设
写化学方程式…………………………………方
找质量关系、已知量和未知量………………关
列比例式………………………………………比
解比例式,求未知数…………………………算
简明作答………………………………………答
课
堂
小
结
同课章节目录
- 绪言 化学使世界变得更加绚丽多彩
- 第一单元 走进化学世界
- 课题1 物质的变化和性质
- 课题2 化学是一门以实验为基础的科学
- 课题3 走进化学实验室
- 第二单元 我们周围的空气
- 课题1 空气
- 课题2 氧气
- 课题3 制取氧气
- 实验活动1 氧气的实验室制取与性质
- 第三单元 物质构成的奥秘
- 课题1 分子和原子
- 课题2 原子的结构
- 课题3 元素
- 第四单元 自然界的水
- 课题1 爱护水资源
- 课题2 水的净化
- 课题3 水的组成
- 课题4 化学式与化合价
- 第五单元 化学方程式
- 课题 1 质量守恒定律
- 课题 2 如何正确书写化学方程式
- 课题 3 利用化学方程式的简单计算
- 第六单元 碳和碳的氧化物
- 课题1 金刚石、石墨和C60
- 课题2 二氧化碳制取的研究
- 课题3 二氧化碳和一氧化碳
- 实验活动2 二氧化碳的实验室制取与性质
- 第七单元 燃料及其利用
- 课题 1 燃烧和灭火
- 课题2 燃料的合理利用与开发
- 实验活动 3 燃烧的条件
