外界条件对反应速率的影响
图片预览








文档简介
(共25张PPT)
不同的化学反应快慢是不一样的。
怎么样来比较和描述不同反应的快慢呢?
化学反应速率是用来衡量化学反应进行快慢程度的一个物理量。
化学反应是否是越快越好呢?举例说明?
橡胶老化,钢铁生锈。
化学反应为何有快有慢?
内因:反应物的性质
外因:浓度、温度、颗粒大小、 压强、催化剂等
(主要因素)
外界条件对反应速率的影响
1、颗粒大小对化学反应速率的影响
[实验]
在两支试管里分别装入块状和粉末状大理石,同时加入等浓度的盐酸溶液。
[现象]
装有粉末状大理石的试管反应更剧烈。
结论
颗粒越小,化学反应速率越大。
2、浓度对反应速率的影响
[实验]
在两支试管中,分别加入不同浓度的硫代硫酸钠溶液各2ml,同时加入等浓度的盐酸各2ml。
[现象]
浓度大的硫代硫酸钠和盐酸反应时产生浑浊更快。
Na2S2O3+2HCl 2NaCl+S +SO2 +H2O
为什么浓度能影响化学反应速率呢?
碰撞理论
有效碰撞
活化分子
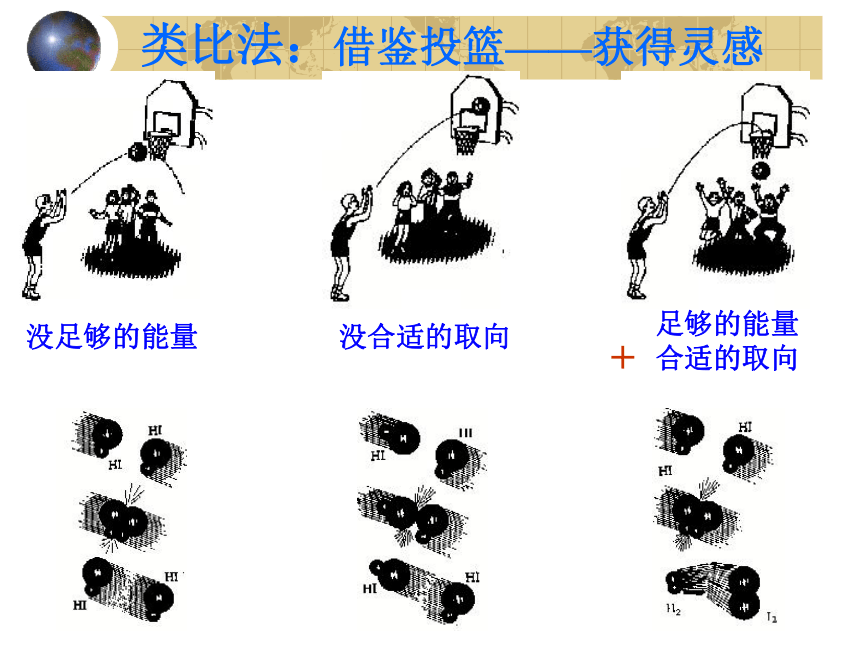
没合适的取向
没足够的能量
足够的能量
合适的取向
类比法:借鉴投篮——获得灵感
+
浓度增大
单位体积内活化分子数目增多
碰撞机会增多
有效碰撞增多
反应速率增大
其他条件不变,增大反应物的浓度,可以增大化学反应速率;减小反应物的浓度,可以减小化学反应速率
结论
例、把下列四种X溶液分别加进4个均盛有10mL2mol/L盐酸的烧杯中,此时X和盐酸进行反应,其中反应速率最快的是( )
A、20mL,2.5mol/L B、20mL,2mol/L
C、10ml,5mol/L D、30mL,2mol/L
C
1、浓度对反应速率的影响,只适用于气体与液体,不适用于固体
备注
2、反应速率快慢与浓度有关,而与物质的总量无关
例、对10mL 1mol/L盐酸与一小块大理石的化学反应
CaCO3 + 2HCl= CaCl2 + CO2 ↑+ H2O,下列措施能使化学反应速率提高的是( )
A、加入一定量的CaCl2 B、加入5mL 1.5mol/L盐酸
C、加入15mL 0.5mol/L盐酸 D、加入5mL H2O
B
析:CaCl2是生成物,其浓度的增大不能增大反应速率。
影响反应速率的是浓度,与总量没有必然的联系。
3、温度对反应速率的影响
[实验]
在两支试管中,分别加入等浓度的盐酸各2ml,再同时加入不同温度的等浓度的硫代硫酸钠溶液各2ml。
[现象]
温度高的一组反应时产生浑浊更快。
Na2S2O3+2HCl 2NaCl+S +SO2 +H2O
升高温度
活化分子数目增多
碰撞机会增多
有效碰撞增多
反应速率增大
原理
反应物能量增加
当其他条件不变的的情况时,升高温度可以增大反应速率。
结论
温度每升高10℃,化学反应速率通常增大到原来的2~4倍。
经验
4、压强对化学反应速率的影响
结论
对有气体参加的反应,若其他条件不变,增大压强,反应速率加快;减小压强,反应速率减慢
p
2p
3p
压强增大
气体体积减小
气体反应物浓度增大
反应速率增大
备注
1、压强对反应速率的影响仅限于有气体参与的反应。
2、压强对反应的影响本质上是浓度的影响。
例1、在一密闭容器中,加入SO2和O2发生2SO2 + O2 = 2SO3,试分析下列情况对反应速率的影响。
1、容器体积变为原来的2/3
气体反应物浓度增大
反应速率增大
2、容器体积不变,加入SO2,(O2)
气体反应物浓度增大
化学反应速率增大
3、恒温、恒压时,充入惰性气体
要保持压强不变
体积增大
浓度减小
反应速率减慢
4、恒温、恒容时,充入惰性气体
体积不变
浓度不变
反应速率不变
例2:对于反应N2+O2=2NO在密闭容器中进行,下列条件哪些不能加快该反应的化学反应速率( )
A、缩小体积使压强增大
B、体积不变充入 N2 使压强增大
C、体积不变充入 O2使压强增大
D、使体积增大到原来的2倍
E、体积不变充入氦气使压强增大
DE
5、催化剂对化学反应速率的影响
[实验]
在两支试管里分别加2ml H2O2,向其中一支试管加入少量MnO2粉末。
[现象]
加入MnO2的试管,立即产生大量的气泡。
没有假如MnO2的试管只有少量气泡出现。
结论
催化剂能够改变化学反应速率
催化剂:在化学反应前后质量和化学性质都保持不变。
催化剂有正、负之分。
能加快化学反应速率的催化剂叫正催化剂
能减慢化学反应速率的催化剂叫负催化剂
催化剂中毒
催化剂的催化性能因接触少量杂质而明显下降甚至遭到破坏,称为催化剂中毒。
为防止催化剂中毒,应对原料进行净化。
正催化剂能加快反应速率的原因。
它能够降低化学反应所需要的能量,使更多的反应物分子成为活化分子,增加了单位体积内活化分子的质量分数。
催化剂
反应所需能量降低
活化分子增多
反应速率加快
生成物平均能量
活化分子具有能量
反应物平均能量
能量
无催化剂
活化分子能量
反应物平均能量
生成物平均能量
有催化剂
6、其他因素对化学反应速率的影响
光、超声波、放射线、电磁波、反应物颗粒大小、溶剂等对反应速率也有影响。
在各种外界条件中,温度对反应速率的影响能适应所有的反应。
小结:影响化学反应速率的因素
内因:反应物本身的性质(主要因素)
外因:
反应条件改变 反应速率的变化
颗粒大小 反应物(固)颗粒变小
反应物(固)颗粒变大
浓度 增大反应物浓度
减小反应物浓度
温度 升高温度
降低温度
压强 增大压强
减小压强
催化剂
增大
减小
增大
减小
减小
减小
增大
增大
增大
1、将一定浓度的盐酸倒入碳酸钙中,若作如下改变的情况,其中能使最初的化学反应速率增大的是 ( )
A、盐酸的浓度不变,而使盐酸的用量一倍
B、盐酸的浓度增大一倍,而使盐酸的用量减少到原来的一半
C、盐酸的浓度和用量都不变,增加碳酸钙的量
D、盐酸和碳酸钙不变,增大压强一倍
E、加入CaCl2溶液
F、加入CaCl2固体
G、将CaCO3用CaCO3粉末代替
外在条件对反应速率的影响——综合
——实践应用类
BG
2、硫代硫酸钠( Na2S2O3)与稀硫酸发生如下反应:Na2S2O3+H2SO4=Na2SO4+SO2+S↓+H2O
外在条件对反应速率的影响——综合
——实践应用类
下列四种情况中最早出现浑浊的是: ( )
(1)10℃时0.1 mol /L Na2S2O3和0.1 mol /L H2SO4各 5 mL
(2)10℃时0.1 mol /L Na2S2O3和0.1 mol /L H2SO4 各5 mL,加水10mL
(3) 20℃ 时0.1 mol /L Na2S2O3和0.1 mol /L H2SO4各 5 mL
(4) 20℃ 时0.1mol /L Na2S2O3和0.1 mol /L H2SO4各5 mL,加水10 mL
C
3、右图为反应 2A(g)= B(g)+ C(g)的速率
ひ(A)变化的图像,其中纵坐标可能是( )
A. 温度 B. 压强
C. A的浓度 D. 反应时间
0
ひ(A)
D
外在条件对反应速率的影响——综合
——实践应用类
不同的化学反应快慢是不一样的。
怎么样来比较和描述不同反应的快慢呢?
化学反应速率是用来衡量化学反应进行快慢程度的一个物理量。
化学反应是否是越快越好呢?举例说明?
橡胶老化,钢铁生锈。
化学反应为何有快有慢?
内因:反应物的性质
外因:浓度、温度、颗粒大小、 压强、催化剂等
(主要因素)
外界条件对反应速率的影响
1、颗粒大小对化学反应速率的影响
[实验]
在两支试管里分别装入块状和粉末状大理石,同时加入等浓度的盐酸溶液。
[现象]
装有粉末状大理石的试管反应更剧烈。
结论
颗粒越小,化学反应速率越大。
2、浓度对反应速率的影响
[实验]
在两支试管中,分别加入不同浓度的硫代硫酸钠溶液各2ml,同时加入等浓度的盐酸各2ml。
[现象]
浓度大的硫代硫酸钠和盐酸反应时产生浑浊更快。
Na2S2O3+2HCl 2NaCl+S +SO2 +H2O
为什么浓度能影响化学反应速率呢?
碰撞理论
有效碰撞
活化分子
没合适的取向
没足够的能量
足够的能量
合适的取向
类比法:借鉴投篮——获得灵感
+
浓度增大
单位体积内活化分子数目增多
碰撞机会增多
有效碰撞增多
反应速率增大
其他条件不变,增大反应物的浓度,可以增大化学反应速率;减小反应物的浓度,可以减小化学反应速率
结论
例、把下列四种X溶液分别加进4个均盛有10mL2mol/L盐酸的烧杯中,此时X和盐酸进行反应,其中反应速率最快的是( )
A、20mL,2.5mol/L B、20mL,2mol/L
C、10ml,5mol/L D、30mL,2mol/L
C
1、浓度对反应速率的影响,只适用于气体与液体,不适用于固体
备注
2、反应速率快慢与浓度有关,而与物质的总量无关
例、对10mL 1mol/L盐酸与一小块大理石的化学反应
CaCO3 + 2HCl= CaCl2 + CO2 ↑+ H2O,下列措施能使化学反应速率提高的是( )
A、加入一定量的CaCl2 B、加入5mL 1.5mol/L盐酸
C、加入15mL 0.5mol/L盐酸 D、加入5mL H2O
B
析:CaCl2是生成物,其浓度的增大不能增大反应速率。
影响反应速率的是浓度,与总量没有必然的联系。
3、温度对反应速率的影响
[实验]
在两支试管中,分别加入等浓度的盐酸各2ml,再同时加入不同温度的等浓度的硫代硫酸钠溶液各2ml。
[现象]
温度高的一组反应时产生浑浊更快。
Na2S2O3+2HCl 2NaCl+S +SO2 +H2O
升高温度
活化分子数目增多
碰撞机会增多
有效碰撞增多
反应速率增大
原理
反应物能量增加
当其他条件不变的的情况时,升高温度可以增大反应速率。
结论
温度每升高10℃,化学反应速率通常增大到原来的2~4倍。
经验
4、压强对化学反应速率的影响
结论
对有气体参加的反应,若其他条件不变,增大压强,反应速率加快;减小压强,反应速率减慢
p
2p
3p
压强增大
气体体积减小
气体反应物浓度增大
反应速率增大
备注
1、压强对反应速率的影响仅限于有气体参与的反应。
2、压强对反应的影响本质上是浓度的影响。
例1、在一密闭容器中,加入SO2和O2发生2SO2 + O2 = 2SO3,试分析下列情况对反应速率的影响。
1、容器体积变为原来的2/3
气体反应物浓度增大
反应速率增大
2、容器体积不变,加入SO2,(O2)
气体反应物浓度增大
化学反应速率增大
3、恒温、恒压时,充入惰性气体
要保持压强不变
体积增大
浓度减小
反应速率减慢
4、恒温、恒容时,充入惰性气体
体积不变
浓度不变
反应速率不变
例2:对于反应N2+O2=2NO在密闭容器中进行,下列条件哪些不能加快该反应的化学反应速率( )
A、缩小体积使压强增大
B、体积不变充入 N2 使压强增大
C、体积不变充入 O2使压强增大
D、使体积增大到原来的2倍
E、体积不变充入氦气使压强增大
DE
5、催化剂对化学反应速率的影响
[实验]
在两支试管里分别加2ml H2O2,向其中一支试管加入少量MnO2粉末。
[现象]
加入MnO2的试管,立即产生大量的气泡。
没有假如MnO2的试管只有少量气泡出现。
结论
催化剂能够改变化学反应速率
催化剂:在化学反应前后质量和化学性质都保持不变。
催化剂有正、负之分。
能加快化学反应速率的催化剂叫正催化剂
能减慢化学反应速率的催化剂叫负催化剂
催化剂中毒
催化剂的催化性能因接触少量杂质而明显下降甚至遭到破坏,称为催化剂中毒。
为防止催化剂中毒,应对原料进行净化。
正催化剂能加快反应速率的原因。
它能够降低化学反应所需要的能量,使更多的反应物分子成为活化分子,增加了单位体积内活化分子的质量分数。
催化剂
反应所需能量降低
活化分子增多
反应速率加快
生成物平均能量
活化分子具有能量
反应物平均能量
能量
无催化剂
活化分子能量
反应物平均能量
生成物平均能量
有催化剂
6、其他因素对化学反应速率的影响
光、超声波、放射线、电磁波、反应物颗粒大小、溶剂等对反应速率也有影响。
在各种外界条件中,温度对反应速率的影响能适应所有的反应。
小结:影响化学反应速率的因素
内因:反应物本身的性质(主要因素)
外因:
反应条件改变 反应速率的变化
颗粒大小 反应物(固)颗粒变小
反应物(固)颗粒变大
浓度 增大反应物浓度
减小反应物浓度
温度 升高温度
降低温度
压强 增大压强
减小压强
催化剂
增大
减小
增大
减小
减小
减小
增大
增大
增大
1、将一定浓度的盐酸倒入碳酸钙中,若作如下改变的情况,其中能使最初的化学反应速率增大的是 ( )
A、盐酸的浓度不变,而使盐酸的用量一倍
B、盐酸的浓度增大一倍,而使盐酸的用量减少到原来的一半
C、盐酸的浓度和用量都不变,增加碳酸钙的量
D、盐酸和碳酸钙不变,增大压强一倍
E、加入CaCl2溶液
F、加入CaCl2固体
G、将CaCO3用CaCO3粉末代替
外在条件对反应速率的影响——综合
——实践应用类
BG
2、硫代硫酸钠( Na2S2O3)与稀硫酸发生如下反应:Na2S2O3+H2SO4=Na2SO4+SO2+S↓+H2O
外在条件对反应速率的影响——综合
——实践应用类
下列四种情况中最早出现浑浊的是: ( )
(1)10℃时0.1 mol /L Na2S2O3和0.1 mol /L H2SO4各 5 mL
(2)10℃时0.1 mol /L Na2S2O3和0.1 mol /L H2SO4 各5 mL,加水10mL
(3) 20℃ 时0.1 mol /L Na2S2O3和0.1 mol /L H2SO4各 5 mL
(4) 20℃ 时0.1mol /L Na2S2O3和0.1 mol /L H2SO4各5 mL,加水10 mL
C
3、右图为反应 2A(g)= B(g)+ C(g)的速率
ひ(A)变化的图像,其中纵坐标可能是( )
A. 温度 B. 压强
C. A的浓度 D. 反应时间
0
ひ(A)
D
外在条件对反应速率的影响——综合
——实践应用类
