安徽省太和一中2020-2021学年高二上学期期中考试化学(普通班)试题
文档属性
| 名称 | 安徽省太和一中2020-2021学年高二上学期期中考试化学(普通班)试题 |

|
|
| 格式 | docx | ||
| 文件大小 | 571.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-11-09 00:00:00 | ||
图片预览


文档简介
太和一中2020—2021学年度高二第一学期
期中考试(化学)试卷
(考试时间:90分钟 总分:100分)
本试卷分第I卷(选择题)和第II卷(非选择题)两部分
可能用到的相对原子质量:H-1 C-12 N-14 O-16 Na-23 Mg-24 S-32 Cl-35.5 Ca-40 Mn-55 Cu-64 S-32 Fe-56 Cr-52
第Ⅰ卷 (选择题 共48分)
选择题:(16个小题,每小题3分,共48分,在每小题给出的四个选项中,只有一项是符合题目要求的)。
1.下列过程或现象与盐类水解无关的是( )
A.纯碱溶液去油污 B.铁在潮湿的环境下生锈
C.加热氯化铁溶液颜色变深 D.浓硫化钠溶液有臭鸡蛋味
2.根据下列操作及现象,所得结论正确的是( )
序号
操作及现象
结论
A
将0.1mol?L﹣1氨水稀释成0.01mol?L﹣1,测得pH由11.1变成10.6
稀释后NH3?H2O的电离程度减小
B
常温下,测得饱和Na2CO3溶液的pH大于饱和NaHCO3溶液
常温下水解程度:CO32﹣>HCO3﹣
C
向25mL冷水和沸水中分别滴入5滴FeCl3饱和溶液,前者为黄色,后者为红褐色
温度升高,Fe3+的水解程度增大
D
将固体CaSO4加入Na2CO3饱和溶液中,一段时间后,检验固体成分为CaCO3
同温下溶解度:CaSO4<CaCO3
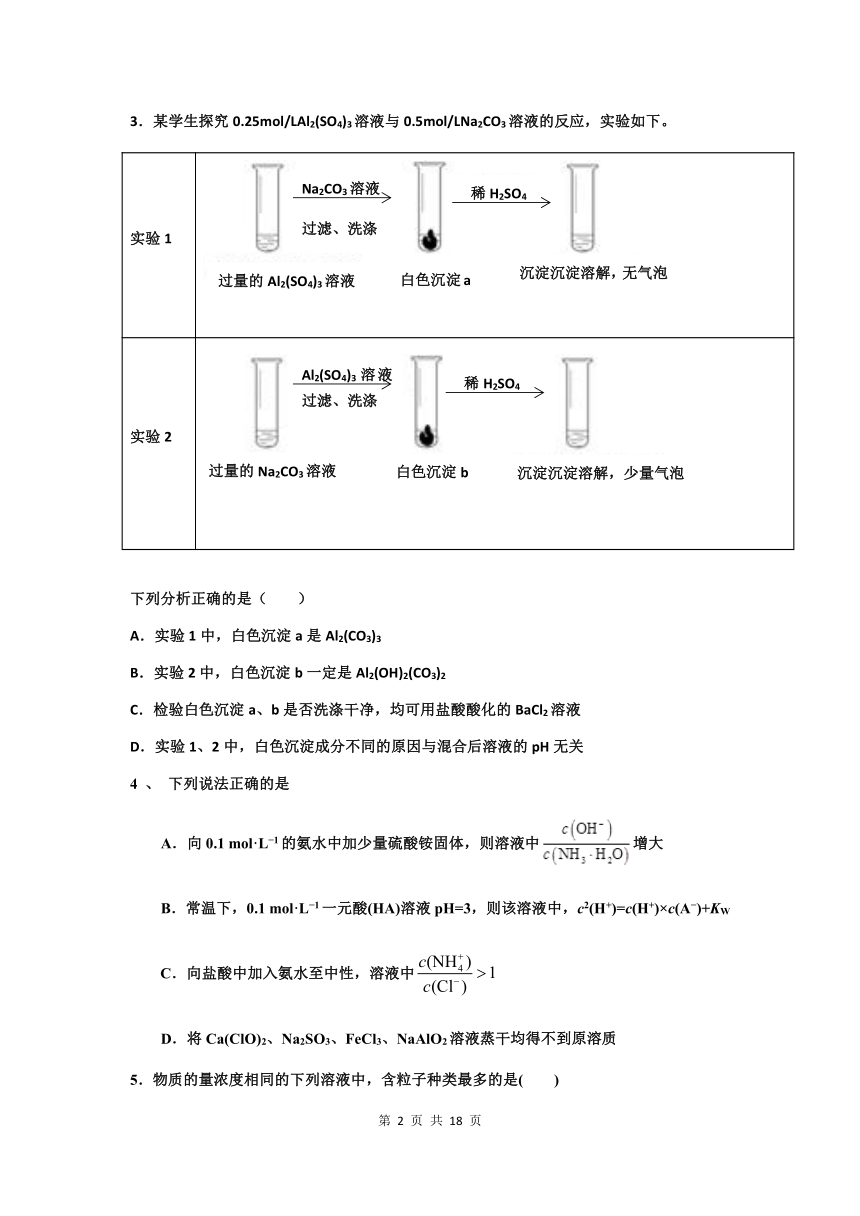
3.某学生探究0.25mol/LAl2(SO4)3溶液与0.5mol/LNa2CO3溶液的反应,实验如下。
实验1
1635760899795白色沉淀a
白色沉淀a
2683510839470沉淀沉淀溶解,无气泡
沉淀沉淀溶解,无气泡
35560909320过量的Al2(SO4)3溶液
过量的Al2(SO4)3溶液
2121535137795稀H2SO4
稀H2SO4
218821038544578803534290076898595250Na2CO3溶液
过滤、洗涤
Na2CO3溶液
过滤、洗涤
实验2
2664460972820沉淀沉淀溶解,少量气泡
沉淀沉淀溶解,少量气泡
1597660963295白色沉淀b
白色沉淀b
-50165953770过量的Na2CO3溶液
过量的Na2CO3溶液
2064385182245稀H2SO4
稀H2SO4
2131060429895788035354330768985106680Al2(SO4)3溶液过滤、洗涤
Al2(SO4)3溶液过滤、洗涤
下列分析正确的是( )
A.实验1中,白色沉淀a是Al2(CO3)3
B.实验2中,白色沉淀b一定是Al2(OH)2(CO3)2
C.检验白色沉淀a、b是否洗涤干净,均可用盐酸酸化的BaCl2溶液
D.实验1、2中,白色沉淀成分不同的原因与混合后溶液的pH无关
4 、 下列说法正确的是
A.向0.1 mol·L?1的氨水中加少量硫酸铵固体,则溶液中增大
B.常温下,0.1 mol·L?1一元酸(HA)溶液pH=3,则该溶液中,c2(H+)=c(H+)×c(A?)+KW
C.向盐酸中加入氨水至中性,溶液中false
D.将Ca(ClO)2、Na2SO3、FeCl3、NaAlO2溶液蒸干均得不到原溶质
5.物质的量浓度相同的下列溶液中,含粒子种类最多的是( )
A.CaCl2 B.CH3COONa C.NH3 D.K2S
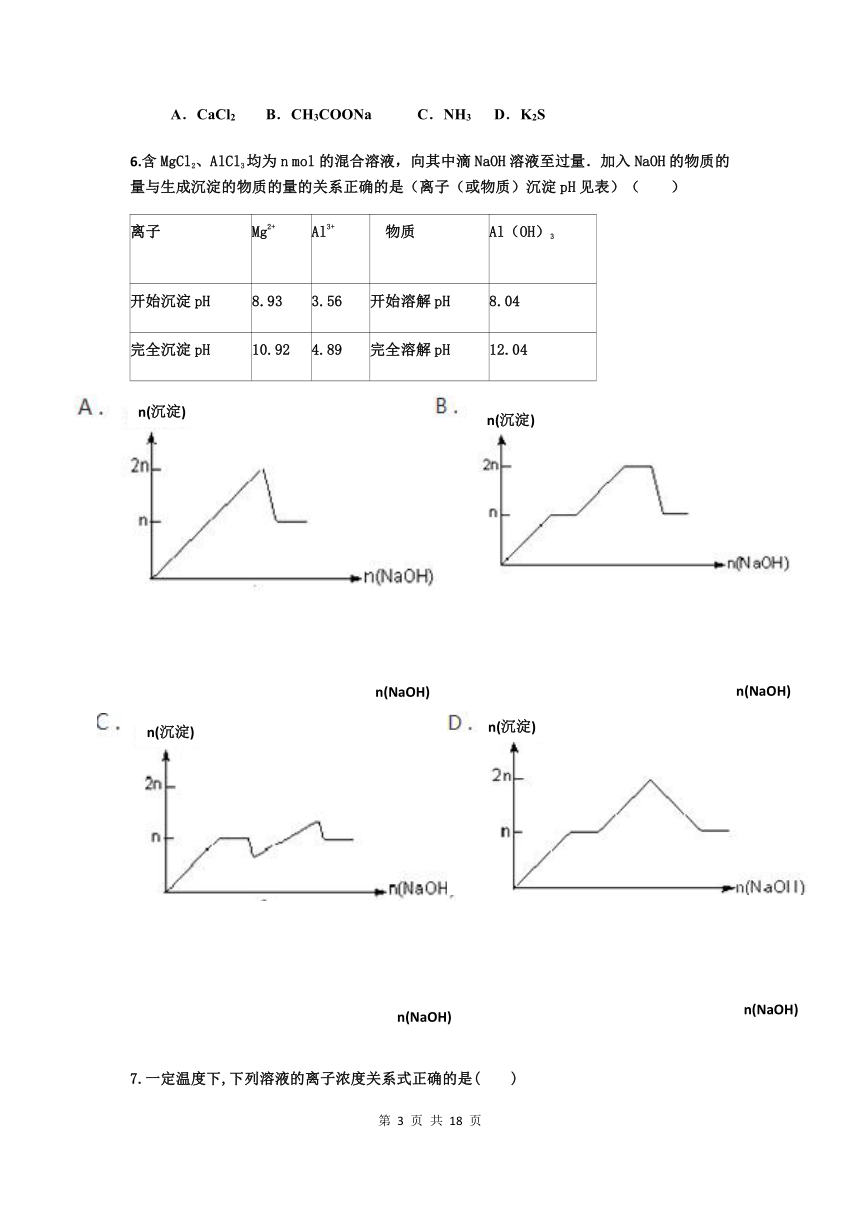
6.含MgCl2、AlCl3均为n mol的混合溶液,向其中滴NaOH溶液至过量.加入NaOH的物质的量与生成沉淀的物质的量的关系正确的是(离子(或物质)沉淀pH见表)( )
离子
Mg2+
Al3+
物质
Al(OH)3
开始沉淀pH
8.93
3.56
开始溶解pH
8.04
完全沉淀pH
10.92
4.89
完全溶解pH
12.04
3042285175260n(沉淀)
n(沉淀)
2667000129540-24765102235n(沉淀)
n(沉淀)
-485775114300
523303574295n(NaOH)
n(NaOH)
206121084455n(NaOH)
n(NaOH)
305181033020n(沉淀)
n(沉淀)
2790825679455143580645n(沉淀)
n(沉淀)
-28575085725
529971036830n(NaOH)
n(NaOH)
2251710100330n(NaOH)
n(NaOH)
7.一定温度下,下列溶液的离子浓度关系式正确的是( )
A.pH=5的H2S溶液中,c(H+)= c(HS-)=1×10-5 mol·L-1
B.pH=a的氨水溶液,稀释10倍后,其pH=b,则a=b+1
C.pH=2的H2CO3溶液与pH=12的NaOH溶液任意比例混合:c(Na+)+c(H+)=c(OH-)+ c(HC)
D.已知酸性CH3COOH>H2CO3>HClO,PH相同的①CH3COONa②NaHCO3③NaClO三种溶液的c(Na+):①>②>③
8.一定温度下,金属硫化物的沉淀溶解平衡曲线如图所示。纵坐标p(Mn+)表示-lg c(Mn+),横坐标p(S2-)表示-lg c(S2-),下列说法不正确的是( )
A.该温度下,Ag2S的Ksp=1.6×10-49 B.该温度下,溶解度的大小关系为NiS>SnS
C.SnS和NiS的饱和溶液中等=104
D.向含有等物质的量浓度的Ag+、Ni2+、Sn2+的溶液中加入饱和Na2S溶液,则析出沉淀的先后顺序为Ag2S、SnS、NiS
9.下列溶液中微粒的物质的量浓度关系正确的是( )
A.室温下,向0.01 mol·L-1 NH4HSO4溶液中滴加NaOH溶液至中性:
c平(Na+)>c平(SO)>c平(NH)>c平(OH-)=c平(H+)
B.0.1 mol·L-1 NaHCO3溶液:c平(Na+)>c平(OH-)>c平(HCO)>c平(H+)
C.Na2CO3溶液:c平(OH-)-c平(H+)=c平(HCO)+c平(H2CO3)
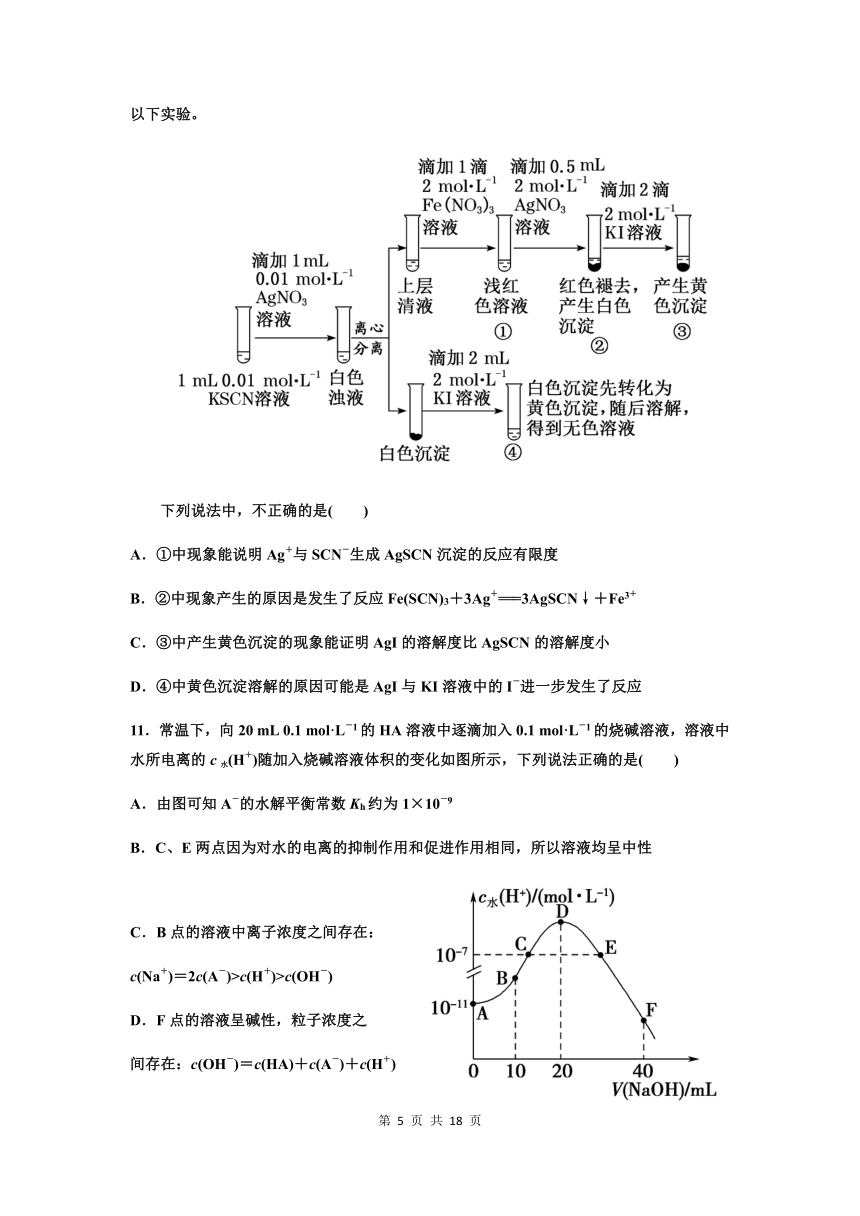
D.25 ℃时,pH=4.75、浓度均为0.1 mol·L-1的CH3COOH、CH3COONa混合溶液:c平(CH3COO-)+c平(OH-) 10.已知:Ag++SCN-===AgSCN↓(白色),某同学探究AgSCN的溶解平衡及转化,进行以下实验。
下列说法中,不正确的是( )
A.①中现象能说明Ag+与SCN-生成AgSCN沉淀的反应有限度
B.②中现象产生的原因是发生了反应Fe(SCN)3+3Ag+===3AgSCN↓+Fe3+
C.③中产生黄色沉淀的现象能证明AgI的溶解度比AgSCN的溶解度小
D.④中黄色沉淀溶解的原因可能是AgI与KI溶液中的I-进一步发生了反应
11.常温下,向20 mL 0.1 mol·L-1的HA溶液中逐滴加入0.1 mol·L-1的烧碱溶液,溶液中水所电离的c水(H+)随加入烧碱溶液体积的变化如图所示,下列说法正确的是( )
A.由图可知A-的水解平衡常数Kh约为1×10-9
B.C、E两点因为对水的电离的抑制作用和促进作用相同,所以溶液均呈中性
26276305080
B点的溶液中离子浓度之间存在:
c(Na+)=2c(A-)>c(H+)>c(OH-)
F点的溶液呈碱性,粒子浓度之
间存在:c(OH-)=c(HA)+c(A-)+c(H+)
12.通过滴加相同浓度的盐酸或KOH溶液来调节0.01 mol·L-1 Na2HAsO3溶液的pH,实验测得含砷的各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与溶液pH的关系如图所示。
下列有关说法正确的是( )
A.NaH2AsO3溶于水,所得溶液中H2AsO的水解程度小于其电离程度
B.K1(H3AsO3)的数量级为10-9 C.水的电离程度:a点大于b点
D.c点溶液中存在:c(Na+)=2c(H2AsO)+4c(HAsO)+2c(AsO)
13.室温下,反应HC+H2OH2CO3+OH-的平衡常数K=2.2×10-8。将NH4HCO3溶液和氨水按一定比例混合,可用于浸取废渣中的ZnO。若溶液混合引起的体积变化可忽略,室温时下列指定溶液中微粒物质的量浓度关系正确的是 ( )
A.0.2 mol·L-1氨水:c(NH3·H2O)>c(N) >c(OH-)>c(H+)
B.0.2 mol·L-1 NH4HCO3溶液(pH>7):c(N)>c(HC)>c(NH3·H2O) >c(H2CO3)
C.0.2 mol·L-1氨水和0.2 mol·L-1 NH4HCO3溶液等体积混合c(N)+c(NH3·H2O)=c(H2CO3)+c(HC)+c(C)
D.0.6 mol·L-1氨水和0.2 mol·L-1 NH4HCO3溶液等体积混合c(NH3·H2O)+c(C)+c(OH-)=0.3 mol·L-1+c(H2CO3)+c(H+)
14、某同学探究溶液的酸碱性对FeCl3水解平衡的影响,实验方案如下:配制50 mL 0.001 mol·L-1 FeCl3溶液、50 mL对照组溶液X,向两种溶液中分别滴加1滴1 mol·L-1 HCl溶液、1滴1 mol·L-1 NaOH溶液,测得溶液pH随时间变化的曲线如图所示。
下列说法不正确的是 ( )
A.依据M点对应的pH,说明Fe3+发生了水解反应
B.对照组溶液X的组成可能是0.003 mol·L-1 KCl
C.依据曲线c和d说明Fe3+水解平衡发生了移动
D.通过仪器检测体系浑浊度的变化,可表明水解平衡移动的方向
15.常温时,改变饱和氯水的pH,得到部分含氯微粒的物质的量分数与pH的关系如图所示。下列叙述不正确的是( )
A.该温度下,HClO?H++ClO-的电离常数Ka的对值lg Ka=-7.54
B.氯水中的Cl2、ClO-、HClO均能与KI发生反应
C.pH=1的氯水中,c(Cl2)>c(Cl)>c(HClO)>c(ClO-)
D.已知常温下反应Cl2(aq)+Cl-(aq)?Cl(aq)的K=0.191,当pH增大时,K减小
321818070675516.草酸(H2C2O4)是一种二元弱酸。常温下,向H2C2O4溶液中逐滴加入NaOH溶液,混合溶液中lg X与pH的变化关系如图所示。下列说法不正确的是( )
A.曲线Ⅰ表示lg与pH的变化关系
pH=1.22的溶液中:
2c(C2O)+c(HC2O)>c(Na+)
C.1.22<pH<4.19的溶液中:
c(HC2O)>c(C2O)>c(H2C2O4)
D.pH=4.19的溶液中:c(Na+)<3c(HC2O)
第Ⅱ卷 (非选择题 共52分)
17(13分)、根据要求回答下列问题
Ⅰ、用系统命名法给下列物质命名:
(1) ;?
(2) 的名称为 。
(3)
Ⅱ、根据下列有机物的名称,写出相应的结构简式
(4)3,5-二甲基庚烷
(5)
Ⅲ、按要求回答下列问题:
(6) 命名为“2-乙基丙烷”,错误原因是 ;将其命名为“3-甲基丁烷”,错误原因是 _。正确命名为 。
18.(9分)常温下,水的离子积Kw=1×10﹣14.有酸溶液A,pH=a;碱溶液B,pH=b.为测定A、B混合后溶液导电性的变化以及探究A、B的相关性质,某同学设计了如图所示的实验装置.
(1)实验时,滴定管中应盛 (选A或B)溶液.
(2)若A为一元强酸,B为一元强碱,且a+b=14.该同学在烧杯中先加入其中一种溶液,闭合开关K,测得烧杯中灯泡的亮度为10(假设亮度由暗到亮表示为1、2、3、…10、11、12、…20).
断开开关K,将滴定管中的溶液逐滴加入到烧杯中.当从滴定管滴入烧杯中的溶液体积和烧杯中盛有的溶液体积相等时,停止滴加溶液并闭合开关K,此时灯泡G的亮度约为 ,原因是 .烧杯中得到的溶液pH= .
(3)若A为强酸,B为强碱,且a+b=14.断开开关K,将滴定管中的溶液逐滴加入到烧杯中.当测得烧杯中溶液pH和“(2)”中最后得到的溶液pH相同时,停止滴加溶液.此时烧杯中的溶液中阳离子浓度大于阴离子浓度,原因可能是 .
3752850596265(4)若A的化学式为HR,B的化学式为MOH,且a+b=14,两者等体积混合后溶液显碱性.则混合溶液中必定有一种离子能发生水解,该水解反应的离子方程为 .此时烧杯中的混合溶液中,微粒浓度大小关系一定正确的是 (填序号).
①c(MOH)>c(M+)>c(R﹣)>c(H+)>c(OH﹣)
②c(HR)>c(M+)>c(R﹣)>c(OH﹣)>c(H+)
③c(R﹣)>c(M+)>c(H+)>c(OH﹣)
④c(M+)>c(R﹣)>c(OH﹣)>c(H+)
⑤c(M+)+c(H+)=c(R﹣)+c(OH﹣)
⑥c(MOH)=c(H+)﹣c(OH﹣)
19.(10分)某种电镀污泥主要含有碲化亚铜(Cu2Te)、三氧化二铬(Cr2O3)以及少量的金(Au),可以用于制取Na2Cr2O7溶液、金属铜和粗碲等,以实现有害废料的资源化利用,工艺流程如下:
已知:煅烧时,Cu2Te发生的反应为Cu2Te+2O22CuO+TeO2。
(1)煅烧时,Cr2O3发生反应的化学方程式为__________________。?
(2)浸出液中除了含有TeOSO4(在电解过程中不反应)外,还可能含有____(填化学式)。
(3)工业上用重铬酸钠(Na2Cr2O7)母液生产重铬酸钾(K2Cr2O7)的工艺流程如图所示:
通过冷却结晶能析出大量K2Cr2O7的原因是__________________。?
(4)测定产品中K2Cr2O7含量的方法如下:称取产品试样2.50 g配成250 mL溶液,用移液管取出25.00 mL于锥形瓶中,加入足量稀硫酸酸化后,再加入几滴指示剂,用0.1000 mol·L-1硫酸亚铁铵(NH4)2Fe(SO4)2标准液进行滴定,重复进行二次实验。(已知Cr200
false被还原为Cr3+)
①氧化还原滴定过程中的离子方程式为________________。?
②若三次实验消耗(NH4)2Fe(SO4)2标准液的平均体积为25.00 mL,则所得产品中K2Cr2O7的纯度为_____%。[已知M(K2Cr2O7)=294 g·mol-1,计算结果保留三位有效数字]。?
(5)上述流程中K2Cr2O7发生氧化还原反应后所得溶液中除含有Cr3+外,还含有一定浓度的Fe3+杂质,可通过加碱调pH的方法使两者转化为沉淀。已知c(Cr3+)=3×10-5 mol·L-1,则当溶液中开始析出Cr(OH)3沉淀时Fe3+是否沉淀完全?____(填“是”或“否”)。{已知:Ksp[Fe(OH)3]=4.0×10-38, Ksp[Cr(OH)3]=6.0×10-31}
20.(10分)以硫铁矿为原料生产硫酸所得的酸性废水中砷元素含量极高,为控制砷的排放,采用化学沉降法处理含砷废水,相关数据如下表。
表1 几种砷酸盐的Ksp
难溶物
Ksp
Ca3(AsO4)2
6.8×10-19
AlAsO4
1.6×10-16
FeAsO4
5.7×10-21
表2 工厂污染物排放浓度及允许排放标准
污染物
H2SO4
As
浓度
28.42 g·L-1
1.6 g·L-1
排放标准
pH 6~9
0.5 mg·L-1
回答下列问题:
(1)该硫酸工厂排放的废水中硫酸的物质的量浓度c(H2SO4)=___mol·L-1。 ?
(2)写出难溶物Ca3(AsO4)2的Ksp表达式:
Ksp[Ca3(AsO4)2]=____________。若混合溶液中Al3+、Fe3+的浓度均为1.0×10-4 mol·L-1,c(As)最大是________mol·L-1。?
(3)工厂排放出的酸性废水中的三价砷(H3AsO3为弱酸)不易沉降,可投入MnO2先将其氧化成五价砷(H3AsO4为弱酸),写出该反应的离子方程式:________。?
(4)在处理含砷废水时采用分段式,先向废水中投入生石灰调节pH到2,再投入生石灰将pH调节到8左右使五价砷以Ca3(AsO4)2的形式沉降。
①将pH调节到2时废水中有大量沉淀产生,沉淀主要成分的化学式为_____。 ?
②Ca3(AsO4)2在pH调节到8左右才开始沉淀的原因为____________。?
21.(10分)某研究小组进行Mg(OH)2沉淀溶解和生成的实验探究。
(查阅资料)25 ℃时,Ksp[Mg(OH)2]=1.8×10-11,Ksp[Fe(OH)3]=4.0×10-38。
(实验探究)向2支均盛有1 mL 0.1 mol·L-1 MgCl2溶液的试管中分别加入2滴2 mol·L-1 NaOH溶液,制得等量Mg(OH)2沉淀。
(1)分别向两支试管中加入不同试剂,记录实验现象如表:(表中填空填下列选项中字母代号)
试管编号
加入试剂
实验现象
Ⅰ
2滴0.1 mol·L-1 FeCl3溶液
①_____
Ⅱ
4 mL 2 mol·L-1 NH4Cl溶液
②_____
A.白色沉淀转化为红褐色沉淀 B.白色沉淀不发生改变
C.红褐色沉淀转化为白色沉淀 D.白色沉淀溶解,得无色溶液
(2)测得试管Ⅰ中所得混合液pH=6,则溶液中c(Fe3+)=______________。
(3)同学们猜想实验Ⅱ中沉淀溶解的主要原因有两种:
猜想1:NH结合Mg(OH)2电离出的OH-,使Mg(OH)2的溶解平衡正向移动。
猜想2:_________________________________________________________。
(4)为验证猜想,同学们取少量相同质量的氢氧化镁盛放在两支试管中,一支试管中加入醋酸铵溶液(pH=7),另一支试管中加入NH4Cl和氨水混合液(pH=8),两者沉淀均溶解。该实验证明猜想正确的是________(填“1”或“2”)。
太和一中2020—2021学年度高二第一学期化学答题卡
304038072390
条 码 粘 贴 处
(正面朝上贴在此虚线框内)
条 码 粘 贴 处
(正面朝上贴在此虚线框内)
试卷类型:B
姓名:______________班级:______________
准考证号
Ⅰ选择题(请用2B铅笔填涂)
2857557150缺考标记
考生禁止填涂缺考标记!只能由监考老师负责用黑色字迹的签字笔填涂。
缺考标记
考生禁止填涂缺考标记!只能由监考老师负责用黑色字迹的签字笔填涂。
-6477057150注意事项
1、答题前,考生先将自己的姓名、准考证号码填写清楚。
2、请将准考证条码粘贴在右侧的[条码粘贴处]的方框内
3、选择题必须使用2B铅笔填涂;非选择题必须用0.5毫米黑色字迹的签字笔填写,字体工整
4、请按题号顺序在各题的答题区内作答,超出范围的答案无效,在草纸、试卷上作答无效。
5、保持卡面清洁,不要折叠、不要弄破、弄皱,不准使用涂改液、刮纸刀。
6、填涂样例 正确 [■] 错误 [--][√] [×]
注意事项
1、答题前,考生先将自己的姓名、准考证号码填写清楚。
2、请将准考证条码粘贴在右侧的[条码粘贴处]的方框内
3、选择题必须使用2B铅笔填涂;非选择题必须用0.5毫米黑色字迹的签字笔填写,字体工整
4、请按题号顺序在各题的答题区内作答,超出范围的答案无效,在草纸、试卷上作答无效。
5、保持卡面清洁,不要折叠、不要弄破、弄皱,不准使用涂改液、刮纸刀。
6、填涂样例 正确 [■] 错误 [--][√] [×]
1. [A][B][C][D]
2. [A][B][C][D]
3. [A][B][C][D]
4. [A][B][C][D]
5. [A][B][C][D]
6. [A][B][C][D]
7. [A][B][C][D]
8. [A][B][C][D]
9. [A][B][C][D]
10. [A][B][C][D]
11. [A][B][C][D]
12. [A][B][C][D]
13. [A][B][C][D]
14. [A][B][C][D]
15. [A][B][C][D]
16. [A][B][C][D]
Ⅱ非选择题(请在各试题的答题区内作答)
-65722515240
17. (13分)
17. (13分)
-657225163830 18(10分)
18(10分)
-561975-695960 19(9分)
19(9分)
-62865016002020. (10分)
20. (10分)
-628650199263021. (10分)
21. (10分)
1
2
3
4
5
6
7
8
9
10
B
C
C
B
D
C
D
C
A
C
11
12
13
14
15
16
A
D
D
B
D
C
17(13分)Ⅰ、(1)名称为2-甲基-5-乙基辛烷(2分)。(2) __2,5,5-三甲基-4-乙基庚烷__(2分)。
(3)2,4-二甲基-3-乙基己烷(2分)
Ⅱ(4)
(2分)
(5)
(2分)
Ⅲ、(6) _主链选错_(1分)_;__编号顺序错__(1分)。__2-甲基丁烷_(1分)_。
18.(10分)(1)A(1分);(2)5(1分);反应后烧杯中自由离子的浓度约为原溶液的一半(1分);7(1分);
(3)A为多元强酸;(2分)(4)M++H2O?MOH+H+(2分);④⑤.(2分)
19.(9分)2Cr2O3+3O2+4Na2CO34Na2CrO4+4CO2 (2分) CuSO4(或CuSO4和H2SO4) (1分) 低温条件下,K2Cr2O7的溶解度在整个体系中最小,且K2Cr2O7的溶解度随温度的降低而显著减小(2分) Cr2false+6Fe2++14H+2Cr3++6Fe3++7H2O (2分) 49.0 (1分) 是 (1分)
20.(10分) (1)0.29 (1分) (2)c3(Ca2+)·c2(As)(2分) 5.7×10-17(2分)
(3)2H++MnO2+H3AsO3H3AsO4+Mn2++H2O(2分)(4)①CaSO4(1分)
②H3AsO4是弱酸,当溶液中pH调节到8左右时As浓度增大,Ca3(AsO4)2开始沉淀(2分)
21(10分).答案:(1)①A(2分) ②D(2分) (2)4×10-14 mol·L-1(2分)
(3)NH4Cl水解出来的H+与Mg(OH)2电离出的OH-结合生成水,使Mg(OH)2的溶解平衡正向移动(2分) (4)1(2分)
期中考试(化学)试卷
(考试时间:90分钟 总分:100分)
本试卷分第I卷(选择题)和第II卷(非选择题)两部分
可能用到的相对原子质量:H-1 C-12 N-14 O-16 Na-23 Mg-24 S-32 Cl-35.5 Ca-40 Mn-55 Cu-64 S-32 Fe-56 Cr-52
第Ⅰ卷 (选择题 共48分)
选择题:(16个小题,每小题3分,共48分,在每小题给出的四个选项中,只有一项是符合题目要求的)。
1.下列过程或现象与盐类水解无关的是( )
A.纯碱溶液去油污 B.铁在潮湿的环境下生锈
C.加热氯化铁溶液颜色变深 D.浓硫化钠溶液有臭鸡蛋味
2.根据下列操作及现象,所得结论正确的是( )
序号
操作及现象
结论
A
将0.1mol?L﹣1氨水稀释成0.01mol?L﹣1,测得pH由11.1变成10.6
稀释后NH3?H2O的电离程度减小
B
常温下,测得饱和Na2CO3溶液的pH大于饱和NaHCO3溶液
常温下水解程度:CO32﹣>HCO3﹣
C
向25mL冷水和沸水中分别滴入5滴FeCl3饱和溶液,前者为黄色,后者为红褐色
温度升高,Fe3+的水解程度增大
D
将固体CaSO4加入Na2CO3饱和溶液中,一段时间后,检验固体成分为CaCO3
同温下溶解度:CaSO4<CaCO3
3.某学生探究0.25mol/LAl2(SO4)3溶液与0.5mol/LNa2CO3溶液的反应,实验如下。
实验1
1635760899795白色沉淀a
白色沉淀a
2683510839470沉淀沉淀溶解,无气泡
沉淀沉淀溶解,无气泡
35560909320过量的Al2(SO4)3溶液
过量的Al2(SO4)3溶液
2121535137795稀H2SO4
稀H2SO4
218821038544578803534290076898595250Na2CO3溶液
过滤、洗涤
Na2CO3溶液
过滤、洗涤
实验2
2664460972820沉淀沉淀溶解,少量气泡
沉淀沉淀溶解,少量气泡
1597660963295白色沉淀b
白色沉淀b
-50165953770过量的Na2CO3溶液
过量的Na2CO3溶液
2064385182245稀H2SO4
稀H2SO4
2131060429895788035354330768985106680Al2(SO4)3溶液过滤、洗涤
Al2(SO4)3溶液过滤、洗涤
下列分析正确的是( )
A.实验1中,白色沉淀a是Al2(CO3)3
B.实验2中,白色沉淀b一定是Al2(OH)2(CO3)2
C.检验白色沉淀a、b是否洗涤干净,均可用盐酸酸化的BaCl2溶液
D.实验1、2中,白色沉淀成分不同的原因与混合后溶液的pH无关
4 、 下列说法正确的是
A.向0.1 mol·L?1的氨水中加少量硫酸铵固体,则溶液中增大
B.常温下,0.1 mol·L?1一元酸(HA)溶液pH=3,则该溶液中,c2(H+)=c(H+)×c(A?)+KW
C.向盐酸中加入氨水至中性,溶液中false
D.将Ca(ClO)2、Na2SO3、FeCl3、NaAlO2溶液蒸干均得不到原溶质
5.物质的量浓度相同的下列溶液中,含粒子种类最多的是( )
A.CaCl2 B.CH3COONa C.NH3 D.K2S
6.含MgCl2、AlCl3均为n mol的混合溶液,向其中滴NaOH溶液至过量.加入NaOH的物质的量与生成沉淀的物质的量的关系正确的是(离子(或物质)沉淀pH见表)( )
离子
Mg2+
Al3+
物质
Al(OH)3
开始沉淀pH
8.93
3.56
开始溶解pH
8.04
完全沉淀pH
10.92
4.89
完全溶解pH
12.04
3042285175260n(沉淀)
n(沉淀)
2667000129540-24765102235n(沉淀)
n(沉淀)
-485775114300
523303574295n(NaOH)
n(NaOH)
206121084455n(NaOH)
n(NaOH)
305181033020n(沉淀)
n(沉淀)
2790825679455143580645n(沉淀)
n(沉淀)
-28575085725
529971036830n(NaOH)
n(NaOH)
2251710100330n(NaOH)
n(NaOH)
7.一定温度下,下列溶液的离子浓度关系式正确的是( )
A.pH=5的H2S溶液中,c(H+)= c(HS-)=1×10-5 mol·L-1
B.pH=a的氨水溶液,稀释10倍后,其pH=b,则a=b+1
C.pH=2的H2CO3溶液与pH=12的NaOH溶液任意比例混合:c(Na+)+c(H+)=c(OH-)+ c(HC)
D.已知酸性CH3COOH>H2CO3>HClO,PH相同的①CH3COONa②NaHCO3③NaClO三种溶液的c(Na+):①>②>③
8.一定温度下,金属硫化物的沉淀溶解平衡曲线如图所示。纵坐标p(Mn+)表示-lg c(Mn+),横坐标p(S2-)表示-lg c(S2-),下列说法不正确的是( )
A.该温度下,Ag2S的Ksp=1.6×10-49 B.该温度下,溶解度的大小关系为NiS>SnS
C.SnS和NiS的饱和溶液中等=104
D.向含有等物质的量浓度的Ag+、Ni2+、Sn2+的溶液中加入饱和Na2S溶液,则析出沉淀的先后顺序为Ag2S、SnS、NiS
9.下列溶液中微粒的物质的量浓度关系正确的是( )
A.室温下,向0.01 mol·L-1 NH4HSO4溶液中滴加NaOH溶液至中性:
c平(Na+)>c平(SO)>c平(NH)>c平(OH-)=c平(H+)
B.0.1 mol·L-1 NaHCO3溶液:c平(Na+)>c平(OH-)>c平(HCO)>c平(H+)
C.Na2CO3溶液:c平(OH-)-c平(H+)=c平(HCO)+c平(H2CO3)
D.25 ℃时,pH=4.75、浓度均为0.1 mol·L-1的CH3COOH、CH3COONa混合溶液:c平(CH3COO-)+c平(OH-)
下列说法中,不正确的是( )
A.①中现象能说明Ag+与SCN-生成AgSCN沉淀的反应有限度
B.②中现象产生的原因是发生了反应Fe(SCN)3+3Ag+===3AgSCN↓+Fe3+
C.③中产生黄色沉淀的现象能证明AgI的溶解度比AgSCN的溶解度小
D.④中黄色沉淀溶解的原因可能是AgI与KI溶液中的I-进一步发生了反应
11.常温下,向20 mL 0.1 mol·L-1的HA溶液中逐滴加入0.1 mol·L-1的烧碱溶液,溶液中水所电离的c水(H+)随加入烧碱溶液体积的变化如图所示,下列说法正确的是( )
A.由图可知A-的水解平衡常数Kh约为1×10-9
B.C、E两点因为对水的电离的抑制作用和促进作用相同,所以溶液均呈中性
26276305080
B点的溶液中离子浓度之间存在:
c(Na+)=2c(A-)>c(H+)>c(OH-)
F点的溶液呈碱性,粒子浓度之
间存在:c(OH-)=c(HA)+c(A-)+c(H+)
12.通过滴加相同浓度的盐酸或KOH溶液来调节0.01 mol·L-1 Na2HAsO3溶液的pH,实验测得含砷的各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与溶液pH的关系如图所示。
下列有关说法正确的是( )
A.NaH2AsO3溶于水,所得溶液中H2AsO的水解程度小于其电离程度
B.K1(H3AsO3)的数量级为10-9 C.水的电离程度:a点大于b点
D.c点溶液中存在:c(Na+)=2c(H2AsO)+4c(HAsO)+2c(AsO)
13.室温下,反应HC+H2OH2CO3+OH-的平衡常数K=2.2×10-8。将NH4HCO3溶液和氨水按一定比例混合,可用于浸取废渣中的ZnO。若溶液混合引起的体积变化可忽略,室温时下列指定溶液中微粒物质的量浓度关系正确的是 ( )
A.0.2 mol·L-1氨水:c(NH3·H2O)>c(N) >c(OH-)>c(H+)
B.0.2 mol·L-1 NH4HCO3溶液(pH>7):c(N)>c(HC)>c(NH3·H2O) >c(H2CO3)
C.0.2 mol·L-1氨水和0.2 mol·L-1 NH4HCO3溶液等体积混合c(N)+c(NH3·H2O)=c(H2CO3)+c(HC)+c(C)
D.0.6 mol·L-1氨水和0.2 mol·L-1 NH4HCO3溶液等体积混合c(NH3·H2O)+c(C)+c(OH-)=0.3 mol·L-1+c(H2CO3)+c(H+)
14、某同学探究溶液的酸碱性对FeCl3水解平衡的影响,实验方案如下:配制50 mL 0.001 mol·L-1 FeCl3溶液、50 mL对照组溶液X,向两种溶液中分别滴加1滴1 mol·L-1 HCl溶液、1滴1 mol·L-1 NaOH溶液,测得溶液pH随时间变化的曲线如图所示。
下列说法不正确的是 ( )
A.依据M点对应的pH,说明Fe3+发生了水解反应
B.对照组溶液X的组成可能是0.003 mol·L-1 KCl
C.依据曲线c和d说明Fe3+水解平衡发生了移动
D.通过仪器检测体系浑浊度的变化,可表明水解平衡移动的方向
15.常温时,改变饱和氯水的pH,得到部分含氯微粒的物质的量分数与pH的关系如图所示。下列叙述不正确的是( )
A.该温度下,HClO?H++ClO-的电离常数Ka的对值lg Ka=-7.54
B.氯水中的Cl2、ClO-、HClO均能与KI发生反应
C.pH=1的氯水中,c(Cl2)>c(Cl)>c(HClO)>c(ClO-)
D.已知常温下反应Cl2(aq)+Cl-(aq)?Cl(aq)的K=0.191,当pH增大时,K减小
321818070675516.草酸(H2C2O4)是一种二元弱酸。常温下,向H2C2O4溶液中逐滴加入NaOH溶液,混合溶液中lg X与pH的变化关系如图所示。下列说法不正确的是( )
A.曲线Ⅰ表示lg与pH的变化关系
pH=1.22的溶液中:
2c(C2O)+c(HC2O)>c(Na+)
C.1.22<pH<4.19的溶液中:
c(HC2O)>c(C2O)>c(H2C2O4)
D.pH=4.19的溶液中:c(Na+)<3c(HC2O)
第Ⅱ卷 (非选择题 共52分)
17(13分)、根据要求回答下列问题
Ⅰ、用系统命名法给下列物质命名:
(1) ;?
(2) 的名称为 。
(3)
Ⅱ、根据下列有机物的名称,写出相应的结构简式
(4)3,5-二甲基庚烷
(5)
Ⅲ、按要求回答下列问题:
(6) 命名为“2-乙基丙烷”,错误原因是 ;将其命名为“3-甲基丁烷”,错误原因是 _。正确命名为 。
18.(9分)常温下,水的离子积Kw=1×10﹣14.有酸溶液A,pH=a;碱溶液B,pH=b.为测定A、B混合后溶液导电性的变化以及探究A、B的相关性质,某同学设计了如图所示的实验装置.
(1)实验时,滴定管中应盛 (选A或B)溶液.
(2)若A为一元强酸,B为一元强碱,且a+b=14.该同学在烧杯中先加入其中一种溶液,闭合开关K,测得烧杯中灯泡的亮度为10(假设亮度由暗到亮表示为1、2、3、…10、11、12、…20).
断开开关K,将滴定管中的溶液逐滴加入到烧杯中.当从滴定管滴入烧杯中的溶液体积和烧杯中盛有的溶液体积相等时,停止滴加溶液并闭合开关K,此时灯泡G的亮度约为 ,原因是 .烧杯中得到的溶液pH= .
(3)若A为强酸,B为强碱,且a+b=14.断开开关K,将滴定管中的溶液逐滴加入到烧杯中.当测得烧杯中溶液pH和“(2)”中最后得到的溶液pH相同时,停止滴加溶液.此时烧杯中的溶液中阳离子浓度大于阴离子浓度,原因可能是 .
3752850596265(4)若A的化学式为HR,B的化学式为MOH,且a+b=14,两者等体积混合后溶液显碱性.则混合溶液中必定有一种离子能发生水解,该水解反应的离子方程为 .此时烧杯中的混合溶液中,微粒浓度大小关系一定正确的是 (填序号).
①c(MOH)>c(M+)>c(R﹣)>c(H+)>c(OH﹣)
②c(HR)>c(M+)>c(R﹣)>c(OH﹣)>c(H+)
③c(R﹣)>c(M+)>c(H+)>c(OH﹣)
④c(M+)>c(R﹣)>c(OH﹣)>c(H+)
⑤c(M+)+c(H+)=c(R﹣)+c(OH﹣)
⑥c(MOH)=c(H+)﹣c(OH﹣)
19.(10分)某种电镀污泥主要含有碲化亚铜(Cu2Te)、三氧化二铬(Cr2O3)以及少量的金(Au),可以用于制取Na2Cr2O7溶液、金属铜和粗碲等,以实现有害废料的资源化利用,工艺流程如下:
已知:煅烧时,Cu2Te发生的反应为Cu2Te+2O22CuO+TeO2。
(1)煅烧时,Cr2O3发生反应的化学方程式为__________________。?
(2)浸出液中除了含有TeOSO4(在电解过程中不反应)外,还可能含有____(填化学式)。
(3)工业上用重铬酸钠(Na2Cr2O7)母液生产重铬酸钾(K2Cr2O7)的工艺流程如图所示:
通过冷却结晶能析出大量K2Cr2O7的原因是__________________。?
(4)测定产品中K2Cr2O7含量的方法如下:称取产品试样2.50 g配成250 mL溶液,用移液管取出25.00 mL于锥形瓶中,加入足量稀硫酸酸化后,再加入几滴指示剂,用0.1000 mol·L-1硫酸亚铁铵(NH4)2Fe(SO4)2标准液进行滴定,重复进行二次实验。(已知Cr200
false被还原为Cr3+)
①氧化还原滴定过程中的离子方程式为________________。?
②若三次实验消耗(NH4)2Fe(SO4)2标准液的平均体积为25.00 mL,则所得产品中K2Cr2O7的纯度为_____%。[已知M(K2Cr2O7)=294 g·mol-1,计算结果保留三位有效数字]。?
(5)上述流程中K2Cr2O7发生氧化还原反应后所得溶液中除含有Cr3+外,还含有一定浓度的Fe3+杂质,可通过加碱调pH的方法使两者转化为沉淀。已知c(Cr3+)=3×10-5 mol·L-1,则当溶液中开始析出Cr(OH)3沉淀时Fe3+是否沉淀完全?____(填“是”或“否”)。{已知:Ksp[Fe(OH)3]=4.0×10-38, Ksp[Cr(OH)3]=6.0×10-31}
20.(10分)以硫铁矿为原料生产硫酸所得的酸性废水中砷元素含量极高,为控制砷的排放,采用化学沉降法处理含砷废水,相关数据如下表。
表1 几种砷酸盐的Ksp
难溶物
Ksp
Ca3(AsO4)2
6.8×10-19
AlAsO4
1.6×10-16
FeAsO4
5.7×10-21
表2 工厂污染物排放浓度及允许排放标准
污染物
H2SO4
As
浓度
28.42 g·L-1
1.6 g·L-1
排放标准
pH 6~9
0.5 mg·L-1
回答下列问题:
(1)该硫酸工厂排放的废水中硫酸的物质的量浓度c(H2SO4)=___mol·L-1。 ?
(2)写出难溶物Ca3(AsO4)2的Ksp表达式:
Ksp[Ca3(AsO4)2]=____________。若混合溶液中Al3+、Fe3+的浓度均为1.0×10-4 mol·L-1,c(As)最大是________mol·L-1。?
(3)工厂排放出的酸性废水中的三价砷(H3AsO3为弱酸)不易沉降,可投入MnO2先将其氧化成五价砷(H3AsO4为弱酸),写出该反应的离子方程式:________。?
(4)在处理含砷废水时采用分段式,先向废水中投入生石灰调节pH到2,再投入生石灰将pH调节到8左右使五价砷以Ca3(AsO4)2的形式沉降。
①将pH调节到2时废水中有大量沉淀产生,沉淀主要成分的化学式为_____。 ?
②Ca3(AsO4)2在pH调节到8左右才开始沉淀的原因为____________。?
21.(10分)某研究小组进行Mg(OH)2沉淀溶解和生成的实验探究。
(查阅资料)25 ℃时,Ksp[Mg(OH)2]=1.8×10-11,Ksp[Fe(OH)3]=4.0×10-38。
(实验探究)向2支均盛有1 mL 0.1 mol·L-1 MgCl2溶液的试管中分别加入2滴2 mol·L-1 NaOH溶液,制得等量Mg(OH)2沉淀。
(1)分别向两支试管中加入不同试剂,记录实验现象如表:(表中填空填下列选项中字母代号)
试管编号
加入试剂
实验现象
Ⅰ
2滴0.1 mol·L-1 FeCl3溶液
①_____
Ⅱ
4 mL 2 mol·L-1 NH4Cl溶液
②_____
A.白色沉淀转化为红褐色沉淀 B.白色沉淀不发生改变
C.红褐色沉淀转化为白色沉淀 D.白色沉淀溶解,得无色溶液
(2)测得试管Ⅰ中所得混合液pH=6,则溶液中c(Fe3+)=______________。
(3)同学们猜想实验Ⅱ中沉淀溶解的主要原因有两种:
猜想1:NH结合Mg(OH)2电离出的OH-,使Mg(OH)2的溶解平衡正向移动。
猜想2:_________________________________________________________。
(4)为验证猜想,同学们取少量相同质量的氢氧化镁盛放在两支试管中,一支试管中加入醋酸铵溶液(pH=7),另一支试管中加入NH4Cl和氨水混合液(pH=8),两者沉淀均溶解。该实验证明猜想正确的是________(填“1”或“2”)。
太和一中2020—2021学年度高二第一学期化学答题卡
304038072390
条 码 粘 贴 处
(正面朝上贴在此虚线框内)
条 码 粘 贴 处
(正面朝上贴在此虚线框内)
试卷类型:B
姓名:______________班级:______________
准考证号
Ⅰ选择题(请用2B铅笔填涂)
2857557150缺考标记
考生禁止填涂缺考标记!只能由监考老师负责用黑色字迹的签字笔填涂。
缺考标记
考生禁止填涂缺考标记!只能由监考老师负责用黑色字迹的签字笔填涂。
-6477057150注意事项
1、答题前,考生先将自己的姓名、准考证号码填写清楚。
2、请将准考证条码粘贴在右侧的[条码粘贴处]的方框内
3、选择题必须使用2B铅笔填涂;非选择题必须用0.5毫米黑色字迹的签字笔填写,字体工整
4、请按题号顺序在各题的答题区内作答,超出范围的答案无效,在草纸、试卷上作答无效。
5、保持卡面清洁,不要折叠、不要弄破、弄皱,不准使用涂改液、刮纸刀。
6、填涂样例 正确 [■] 错误 [--][√] [×]
注意事项
1、答题前,考生先将自己的姓名、准考证号码填写清楚。
2、请将准考证条码粘贴在右侧的[条码粘贴处]的方框内
3、选择题必须使用2B铅笔填涂;非选择题必须用0.5毫米黑色字迹的签字笔填写,字体工整
4、请按题号顺序在各题的答题区内作答,超出范围的答案无效,在草纸、试卷上作答无效。
5、保持卡面清洁,不要折叠、不要弄破、弄皱,不准使用涂改液、刮纸刀。
6、填涂样例 正确 [■] 错误 [--][√] [×]
1. [A][B][C][D]
2. [A][B][C][D]
3. [A][B][C][D]
4. [A][B][C][D]
5. [A][B][C][D]
6. [A][B][C][D]
7. [A][B][C][D]
8. [A][B][C][D]
9. [A][B][C][D]
10. [A][B][C][D]
11. [A][B][C][D]
12. [A][B][C][D]
13. [A][B][C][D]
14. [A][B][C][D]
15. [A][B][C][D]
16. [A][B][C][D]
Ⅱ非选择题(请在各试题的答题区内作答)
-65722515240
17. (13分)
17. (13分)
-657225163830 18(10分)
18(10分)
-561975-695960 19(9分)
19(9分)
-62865016002020. (10分)
20. (10分)
-628650199263021. (10分)
21. (10分)
1
2
3
4
5
6
7
8
9
10
B
C
C
B
D
C
D
C
A
C
11
12
13
14
15
16
A
D
D
B
D
C
17(13分)Ⅰ、(1)名称为2-甲基-5-乙基辛烷(2分)。(2) __2,5,5-三甲基-4-乙基庚烷__(2分)。
(3)2,4-二甲基-3-乙基己烷(2分)
Ⅱ(4)
(2分)
(5)
(2分)
Ⅲ、(6) _主链选错_(1分)_;__编号顺序错__(1分)。__2-甲基丁烷_(1分)_。
18.(10分)(1)A(1分);(2)5(1分);反应后烧杯中自由离子的浓度约为原溶液的一半(1分);7(1分);
(3)A为多元强酸;(2分)(4)M++H2O?MOH+H+(2分);④⑤.(2分)
19.(9分)2Cr2O3+3O2+4Na2CO34Na2CrO4+4CO2 (2分) CuSO4(或CuSO4和H2SO4) (1分) 低温条件下,K2Cr2O7的溶解度在整个体系中最小,且K2Cr2O7的溶解度随温度的降低而显著减小(2分) Cr2false+6Fe2++14H+2Cr3++6Fe3++7H2O (2分) 49.0 (1分) 是 (1分)
20.(10分) (1)0.29 (1分) (2)c3(Ca2+)·c2(As)(2分) 5.7×10-17(2分)
(3)2H++MnO2+H3AsO3H3AsO4+Mn2++H2O(2分)(4)①CaSO4(1分)
②H3AsO4是弱酸,当溶液中pH调节到8左右时As浓度增大,Ca3(AsO4)2开始沉淀(2分)
21(10分).答案:(1)①A(2分) ②D(2分) (2)4×10-14 mol·L-1(2分)
(3)NH4Cl水解出来的H+与Mg(OH)2电离出的OH-结合生成水,使Mg(OH)2的溶解平衡正向移动(2分) (4)1(2分)
同课章节目录
