新疆生产建设兵团四师一中2020-2021学年高二上学期期中考试化学试题
文档属性
| 名称 | 新疆生产建设兵团四师一中2020-2021学年高二上学期期中考试化学试题 |  | |
| 格式 | docx | ||
| 文件大小 | 373.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-11-10 18:31:03 | ||
图片预览


文档简介
四师一中2020-2021学年第一学期高二年级期中化学考试试卷
考试时间:90分钟 卷面分值:100分
一、单选题(共18题,每题2.5分,共45分)
1.下列设备工作时,将化学能转化为热能的是 ( )
A
B
C
D
硅太阳能电池
锂离子电池
太阳能集热器
燃气灶
A.A B.B C.C D.D
2.电能是一种应用最广的能源。电能是(? ?)
A.一次能源 B.二次能源 C.可再生能源 D.不可再生能源
3.下列事实能用勒夏特列原理来解释的是( )
A.false被氧化为false,往往需要使用催化剂:false false
B.500 ℃温度比室温更有利于合成氨反应:false false false<0
C.false平衡混合气体加压后颜色加深:false 2HI(g)
D.实验室采用排饱和食盐水的方法收集氯气:false false
4.目前认为酸催化乙烯水合制乙醇的反应机理及能量与反应进程的关系如图所示。下列说
法正确的是( )
A.①、②、③三步反应均释放能量 B.该反应进程中有两个过渡态
C.第①步反应的活化能最小 D.总反应速率主要由第①步反应决定
5.100 mL6 mol·L-1的硫酸溶液与过量锌粉反应,在一定温度下为了减缓反应速率但又不影响生成氢气的总质量,可向反应物中加入适量的(?? )
A.硝酸钾 B.醋酸钠 C.硫酸氢钾 D.氯化氢气体
6.下列热化学方程式中,△H能正确表示物质的燃烧热的是( )
A. CO(g) +1/2O2(g)=CO2(g); △H=-283.0kJ/mol
B. C(s) +1/2O2(g)=CO(g); △H=-110.5kJ/mol
C. H2(g) +1/2O2(g)=H2O(g); △H=-241.8kJ/mol
D. 2C8H18(l) +25O2(g)=16CO2(g)+18H2O(l); △H=-11036kJ/mol
7.在5L的密闭容器中充入2mol气体A和1mol气体B,一定条件下发生反应2A(g)+B(g)2C(g)。达到平衡时,在相同温度下测得容器内混合气体的压强是反应前的5/6,则A的转化率为(?? )
A.67% B.50% C.25% D.5%
8.下列图示变化为放热反应的是( )
A. B.
C. D.
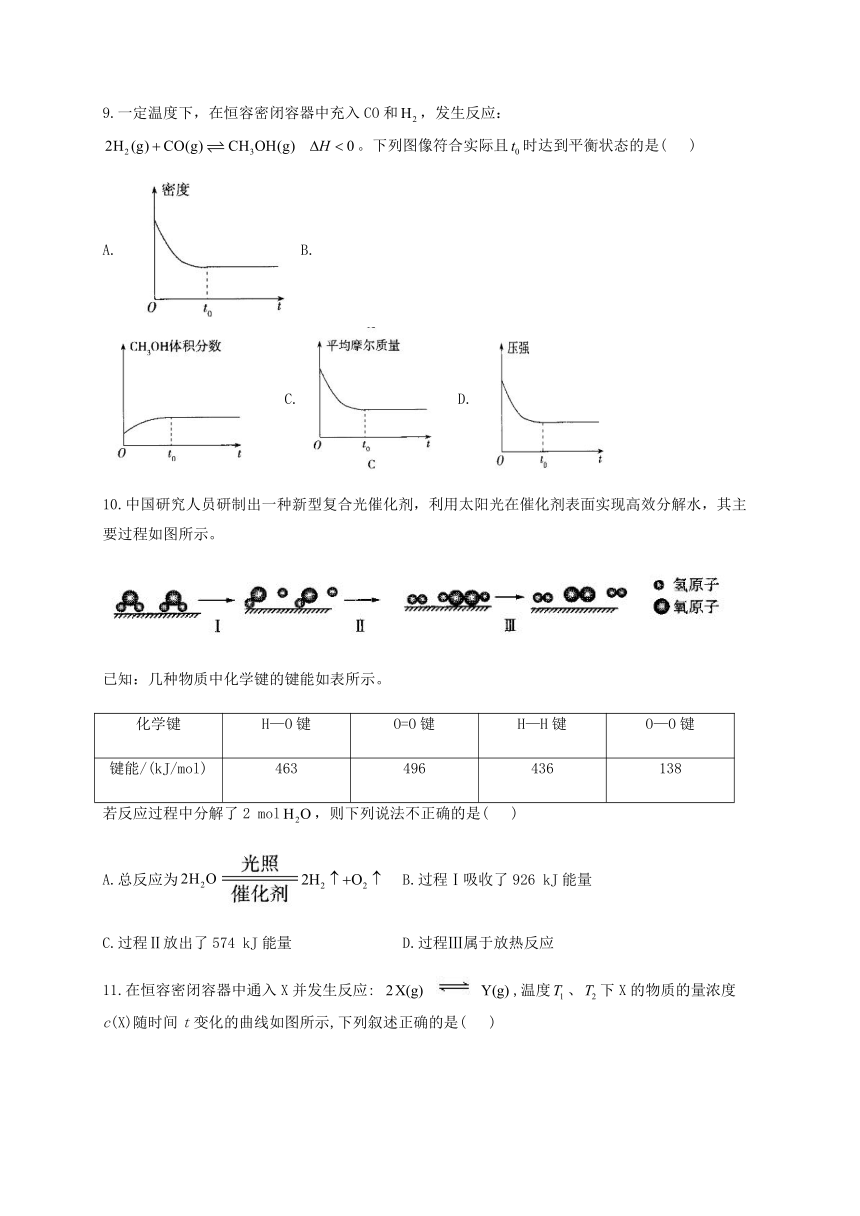
9.一定温度下,在恒容密闭容器中充入CO和false,发生反应:false。下列图像符合实际且false时达到平衡状态的是( )
A. B. C.D.
10.中国研究人员研制出一种新型复合光催化剂,利用太阳光在催化剂表面实现高效分解水,其主要过程如图所示。
已知:几种物质中化学键的键能如表所示。
化学键
H—O键
O=O键
H—H键
O—O键
键能/(kJ/mol)
463
496
436
138
若反应过程中分解了2 molfalse,则下列说法不正确的是( )
A.总反应为falsefalse B.过程Ⅰ吸收了926 kJ能量
C.过程Ⅱ放出了574 kJ能量 D.过程Ⅲ属于放热反应
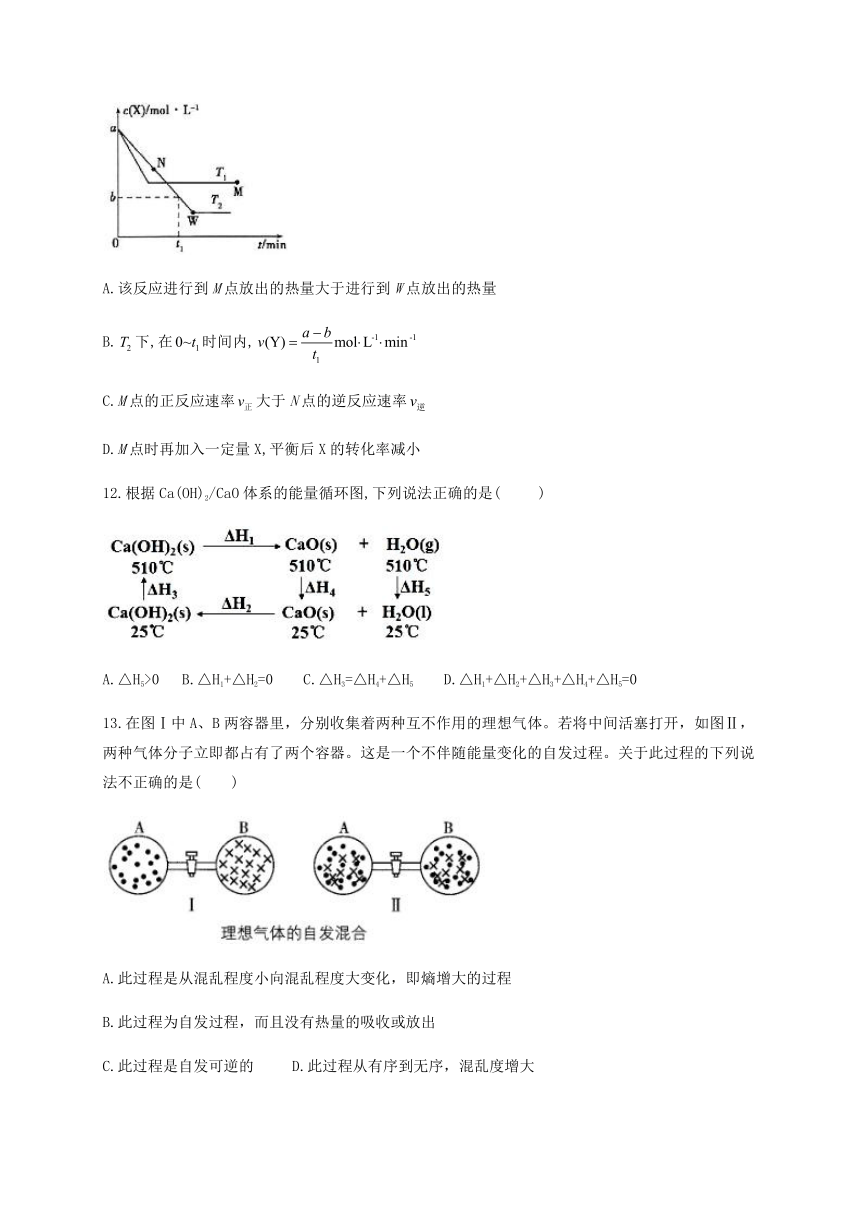
11.在恒容密闭容器中通入X并发生反应: false false,温度false、false下X的物质的量浓度c(X)随时间t变化的曲线如图所示,下列叙述正确的是( )
A.该反应进行到M点放出的热量大于进行到W点放出的热量
B.false下,在false时间内,false
C.M点的正反应速率false大于N点的逆反应速率false
D.M点时再加入一定量X,平衡后X的转化率减小
12.根据Ca(OH)2/CaO体系的能量循环图,下列说法正确的是(?? )
A.△H5>0 B.△H1+△H2=0 C.△H3=△H4+△H5 D.△H1+△H2+△H3+△H4+△H5=0
13.在图Ⅰ中A、B两容器里,分别收集着两种互不作用的理想气体。若将中间活塞打开,如图Ⅱ,两种气体分子立即都占有了两个容器。这是一个不伴随能量变化的自发过程。关于此过程的下列说法不正确的是( )
A.此过程是从混乱程度小向混乱程度大变化,即熵增大的过程
B.此过程为自发过程,而且没有热量的吸收或放出
C.此过程是自发可逆的 D.此过程从有序到无序,混乱度增大
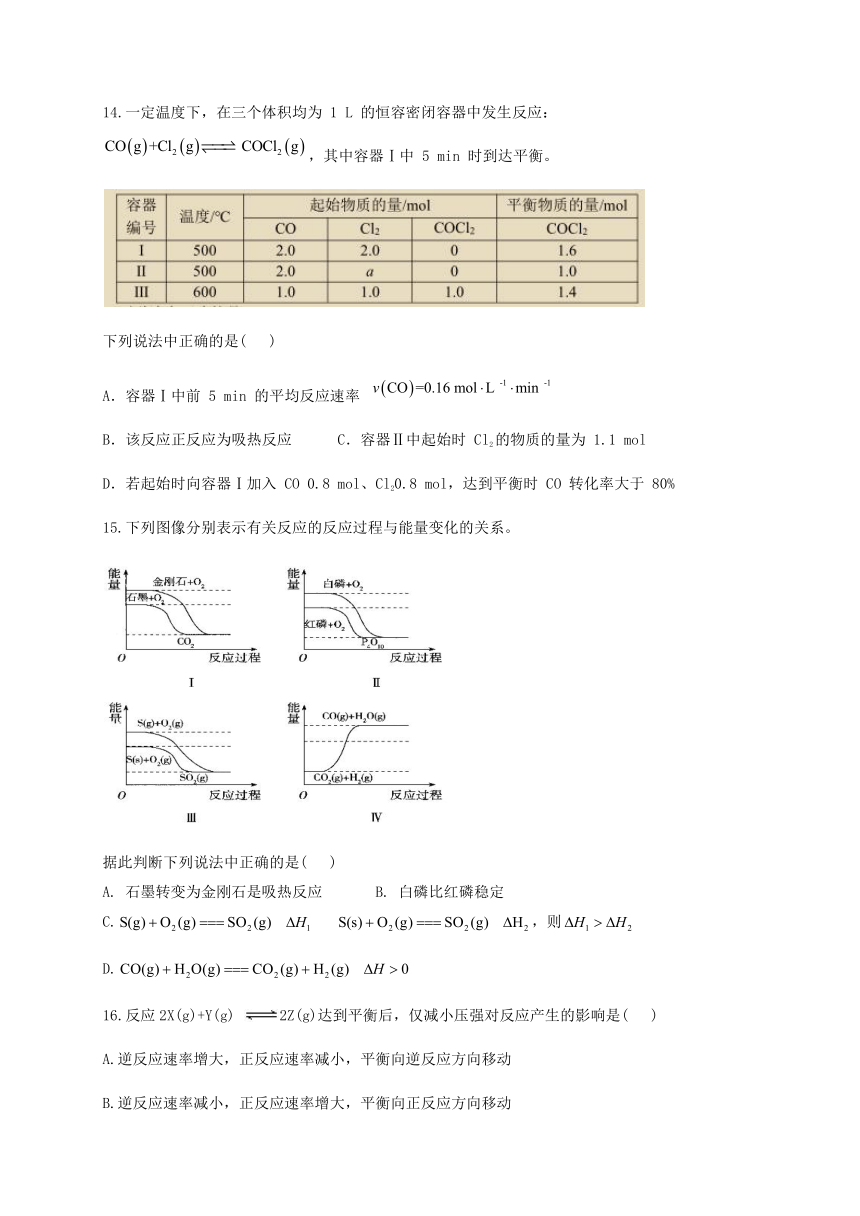
14.一定温度下,在三个体积均为 1 L 的恒容密闭容器中发生反应:,其中容器Ⅰ中 5 min 时到达平衡。
下列说法中正确的是( )
A.容器Ⅰ中前 5 min 的平均反应速率
B.该反应正反应为吸热反应 C.容器Ⅱ中起始时 Cl2的物质的量为 1.1 mol
D.若起始时向容器Ⅰ加入 CO 0.8 mol、Cl20.8 mol,达到平衡时 CO 转化率大于 80%
15.下列图像分别表示有关反应的反应过程与能量变化的关系。
据此判断下列说法中正确的是( )
A. 石墨转变为金刚石是吸热反应 B. 白磷比红磷稳定
C.false false,则false
D.false
16.反应2X(g)+Y(g) 2Z(g)达到平衡后,仅减小压强对反应产生的影响是( )
A.逆反应速率增大,正反应速率减小,平衡向逆反应方向移动
B.逆反应速率减小,正反应速率增大,平衡向正反应方向移动
C.正、逆反应速率都减小,平衡向逆反应方向移动
D.正、逆反应速率都增大,平衡向正反应方向移动
17.实验室用false与false进行反应:2SO2(g)+O2(g)2SO3(g) false,当放出314.624 kJ热量时,false的转化率为( )
A.40% B.50% C.80% D.90%
18.溶液中的反应:false分别在①、②、③三种不同实验条件下进行,它们的起始浓度false,false,反应物X的浓度随时间变化的关系如图所示。②、③与①比较只有一个实验条件不同,下列说法不正确的是( )
A.反应在0至 5.0min之间实验③的反应速率最快 B.实验②的反应最先达到平衡
C.与①相比,②可能是增大了压强 D.该反应的正反应是吸热反应
二、填空题(2题,共27分)
19(14分) Ⅰ.某温度时,在一个2L的密闭容器中,X、Y、Z三种气体物质的物质的量随时间的变化曲线如图所示。根据图中数据,试填写下列空白:
(1) 该反应的化学方程式为_______________。
(2)反应开始~2min,气体X的平均反应速率为_____。
(3)此反应在四种不同情况下的反应速率分别为:
①v(X)=5mol/( L·min )? ②v(Y)=0.05mol/( L·S )? ③v(Z)=4.5mol/(L·min) ?
其中反应速率最快的是__________(填编号)
Ⅱ.在恒容的密闭容器内,使1molN2和3molH2混合发生下列反应:false。
(1)升高温度时,混合气体的密度_________(填“变大”“变小”或“不变”)。
(2)当达到平衡时,充入N2,平衡将_________(填“正向”“逆向”或“不”,下同)移动。
(3)当达到平衡时,充入Ar,平衡将_________移动。
(4)当达到平衡时,将C(N2)、C(H2)、C(NH3)同时增大1倍,平衡将________移动。
20.(13分)回答下面各题。
Ⅰ.2018年,美国退出了《巴黎协定》实行再工业化战略,而中国却加大了环保力度,生动诠释了我国负责任的大国形象。近年我国大力加强温室气体CO2催化氢化合成甲醇技术的工业化生产研究,实现可持续发展。
已知: CO2(g)+H2(g)H2O(g) +CO(g) false= +41.1 kJ?mol-1 ; CO(g)+2H2(g)CH3OH(g) false=-90.0 kJ?mol-1
则CO2催化氢化合成甲醇的热化学方程式: 。
Ⅱ.工业上一般在恒容密闭容器中可以采用下列反应合成甲醇:CO(g)+2H2(g)CH3OH(g)
温度℃
250
300
350
K
2.041
0.270
0.012
如表所列数据是反应在不同温度下的化学平衡常数(K)
(1)该反应的化学平衡常数表达式为K=________________。
(2)由表中数据判断该反应的△H______0(填“>”、“=”或“<”);
(3)某温度下,将2molCO和6molH2充入2L的密闭容器中,充分反应后,达到平衡时测得false=0.2mol/L,
则此时的温度为 ℃。
(4)判断反应达到平衡状态的依据是(填字母序号) .
A.生成CH3OH的速率与消耗CO的速率相等
B.混合气体的密度不变
C.混合气体的相对平均分子质量不变
D.false的浓度都不再发生变化
(5)要提高CO的转化率,可以采取的措施是(填字母序号) .
a.增加CO的浓度 b.加入催化剂 c.升温 d.加入H2 e.加入惰性气体 f.分离出甲醇
三、实验题(2题,28分)
21.(14分)某实验小组用0.50mol/L NaOH溶液和0.50mol/LH2SO4溶液进行中和热的测定实验。
I.配制0.50mol/L NaOH溶液,若实验中大约要使用245mL NaOH溶液,则至少需要称量NaOH固体_______g。
II.实验小组组装的实验装置如图所示
(1)从实验装置上看,图中尚缺少的一种玻璃用品是__________,装置中仍存在的缺陷是____________________________。
(2)若将NaOH溶液改为相同体积、相同浓度的氨水,测得的中和热数值会____________(填“偏大”“偏小”或“无影响”,下同);若将NaOH溶液改为相同体积、相同浓度的Ba(OH)2溶液,测得的中和热数值会___________________。
(3)纠正好实验装置后进行实验,在实验测定过程中保证酸稍过量,原因是____________________________。最终实验结果的数值偏大,产生偏差的原因可能是__________(填字母)。
a.实验装置保温、隔热效果差
b.在量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有H2SO4溶液的小烧杯中
d.用温度汁测定NaOH溶液的起始温度后直接测定H2SO4溶液的起始温度
22.(14分)Ⅰ用酸性KMnO4和H2C2O4(草酸)反应研究影响反应速率的因素,离子方程式为
2MnO-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O。一实验小组欲通过测定单位时间内生成CO2的速率,探究某种影响化学反应速率的因素,设计实验方案如下(KMnO4溶液已酸化):
实验序号
A溶液
B溶液
①
20mL 0.1mol·L-1 H2C2O4溶液
30mL 0.01mol·L-1 KMnO4溶液
②
20mL 0.2mol·L-1 H2C2O4溶液
30mL 0.01mol·L-1 KMnO4溶液
(1)该实验探究的是__________因素对化学反应速率的影响。
(2)若实验①在2min末收集了4.48mL CO2(标准状况下),则在2min末,c(MnO4-)=__________mol·L-1。
(3)除通过测定一定时间内CO2的体积来比较反应速率外,本实验还可通过测定__________来比较化学反应速率。
(4)小组同学发现反应速率总是如图二,其中t1~t2时间内速率变快的主要原因可能是①该反应放热、②________________。
II.工业废水中常含有一定量的false和false,它们会对人类及生态系统产生很大的危害,必须进行处理。常用的处理方法有还原沉淀法,该法的工艺流程为:
其中第①步存在平衡:2 false(黄色)+2H+false(橙色)+H2O
(1)若平衡体系的pH=2,则溶液显________色;
(2)能说明第①步反应达平衡状态的是________;
a.溶液的颜色不变 b.2v (false)= v (false) c.false和false的浓度相同
(3)第②步中,还原1mol false离子,需要________mol的FeSO4·7H2O。
2020-2021学年第一学期高二年级期中化学考试答案
一、单选题(共16题,每题2.5分,共45分)
题号
1
2
3
4
5
6
7
8
9
答案
D
B
D
D
B
A
B
B
D
题号
10
11
12
13
14
15
16
17
18
答案
D
C
D
C
C
A
C
C
C
二、填空题(2题,共27分)
19(14分)I(1) 3X+Y2Z;(2)0.075mol/(L·min) ;(3)②
II(1)不变(2)正向(3)不(4)正向
20(13分) I.CO2(g)+3H2(g) CH3OH(g) + H2O(g) false=-48.9 kJ·mol-1 (3分)
II (1)K =false;(2) < ;(3)250; (4) C、D;(5) d、f
三、实验题(2题,28分)
21(14分)I..5.0 ;II.2(1)环形玻璃搅拌棒; 大小烧杯杯口未平(或大小烧杯杯口未平,大小烧杯间未用碎纸条填满);
(2)偏小; 偏大 (3)确保碱能反应完全 b
22(14分) Ⅰ(1)浓度; (2)0.0052; (3)KMnO4溶液完全退色所需时间(或产生相同体积气体所需时间)
(4)产物Mn2+(或MnSO4)是反应的催化剂.
II. (1)橙 (2)a (3)6
考试时间:90分钟 卷面分值:100分
一、单选题(共18题,每题2.5分,共45分)
1.下列设备工作时,将化学能转化为热能的是 ( )
A
B
C
D
硅太阳能电池
锂离子电池
太阳能集热器
燃气灶
A.A B.B C.C D.D
2.电能是一种应用最广的能源。电能是(? ?)
A.一次能源 B.二次能源 C.可再生能源 D.不可再生能源
3.下列事实能用勒夏特列原理来解释的是( )
A.false被氧化为false,往往需要使用催化剂:false false
B.500 ℃温度比室温更有利于合成氨反应:false false false<0
C.false平衡混合气体加压后颜色加深:false 2HI(g)
D.实验室采用排饱和食盐水的方法收集氯气:false false
4.目前认为酸催化乙烯水合制乙醇的反应机理及能量与反应进程的关系如图所示。下列说
法正确的是( )
A.①、②、③三步反应均释放能量 B.该反应进程中有两个过渡态
C.第①步反应的活化能最小 D.总反应速率主要由第①步反应决定
5.100 mL6 mol·L-1的硫酸溶液与过量锌粉反应,在一定温度下为了减缓反应速率但又不影响生成氢气的总质量,可向反应物中加入适量的(?? )
A.硝酸钾 B.醋酸钠 C.硫酸氢钾 D.氯化氢气体
6.下列热化学方程式中,△H能正确表示物质的燃烧热的是( )
A. CO(g) +1/2O2(g)=CO2(g); △H=-283.0kJ/mol
B. C(s) +1/2O2(g)=CO(g); △H=-110.5kJ/mol
C. H2(g) +1/2O2(g)=H2O(g); △H=-241.8kJ/mol
D. 2C8H18(l) +25O2(g)=16CO2(g)+18H2O(l); △H=-11036kJ/mol
7.在5L的密闭容器中充入2mol气体A和1mol气体B,一定条件下发生反应2A(g)+B(g)2C(g)。达到平衡时,在相同温度下测得容器内混合气体的压强是反应前的5/6,则A的转化率为(?? )
A.67% B.50% C.25% D.5%
8.下列图示变化为放热反应的是( )
A. B.
C. D.
9.一定温度下,在恒容密闭容器中充入CO和false,发生反应:false。下列图像符合实际且false时达到平衡状态的是( )
A. B. C.D.
10.中国研究人员研制出一种新型复合光催化剂,利用太阳光在催化剂表面实现高效分解水,其主要过程如图所示。
已知:几种物质中化学键的键能如表所示。
化学键
H—O键
O=O键
H—H键
O—O键
键能/(kJ/mol)
463
496
436
138
若反应过程中分解了2 molfalse,则下列说法不正确的是( )
A.总反应为falsefalse B.过程Ⅰ吸收了926 kJ能量
C.过程Ⅱ放出了574 kJ能量 D.过程Ⅲ属于放热反应
11.在恒容密闭容器中通入X并发生反应: false false,温度false、false下X的物质的量浓度c(X)随时间t变化的曲线如图所示,下列叙述正确的是( )
A.该反应进行到M点放出的热量大于进行到W点放出的热量
B.false下,在false时间内,false
C.M点的正反应速率false大于N点的逆反应速率false
D.M点时再加入一定量X,平衡后X的转化率减小
12.根据Ca(OH)2/CaO体系的能量循环图,下列说法正确的是(?? )
A.△H5>0 B.△H1+△H2=0 C.△H3=△H4+△H5 D.△H1+△H2+△H3+△H4+△H5=0
13.在图Ⅰ中A、B两容器里,分别收集着两种互不作用的理想气体。若将中间活塞打开,如图Ⅱ,两种气体分子立即都占有了两个容器。这是一个不伴随能量变化的自发过程。关于此过程的下列说法不正确的是( )
A.此过程是从混乱程度小向混乱程度大变化,即熵增大的过程
B.此过程为自发过程,而且没有热量的吸收或放出
C.此过程是自发可逆的 D.此过程从有序到无序,混乱度增大
14.一定温度下,在三个体积均为 1 L 的恒容密闭容器中发生反应:,其中容器Ⅰ中 5 min 时到达平衡。
下列说法中正确的是( )
A.容器Ⅰ中前 5 min 的平均反应速率
B.该反应正反应为吸热反应 C.容器Ⅱ中起始时 Cl2的物质的量为 1.1 mol
D.若起始时向容器Ⅰ加入 CO 0.8 mol、Cl20.8 mol,达到平衡时 CO 转化率大于 80%
15.下列图像分别表示有关反应的反应过程与能量变化的关系。
据此判断下列说法中正确的是( )
A. 石墨转变为金刚石是吸热反应 B. 白磷比红磷稳定
C.false false,则false
D.false
16.反应2X(g)+Y(g) 2Z(g)达到平衡后,仅减小压强对反应产生的影响是( )
A.逆反应速率增大,正反应速率减小,平衡向逆反应方向移动
B.逆反应速率减小,正反应速率增大,平衡向正反应方向移动
C.正、逆反应速率都减小,平衡向逆反应方向移动
D.正、逆反应速率都增大,平衡向正反应方向移动
17.实验室用false与false进行反应:2SO2(g)+O2(g)2SO3(g) false,当放出314.624 kJ热量时,false的转化率为( )
A.40% B.50% C.80% D.90%
18.溶液中的反应:false分别在①、②、③三种不同实验条件下进行,它们的起始浓度false,false,反应物X的浓度随时间变化的关系如图所示。②、③与①比较只有一个实验条件不同,下列说法不正确的是( )
A.反应在0至 5.0min之间实验③的反应速率最快 B.实验②的反应最先达到平衡
C.与①相比,②可能是增大了压强 D.该反应的正反应是吸热反应
二、填空题(2题,共27分)
19(14分) Ⅰ.某温度时,在一个2L的密闭容器中,X、Y、Z三种气体物质的物质的量随时间的变化曲线如图所示。根据图中数据,试填写下列空白:
(1) 该反应的化学方程式为_______________。
(2)反应开始~2min,气体X的平均反应速率为_____。
(3)此反应在四种不同情况下的反应速率分别为:
①v(X)=5mol/( L·min )? ②v(Y)=0.05mol/( L·S )? ③v(Z)=4.5mol/(L·min) ?
其中反应速率最快的是__________(填编号)
Ⅱ.在恒容的密闭容器内,使1molN2和3molH2混合发生下列反应:false。
(1)升高温度时,混合气体的密度_________(填“变大”“变小”或“不变”)。
(2)当达到平衡时,充入N2,平衡将_________(填“正向”“逆向”或“不”,下同)移动。
(3)当达到平衡时,充入Ar,平衡将_________移动。
(4)当达到平衡时,将C(N2)、C(H2)、C(NH3)同时增大1倍,平衡将________移动。
20.(13分)回答下面各题。
Ⅰ.2018年,美国退出了《巴黎协定》实行再工业化战略,而中国却加大了环保力度,生动诠释了我国负责任的大国形象。近年我国大力加强温室气体CO2催化氢化合成甲醇技术的工业化生产研究,实现可持续发展。
已知: CO2(g)+H2(g)H2O(g) +CO(g) false= +41.1 kJ?mol-1 ; CO(g)+2H2(g)CH3OH(g) false=-90.0 kJ?mol-1
则CO2催化氢化合成甲醇的热化学方程式: 。
Ⅱ.工业上一般在恒容密闭容器中可以采用下列反应合成甲醇:CO(g)+2H2(g)CH3OH(g)
温度℃
250
300
350
K
2.041
0.270
0.012
如表所列数据是反应在不同温度下的化学平衡常数(K)
(1)该反应的化学平衡常数表达式为K=________________。
(2)由表中数据判断该反应的△H______0(填“>”、“=”或“<”);
(3)某温度下,将2molCO和6molH2充入2L的密闭容器中,充分反应后,达到平衡时测得false=0.2mol/L,
则此时的温度为 ℃。
(4)判断反应达到平衡状态的依据是(填字母序号) .
A.生成CH3OH的速率与消耗CO的速率相等
B.混合气体的密度不变
C.混合气体的相对平均分子质量不变
D.false的浓度都不再发生变化
(5)要提高CO的转化率,可以采取的措施是(填字母序号) .
a.增加CO的浓度 b.加入催化剂 c.升温 d.加入H2 e.加入惰性气体 f.分离出甲醇
三、实验题(2题,28分)
21.(14分)某实验小组用0.50mol/L NaOH溶液和0.50mol/LH2SO4溶液进行中和热的测定实验。
I.配制0.50mol/L NaOH溶液,若实验中大约要使用245mL NaOH溶液,则至少需要称量NaOH固体_______g。
II.实验小组组装的实验装置如图所示
(1)从实验装置上看,图中尚缺少的一种玻璃用品是__________,装置中仍存在的缺陷是____________________________。
(2)若将NaOH溶液改为相同体积、相同浓度的氨水,测得的中和热数值会____________(填“偏大”“偏小”或“无影响”,下同);若将NaOH溶液改为相同体积、相同浓度的Ba(OH)2溶液,测得的中和热数值会___________________。
(3)纠正好实验装置后进行实验,在实验测定过程中保证酸稍过量,原因是____________________________。最终实验结果的数值偏大,产生偏差的原因可能是__________(填字母)。
a.实验装置保温、隔热效果差
b.在量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有H2SO4溶液的小烧杯中
d.用温度汁测定NaOH溶液的起始温度后直接测定H2SO4溶液的起始温度
22.(14分)Ⅰ用酸性KMnO4和H2C2O4(草酸)反应研究影响反应速率的因素,离子方程式为
2MnO-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O。一实验小组欲通过测定单位时间内生成CO2的速率,探究某种影响化学反应速率的因素,设计实验方案如下(KMnO4溶液已酸化):
实验序号
A溶液
B溶液
①
20mL 0.1mol·L-1 H2C2O4溶液
30mL 0.01mol·L-1 KMnO4溶液
②
20mL 0.2mol·L-1 H2C2O4溶液
30mL 0.01mol·L-1 KMnO4溶液
(1)该实验探究的是__________因素对化学反应速率的影响。
(2)若实验①在2min末收集了4.48mL CO2(标准状况下),则在2min末,c(MnO4-)=__________mol·L-1。
(3)除通过测定一定时间内CO2的体积来比较反应速率外,本实验还可通过测定__________来比较化学反应速率。
(4)小组同学发现反应速率总是如图二,其中t1~t2时间内速率变快的主要原因可能是①该反应放热、②________________。
II.工业废水中常含有一定量的false和false,它们会对人类及生态系统产生很大的危害,必须进行处理。常用的处理方法有还原沉淀法,该法的工艺流程为:
其中第①步存在平衡:2 false(黄色)+2H+false(橙色)+H2O
(1)若平衡体系的pH=2,则溶液显________色;
(2)能说明第①步反应达平衡状态的是________;
a.溶液的颜色不变 b.2v (false)= v (false) c.false和false的浓度相同
(3)第②步中,还原1mol false离子,需要________mol的FeSO4·7H2O。
2020-2021学年第一学期高二年级期中化学考试答案
一、单选题(共16题,每题2.5分,共45分)
题号
1
2
3
4
5
6
7
8
9
答案
D
B
D
D
B
A
B
B
D
题号
10
11
12
13
14
15
16
17
18
答案
D
C
D
C
C
A
C
C
C
二、填空题(2题,共27分)
19(14分)I(1) 3X+Y2Z;(2)0.075mol/(L·min) ;(3)②
II(1)不变(2)正向(3)不(4)正向
20(13分) I.CO2(g)+3H2(g) CH3OH(g) + H2O(g) false=-48.9 kJ·mol-1 (3分)
II (1)K =false;(2) < ;(3)250; (4) C、D;(5) d、f
三、实验题(2题,28分)
21(14分)I..5.0 ;II.2(1)环形玻璃搅拌棒; 大小烧杯杯口未平(或大小烧杯杯口未平,大小烧杯间未用碎纸条填满);
(2)偏小; 偏大 (3)确保碱能反应完全 b
22(14分) Ⅰ(1)浓度; (2)0.0052; (3)KMnO4溶液完全退色所需时间(或产生相同体积气体所需时间)
(4)产物Mn2+(或MnSO4)是反应的催化剂.
II. (1)橙 (2)a (3)6
同课章节目录
