陕西省黄陵中学2020-2021学年高二(本部)上学期期中考试化学试题
文档属性
| 名称 | 陕西省黄陵中学2020-2021学年高二(本部)上学期期中考试化学试题 |  | |
| 格式 | docx | ||
| 文件大小 | 229.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-11-10 21:57:16 | ||
图片预览



文档简介
黄陵中学2020-2021学年第一学期期中考试
本部高二化学试题
第 Ⅰ 卷
一、单选题(共20题;共60分)
1.下列能源组合中,均属于新能源的一组是( ??)
?①天然气②煤③核能④石油⑤太阳能⑥生物质能⑦风能⑧氢能
A.?①②③④???B.?③⑤⑥⑦⑧?C.?①③⑤⑥⑦⑧??D.①⑤⑥⑦⑧?
2.“即食即热型快餐”适合外出旅行时使用。其内层是用铝箔包裹的并已加工好的真空包装食品,外层则是分别包装的两包化学物质,使用时拉动预留在外的拉线使这两种物质反应,放出的热量便可对食物进行加热,这两包化学物质最合适的选择是:(?? )
A.?生石灰和水????B.浓硫酸和水????C.?熟石灰和水????D.?烧碱和水
3.N2H4是一种高效清洁的火箭燃料。0.25 mol N2H4(g)完全燃烧生成氮气和气态水时,放出133.5 kJ热量。则下列热化学方程式中正确的是(?? )
A.?1/2N2H4(g)+1/2O2(g)=1/2N2(g)+H2O(g)? ΔH=+267 kJ·mol-1
B.?N2H4(g)+O2(g)=N2(g)+2H2O(l)????? ΔH=-133.5 kJ·mol-1
C.?N2H4(g)+O2(g)=N2(g)+2H2O(g)????? ΔH=+534 kJ·mol-1
D.N2H4(g)+O2(g)=N2(g)+2H2O(g)?????ΔH=-534 kJ·mol-1
4.铜锌原电池(如图)工作时,下列叙述错误的是(???? )
A.?正极反应为:Cu2++2e–= Cu??????B.?电池反应为:Zn+Cu2+=Zn2+ +Cu
C.?盐桥中的K+移向ZnSO4溶液D.在外电路中,电子从负极流向正极?
5.在原电池和电解池的电极上所发生的反应,属于氧化反应的是(??? )
A.?原电池的正极和电解池的阳极所发生的反应?
B.?原电池的负极和电解池的阳极所发生的反应
原电池的正极和电解池的阴极所发生的反应?????????
D.?原电池的负极和电解池的阴极所发生的反应
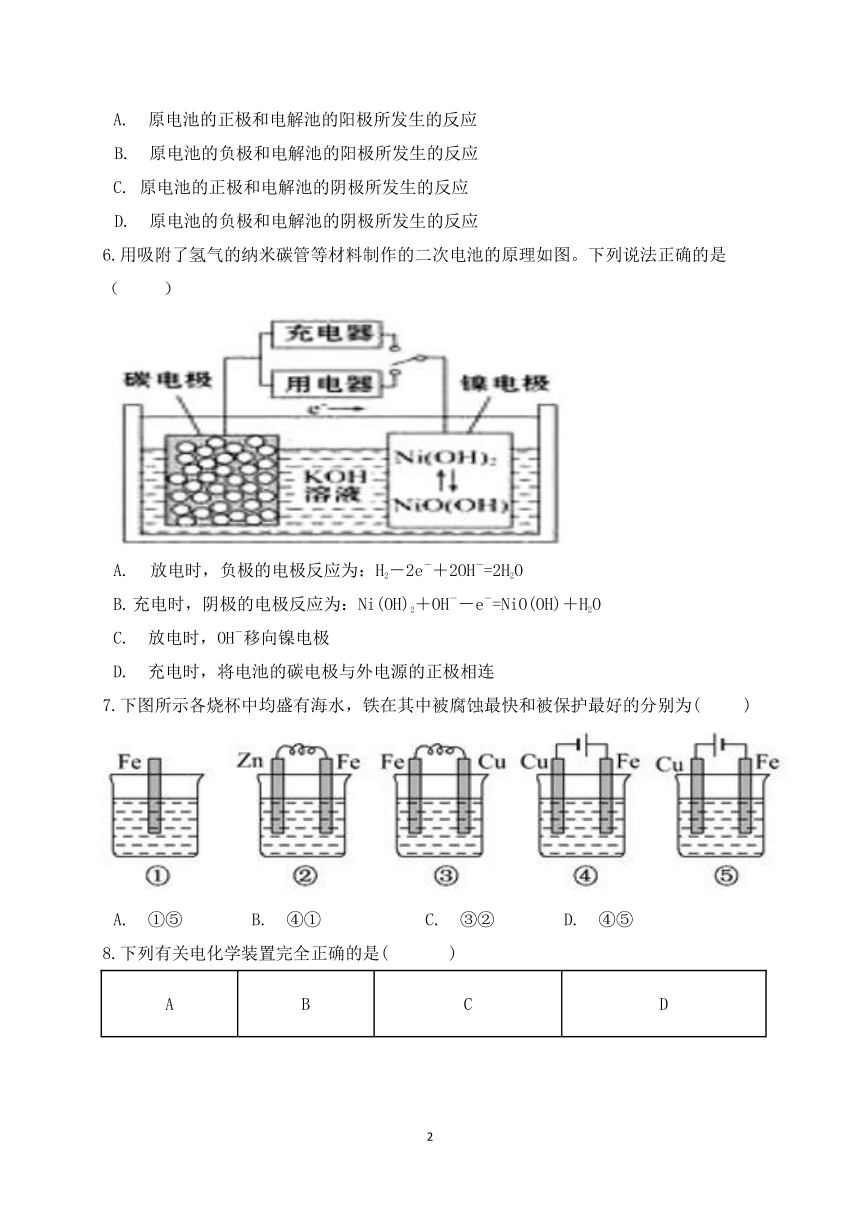
6.用吸附了氢气的纳米碳管等材料制作的二次电池的原理如图。下列说法正确的是(?? )
?放电时,负极的电极反应为:H2-2e-+2OH-=2H2O
充电时,阴极的电极反应为:Ni(OH)2+OH--e-=NiO(OH)+H2O?
C.?放电时,OH-移向镍电极
D.?充电时,将电池的碳电极与外电源的正极相连
7.下图所示各烧杯中均盛有海水,铁在其中被腐蚀最快和被保护最好的分别为(?? )
A.?①⑤????B.?④①??????C.?③②????D.?④⑤?
8.下列有关电化学装置完全正确的是(??? )
A
B
C
D
铜的精炼
铁上镀银
防止Fe被腐蚀
构成铜锌原电池
9.决定化学反应速率的内因是(?? )
①温度?? ②压强?? ③催化剂?? ④浓度?? ⑤反应物本身的性质
A.?①②③④⑤????B.?⑤????C.?①④????D.?①②③④
10.下列生产生活中需要增大化学反应速率的是( ??)
A.?铁桥生锈 ?????B.?牛奶变质
C.?塑料老化 ?????D.?高炉炼铁
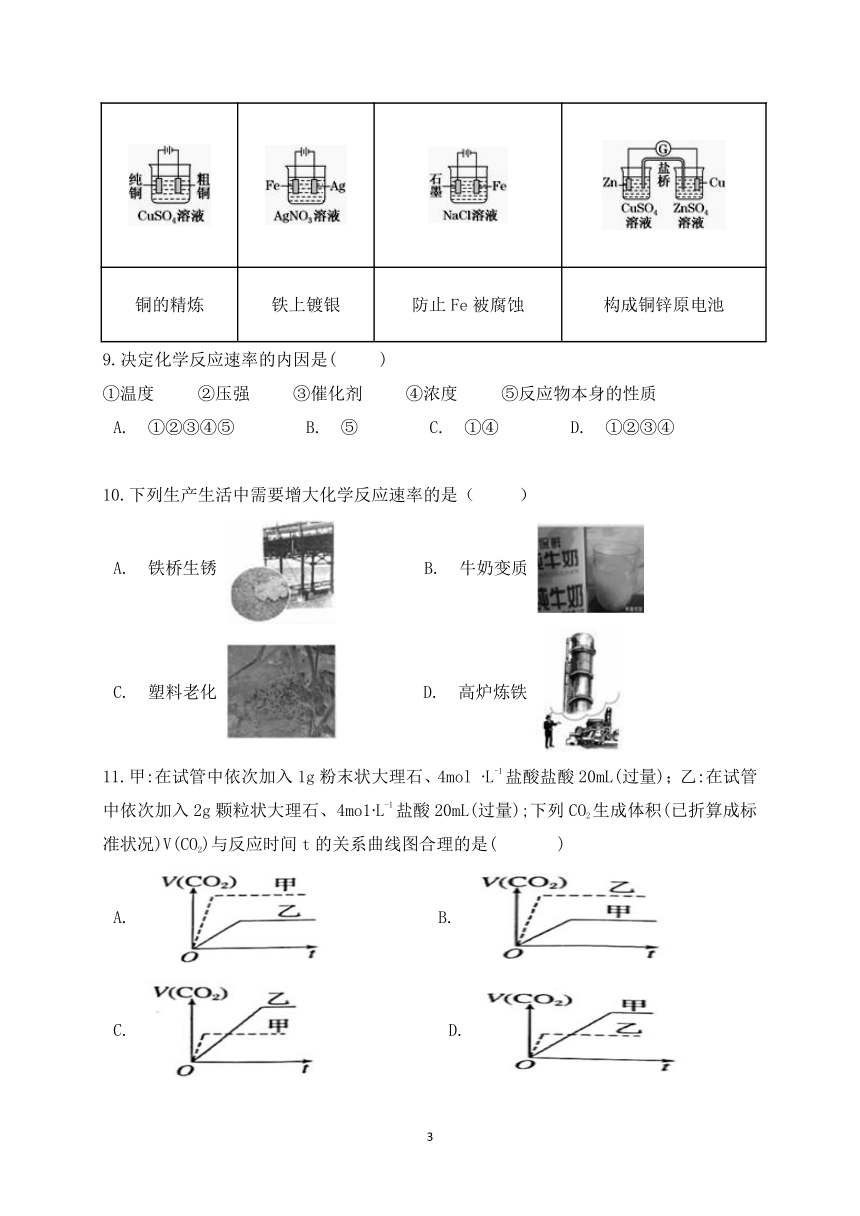
11.甲:在试管中依次加入1g粉末状大理石、4mol ?L-1盐酸盐酸20mL(过量);乙:在试管中依次加入2g颗粒状大理石、4mo1?L-1盐酸20mL(过量);下列CO2生成体积(已折算成标准状况)V(CO2)与反应时间t的关系曲线图合理的是(??? )
A.???????B.?
C.????????D.?
12.化学与生活生产密切相关。下列说法中错误的是()
A.?将海水直接电解可获得 Mg及Cl2等单质
B.?夏天冰箱保鲜食品的原理是降低温度,减小化学反应速率
C.?施用适量石膏(CaSO4·2H2O)可降低盐碱地(含较多NaCl、Na2CO3)的碱性
D.?施肥时,铵态氮肥不能与草木灰(含K2CO3)混合使用
13.反应A(g)+3B(g)=2C(g)+2D(g)在四种不同情况下的反应速率分别为:
①v(A)=0.45 mol·L-1·s-1 ②v(B)=0.6 mol·L-1·s-1 ③v(C)=0.4 mol·L-1·s-1
④v(D)=0.45 mol·L-1·s-1。下列有关反应速率的比较中正确的是(? )
A.?④>③=②>①??B.?①>④>②=③??C.?①>②>③>④??D.?④>③>②>①
14.反应O2+2SO2??2SO3?经一段时间后,SO3的浓度增加了0.4 mol·L-1?, 在这段时间内用O2表示的反应速率为0.04 mol·L-1·s-1?, 则这段时间为(?? )
A .0.1 s???B .?7.5 s??C .5 s???D .10 s
15.在一定温度下的恒容密闭容器中发生反应:2SO2(g) + O2(g)?2SO3(g),下列证据不能说明反应一定达到化学平衡状态的是( ??)
A.?容器内的压强不再改变???B.c(SO2):c(O2):c(SO3) = 2:1:2?
C.?SO2 的转化率不再改变???D.?SO3 的生成速率与 SO3 的消耗速率相等
16.一定温度下在容积恒定的密闭容器中,进行如下可逆反应:A(s)+2B(g)? C(g)+D(g),下列叙述能表明该反应已达到平衡状态的是( ??)
①混合气体的密度不再变化时 ②容器内气体的压强不再变化时 ③混合气体的总物质的量不再变化时 ④B的物质的量浓度不再变化时 ⑤混合气体的平均相对分子质量不再变化时 ⑥v正(B)=2v逆(C)时
A.?只有④?????B.?②③⑥????C.?②④⑤⑥????D.?①④⑤⑥
17.对于温度与反应方向的关系,下列判断不正确的是(? )
A.?△H<0 ,△S>0,所有温度下反应自发进行????????
B.?△H>0 ,△S>0,所有温度下反应自发进行
C.?△H<0 ,△S<0,低温下反应自发进行???????????????
D.?△H>0 ,△S<0,所有温度下反应均不能自发进行
18.下列有关生活生产中的叙述合理的是()
A.?工业上合成氨采用500℃左右的温度,其原因是适当加快NH3 的合成速率,催化剂在500℃左右时其活性最好,且能提高H2的转化率
B.?明矾和漂白粉分别用于自来水的净化和杀菌消毒,两者的作用原理相同
C.?水库的钢闸门与电源负极相连以防止其生锈,该法即牺牲阳极的阴极保护法
D.?铜的精炼工业和电镀铜工业,均可采用CuSO4溶液做电解质溶液
19.将固体NH4I置于密闭容器中,在一定温度下发生下列反应:
①NH4I(s) NH3(g)+HI(g);②2HI(g) H2(g)+I2(g)达到平衡时,c(H2)=0.5mol·L-1 , c(HI)=4mol·L-1 , 则此温度下,反应①的平衡常数为( ??)
A.?20??B.?16??C.9???D.?25
20.在一定温度下,将气体X和气体Y 各0.16mol充入10L恒容密闭容器中,发生反应
X(g)+Y(g)?2Z(g)△H<0,一段时间后达到平衡.反应过程中测定的数据如下表,下列说法正确的是(?? )
t/min
2
4
7
9
n(Y)/mol
0.12
0.11
0.10
0.10
A .反应前2min的平均速率v(Z)=2.0×10﹣3?mol/(L?min)
B .其他条件不变,降低温度,正反应速率减慢,逆反应速率加快
C .该温度下此反应的平衡常数K=1.44
D .其他条件不变,再充入0.2 mol Z,平衡时X的体积分数不变
第 Ⅱ 卷
二、填空题(共4题;每空1分,共17分)
21.完成下列问题
(1)已知C(s)+O2(g)=CO2(g)△H1=﹣393.5kJ/mol,
2CO(g)+O2(g)=2CO2(g)△H2=﹣566.0kJ/mol,
C(s)+1/2 O2(g)=CO(g)△H3=akJ/mol,则a=________.
(2)甲醇是一种可再生能源,具有广泛的开发和应用前景.工业上常采用下列反应合成甲醇: CO(g)+2H2(g)?CH3OH(g)△H1
下表所列数据是反应在不同温度下的化学平衡常数(K).
温度
250℃
300℃
350℃
K
2.041
0.270
0.012
由表中数据判断△H1________0 (填“>”、“=”或“<”).
某温度下,将2molCO和6molH2充入2L的密闭容器中,充分反应,达到平衡后,测得
c(CO)=0.2mol/L,则CO的转化率为________,此时的温度为________(从上表中选择).
22.原电池是化学对人类的一项重大贡献。某兴趣小组为研究原电池原理,设计如图装置:
①a和b不连接时,烧杯中现象是________。
②a和b用导线连接,Cu极为原电池________极(填“正”或“负”),电极反应式为:________;溶液中H+移向________(填“Cu”或“Zn”)极。电池总反应式为:________。
③若电解质溶液改为AgNO3溶液,当转移0.2mol电子时,则理论上Cu片质量变化为________g。
23.在一定温度下的2L固定容积的密闭容器中,通入2mol CO2和3mol H2 , 发生的反应为CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=﹣akJ?mol﹣1(a>0),测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示.
①能说明该反应已达平衡状态的是________(填编号).
A.单位时间内每消耗1.2mol H2 , 同时生成0.4mol H2O
B.CO2的体积分数在混合气体中保持不变
C.混合气体的平均相对分子质量不随时间的变化而变化
D.该体系中H2O与CH3OH的物质的量浓度之比为1:1,且保持不变
②若要使K=1,则改变的条件可以是________(填选项).
A.增大压强 B.减小压强 C.升高温度?? D.降低温度 E.加入催化剂.
24.工业上用CO生产燃料甲醇.一定条件下发生反应:CO(g)+2H2(g)?CH3OH(g).
(1)图1是表示一定温度下,在体积为2L的密闭容器中加入4mol H2和一定量的CO后,CO和CH3OH(g)的浓度随时间变化情况.从反应开始到平衡,用CO浓度变化表示平均反应速率v(CO)=
(2)图2表示该反应进行过程中能量的变化.曲线a表示不使用催化剂时反应的能量变化,曲线b表示使用催化剂后的能量变化.该反应是 (选填“吸热”或“放热”)反应,写出反应的热化学方程式 .
(3)该反应平衡常数K为 ,温度升高,平衡常数K (填“增大”、“不变”或“减小”).
三、实验探究题(共2题;每空2分,共16分)
25.中和热的测定实验(如图).
①量取反应物时,取50mL0.50mol?L﹣1的盐酸,还应加入的试剂是________(填序号).
A.50mL0.50mol?L﹣1NaOH溶液
B.50mL0.55mol?L﹣1NaOH溶液
C.1.0gNaOH固体
②在该实验过程中,该同学需要测定的实验数据有________(填序号).
A.盐酸的浓度????????? B.盐酸的温度
C.氢氧化钠溶液的浓度??? D.氢氧化钠溶液的温度
E.水的比热容????????? F.反应后混合溶液的终止温度
③若用50mL0.5mol?L﹣1醋酸溶液代替上述盐酸测定中和热,所得数据________.(填“偏大”或“偏小”或“不变”)
26.某化学反应2A ? B+D在四种不同条件下进行,B、D起始浓度为见反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表:
根据上述数据,完成下列填空:
(1)在实验1,反应存10至20分钟时间内平均速率为________mol/(L·min)。
(2)在实验2,A的初始浓度c2=________mol/L,反应经20分钟就达到平衡,可推测实验2中还隐含的条件是________。
(3)设实验3的反应速率为v3 , 实验1的反应速率为v1 , 则v3________v1(填>、<、=)。
(4)比较实验4和实验1,可推测该反应是________反应(选填吸热、放热)。
四.计算题(共7分)
27.某温度下,将2mol SO2与1molO2放入1L的密闭容器中,在一定条件下反应达到平衡:
2SO2(g)+ O2(g)?2SO3(g) 测得平衡时混合物总的物质的量为2.5mol,求:
(1)平衡时各物质的浓度;
(2)平衡时SO2的转化率:
(3)计算该温度下的平衡常数。
高二化学期中考试参考答案
一、选择题(3*20)
1、B 2、A 3、D 4、C 5、B 6、A 7、D 8、C 9、B 10、D
11、C 12、A 13、B 14、C 15、B 16、D 17、B 18、D 19、A 20、C
二、填空题
21、 (1)-110.5 (2)< 80% 250OC
22、①锌片上有气泡冒出
② 正 2H++2e-=H2 Cu Zn+H2SO4=ZnSO4+H2 ③21.6
(1) BC (2) D
24、(1)0.075 mol?L﹣1?min﹣1;
(2)放热, CO(g)+2H2(g)=CH3OH(g)△H=﹣91 kJ?mol﹣1;
(3)12, 减小;
三、实验题
25、①B ②BDF ③偏小
26、①0.013 ②1.0 加入催化剂 ③ > ④吸热
四计算题
27、解:设有已转化的SO2为Xmol?L﹣1
2SO2 + O2 2SO3
起始(mol?L﹣1) 2 1 0
转化mol?L﹣1) X 0.5X X
平衡(mol?L﹣1) 2-X 1-0.5X X
(2-X)+(1-0.5X)+ X=5 X=1mol?L﹣1
平衡时各物质的浓度为:C(SO2)=(2-1) mol/4L=1 mol/L
C(O2)=0.5 mol/L
C(SO3)= 1 mol/L
平衡时SO2的转化率为: (1/2) ×100% = 50%
K=2
答:略
本部高二化学试题
第 Ⅰ 卷
一、单选题(共20题;共60分)
1.下列能源组合中,均属于新能源的一组是( ??)
?①天然气②煤③核能④石油⑤太阳能⑥生物质能⑦风能⑧氢能
A.?①②③④???B.?③⑤⑥⑦⑧?C.?①③⑤⑥⑦⑧??D.①⑤⑥⑦⑧?
2.“即食即热型快餐”适合外出旅行时使用。其内层是用铝箔包裹的并已加工好的真空包装食品,外层则是分别包装的两包化学物质,使用时拉动预留在外的拉线使这两种物质反应,放出的热量便可对食物进行加热,这两包化学物质最合适的选择是:(?? )
A.?生石灰和水????B.浓硫酸和水????C.?熟石灰和水????D.?烧碱和水
3.N2H4是一种高效清洁的火箭燃料。0.25 mol N2H4(g)完全燃烧生成氮气和气态水时,放出133.5 kJ热量。则下列热化学方程式中正确的是(?? )
A.?1/2N2H4(g)+1/2O2(g)=1/2N2(g)+H2O(g)? ΔH=+267 kJ·mol-1
B.?N2H4(g)+O2(g)=N2(g)+2H2O(l)????? ΔH=-133.5 kJ·mol-1
C.?N2H4(g)+O2(g)=N2(g)+2H2O(g)????? ΔH=+534 kJ·mol-1
D.N2H4(g)+O2(g)=N2(g)+2H2O(g)?????ΔH=-534 kJ·mol-1
4.铜锌原电池(如图)工作时,下列叙述错误的是(???? )
A.?正极反应为:Cu2++2e–= Cu??????B.?电池反应为:Zn+Cu2+=Zn2+ +Cu
C.?盐桥中的K+移向ZnSO4溶液D.在外电路中,电子从负极流向正极?
5.在原电池和电解池的电极上所发生的反应,属于氧化反应的是(??? )
A.?原电池的正极和电解池的阳极所发生的反应?
B.?原电池的负极和电解池的阳极所发生的反应
原电池的正极和电解池的阴极所发生的反应?????????
D.?原电池的负极和电解池的阴极所发生的反应
6.用吸附了氢气的纳米碳管等材料制作的二次电池的原理如图。下列说法正确的是(?? )
?放电时,负极的电极反应为:H2-2e-+2OH-=2H2O
充电时,阴极的电极反应为:Ni(OH)2+OH--e-=NiO(OH)+H2O?
C.?放电时,OH-移向镍电极
D.?充电时,将电池的碳电极与外电源的正极相连
7.下图所示各烧杯中均盛有海水,铁在其中被腐蚀最快和被保护最好的分别为(?? )
A.?①⑤????B.?④①??????C.?③②????D.?④⑤?
8.下列有关电化学装置完全正确的是(??? )
A
B
C
D
铜的精炼
铁上镀银
防止Fe被腐蚀
构成铜锌原电池
9.决定化学反应速率的内因是(?? )
①温度?? ②压强?? ③催化剂?? ④浓度?? ⑤反应物本身的性质
A.?①②③④⑤????B.?⑤????C.?①④????D.?①②③④
10.下列生产生活中需要增大化学反应速率的是( ??)
A.?铁桥生锈 ?????B.?牛奶变质
C.?塑料老化 ?????D.?高炉炼铁
11.甲:在试管中依次加入1g粉末状大理石、4mol ?L-1盐酸盐酸20mL(过量);乙:在试管中依次加入2g颗粒状大理石、4mo1?L-1盐酸20mL(过量);下列CO2生成体积(已折算成标准状况)V(CO2)与反应时间t的关系曲线图合理的是(??? )
A.???????B.?
C.????????D.?
12.化学与生活生产密切相关。下列说法中错误的是()
A.?将海水直接电解可获得 Mg及Cl2等单质
B.?夏天冰箱保鲜食品的原理是降低温度,减小化学反应速率
C.?施用适量石膏(CaSO4·2H2O)可降低盐碱地(含较多NaCl、Na2CO3)的碱性
D.?施肥时,铵态氮肥不能与草木灰(含K2CO3)混合使用
13.反应A(g)+3B(g)=2C(g)+2D(g)在四种不同情况下的反应速率分别为:
①v(A)=0.45 mol·L-1·s-1 ②v(B)=0.6 mol·L-1·s-1 ③v(C)=0.4 mol·L-1·s-1
④v(D)=0.45 mol·L-1·s-1。下列有关反应速率的比较中正确的是(? )
A.?④>③=②>①??B.?①>④>②=③??C.?①>②>③>④??D.?④>③>②>①
14.反应O2+2SO2??2SO3?经一段时间后,SO3的浓度增加了0.4 mol·L-1?, 在这段时间内用O2表示的反应速率为0.04 mol·L-1·s-1?, 则这段时间为(?? )
A .0.1 s???B .?7.5 s??C .5 s???D .10 s
15.在一定温度下的恒容密闭容器中发生反应:2SO2(g) + O2(g)?2SO3(g),下列证据不能说明反应一定达到化学平衡状态的是( ??)
A.?容器内的压强不再改变???B.c(SO2):c(O2):c(SO3) = 2:1:2?
C.?SO2 的转化率不再改变???D.?SO3 的生成速率与 SO3 的消耗速率相等
16.一定温度下在容积恒定的密闭容器中,进行如下可逆反应:A(s)+2B(g)? C(g)+D(g),下列叙述能表明该反应已达到平衡状态的是( ??)
①混合气体的密度不再变化时 ②容器内气体的压强不再变化时 ③混合气体的总物质的量不再变化时 ④B的物质的量浓度不再变化时 ⑤混合气体的平均相对分子质量不再变化时 ⑥v正(B)=2v逆(C)时
A.?只有④?????B.?②③⑥????C.?②④⑤⑥????D.?①④⑤⑥
17.对于温度与反应方向的关系,下列判断不正确的是(? )
A.?△H<0 ,△S>0,所有温度下反应自发进行????????
B.?△H>0 ,△S>0,所有温度下反应自发进行
C.?△H<0 ,△S<0,低温下反应自发进行???????????????
D.?△H>0 ,△S<0,所有温度下反应均不能自发进行
18.下列有关生活生产中的叙述合理的是()
A.?工业上合成氨采用500℃左右的温度,其原因是适当加快NH3 的合成速率,催化剂在500℃左右时其活性最好,且能提高H2的转化率
B.?明矾和漂白粉分别用于自来水的净化和杀菌消毒,两者的作用原理相同
C.?水库的钢闸门与电源负极相连以防止其生锈,该法即牺牲阳极的阴极保护法
D.?铜的精炼工业和电镀铜工业,均可采用CuSO4溶液做电解质溶液
19.将固体NH4I置于密闭容器中,在一定温度下发生下列反应:
①NH4I(s) NH3(g)+HI(g);②2HI(g) H2(g)+I2(g)达到平衡时,c(H2)=0.5mol·L-1 , c(HI)=4mol·L-1 , 则此温度下,反应①的平衡常数为( ??)
A.?20??B.?16??C.9???D.?25
20.在一定温度下,将气体X和气体Y 各0.16mol充入10L恒容密闭容器中,发生反应
X(g)+Y(g)?2Z(g)△H<0,一段时间后达到平衡.反应过程中测定的数据如下表,下列说法正确的是(?? )
t/min
2
4
7
9
n(Y)/mol
0.12
0.11
0.10
0.10
A .反应前2min的平均速率v(Z)=2.0×10﹣3?mol/(L?min)
B .其他条件不变,降低温度,正反应速率减慢,逆反应速率加快
C .该温度下此反应的平衡常数K=1.44
D .其他条件不变,再充入0.2 mol Z,平衡时X的体积分数不变
第 Ⅱ 卷
二、填空题(共4题;每空1分,共17分)
21.完成下列问题
(1)已知C(s)+O2(g)=CO2(g)△H1=﹣393.5kJ/mol,
2CO(g)+O2(g)=2CO2(g)△H2=﹣566.0kJ/mol,
C(s)+1/2 O2(g)=CO(g)△H3=akJ/mol,则a=________.
(2)甲醇是一种可再生能源,具有广泛的开发和应用前景.工业上常采用下列反应合成甲醇: CO(g)+2H2(g)?CH3OH(g)△H1
下表所列数据是反应在不同温度下的化学平衡常数(K).
温度
250℃
300℃
350℃
K
2.041
0.270
0.012
由表中数据判断△H1________0 (填“>”、“=”或“<”).
某温度下,将2molCO和6molH2充入2L的密闭容器中,充分反应,达到平衡后,测得
c(CO)=0.2mol/L,则CO的转化率为________,此时的温度为________(从上表中选择).
22.原电池是化学对人类的一项重大贡献。某兴趣小组为研究原电池原理,设计如图装置:
①a和b不连接时,烧杯中现象是________。
②a和b用导线连接,Cu极为原电池________极(填“正”或“负”),电极反应式为:________;溶液中H+移向________(填“Cu”或“Zn”)极。电池总反应式为:________。
③若电解质溶液改为AgNO3溶液,当转移0.2mol电子时,则理论上Cu片质量变化为________g。
23.在一定温度下的2L固定容积的密闭容器中,通入2mol CO2和3mol H2 , 发生的反应为CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=﹣akJ?mol﹣1(a>0),测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示.
①能说明该反应已达平衡状态的是________(填编号).
A.单位时间内每消耗1.2mol H2 , 同时生成0.4mol H2O
B.CO2的体积分数在混合气体中保持不变
C.混合气体的平均相对分子质量不随时间的变化而变化
D.该体系中H2O与CH3OH的物质的量浓度之比为1:1,且保持不变
②若要使K=1,则改变的条件可以是________(填选项).
A.增大压强 B.减小压强 C.升高温度?? D.降低温度 E.加入催化剂.
24.工业上用CO生产燃料甲醇.一定条件下发生反应:CO(g)+2H2(g)?CH3OH(g).
(1)图1是表示一定温度下,在体积为2L的密闭容器中加入4mol H2和一定量的CO后,CO和CH3OH(g)的浓度随时间变化情况.从反应开始到平衡,用CO浓度变化表示平均反应速率v(CO)=
(2)图2表示该反应进行过程中能量的变化.曲线a表示不使用催化剂时反应的能量变化,曲线b表示使用催化剂后的能量变化.该反应是 (选填“吸热”或“放热”)反应,写出反应的热化学方程式 .
(3)该反应平衡常数K为 ,温度升高,平衡常数K (填“增大”、“不变”或“减小”).
三、实验探究题(共2题;每空2分,共16分)
25.中和热的测定实验(如图).
①量取反应物时,取50mL0.50mol?L﹣1的盐酸,还应加入的试剂是________(填序号).
A.50mL0.50mol?L﹣1NaOH溶液
B.50mL0.55mol?L﹣1NaOH溶液
C.1.0gNaOH固体
②在该实验过程中,该同学需要测定的实验数据有________(填序号).
A.盐酸的浓度????????? B.盐酸的温度
C.氢氧化钠溶液的浓度??? D.氢氧化钠溶液的温度
E.水的比热容????????? F.反应后混合溶液的终止温度
③若用50mL0.5mol?L﹣1醋酸溶液代替上述盐酸测定中和热,所得数据________.(填“偏大”或“偏小”或“不变”)
26.某化学反应2A ? B+D在四种不同条件下进行,B、D起始浓度为见反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表:
根据上述数据,完成下列填空:
(1)在实验1,反应存10至20分钟时间内平均速率为________mol/(L·min)。
(2)在实验2,A的初始浓度c2=________mol/L,反应经20分钟就达到平衡,可推测实验2中还隐含的条件是________。
(3)设实验3的反应速率为v3 , 实验1的反应速率为v1 , 则v3________v1(填>、<、=)。
(4)比较实验4和实验1,可推测该反应是________反应(选填吸热、放热)。
四.计算题(共7分)
27.某温度下,将2mol SO2与1molO2放入1L的密闭容器中,在一定条件下反应达到平衡:
2SO2(g)+ O2(g)?2SO3(g) 测得平衡时混合物总的物质的量为2.5mol,求:
(1)平衡时各物质的浓度;
(2)平衡时SO2的转化率:
(3)计算该温度下的平衡常数。
高二化学期中考试参考答案
一、选择题(3*20)
1、B 2、A 3、D 4、C 5、B 6、A 7、D 8、C 9、B 10、D
11、C 12、A 13、B 14、C 15、B 16、D 17、B 18、D 19、A 20、C
二、填空题
21、 (1)-110.5 (2)< 80% 250OC
22、①锌片上有气泡冒出
② 正 2H++2e-=H2 Cu Zn+H2SO4=ZnSO4+H2 ③21.6
(1) BC (2) D
24、(1)0.075 mol?L﹣1?min﹣1;
(2)放热, CO(g)+2H2(g)=CH3OH(g)△H=﹣91 kJ?mol﹣1;
(3)12, 减小;
三、实验题
25、①B ②BDF ③偏小
26、①0.013 ②1.0 加入催化剂 ③ > ④吸热
四计算题
27、解:设有已转化的SO2为Xmol?L﹣1
2SO2 + O2 2SO3
起始(mol?L﹣1) 2 1 0
转化mol?L﹣1) X 0.5X X
平衡(mol?L﹣1) 2-X 1-0.5X X
(2-X)+(1-0.5X)+ X=5 X=1mol?L﹣1
平衡时各物质的浓度为:C(SO2)=(2-1) mol/4L=1 mol/L
C(O2)=0.5 mol/L
C(SO3)= 1 mol/L
平衡时SO2的转化率为: (1/2) ×100% = 50%
K=2
答:略
同课章节目录
