粤教版初中化学 4.3 质量守恒定律(课件共31页)
文档属性
| 名称 | 粤教版初中化学 4.3 质量守恒定律(课件共31页) |

|
|
| 格式 | pptx | ||
| 文件大小 | 1.3MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 粤教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-11-11 00:00:00 | ||
图片预览








文档简介
4.3 质量守恒定律
第四章 生命之源——水
2020年秋粤教版九年级上册化学
1.能准确描述水的物理性质的是( )
A.水不能燃烧 B.在101.3 kPa下,水在4 ℃时密度最大
C.水的沸点是100 ℃ D.电解水可得到氢气和氧气
B
2.下列关于水的电解实验(如图所示)的说法中正确的是( )
A.该实验说明了水是由氢气和氧气组成的 B.该实验的目的是检验生成物的性质 C.试管a中的气体是氧气,试管b中的气体是氢气D.该实验说明水由氢和氧组成
D
旧知回顾
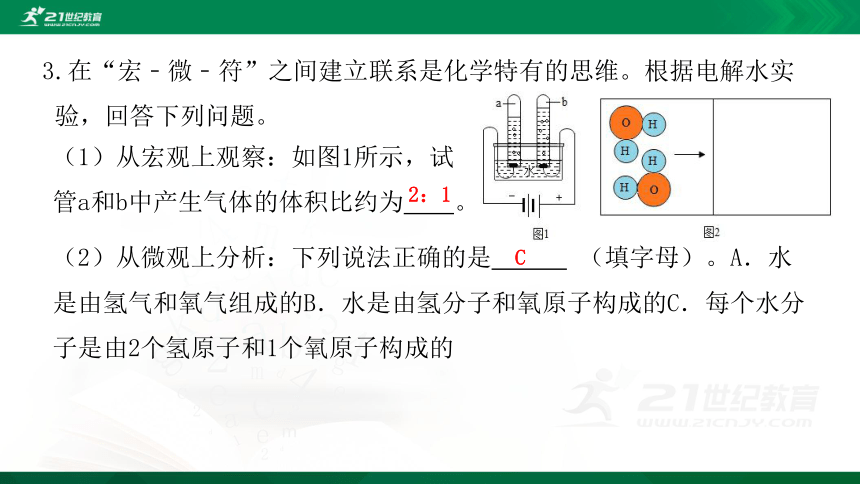
3.在“宏﹣微﹣符”之间建立联系是化学特有的思维。根据电解水实验,回答下列问题。
(2)从微观上分析:下列说法正确的是 (填字母)。A.水是由氢气和氧气组成的B.水是由氢分子和氧原子构成的C.每个水分子是由2个氢原子和1个氧原子构成的
(1)从宏观上观察:如图1所示,试管a和b中产生气体的体积比约为 。
2:1
C
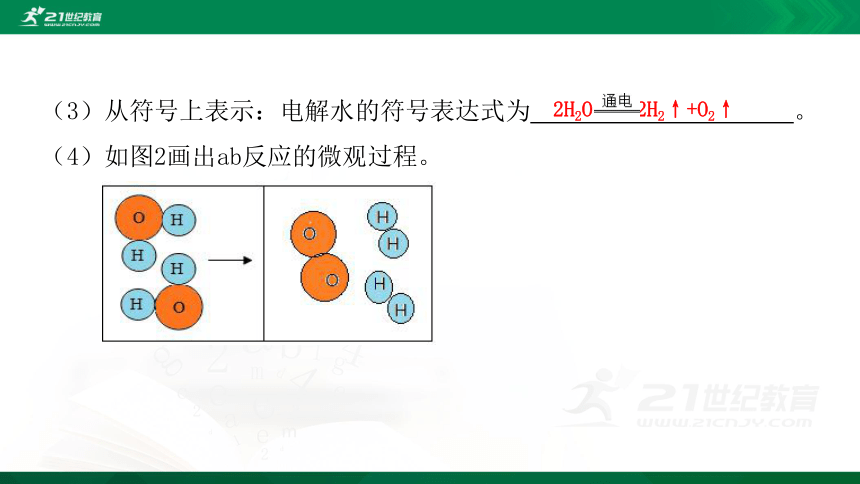
(3)从符号上表示:电解水的符号表达式为 。
(4)如图2画出ab反应的微观过程。
2H2O 2H2↑+O2↑
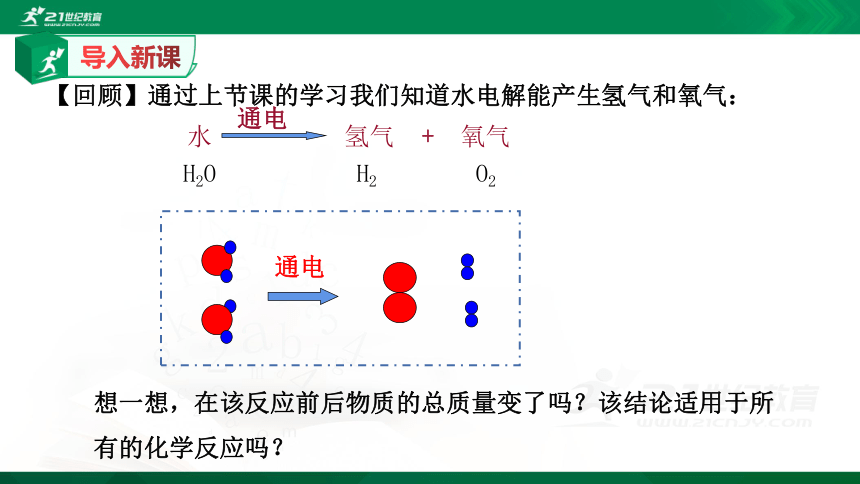
【回顾】通过上节课的学习我们知道水电解能产生氢气和氧气:
通电
通电
水
氢气
+
氧气
H2O
H2
O2
想一想,在该反应前后物质的总质量变了吗?该结论适用于所有的化学反应吗?
导入新课
探究活动
物质发生化学变化的前后,参加反应的各物质质量总和等于生成的各物质质量总和吗?
1.提出问题
①
②
③
2.猜想与假设
参加反应的各物质质量总和等于生成的各物质质量总和;
参加反应的各物质质量总和小于生成的各物质质量总和;
你的猜想?
一、探究质量守恒定律
讲授新课
3.实验与事实
【实验4-7】
①实验操作:如下图装置,锥形瓶塞中插入针筒与大气相通。用注射
①实验操作:如下图装置,用注射器吸取2ml稀盐酸,往装有0.5g石
【实验4-8】
器吸取2ml稀盐酸,往装有0.5g石灰石粉末的锥形瓶里推入1ml。反应前后称量作比较。
灰石粉末的锥形瓶里推入1ml。反应前后再称量作比较。
一、探究质量守恒定律
一、探究质量守恒定律
②实验原理:
盐酸 + 碳酸钙 → 氯化钙 + 水 +二氧化碳
(HCl)
(Ca2CO3)
(CaCl2)
(H2O)
(CO2)
③实验现象:
{5C22544A-7EE6-4342-B048-85BDC9FD1C3A}【实验4-7】
【实验4-8】
锥形瓶中有气泡产生,天平往右偏转
锥形瓶中有气泡产生,注射器的活塞向上移动,天平不偏转
思考:
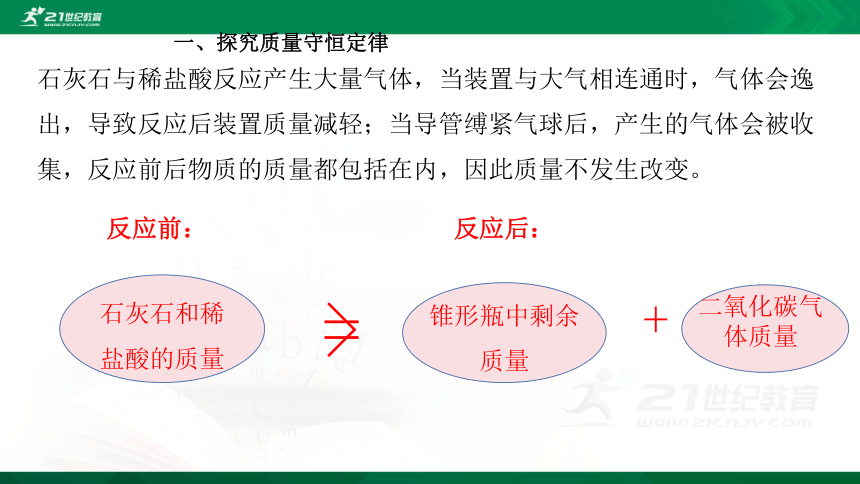
为什么同是石灰石与稀盐酸反应,当装置与大气相通时装置质量会减轻,而在密闭环境中反应前后质量却不变呢?
石灰石与稀盐酸反应产生大量气体,当装置与大气相连通时,气体会逸出,导致反应后装置质量减轻;当导管缚紧气球后,产生的气体会被收集,反应前后物质的质量都包括在内,因此质量不发生改变。
石灰石和稀盐酸的质量
锥形瓶中剩余质量
二氧化碳气体质量
+
>
反应前:
反应后:
=
一、探究质量守恒定律
【实验4-9】
实验操作:如图所示装置,锥形瓶中装入5mL硫酸铜溶液;将装有3mL氢氧化钠溶液的注射器针头插入胶塞。推压注射器活塞至1mL刻度处,观察实验现象,反应前后称量作比较。
实验现象:
锥形瓶中产生蓝色沉淀,天平不偏转。
硫酸铜+氢氧化钠 氢氧化铜+硫酸钠
CuSO4
NaOH
Cu(OH)2
Na2SO4
实验原理:
实验结论:
反应前后物质的总质量相等。
一、探究质量守恒定律
通过上述实验可知,在化学反应中,参加反应的各物质的质量总和等于反应后生成的各物质的质量总和。这就是质量守恒定律。
2.指“参加”反应的物质,未反应完的物质不计算在内。
3.“生成的各物质的质量总和”,应当包括生成的所有物质,如沉淀、气体等。
4.质量守恒定律的“守恒”指的是质量守恒,其它方面如体积等不一定守恒。
1.适用于 “一切化学反应”,不适用于物理变化。
质量守恒定律概念要点:
二、质量守恒定律
讲授新课
【练一练】下列事实能用质量守恒定律解释的是( )
A.过氧化氢溶液与二氧化锰混合后,质量减少 B.10g NaCl溶解在90g水中,形成100g NaCl溶液 C.化学反应中常伴随能量变化,有的放热,有的吸热 D.100mL酒精与100mL水混合后,溶液体积小于200mL
A
二、质量守恒定律
为了验证质量守恒定律,某同学在托盘天平的左盘上放一块石棉网,在石棉网上放一段用砂纸打磨过的镁条,称量。然后点燃镁条,将生成的白色固体全部收集在石棉网上,冷却后再称量,发现质量比实验前的质量增大了。怎样解释反应前后质量不等的现象?
讨论与交流
点燃前
燃烧时
燃烧后
二、质量守恒定律
【解释】
反应前:
镁条的质量
完全反应后:
氧化镁的质量
<
=
气体
O2质量
+
【注意】对于有气体参加或生成的反应,在验证质量守恒定律时一定要在密闭容器中进行。
二、质量守恒定律
【练一练】下列装置及实验能用来验证质量守恒定律的是( )
A
二、质量守恒定律
思考:
为什么参加化学反应的物质,化学反应前后质量总和会保持不变呢?
我们以水电解生成氢气和氧气为例:
通电
水
氢气
+
氧气
H2O
H2
O2
微观过程:
通电
实质:在该反应前后,原子的种类和原子的数目没有改变,原子的质量没有变化,因此质量守恒。
二、质量守恒定律
总结一下吧
在化学反应前后:
六个“不变”
两个“一定变”
三个“可能变”
微观
宏观
①元素的种类
②元素的质量
③物质的总质量
物质的种类
①元素的化合价
②物质的状态
①原子的种类
②原子的数目
③原子的质量
分子的种类
分子的数目
二、质量守恒定律
【练一练】在化学反应前后,一定没有发生变化的是( )
①原子数目 ②分子数目 ③元素种类 ④物质的总质量 ⑤物质种类
A .①④ B. ①③⑤ C .①③④ D. ①②③④⑤
C
【练一练】如图为某反应的部分微观示意图,其中不同的球代表不同种原子。下列说法正确的是( )
A.分子在化学变化中不可分 B.反应后生成了两种新的化合物 C.该反应属于分解反应D.该反应不符合质量守恒定律
C
二、质量守恒定律
质量守恒定律的应用:
1.根据元素守恒,确定物质的元素组成
【例1】植物的光合作用可表示为:水+二氧化碳 淀粉+氧气,产物淀粉的组成一定含有的元素有( )①氢元素 ②碳元素 ③氧元素 ④氮元素A.①②③④ B.①②③ C.①② D.③④
水+二氧化碳 淀粉+氧气
H2O
CO2
O2
C
H
C
三、质量守恒定律的应用
讲授新课
2.利用质量守恒定律确定化学方程式中未知物质的化学式。
【例2】地质人员考察时发现一种带螺纹的矿石。研究发现该矿石能氧气中燃烧,主要反应可表示为4X+11O2 2Fe2O3+8SO2,下列说法不正确的是( )
A.该物质的化学式是FeS2 B.该物质由铁、硫两种元素组C.氧气分子由氧元素组成 D.SO2中硫、氧元素的原子个数比为1:2
C
三、质量守恒定律的应用
3.计算化学反应中某物质的质量
【例3】将50gKClO3和12gMnO2的混合物加热一段时间后,得到剩余固体的质量为44 g,则产生氧气____g。
18
【练一练】已知反应2A+B=3C+D,20gA和10gB完全反应生成15gC,则生成D的质量为( )A.15g B.35g C.20g D.24g
A
三、质量守恒定律的应用
【练一练】黑火药是我国古代四大发明之一,距今有1000多年历史。黑火药爆炸原理用方程式表示:2KNO3+3C+S K2S+N2↑+3X↑,下列说法中错误的是( )
A.物质X的化学式为CO2 B.KNO3中氮元素的化合价为+1
C.存放黑火药的场所应该“严禁烟火”
D.黑火药发生爆炸的过程,属于化学反应的放热现象
B
三、质量守恒定律的应用
质量守恒定律
参加化学反应的各种物质的质量总和等于反应后生成的各物质的质量总和
实质:
原子的种类不变
原子的数目不变
原子的质量不变
元素的种类不变
元素的质量不变
两个一定改变
物质种类一定改变
分子的种类一定改变
分子总数可能改变
1个可能改变——
定义:
物质的总质量不变
六个不变
应用:
根据元素守恒,确定物质的元素组成
利用质量守恒定律,根据化学方程式确定物质的化学式。
计算物质的质量
课堂小结
1.质量守恒定律是自然界基本的规律之一。下列装置及实验(天平未画出)能用来验证质量守恒定律的是( )
A
2.铜与浓硝酸能发生反应生成硝酸铜、水和一种有刺激性气味的气体,该气体可能是( )A.H2 B.HCl C.NO2 D.N2
C
课堂练习
3.下列有关质量守恒定律的理解中,正确的是( )
A.5g盐溶解在100g水中形成105g溶液遵循质量守恒定律
B.化学反应前后分子的总数一定不会发生变化
C.镁条燃烧后质量增加,不遵循质量守恒定律
D.制硅流程中一个化学反应方程式为2H2+SiCl4 Si+4X,则X的化学式为HCl
D
4.在一密闭容器中,有甲、乙、丙、丁四种物质,在一定条件下存在某个反应,测得反应前后各物质的质量如下表:
{5940675A-B579-460E-94D1-54222C63F5DA}物质
甲
乙
丙
丁
反应前质量/g
20
m
8
6
反应后质量/g
4
待测
28
2
对该反应,下列描述正确的是( )A.“待测”数值一定为2g B.该反应中反应物只有甲和丁 C.乙一定是该反应的催化剂 D.反应中甲和丙的质量比为1:7
B
5.某纯净物3g在氧气中完全燃烧,生成8.8g二氧化碳和5.4g水。下列说法不正确的是( )
A.该纯净物中含有C、H元素,不含O元素
B.该纯净物中一定含有C、H元素,可能含有O元素
C.该反应中CO2和H2O的分子数之比为2:3
D.该纯净物中C、H原子的个数比为1:3
B
6.木炭和过量的氧气在密闭容器中燃烧,容器内有关量随反应时间变化的图象中正确的是( )
D
7.化学的发展趋势是从宏观到微观、由定性到定量。如图是化学反应前后质量测定的实验:碳酸钠由 组成;由Na+和 (填离子符号)构成。称量反应前物质的总质量后,将试管中的盐酸倒入烧杯中,观察到的实验现象是 ,反应的化学方程式为 。放回天平重新称量,天平 (填“平衡”或“向左偏”或“向右偏”)。用具体的反应物和生成物解释天平变化的原因是:参加化学反应的碳酸钠和氯化氢的 。
钠元素、碳元素、氧元素
CO32﹣
产生大量气泡
Na2CO3+2HCl=2NaCl+H2O+CO2↑
向右偏
质量总和等于生成的氯化钠、水和二氧化碳的质量总和,由于生成的二氧化碳气体逸出,所以天平的指针偏向右侧
谢谢聆听
第四章 生命之源——水
2020年秋粤教版九年级上册化学
1.能准确描述水的物理性质的是( )
A.水不能燃烧 B.在101.3 kPa下,水在4 ℃时密度最大
C.水的沸点是100 ℃ D.电解水可得到氢气和氧气
B
2.下列关于水的电解实验(如图所示)的说法中正确的是( )
A.该实验说明了水是由氢气和氧气组成的 B.该实验的目的是检验生成物的性质 C.试管a中的气体是氧气,试管b中的气体是氢气D.该实验说明水由氢和氧组成
D
旧知回顾
3.在“宏﹣微﹣符”之间建立联系是化学特有的思维。根据电解水实验,回答下列问题。
(2)从微观上分析:下列说法正确的是 (填字母)。A.水是由氢气和氧气组成的B.水是由氢分子和氧原子构成的C.每个水分子是由2个氢原子和1个氧原子构成的
(1)从宏观上观察:如图1所示,试管a和b中产生气体的体积比约为 。
2:1
C
(3)从符号上表示:电解水的符号表达式为 。
(4)如图2画出ab反应的微观过程。
2H2O 2H2↑+O2↑
【回顾】通过上节课的学习我们知道水电解能产生氢气和氧气:
通电
通电
水
氢气
+
氧气
H2O
H2
O2
想一想,在该反应前后物质的总质量变了吗?该结论适用于所有的化学反应吗?
导入新课
探究活动
物质发生化学变化的前后,参加反应的各物质质量总和等于生成的各物质质量总和吗?
1.提出问题
①
②
③
2.猜想与假设
参加反应的各物质质量总和等于生成的各物质质量总和;
参加反应的各物质质量总和小于生成的各物质质量总和;
你的猜想?
一、探究质量守恒定律
讲授新课
3.实验与事实
【实验4-7】
①实验操作:如下图装置,锥形瓶塞中插入针筒与大气相通。用注射
①实验操作:如下图装置,用注射器吸取2ml稀盐酸,往装有0.5g石
【实验4-8】
器吸取2ml稀盐酸,往装有0.5g石灰石粉末的锥形瓶里推入1ml。反应前后称量作比较。
灰石粉末的锥形瓶里推入1ml。反应前后再称量作比较。
一、探究质量守恒定律
一、探究质量守恒定律
②实验原理:
盐酸 + 碳酸钙 → 氯化钙 + 水 +二氧化碳
(HCl)
(Ca2CO3)
(CaCl2)
(H2O)
(CO2)
③实验现象:
{5C22544A-7EE6-4342-B048-85BDC9FD1C3A}【实验4-7】
【实验4-8】
锥形瓶中有气泡产生,天平往右偏转
锥形瓶中有气泡产生,注射器的活塞向上移动,天平不偏转
思考:
为什么同是石灰石与稀盐酸反应,当装置与大气相通时装置质量会减轻,而在密闭环境中反应前后质量却不变呢?
石灰石与稀盐酸反应产生大量气体,当装置与大气相连通时,气体会逸出,导致反应后装置质量减轻;当导管缚紧气球后,产生的气体会被收集,反应前后物质的质量都包括在内,因此质量不发生改变。
石灰石和稀盐酸的质量
锥形瓶中剩余质量
二氧化碳气体质量
+
>
反应前:
反应后:
=
一、探究质量守恒定律
【实验4-9】
实验操作:如图所示装置,锥形瓶中装入5mL硫酸铜溶液;将装有3mL氢氧化钠溶液的注射器针头插入胶塞。推压注射器活塞至1mL刻度处,观察实验现象,反应前后称量作比较。
实验现象:
锥形瓶中产生蓝色沉淀,天平不偏转。
硫酸铜+氢氧化钠 氢氧化铜+硫酸钠
CuSO4
NaOH
Cu(OH)2
Na2SO4
实验原理:
实验结论:
反应前后物质的总质量相等。
一、探究质量守恒定律
通过上述实验可知,在化学反应中,参加反应的各物质的质量总和等于反应后生成的各物质的质量总和。这就是质量守恒定律。
2.指“参加”反应的物质,未反应完的物质不计算在内。
3.“生成的各物质的质量总和”,应当包括生成的所有物质,如沉淀、气体等。
4.质量守恒定律的“守恒”指的是质量守恒,其它方面如体积等不一定守恒。
1.适用于 “一切化学反应”,不适用于物理变化。
质量守恒定律概念要点:
二、质量守恒定律
讲授新课
【练一练】下列事实能用质量守恒定律解释的是( )
A.过氧化氢溶液与二氧化锰混合后,质量减少 B.10g NaCl溶解在90g水中,形成100g NaCl溶液 C.化学反应中常伴随能量变化,有的放热,有的吸热 D.100mL酒精与100mL水混合后,溶液体积小于200mL
A
二、质量守恒定律
为了验证质量守恒定律,某同学在托盘天平的左盘上放一块石棉网,在石棉网上放一段用砂纸打磨过的镁条,称量。然后点燃镁条,将生成的白色固体全部收集在石棉网上,冷却后再称量,发现质量比实验前的质量增大了。怎样解释反应前后质量不等的现象?
讨论与交流
点燃前
燃烧时
燃烧后
二、质量守恒定律
【解释】
反应前:
镁条的质量
完全反应后:
氧化镁的质量
<
=
气体
O2质量
+
【注意】对于有气体参加或生成的反应,在验证质量守恒定律时一定要在密闭容器中进行。
二、质量守恒定律
【练一练】下列装置及实验能用来验证质量守恒定律的是( )
A
二、质量守恒定律
思考:
为什么参加化学反应的物质,化学反应前后质量总和会保持不变呢?
我们以水电解生成氢气和氧气为例:
通电
水
氢气
+
氧气
H2O
H2
O2
微观过程:
通电
实质:在该反应前后,原子的种类和原子的数目没有改变,原子的质量没有变化,因此质量守恒。
二、质量守恒定律
总结一下吧
在化学反应前后:
六个“不变”
两个“一定变”
三个“可能变”
微观
宏观
①元素的种类
②元素的质量
③物质的总质量
物质的种类
①元素的化合价
②物质的状态
①原子的种类
②原子的数目
③原子的质量
分子的种类
分子的数目
二、质量守恒定律
【练一练】在化学反应前后,一定没有发生变化的是( )
①原子数目 ②分子数目 ③元素种类 ④物质的总质量 ⑤物质种类
A .①④ B. ①③⑤ C .①③④ D. ①②③④⑤
C
【练一练】如图为某反应的部分微观示意图,其中不同的球代表不同种原子。下列说法正确的是( )
A.分子在化学变化中不可分 B.反应后生成了两种新的化合物 C.该反应属于分解反应D.该反应不符合质量守恒定律
C
二、质量守恒定律
质量守恒定律的应用:
1.根据元素守恒,确定物质的元素组成
【例1】植物的光合作用可表示为:水+二氧化碳 淀粉+氧气,产物淀粉的组成一定含有的元素有( )①氢元素 ②碳元素 ③氧元素 ④氮元素A.①②③④ B.①②③ C.①② D.③④
水+二氧化碳 淀粉+氧气
H2O
CO2
O2
C
H
C
三、质量守恒定律的应用
讲授新课
2.利用质量守恒定律确定化学方程式中未知物质的化学式。
【例2】地质人员考察时发现一种带螺纹的矿石。研究发现该矿石能氧气中燃烧,主要反应可表示为4X+11O2 2Fe2O3+8SO2,下列说法不正确的是( )
A.该物质的化学式是FeS2 B.该物质由铁、硫两种元素组C.氧气分子由氧元素组成 D.SO2中硫、氧元素的原子个数比为1:2
C
三、质量守恒定律的应用
3.计算化学反应中某物质的质量
【例3】将50gKClO3和12gMnO2的混合物加热一段时间后,得到剩余固体的质量为44 g,则产生氧气____g。
18
【练一练】已知反应2A+B=3C+D,20gA和10gB完全反应生成15gC,则生成D的质量为( )A.15g B.35g C.20g D.24g
A
三、质量守恒定律的应用
【练一练】黑火药是我国古代四大发明之一,距今有1000多年历史。黑火药爆炸原理用方程式表示:2KNO3+3C+S K2S+N2↑+3X↑,下列说法中错误的是( )
A.物质X的化学式为CO2 B.KNO3中氮元素的化合价为+1
C.存放黑火药的场所应该“严禁烟火”
D.黑火药发生爆炸的过程,属于化学反应的放热现象
B
三、质量守恒定律的应用
质量守恒定律
参加化学反应的各种物质的质量总和等于反应后生成的各物质的质量总和
实质:
原子的种类不变
原子的数目不变
原子的质量不变
元素的种类不变
元素的质量不变
两个一定改变
物质种类一定改变
分子的种类一定改变
分子总数可能改变
1个可能改变——
定义:
物质的总质量不变
六个不变
应用:
根据元素守恒,确定物质的元素组成
利用质量守恒定律,根据化学方程式确定物质的化学式。
计算物质的质量
课堂小结
1.质量守恒定律是自然界基本的规律之一。下列装置及实验(天平未画出)能用来验证质量守恒定律的是( )
A
2.铜与浓硝酸能发生反应生成硝酸铜、水和一种有刺激性气味的气体,该气体可能是( )A.H2 B.HCl C.NO2 D.N2
C
课堂练习
3.下列有关质量守恒定律的理解中,正确的是( )
A.5g盐溶解在100g水中形成105g溶液遵循质量守恒定律
B.化学反应前后分子的总数一定不会发生变化
C.镁条燃烧后质量增加,不遵循质量守恒定律
D.制硅流程中一个化学反应方程式为2H2+SiCl4 Si+4X,则X的化学式为HCl
D
4.在一密闭容器中,有甲、乙、丙、丁四种物质,在一定条件下存在某个反应,测得反应前后各物质的质量如下表:
{5940675A-B579-460E-94D1-54222C63F5DA}物质
甲
乙
丙
丁
反应前质量/g
20
m
8
6
反应后质量/g
4
待测
28
2
对该反应,下列描述正确的是( )A.“待测”数值一定为2g B.该反应中反应物只有甲和丁 C.乙一定是该反应的催化剂 D.反应中甲和丙的质量比为1:7
B
5.某纯净物3g在氧气中完全燃烧,生成8.8g二氧化碳和5.4g水。下列说法不正确的是( )
A.该纯净物中含有C、H元素,不含O元素
B.该纯净物中一定含有C、H元素,可能含有O元素
C.该反应中CO2和H2O的分子数之比为2:3
D.该纯净物中C、H原子的个数比为1:3
B
6.木炭和过量的氧气在密闭容器中燃烧,容器内有关量随反应时间变化的图象中正确的是( )
D
7.化学的发展趋势是从宏观到微观、由定性到定量。如图是化学反应前后质量测定的实验:碳酸钠由 组成;由Na+和 (填离子符号)构成。称量反应前物质的总质量后,将试管中的盐酸倒入烧杯中,观察到的实验现象是 ,反应的化学方程式为 。放回天平重新称量,天平 (填“平衡”或“向左偏”或“向右偏”)。用具体的反应物和生成物解释天平变化的原因是:参加化学反应的碳酸钠和氯化氢的 。
钠元素、碳元素、氧元素
CO32﹣
产生大量气泡
Na2CO3+2HCl=2NaCl+H2O+CO2↑
向右偏
质量总和等于生成的氯化钠、水和二氧化碳的质量总和,由于生成的二氧化碳气体逸出,所以天平的指针偏向右侧
谢谢聆听
同课章节目录
- 第一章 大家都来学化学
- 1.1 身边的化学
- 1.2 化学实验室之旅
- 1.3 物质的变化
- 1.4 物质性质的探究
- 第二章 空气、物质的构成
- 2.1 空气的成分
- 2.2 构成物质的微粒(Ⅰ)——分子
- 2.3 构成物质的微粒(Ⅱ)——原子和离子
- 2.4 辨别物质的元素组成
- 第三章 维持生命之气——氧气
- 3.1 氧气的性质和用途
- 3.2 制取氧气
- 3.3 燃烧条件与灭火原理
- 3.4 物质构成的表示式
- 第四章 生命之源——水
- 4.1 我们的水资源
- 4.2 水的组成
- 4.3 质量守恒定律
- 4.4 化学方程式
- 第五章 燃料
- 5.1 洁净的燃料——氢气
- 5.2 组成燃料的主要元素——碳
- 5.3 二氧化碳的性质和制法
- 5.4 古生物的“遗产”——化石燃料
