山西省太原市2020-2021学年高二上学期期中质量监测化学理科试题(图片版)
文档属性
| 名称 | 山西省太原市2020-2021学年高二上学期期中质量监测化学理科试题(图片版) |  | |
| 格式 | doc | ||
| 文件大小 | 6.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-11-12 19:53:22 | ||
图片预览



文档简介
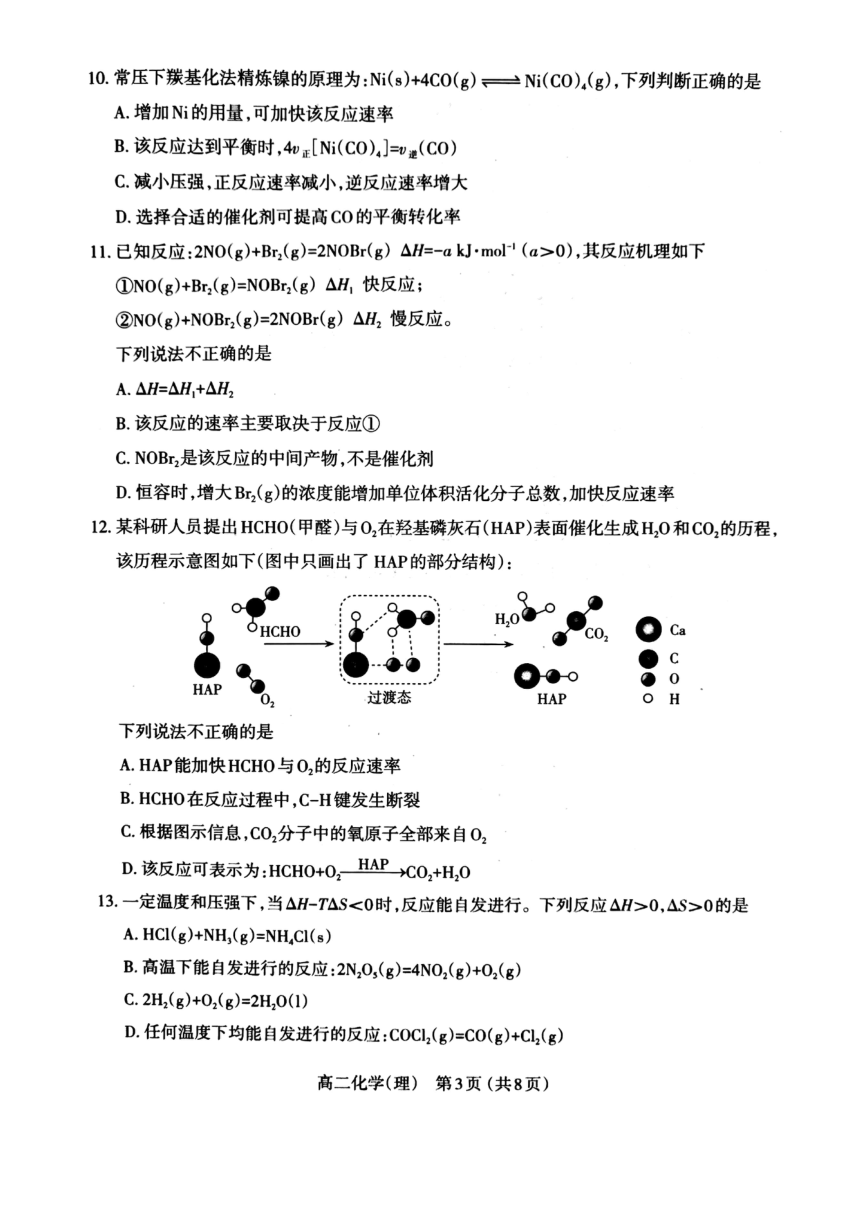
4.下列事实一定能说明亚硝酸(HNO2)是弱电解质的是
①常温下HNO2溶液中存在的微粒有:H、NO2、HNO2OH、H2O
②用HNO2溶液做导电性实验灯泡很暗
③0mL1molL"HNO2溶液恰好与10mL1
mol
L
NaOH溶液完全反应
40.
1
mol-L-
HNO2溶液的c(H)<0.1molL
A.①3
B.②2(3
C.①④
D.②④
5.下列事实不能用勒夏特列原理解释的是
A.H2(g)+2g)2HI(g)反应达平衡后,压缩体积气体颜色变深
BFe(SCN)溶液中加入固体KSCN后颜色变深
CNg)+3H2(g)2NH3(g)△H<0,工业上采用高压条件更有利于合成氨
D浸泡在冰水中的NO2球的红棕色明显变浅
6.下列反应的反应热属于燃烧热的是
A
Na(s)+C1
(g)=NaCl(s)AH
B2Na(s)+0
(g)=Na2O(S)
AH2
C
2Na(s)+02g)=Na,0,()AH
DCH3OCH3(g)+302(g)=2COg)+3H10(1)△H4(已知CH2OCH3沸点为-249℃)
7环戊二烯(区》)是重要的有机化工原料,广泛用于农药橡胶塑料等生产。已知:
(g)=(g)+H2(g)△H1=+103
kJ
mol-1
②H2(g)+2(g)=2HI(g)△H2=-110
kJ
mol
则反应(g+4g)=(+Hm(g)的H等于
A.+893
kJ
mol-l
B.-89.3kJ·mol-l
C+111.3
kJ.mol-l
D.-1113
kJ
mol-
8我国是世界上第二大乙烯生产国,乙烯可由乙烷裂解得到:C2H6(g)=CH1(g)+H2(g),
相关化学键的键能数据如下表所示,则上述反应的△H等于
化学键
C-H
C-C
C=C
H-H
键能/(
k]
mol-I)
412
348
612
436
A.-124kJ·mol
B.
+124
kJ.
mol-
C.-288kJ·moll
D+288
kJ
mol
9下列关于平衡常数K的说法正确的是
AK不变,平衡可能移动
B同一个反应各物质的化学计量数增大2倍,K也增大2倍
C.K越大,反应速率也越快
D.对于合成氨反应,压强增大,平衡右移,K增大
高二化学(理)第2页(共8页)
10.常压下羰基化法精炼镍的原理为:N(s)+4C0(g)=N(CO)4(g),下列判断正确的是
A.增加Ni的用量,可加快该反应速率
B该反应达到平衡时,4[Ni(CO)=遵(CO)
C减小压强,正反应速率减小,逆反应速率增大
D选择合适的催化剂可提高CO的平衡转化率
11已知反应:2NO(g)+Br2(g)=2NOBr(g)△H=-
a
k].
mol(a>0),其反应机理如下
①NO(g)+Br2(g)=NOBr2(g)△H1快反应;
②NO(g)+NOBr2(g)=2NOBr(g)△H2慢反应。
下列说法不正确的是
A.△H=△H+△H2
B该反应的速率主要取决于反应①
CNOB2是该反应的中间产物,不是催化剂
D.恒容时,增大Br2(g)的浓度能增加单位体积活化分子总数加快反应速率
12.某科研人员提出HCH0(甲醛)与O2在羟基磷灰石(HAP)表面催化生成HO和CO2的历程,
该历程示意图如下(图中只画出了HAP的部分结构):
HO
HCHO
CO2
Cco
HAP
过渡态
HAP
O
H
下列说法不正确的是
A.HAP能加快HCH0与O2的反应速率
B
HCHO在反应过程中,C-H键发生断裂
C根据图示信息,CO2分子中的氧原子全部来自O2
D该反应可表示为:HCHO+O,
HAP
CO,+HO
13.一定温度和压强下,当AH-TAS<0时,反应能自发进行。下列反应△H>0,△S>0的是
A
HCl(g)+NH,
(g)=NH
CI(s)
B高温下能自发进行的反应:N2O3(g)=4NO2(g)+O2(g)
C2H2(g)+O2(g)=2H2O(1)
D任何温度下均能自发进行的反应:COCl2(g)=CO(g)+Cl2(g)
高二化学(理)第3页(共8页)
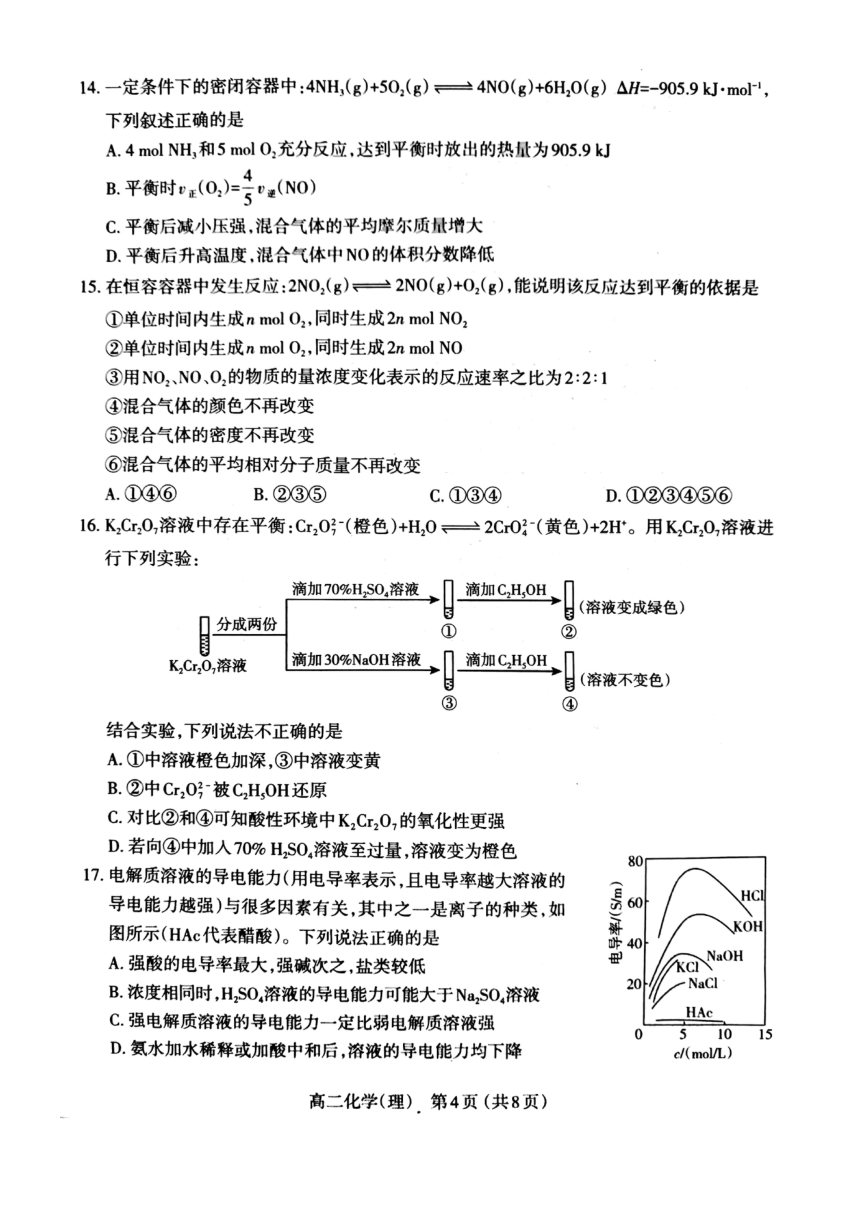
①常温下HNO2溶液中存在的微粒有:H、NO2、HNO2OH、H2O
②用HNO2溶液做导电性实验灯泡很暗
③0mL1molL"HNO2溶液恰好与10mL1
mol
L
NaOH溶液完全反应
40.
1
mol-L-
HNO2溶液的c(H)<0.1molL
A.①3
B.②2(3
C.①④
D.②④
5.下列事实不能用勒夏特列原理解释的是
A.H2(g)+2g)2HI(g)反应达平衡后,压缩体积气体颜色变深
BFe(SCN)溶液中加入固体KSCN后颜色变深
CNg)+3H2(g)2NH3(g)△H<0,工业上采用高压条件更有利于合成氨
D浸泡在冰水中的NO2球的红棕色明显变浅
6.下列反应的反应热属于燃烧热的是
A
Na(s)+C1
(g)=NaCl(s)AH
B2Na(s)+0
(g)=Na2O(S)
AH2
C
2Na(s)+02g)=Na,0,()AH
DCH3OCH3(g)+302(g)=2COg)+3H10(1)△H4(已知CH2OCH3沸点为-249℃)
7环戊二烯(区》)是重要的有机化工原料,广泛用于农药橡胶塑料等生产。已知:
(g)=(g)+H2(g)△H1=+103
kJ
mol-1
②H2(g)+2(g)=2HI(g)△H2=-110
kJ
mol
则反应(g+4g)=(+Hm(g)的H等于
A.+893
kJ
mol-l
B.-89.3kJ·mol-l
C+111.3
kJ.mol-l
D.-1113
kJ
mol-
8我国是世界上第二大乙烯生产国,乙烯可由乙烷裂解得到:C2H6(g)=CH1(g)+H2(g),
相关化学键的键能数据如下表所示,则上述反应的△H等于
化学键
C-H
C-C
C=C
H-H
键能/(
k]
mol-I)
412
348
612
436
A.-124kJ·mol
B.
+124
kJ.
mol-
C.-288kJ·moll
D+288
kJ
mol
9下列关于平衡常数K的说法正确的是
AK不变,平衡可能移动
B同一个反应各物质的化学计量数增大2倍,K也增大2倍
C.K越大,反应速率也越快
D.对于合成氨反应,压强增大,平衡右移,K增大
高二化学(理)第2页(共8页)
10.常压下羰基化法精炼镍的原理为:N(s)+4C0(g)=N(CO)4(g),下列判断正确的是
A.增加Ni的用量,可加快该反应速率
B该反应达到平衡时,4[Ni(CO)=遵(CO)
C减小压强,正反应速率减小,逆反应速率增大
D选择合适的催化剂可提高CO的平衡转化率
11已知反应:2NO(g)+Br2(g)=2NOBr(g)△H=-
a
k].
mol(a>0),其反应机理如下
①NO(g)+Br2(g)=NOBr2(g)△H1快反应;
②NO(g)+NOBr2(g)=2NOBr(g)△H2慢反应。
下列说法不正确的是
A.△H=△H+△H2
B该反应的速率主要取决于反应①
CNOB2是该反应的中间产物,不是催化剂
D.恒容时,增大Br2(g)的浓度能增加单位体积活化分子总数加快反应速率
12.某科研人员提出HCH0(甲醛)与O2在羟基磷灰石(HAP)表面催化生成HO和CO2的历程,
该历程示意图如下(图中只画出了HAP的部分结构):
HO
HCHO
CO2
Cco
HAP
过渡态
HAP
O
H
下列说法不正确的是
A.HAP能加快HCH0与O2的反应速率
B
HCHO在反应过程中,C-H键发生断裂
C根据图示信息,CO2分子中的氧原子全部来自O2
D该反应可表示为:HCHO+O,
HAP
CO,+HO
13.一定温度和压强下,当AH-TAS<0时,反应能自发进行。下列反应△H>0,△S>0的是
A
HCl(g)+NH,
(g)=NH
CI(s)
B高温下能自发进行的反应:N2O3(g)=4NO2(g)+O2(g)
C2H2(g)+O2(g)=2H2O(1)
D任何温度下均能自发进行的反应:COCl2(g)=CO(g)+Cl2(g)
高二化学(理)第3页(共8页)
同课章节目录
