鲁教版 化学九上 第二单元 探秘水世界复习课件(23张ppt)
文档属性
| 名称 | 鲁教版 化学九上 第二单元 探秘水世界复习课件(23张ppt) |  | |
| 格式 | ppt | ||
| 文件大小 | 416.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-11-12 10:49:18 | ||
图片预览








文档简介
第二单元 探秘水世界
学习目标:
1、分析水分子的运动、水的三态变化、水的人工净化,明确分子的特性、物理变化的实质。
2、掌握水的电解和氢气燃烧的相关知识,明确化学变化的实质。
3、了解原子的结构,知道原子内部电子的特性、相对原子质量。
4、明确元素和元素符号的意义,了解元素周期表。
考点1、水的三态变化:
三态变化的实质:水分子的运动导致水的三态变化。水分子获得能量时,运动 ,分子间的间隔 ,水由液态变成了气态;失去能量时,运动 ,分子间的间隔 ,水由气态又变回了液态。
加快
变大
减慢
变小
考点2: 构成物质的基本微粒
1.对于分子构成的物质,分子是
2.分子:
基本性质:⑴、分子很__, ⑵、分子总在不停地____, ⑶、分子之间存在___, ⑷、同种分子__________,不同分子__________.
_________________________。
保持物质化学性质的最小微粒
小
运动
间隔
性质相同
性质不同
考点3、水的净化方法(重点、难点)
1、水的净化方法过程:
①沉降(除去水中颗粒较大的不溶性杂质),(明矾:加速沉降)
②过滤(除去水中不溶性固体杂质)
③吸附(除去颜色或气味)(活性炭:表面疏松多孔)
④蒸馏(除去水中可溶性杂质,净化程度最高---得到的是蒸馏水)、
注:自来水生产过程:沉降,过滤,灭菌。
2、分离物质的方法:
①过滤:分离不溶性固体和液体
②蒸发:分离可溶性固体和液体
③蒸馏:分离沸点不同的液体
3、硬水和软水:
(1)硬水:含有较多可溶性钙、镁矿物质 的天然水。
软水:不含或含较少钙、镁矿物质的水。
(2)鉴别方法:加入肥皂水搅拌,产生泡沫多、浮渣少的为软水,反之为硬水。
(3)硬水软化的方法:煮沸、蒸馏等
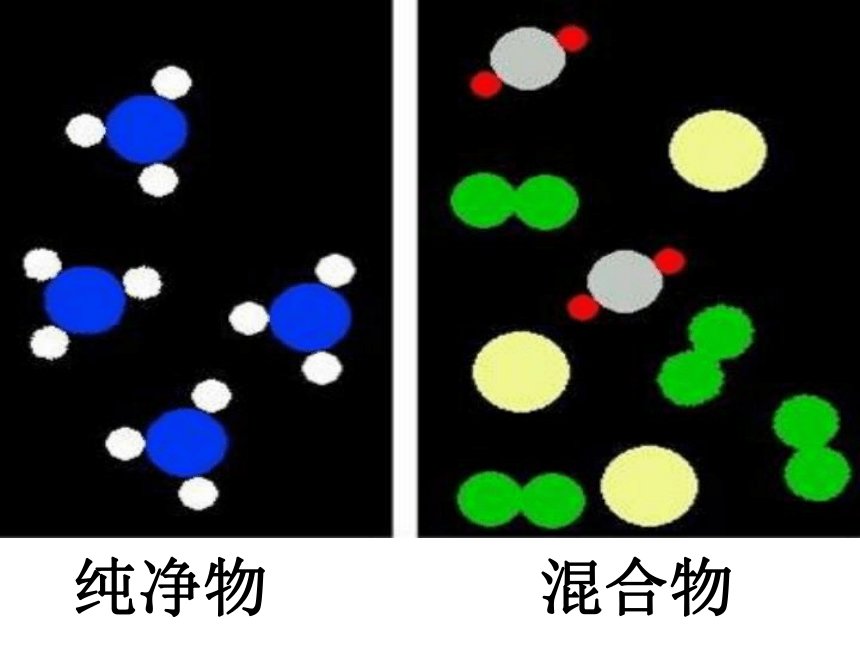
考点4、纯净物、混合物、单质、化合物
混合物: 由两种或两种以上的物质组成的物质
纯净物:由单一物质组成的物质
单质: 由一种元素组成的纯净物
化合物:由两种或两种以上元素组成的纯净物
纯净物
混合物
训练反馈一:
1、下列叙述正确的是:( )
A、自然界的物质都是以化合物的形式存在的
B、天然水中的软水是纯净物
C、冰块和水混合得到混合物
D、同种元素组成的纯净物是单质
2.下列物质中,属于纯净物的是( )
A.空气 B.海水 C.白醋 D.液氧
D
D
3、下列分别盛有不同物质的容器中,所盛物质属于混合物的是????????,纯净物的是????????,单质的是????????,化合物的是????????。(均填容器下的代号)
BCE
AD
A
D
4. 如右图是实验过滤操作的示意图,回答下列问题:
(1)仪器名称:①__________
②________ ③_________
(2)过滤时,滤纸要_________漏
斗内壁;滤纸的边缘要 漏
斗边缘, 过滤时液面要 滤纸边缘。
(3)过滤时,烧杯嘴应紧靠______________,玻璃棒应紧靠三层滤纸处,漏斗下端的管口应紧靠烧杯的内壁的原因是______________________________.
①
②
③
烧杯
漏斗
玻璃棒
紧贴
低于
低于
玻璃棒
防止液体四溅
考点5:水的分解与合成
⑴水的
分解
⑵水的合成 实验现象:
结论:
①实验现象:正负极均产生______,体积比约为_____。
②结论:a.水由___________________组成;
b.在化学变化中,_____可以再分,_____不能再分。
气泡
1:2
氢、氧两种元素
分子
原子
考点6、化合反应及分解反应
化合反应
分解反应
概念
由两种或两种以上的物质生成另一种物质的反应
由一种物质生成两种或两种以上其他物质的反应
特点
多变一
一变多
形式
A+B→AB
AB→ A+B
训练反馈二:
1.下列有关水的说法中错误的是( )
A.自然界中的河水、井水和湖水都属于混合物
B.实验室电解水时,正极端玻璃管内的气体是氢气
C.农业上合理使用化肥和农药有利于水资源的保护
D.生活中可以通过煮沸降低水的硬度
B
2. 右下图表示通电分解水的简易装置。回答下列问题:
(1)与A量筒中的电极相连接的是电池的 极,
B量筒中产生的气体是 ______ 。
(2)如果该实验中产生氢气4mL,则生成
氧气 mL。
(3)该实验能证明的结论是:
① _____________________
② ___________________
负
氧气
2
水是由氢氧两种元素组成的
在化学变化中,分子可分,原子不可分
(1)原子的构成
原子
原子核
核外电子
质子
中子
(带正电)
(不带电)
(带负电)
(中心、带正电)
(不显电性)
注:1、质子数=核电荷数=核外电子数=原子序数;
2、不是所有原子核内都有中子。
(例:氢原子核内没有中子。)
考点7.原子
⑵原子中的电子。
①原子的体积是由______决定的。在化学反应中,________是不变的,发生改变的是__________。元素的化学性质是由_______________决定的。一般的,最外层电子数相等,____________________。用_______________表示原子核外电子的排布。
②请画出氧原子的原子结构示意图。
电子
原子核
核外电子
最外层电子
元素的化学性质相似
原子结构示意图
2
6
+8
原子核
质子数
该层电子数
电子层
氧原子结构示意图:
+8
考点8、离子
⑴定义:带电的_______或______。
写出下列离子符号:
钠离子、镁离子、铝离子
硫离子、氯离子、氧离子
⑵分子、原子、离子有何异同?它们之间有什么关系?
原子
原子团
训练反馈三:
1.保持水的化学性质的微粒是( )。
A.氢分子 B.氢原子和氧原子
C.氧分子 D.水分子
2.某R原子,在发生变化时失去2个电子,变成( )
A、R B、R2+ C、R2- D、R+
C
B
3.下列微粒在化学变化中不能再分的是( )。
A.水分子 B.二氧化碳分子 C.氧原子 D.氧化汞分子
4.下列物质中直接由原子构成的是( )。
A.氧气 B.汞
C.二氧化碳 D.水
C
B
5.科学家发现了核电荷数是112的新元素,其相对原子质量约为277。下列说法正确的是( )
A.该元素原子核中中子数为112
B.该元素原子核中中子数为165,核外电子数为112
C.该元素一个原子的质量为一个碳-12原子质量的227倍
D.该元素原子核中质子数等于中子数等于核外电子数
B
6.下图为四种粒子的结构示意图,请用对应的序号填空。
属于同种元素的粒子是___________;
属于原子的粒子是____________;
具有相对稳定结构的粒子是_____________;
属于金属元素的粒子是____________;
属于非金属元素的粒子是___________。
BD
CD
AB
C
ABD
学习目标:
1、分析水分子的运动、水的三态变化、水的人工净化,明确分子的特性、物理变化的实质。
2、掌握水的电解和氢气燃烧的相关知识,明确化学变化的实质。
3、了解原子的结构,知道原子内部电子的特性、相对原子质量。
4、明确元素和元素符号的意义,了解元素周期表。
考点1、水的三态变化:
三态变化的实质:水分子的运动导致水的三态变化。水分子获得能量时,运动 ,分子间的间隔 ,水由液态变成了气态;失去能量时,运动 ,分子间的间隔 ,水由气态又变回了液态。
加快
变大
减慢
变小
考点2: 构成物质的基本微粒
1.对于分子构成的物质,分子是
2.分子:
基本性质:⑴、分子很__, ⑵、分子总在不停地____, ⑶、分子之间存在___, ⑷、同种分子__________,不同分子__________.
_________________________。
保持物质化学性质的最小微粒
小
运动
间隔
性质相同
性质不同
考点3、水的净化方法(重点、难点)
1、水的净化方法过程:
①沉降(除去水中颗粒较大的不溶性杂质),(明矾:加速沉降)
②过滤(除去水中不溶性固体杂质)
③吸附(除去颜色或气味)(活性炭:表面疏松多孔)
④蒸馏(除去水中可溶性杂质,净化程度最高---得到的是蒸馏水)、
注:自来水生产过程:沉降,过滤,灭菌。
2、分离物质的方法:
①过滤:分离不溶性固体和液体
②蒸发:分离可溶性固体和液体
③蒸馏:分离沸点不同的液体
3、硬水和软水:
(1)硬水:含有较多可溶性钙、镁矿物质 的天然水。
软水:不含或含较少钙、镁矿物质的水。
(2)鉴别方法:加入肥皂水搅拌,产生泡沫多、浮渣少的为软水,反之为硬水。
(3)硬水软化的方法:煮沸、蒸馏等
考点4、纯净物、混合物、单质、化合物
混合物: 由两种或两种以上的物质组成的物质
纯净物:由单一物质组成的物质
单质: 由一种元素组成的纯净物
化合物:由两种或两种以上元素组成的纯净物
纯净物
混合物
训练反馈一:
1、下列叙述正确的是:( )
A、自然界的物质都是以化合物的形式存在的
B、天然水中的软水是纯净物
C、冰块和水混合得到混合物
D、同种元素组成的纯净物是单质
2.下列物质中,属于纯净物的是( )
A.空气 B.海水 C.白醋 D.液氧
D
D
3、下列分别盛有不同物质的容器中,所盛物质属于混合物的是????????,纯净物的是????????,单质的是????????,化合物的是????????。(均填容器下的代号)
BCE
AD
A
D
4. 如右图是实验过滤操作的示意图,回答下列问题:
(1)仪器名称:①__________
②________ ③_________
(2)过滤时,滤纸要_________漏
斗内壁;滤纸的边缘要 漏
斗边缘, 过滤时液面要 滤纸边缘。
(3)过滤时,烧杯嘴应紧靠______________,玻璃棒应紧靠三层滤纸处,漏斗下端的管口应紧靠烧杯的内壁的原因是______________________________.
①
②
③
烧杯
漏斗
玻璃棒
紧贴
低于
低于
玻璃棒
防止液体四溅
考点5:水的分解与合成
⑴水的
分解
⑵水的合成 实验现象:
结论:
①实验现象:正负极均产生______,体积比约为_____。
②结论:a.水由___________________组成;
b.在化学变化中,_____可以再分,_____不能再分。
气泡
1:2
氢、氧两种元素
分子
原子
考点6、化合反应及分解反应
化合反应
分解反应
概念
由两种或两种以上的物质生成另一种物质的反应
由一种物质生成两种或两种以上其他物质的反应
特点
多变一
一变多
形式
A+B→AB
AB→ A+B
训练反馈二:
1.下列有关水的说法中错误的是( )
A.自然界中的河水、井水和湖水都属于混合物
B.实验室电解水时,正极端玻璃管内的气体是氢气
C.农业上合理使用化肥和农药有利于水资源的保护
D.生活中可以通过煮沸降低水的硬度
B
2. 右下图表示通电分解水的简易装置。回答下列问题:
(1)与A量筒中的电极相连接的是电池的 极,
B量筒中产生的气体是 ______ 。
(2)如果该实验中产生氢气4mL,则生成
氧气 mL。
(3)该实验能证明的结论是:
① _____________________
② ___________________
负
氧气
2
水是由氢氧两种元素组成的
在化学变化中,分子可分,原子不可分
(1)原子的构成
原子
原子核
核外电子
质子
中子
(带正电)
(不带电)
(带负电)
(中心、带正电)
(不显电性)
注:1、质子数=核电荷数=核外电子数=原子序数;
2、不是所有原子核内都有中子。
(例:氢原子核内没有中子。)
考点7.原子
⑵原子中的电子。
①原子的体积是由______决定的。在化学反应中,________是不变的,发生改变的是__________。元素的化学性质是由_______________决定的。一般的,最外层电子数相等,____________________。用_______________表示原子核外电子的排布。
②请画出氧原子的原子结构示意图。
电子
原子核
核外电子
最外层电子
元素的化学性质相似
原子结构示意图
2
6
+8
原子核
质子数
该层电子数
电子层
氧原子结构示意图:
+8
考点8、离子
⑴定义:带电的_______或______。
写出下列离子符号:
钠离子、镁离子、铝离子
硫离子、氯离子、氧离子
⑵分子、原子、离子有何异同?它们之间有什么关系?
原子
原子团
训练反馈三:
1.保持水的化学性质的微粒是( )。
A.氢分子 B.氢原子和氧原子
C.氧分子 D.水分子
2.某R原子,在发生变化时失去2个电子,变成( )
A、R B、R2+ C、R2- D、R+
C
B
3.下列微粒在化学变化中不能再分的是( )。
A.水分子 B.二氧化碳分子 C.氧原子 D.氧化汞分子
4.下列物质中直接由原子构成的是( )。
A.氧气 B.汞
C.二氧化碳 D.水
C
B
5.科学家发现了核电荷数是112的新元素,其相对原子质量约为277。下列说法正确的是( )
A.该元素原子核中中子数为112
B.该元素原子核中中子数为165,核外电子数为112
C.该元素一个原子的质量为一个碳-12原子质量的227倍
D.该元素原子核中质子数等于中子数等于核外电子数
B
6.下图为四种粒子的结构示意图,请用对应的序号填空。
属于同种元素的粒子是___________;
属于原子的粒子是____________;
具有相对稳定结构的粒子是_____________;
属于金属元素的粒子是____________;
属于非金属元素的粒子是___________。
BD
CD
AB
C
ABD
同课章节目录
- 第一单元 步入化学殿堂
- 第一节 化学真奇妙
- 第二节 体验化学探究
- 到实验室去:化学实验基本技能训练(一)
- 第二单元 探秘水世界
- 第一节 运动的水分子
- 第二节 水分子的变化
- 第三节 原子的构成
- 第四节 元素
- 到实验室去:化学实验基本技能训练(二)
- 第三单元 溶液
- 第一节 溶液的形成
- 第二节 溶液组成的定量表示
- 到实验室去:配制一定溶质质量分数的溶液
- 第四单元 我们周围的空气
- 第一节 空气的成分
- 第二节 物质组成的表示
- 第三节 氧气
- 到实验室去:氧气的实验室制取与性质
- 第五单元 定量研究化学反应
- 第一节 化学反应中的质量守恒
- 第二节 化学反应的表示
- 第三节 化学反应中的有关计算
- 到实验室去:探究燃烧的条件
- 第六单元 燃烧与燃料
- 第一节 燃烧与灭火
- 第二节 化石燃料的利用
- 第三节 大自然中的二氧化碳
- 到实验室去:二氧化碳的实验室制取与性质
