山西省古县一中2020-2021学年高二上学期期中考试化学试题
文档属性
| 名称 | 山西省古县一中2020-2021学年高二上学期期中考试化学试题 |  | |
| 格式 | docx | ||
| 文件大小 | 137.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-11-13 07:44:38 | ||
图片预览


文档简介
古县一中2020~2021学年第一学期期中考试试卷
高二化学
(时间:90分钟 满分:100分)
相对原子质量:H 1 C 12 N 14 O 16 Cl 35.5 Fe 56 Mn 55 Ba 137
一、选择题(每小题3分,共48分,每小题只有一个选项符合题意)
43186353327401.反应N2(g)+O2(g)=2NO(g)的能量变化如图所示。已知:断开1mol N2(g)中化学键需吸收946kJ能量,断开1mol O2(g)中化学键需吸收498kJ能量。下列说法正确的是
A.N2(g)+O2(g)=2NO(g) ΔH=-180false
B.NO(g)=1/2N2(g)+1/2O2(g) ΔH=+90false
C.断开1mol NO(g)中化学键需要吸收632kJ能量
D.形成1mol NO(g)中化学键可释放90kJ能量
2. 下列判断反应自发性的描述正确的是
A.焓减少的反应一定可以自发进行 B.焓增加的反应可能自发进行
C.熵增加的反应一定可以自发进行 D.熵减少的反应一定不能自发进行
3. 汽车尾气无害化处理的反应为2NO(g)+2CO(g)?N2(g)+2CO2(g) ΔH<0。下列说法不正确的是
A.升高温度,活化分子百分数增大,正、逆反应速率都加快
B.使用催化剂,活化分子百分数增大,正、逆反应速率都加快
C.使用催化剂可以降低反应的活化能
D.升高温度,上述反应的平衡常数会增大
4. 一定温度下,在体积不变的密闭容器中,对于可逆反应:2HI(g)?H2(g)+I2(g)的下列叙述中,能说明反应已达到平衡的是
A.HI生成的速率与分解的速率相等 B.单位时间内消耗a mol H2,同时生成2a molHI
C.容器内的压强不再变化 D.混合气体的物质的量不再变化
5 .嫦娥二号卫星采用“长三丙火箭”进行发射,其第三级推进器使用的燃料是液态氢。已知在250C时,2 g H2(g)与O2(g)完全反应生成H2O(g)时放热241.8KJ。则下列有关判断正确的是
A. H2(g)的燃烧热是-241.8KJ/mol
B.250C时,H2(g)+1/2O2(g)?H2O(g) ΔH>-241.8KJ/mol
C.250C时,22.4L H2 完全燃烧生成H2O(g)放出的热量为241.8KJ
D.已知H2O(g)H2O(l) ΔH=-44KJ/mol,则H2O(l)H2(g)+1/2O2(g) ΔH=+241.8KJ/mol
6. 下列说法正确的是
A. 可逆反应的特征是正反应速率和逆反应速率相等
B. 在其他条件不变时,使用催化剂只能改变反应速率,而不能改变化学平衡状态
C. 在其他条件不变时,升高温度可以使平衡向放热反应方向移动
D. 在其他条件不变时,增大压强一定会破坏气体反应的平衡状态
7. A2(g)+B2(g)=2AB(g),ΔH>0。下列因素能使活化分子百分数增加的是
A. 降温 B. 使用催化剂 C. 增大反应物浓度 D. 增大气体的压强
8. 以下是反应A(g)+3B(g)2C(g)+2D(g)在四种不同情况下的反应速率,反应速率最大的是
A. υ(A)=0.45mol·L-1·s-1 B. υ(B)=0.6mol·L-1·s-1
C. υ(C)=0.4mol·L-1·s-1 D. υ(D)=0.45mol·L-1·s-1
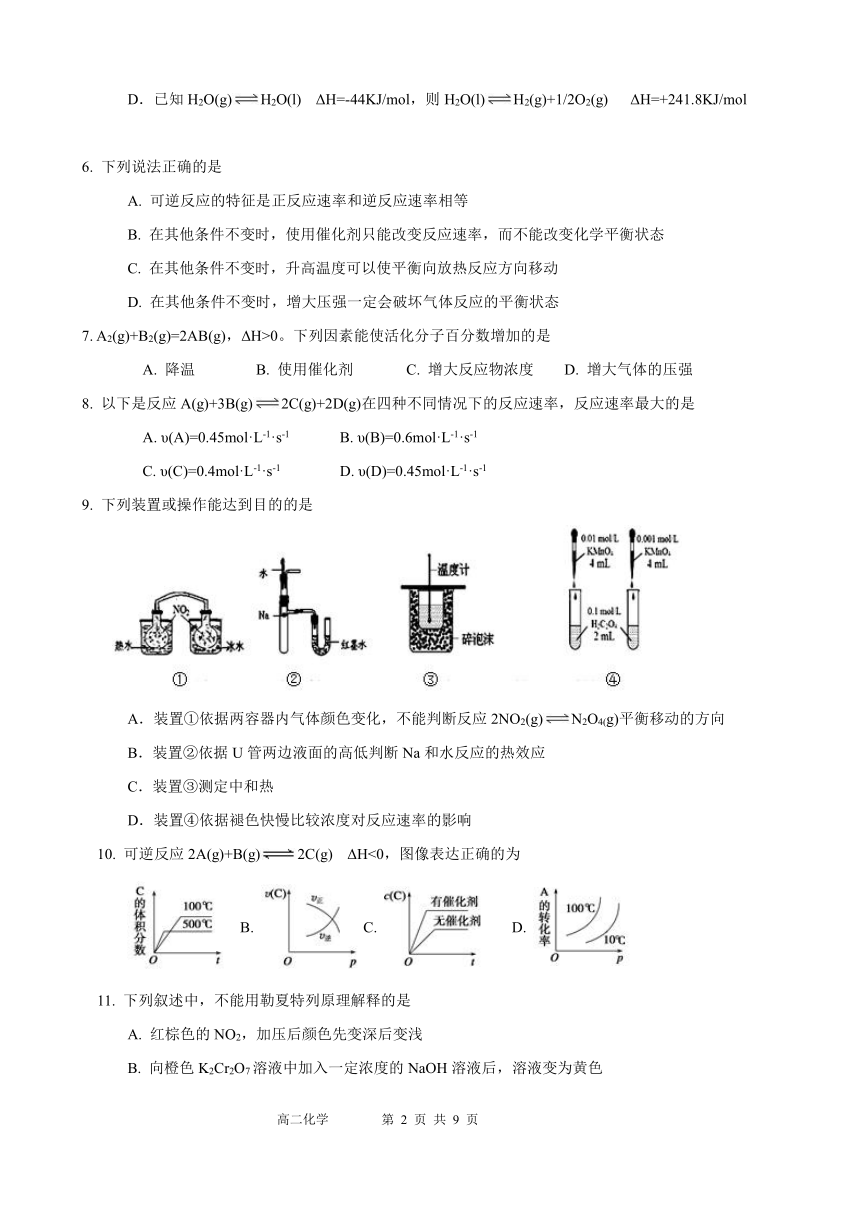
9. 下列装置或操作能达到目的的是
A.装置①依据两容器内气体颜色变化,不能判断反应2NO2(g)N2O4(g)平衡移动的方向
B.装置②依据U管两边液面的高低判断Na和水反应的热效应
C.装置③测定中和热
D.装置④依据褪色快慢比较浓度对反应速率的影响
10. 可逆反应2A(g)+B(g)2C(g) ΔH<0,图像表达正确的为
B. C. D.
11. 下列叙述中,不能用勒夏特列原理解释的是
A. 红棕色的NO2,加压后颜色先变深后变浅
B. 向橙色K2Cr2O7溶液中加入一定浓度的NaOH溶液后,溶液变为黄色
C. 对2HI(g)H2(g)+I2(g)平衡体系增大压强使气体颜色变深
D. 溴水中有下列平衡Br2+H2OHBr+HBrO,当加入AgNO3溶液后,溶液颜色变浅
12. —定温度下,0.1mol N2(g)与0.3mol H2(g)在密闭容器中发生反应:N2(g)+3H2(g)2NH3(g)
ΔH=-akJ·mol-1(a>0)。下列说法正确的是
A.达到化学平衡状态时,反应放出0.la kJ热量
B. 达到化学平衡状态时,v正(NH3)∶v逆(N2)=2∶1
C. n(N2)∶n(H2)∶n(NH3)=l∶3∶2时,说明该反应达到平衡
D. 缩小容器体积,用氮气表示的反应速率:v正(N2)增大,v逆(N2)减小
13. 已知反应:①2C(s)+O2(g)=2CO(g) ΔH=-221 kJ/mol
② 稀溶液中,H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3 kJ/mol
下列结论正确的是
A. 碳的燃烧热为ΔH=-110.5 kJ/mol
B. 1mol C(s)所具有的能量一定高于1mol CO(g)所具有的能量
C. 稀硫酸与稀NaOH溶液反应的中和热为ΔH=-57.3 kJ/mol
D. 稀醋酸与稀NaOH溶液反应生成1mol水,也放出57.3 kJ热量
14. 在密闭容中发生下列反应aA(g)cC(g)+dD(g),反应达到平衡后,将气体体积压缩到原来的一半,当再次达到平衡时,D的浓度为原平衡的1.8倍,下列叙述正确的是
A. A的转化率变大 B. 平衡向正反应方向移动 C. D的体积分数变大 D. a<c+d
15. 对于2SO2(g)+O2(g)2SO3(g),ΔH<0,根据下图,下列说法错误的是
A. t2时使用了催化剂 B. t3时采取减小反应体系压强的措施
C. t5时采取升温的措施 D. 反应在t6时刻,SO3体积分数最大
16. 密闭容器中盛有1mol PCl5,加热到 200℃时发生了反应:PCl5(g)PCl3(g)+Cl2(g),反应达到平衡时PCl5的分解率为M%,若在同一温度和同样容器中最初投入的是2mol PCl5,反应达到平衡时PCl5的分解率为N%。M与N的关系是
A. M>N B. M二、实验题
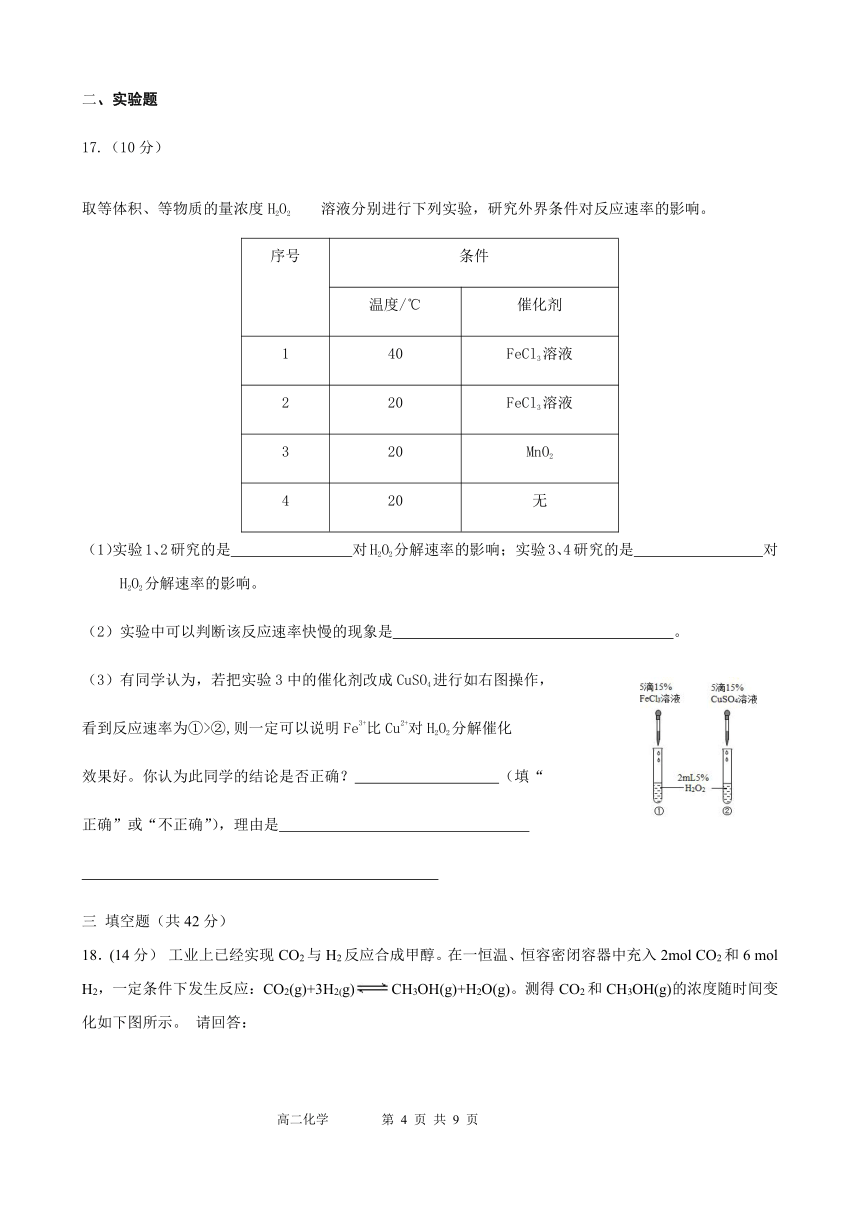
17.(10分)
取等体积、等物质的量浓度H2O2溶液分别进行下列实验,研究外界条件对反应速率的影响。
序号
条件
温度/℃
催化剂
1
40
FeCl3溶液
2
20
FeCl3溶液
3
20
MnO2
4
20
无
(1)实验1、2研究的是 对H2O2分解速率的影响; 实验3、4研究的是 对H2O2分解速率的影响。
(2)实验中可以判断该反应速率快慢的现象是 。
4911725127000(3)有同学认为,若把实验3中的催化剂改成CuSO4进行如右图操作,
看到反应速率为①>②,则一定可以说明Fe3+比Cu2+对H2O2分解催化
效果好。你认为此同学的结论是否正确? (填“
正确”或“不正确”),理由是
三 填空题(共42分)
18.(14分) 工业上已经实现CO2与H2反应合成甲醇。在一恒温、恒容密闭容器中充入2mol CO2和6 mol H2,一定条件下发生反应:CO2(g)+3H2(g)CH3OH(g)+H2O(g)。测得CO2和CH3OH(g)的浓度随时间变化如下图所示。 请回答:
‘
(1)该密闭容器的容积是__________L。
(2)达到平衡状态的时刻是__________min(填“3”或“10”)。
(3)在前10min内,用CO2浓度的变化表示的反应速率false(CO2)=_________mol/(L·min)。
(4)10min时体系的压强与开始时压强之比为______。
(5)该温度下,反应的化学平衡常数数值是____。
(6)已知:①CO(g)+2H2(g)CH3OH(g) ΔH= -90.1kJ·mol-1 ②CO(g)+H2O(g)CO2(g)+H2(g) ΔH= -41.1kJ·mol-1,则CO2与H2反应合成CH3OH(g)的热化学方程式为_____,反应在10 min内所放出的热量为_____kJ。
19.(14分)研究含氮污染物的治理是环保的一项重要工作。合理应用和处理氮的化合物,在生产生活中有重要意义。
(1)已知:N2(g)+O2(g)=2NO(g) ΔH=+180.5 kJ·mol?1
2C(s)+O2(g)=2CO(g) ΔH=﹣221.0 kJ·mol?1
C(s)+O2(g)=CO2(g) ΔH=﹣393.5 kJ·mol?1
则汽车尾气处理的反应之一:2NO(g)+2CO(g)=N2(g)+2CO2(g) ΔH=_____ kJ·mol?1,利于该反应自发进行的条件是_______(选填“高温”或“低温”)。
(2)将0.20mol NO和0.10mol CO充入一个容积恒定为1L的密闭容器中发生反应:
2NO(g)+2CO(g)N2(g)+2CO2(g),反应过程中部分物质的浓度变化如图所示:
①反应从开始到9min时,用CO2表示该反应的速率是____________________(保留2位有效数字)
②第12min时改变的条件是______________(填“升温或降温”)。
③第18min时建立新的平衡,此温度下的平衡常数为______________(列计算式),第24min时,若保持温度不变,再向容器中充入CO和N2各0.060mol,平衡将_____移动(填“正向”、“逆向”或“不”)。
(3)若该反应在绝热、恒容的密闭体系中进行,下列示意图正确且能说明反应在t1时刻达到平衡状态的是________________(填序号)。
(如图中v正、K、n、m分别表示正反应速率、平衡常数、物质的量和质量)
20.(14分)(1)在2L密闭容器中,起始投入4mol N2和6mol H2在一定条件下生成NH3,平衡时仅改变温度测得的数据如表所示(已知:T1①则K1______K2(填“>”、“<”或“=”),原因:_______。
②在T2下,经过10s达到化学平衡状态,则0~10s内N2的平均速率v(N2)为______,平衡时H2的转化率为______。若再同时增加各物质的量为1mol,该反应的平衡V正_____V逆,(>或=或<)平衡常数将_____(填“增大”、“减小”或“不变”)
③下列能说明该反应已达到平衡状态的是___。
A. 3v(H2)正=2v(NH3)逆 B. 容器内气体压强不变
C. 混合气体的平均相对分子质量不再改变的状态 D. ΔH保持不变
(2)已知下列化学键的键能写出工业上制氨的热化学方程式:
化学键
H-H
N≡N
N-H
键能/kJ·mol-1
430
936
390
热化学方程式:__________。
2020-2021学年第一学期期中考试试题(卷)
高二化学答案
选择题(每小题3分,共48分,每小题只有一个选项符合题意)
1—5 CBDAB 6—10 BBABA 11—15 C BCDD 16 A
实验题
(10分,每空2分)
温度;催化剂
产生气泡的快慢
不正确 因为实验可能受到阴离子的干扰
(14分,每空2分)
【答案】(1)2
(2)10
(3)0.075
(4)5∶8
(5)5.3
CO2(g)+3H2(g)CH3OH(g) ΔH=-49kJ/mol 73.5
(14分,每空2分)
【答案】(1)ΔH=﹣746.5KJ/mol 低温
(2)0.0044 mol·(L·min)?1 升温 逆向
BD
(14分,1,5空1分其余每空2分)
【答案】(1)①> 温度升高,nNH3在减小,平衡逆向移动,ΔH<0,温度升高K在减小
②0.05mol/ mol/(L·s) 50﹪ > 不变
③ BC
(2)N2(g)+3H2(g)2NH3(g),ΔH=-114kJ/mol
高二化学
(时间:90分钟 满分:100分)
相对原子质量:H 1 C 12 N 14 O 16 Cl 35.5 Fe 56 Mn 55 Ba 137
一、选择题(每小题3分,共48分,每小题只有一个选项符合题意)
43186353327401.反应N2(g)+O2(g)=2NO(g)的能量变化如图所示。已知:断开1mol N2(g)中化学键需吸收946kJ能量,断开1mol O2(g)中化学键需吸收498kJ能量。下列说法正确的是
A.N2(g)+O2(g)=2NO(g) ΔH=-180false
B.NO(g)=1/2N2(g)+1/2O2(g) ΔH=+90false
C.断开1mol NO(g)中化学键需要吸收632kJ能量
D.形成1mol NO(g)中化学键可释放90kJ能量
2. 下列判断反应自发性的描述正确的是
A.焓减少的反应一定可以自发进行 B.焓增加的反应可能自发进行
C.熵增加的反应一定可以自发进行 D.熵减少的反应一定不能自发进行
3. 汽车尾气无害化处理的反应为2NO(g)+2CO(g)?N2(g)+2CO2(g) ΔH<0。下列说法不正确的是
A.升高温度,活化分子百分数增大,正、逆反应速率都加快
B.使用催化剂,活化分子百分数增大,正、逆反应速率都加快
C.使用催化剂可以降低反应的活化能
D.升高温度,上述反应的平衡常数会增大
4. 一定温度下,在体积不变的密闭容器中,对于可逆反应:2HI(g)?H2(g)+I2(g)的下列叙述中,能说明反应已达到平衡的是
A.HI生成的速率与分解的速率相等 B.单位时间内消耗a mol H2,同时生成2a molHI
C.容器内的压强不再变化 D.混合气体的物质的量不再变化
5 .嫦娥二号卫星采用“长三丙火箭”进行发射,其第三级推进器使用的燃料是液态氢。已知在250C时,2 g H2(g)与O2(g)完全反应生成H2O(g)时放热241.8KJ。则下列有关判断正确的是
A. H2(g)的燃烧热是-241.8KJ/mol
B.250C时,H2(g)+1/2O2(g)?H2O(g) ΔH>-241.8KJ/mol
C.250C时,22.4L H2 完全燃烧生成H2O(g)放出的热量为241.8KJ
D.已知H2O(g)H2O(l) ΔH=-44KJ/mol,则H2O(l)H2(g)+1/2O2(g) ΔH=+241.8KJ/mol
6. 下列说法正确的是
A. 可逆反应的特征是正反应速率和逆反应速率相等
B. 在其他条件不变时,使用催化剂只能改变反应速率,而不能改变化学平衡状态
C. 在其他条件不变时,升高温度可以使平衡向放热反应方向移动
D. 在其他条件不变时,增大压强一定会破坏气体反应的平衡状态
7. A2(g)+B2(g)=2AB(g),ΔH>0。下列因素能使活化分子百分数增加的是
A. 降温 B. 使用催化剂 C. 增大反应物浓度 D. 增大气体的压强
8. 以下是反应A(g)+3B(g)2C(g)+2D(g)在四种不同情况下的反应速率,反应速率最大的是
A. υ(A)=0.45mol·L-1·s-1 B. υ(B)=0.6mol·L-1·s-1
C. υ(C)=0.4mol·L-1·s-1 D. υ(D)=0.45mol·L-1·s-1
9. 下列装置或操作能达到目的的是
A.装置①依据两容器内气体颜色变化,不能判断反应2NO2(g)N2O4(g)平衡移动的方向
B.装置②依据U管两边液面的高低判断Na和水反应的热效应
C.装置③测定中和热
D.装置④依据褪色快慢比较浓度对反应速率的影响
10. 可逆反应2A(g)+B(g)2C(g) ΔH<0,图像表达正确的为
B. C. D.
11. 下列叙述中,不能用勒夏特列原理解释的是
A. 红棕色的NO2,加压后颜色先变深后变浅
B. 向橙色K2Cr2O7溶液中加入一定浓度的NaOH溶液后,溶液变为黄色
C. 对2HI(g)H2(g)+I2(g)平衡体系增大压强使气体颜色变深
D. 溴水中有下列平衡Br2+H2OHBr+HBrO,当加入AgNO3溶液后,溶液颜色变浅
12. —定温度下,0.1mol N2(g)与0.3mol H2(g)在密闭容器中发生反应:N2(g)+3H2(g)2NH3(g)
ΔH=-akJ·mol-1(a>0)。下列说法正确的是
A.达到化学平衡状态时,反应放出0.la kJ热量
B. 达到化学平衡状态时,v正(NH3)∶v逆(N2)=2∶1
C. n(N2)∶n(H2)∶n(NH3)=l∶3∶2时,说明该反应达到平衡
D. 缩小容器体积,用氮气表示的反应速率:v正(N2)增大,v逆(N2)减小
13. 已知反应:①2C(s)+O2(g)=2CO(g) ΔH=-221 kJ/mol
② 稀溶液中,H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3 kJ/mol
下列结论正确的是
A. 碳的燃烧热为ΔH=-110.5 kJ/mol
B. 1mol C(s)所具有的能量一定高于1mol CO(g)所具有的能量
C. 稀硫酸与稀NaOH溶液反应的中和热为ΔH=-57.3 kJ/mol
D. 稀醋酸与稀NaOH溶液反应生成1mol水,也放出57.3 kJ热量
14. 在密闭容中发生下列反应aA(g)cC(g)+dD(g),反应达到平衡后,将气体体积压缩到原来的一半,当再次达到平衡时,D的浓度为原平衡的1.8倍,下列叙述正确的是
A. A的转化率变大 B. 平衡向正反应方向移动 C. D的体积分数变大 D. a<c+d
15. 对于2SO2(g)+O2(g)2SO3(g),ΔH<0,根据下图,下列说法错误的是
A. t2时使用了催化剂 B. t3时采取减小反应体系压强的措施
C. t5时采取升温的措施 D. 反应在t6时刻,SO3体积分数最大
16. 密闭容器中盛有1mol PCl5,加热到 200℃时发生了反应:PCl5(g)PCl3(g)+Cl2(g),反应达到平衡时PCl5的分解率为M%,若在同一温度和同样容器中最初投入的是2mol PCl5,反应达到平衡时PCl5的分解率为N%。M与N的关系是
A. M>N B. M
17.(10分)
取等体积、等物质的量浓度H2O2溶液分别进行下列实验,研究外界条件对反应速率的影响。
序号
条件
温度/℃
催化剂
1
40
FeCl3溶液
2
20
FeCl3溶液
3
20
MnO2
4
20
无
(1)实验1、2研究的是 对H2O2分解速率的影响; 实验3、4研究的是 对H2O2分解速率的影响。
(2)实验中可以判断该反应速率快慢的现象是 。
4911725127000(3)有同学认为,若把实验3中的催化剂改成CuSO4进行如右图操作,
看到反应速率为①>②,则一定可以说明Fe3+比Cu2+对H2O2分解催化
效果好。你认为此同学的结论是否正确? (填“
正确”或“不正确”),理由是
三 填空题(共42分)
18.(14分) 工业上已经实现CO2与H2反应合成甲醇。在一恒温、恒容密闭容器中充入2mol CO2和6 mol H2,一定条件下发生反应:CO2(g)+3H2(g)CH3OH(g)+H2O(g)。测得CO2和CH3OH(g)的浓度随时间变化如下图所示。 请回答:
‘
(1)该密闭容器的容积是__________L。
(2)达到平衡状态的时刻是__________min(填“3”或“10”)。
(3)在前10min内,用CO2浓度的变化表示的反应速率false(CO2)=_________mol/(L·min)。
(4)10min时体系的压强与开始时压强之比为______。
(5)该温度下,反应的化学平衡常数数值是____。
(6)已知:①CO(g)+2H2(g)CH3OH(g) ΔH= -90.1kJ·mol-1 ②CO(g)+H2O(g)CO2(g)+H2(g) ΔH= -41.1kJ·mol-1,则CO2与H2反应合成CH3OH(g)的热化学方程式为_____,反应在10 min内所放出的热量为_____kJ。
19.(14分)研究含氮污染物的治理是环保的一项重要工作。合理应用和处理氮的化合物,在生产生活中有重要意义。
(1)已知:N2(g)+O2(g)=2NO(g) ΔH=+180.5 kJ·mol?1
2C(s)+O2(g)=2CO(g) ΔH=﹣221.0 kJ·mol?1
C(s)+O2(g)=CO2(g) ΔH=﹣393.5 kJ·mol?1
则汽车尾气处理的反应之一:2NO(g)+2CO(g)=N2(g)+2CO2(g) ΔH=_____ kJ·mol?1,利于该反应自发进行的条件是_______(选填“高温”或“低温”)。
(2)将0.20mol NO和0.10mol CO充入一个容积恒定为1L的密闭容器中发生反应:
2NO(g)+2CO(g)N2(g)+2CO2(g),反应过程中部分物质的浓度变化如图所示:
①反应从开始到9min时,用CO2表示该反应的速率是____________________(保留2位有效数字)
②第12min时改变的条件是______________(填“升温或降温”)。
③第18min时建立新的平衡,此温度下的平衡常数为______________(列计算式),第24min时,若保持温度不变,再向容器中充入CO和N2各0.060mol,平衡将_____移动(填“正向”、“逆向”或“不”)。
(3)若该反应在绝热、恒容的密闭体系中进行,下列示意图正确且能说明反应在t1时刻达到平衡状态的是________________(填序号)。
(如图中v正、K、n、m分别表示正反应速率、平衡常数、物质的量和质量)
20.(14分)(1)在2L密闭容器中,起始投入4mol N2和6mol H2在一定条件下生成NH3,平衡时仅改变温度测得的数据如表所示(已知:T1
②在T2下,经过10s达到化学平衡状态,则0~10s内N2的平均速率v(N2)为______,平衡时H2的转化率为______。若再同时增加各物质的量为1mol,该反应的平衡V正_____V逆,(>或=或<)平衡常数将_____(填“增大”、“减小”或“不变”)
③下列能说明该反应已达到平衡状态的是___。
A. 3v(H2)正=2v(NH3)逆 B. 容器内气体压强不变
C. 混合气体的平均相对分子质量不再改变的状态 D. ΔH保持不变
(2)已知下列化学键的键能写出工业上制氨的热化学方程式:
化学键
H-H
N≡N
N-H
键能/kJ·mol-1
430
936
390
热化学方程式:__________。
2020-2021学年第一学期期中考试试题(卷)
高二化学答案
选择题(每小题3分,共48分,每小题只有一个选项符合题意)
1—5 CBDAB 6—10 BBABA 11—15 C BCDD 16 A
实验题
(10分,每空2分)
温度;催化剂
产生气泡的快慢
不正确 因为实验可能受到阴离子的干扰
(14分,每空2分)
【答案】(1)2
(2)10
(3)0.075
(4)5∶8
(5)5.3
CO2(g)+3H2(g)CH3OH(g) ΔH=-49kJ/mol 73.5
(14分,每空2分)
【答案】(1)ΔH=﹣746.5KJ/mol 低温
(2)0.0044 mol·(L·min)?1 升温 逆向
BD
(14分,1,5空1分其余每空2分)
【答案】(1)①> 温度升高,nNH3在减小,平衡逆向移动,ΔH<0,温度升高K在减小
②0.05mol/ mol/(L·s) 50﹪ > 不变
③ BC
(2)N2(g)+3H2(g)2NH3(g),ΔH=-114kJ/mol
同课章节目录
