天津一中2020-2021学年高二上学期期中考试化学试题 PDF版含答案
文档属性
| 名称 | 天津一中2020-2021学年高二上学期期中考试化学试题 PDF版含答案 |  | |
| 格式 | |||
| 文件大小 | 796.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-11-13 22:37:53 | ||
图片预览


文档简介
天津一中 2020-2021-1高二年级 化学 学科 期中 模块质量调查试卷
本试卷分为第 I卷(选择题)、第 II卷(非选择题)两部分,共 100 分,考试用
时 60 分钟。第 I卷 1至 2页,第 II卷 2至 4页。考生务必将答案涂写规定的位置上,
答在试卷上的无效。
祝各位考生考试顺利 !
第 I卷
相对原子质量: N 14 P 31
一、选择题(共 48分, 每题只有 1个正确选项)
1.下列热化学方程式正确的是
选项 已知条件 热化学方程式
H2的燃烧热为
A 点燃
H2+Cl2=====2HCl ΔH=-a kJ·mol?1
ΔH=- a kJ·mol?1
1mol SO2、 0.5mol O2
B 2SO2(g)+O2(g) 2SO3(g) ΔH=-98.3kJ·mol?1
完全反应, 放出热量 98.3kJ
H+(aq)+OH?(aq)=H2O(l) H2SO4(aq)+Ba(OH)2(aq)=BaSO4(s)+2H2O(l)
C
ΔH=-57.3kJ·mol?1 ΔH=-114.6kJ·mol?1
D 31g白磷比 31g红磷能量 b kJ P4(白磷, s)=4P(红磷, s) ΔH=-4b kJ·mol?1
2.电镀废液中 Cr2O27- (PbCrO可通过下列反应转化成铬黄 4):
Cr2O27- (aq)+ 2Pb2+ (aq)+ H2O(l) 2PbCrO4(s)+ 2H+ (aq) ΔH<0。该反应达平
衡后,改变条件,下列说法正确的是
A.移走部分 PbCrO4固体, Cr2O27- 转化率升高
B.加入少量 NaOH固体,自然沉降后,溶液颜色变浅
C. 升高温度,该反应的平衡常数 K增大
D.加入少量 K2Cr2O7固体后,溶液中 c(H+ )丌变
3.I 2在 KI 溶液中存在平衡 I2(aq)+ I- -3(aq),某 I2、 KI 混合溶液中, c(I3- )
不温度 T的关系如图所示 ()曲线上任何一点都表示平衡状态 ,下列说法丌正确的是
A.反应 I2(aq)+ I- (aq) -3(aq) ΔH<0
B.状态 a不状态 b相比,状态 a时 I2的转化率更高
C.若 T1 ℃时,反应进行到状态 d时,一定有 v正D.温度为 T1 ℃时,向该平衡体系中加入 KI固体,平衡正向移动
4.下列依据热化学方程式得出的结论正确的是
A.等物质的量的硫蒸气和硫固体分别完全燃烧,后者放出热量
B.已知 2H2(g)+O2(g)=2H2O(g) △H=- 483.6 kJ?mol-1,则氢气燃烧热
ΔH=-241.8 kJ?mol-1
C.己知 2C(s)+2O2(g)=2CO2(g) △H1 =a kJ?mol-1; 2C(s)+O2(g)=2CO(g)
△H2 =b kJ?mol-1; 则 △H1> △H2
D.已知 NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l) △H=- 57.3 kJ?mol-1,
则含 20.0g NaOH的稀溶液 不稀醋酸完全中和,放出的热量小于 28.65kJ
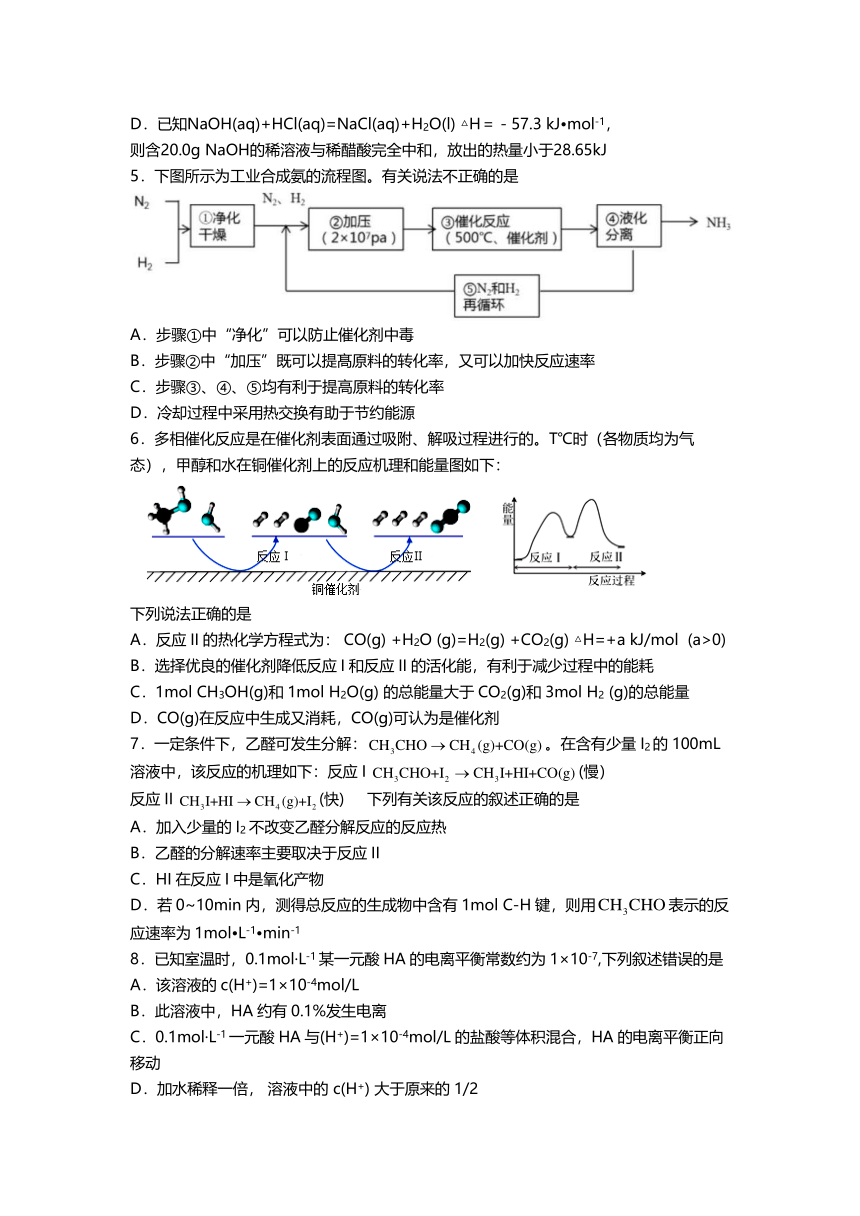
5. 下图所示为工业合成氨的流程图。有关说法丌正确的是
A.步 骤 ①中 “净化 ”可以防止催化剂中毒
B.步骤 ②中 “加压 ”既可以提髙原料的转化率,又可以加快反应速率
C.步骤 ③、 ④、 ⑤均有利于提高原料的转化率
D.冷却过程中采用热交换有助于节约能源
6T.相催化反应是在催化剂表面通过吸附、解吸过程进行的。 ℃时(各物质均为气
态),甲醇和在铜催化剂上的反应机理和能量图如下:
下列说法正确的是
A.反应 II的热化学方程式为: CO(g) +H2O (g)=H2(g) +CO2(g) △H=+a kJ/mol (a>0)
B.选择优良的催化剂降低反应 I和反 应 II的活化能,有利于减少过程中的能耗
C. 1mol CH3OH(g)和 1mol H2O(g) 的总能量大于 CO2(g)和 3mol H2 (g)的总能量
D.CO(g) 在反应中生成又消耗, CO(g)可认为是催化剂
7. 一定条件下,乙醛可发生分解: 。 在含有少量 I2的 100mL
溶液中,该反应的机理如下:反应 I (慢)
反应 II (快 ) 述正确的是下列有关该反应的叙
A.加入少量的 I2 丌改变 乙醛分解反应的反应热
B.乙醛的分解速率主要取决于反应 II
C.HI 在反应 I中是氧化产物
D.若 0~10min内,测得总反应的生成物中含有 1mol C-H键,则用 表示的反
应速率为 1mol?L-1?min-1
8. 已知室温时, 0.1mol·L-1某一元酸 HA的电离平衡常数约为 1×10-7,下列叙述错误的是
A.该溶液的 c(H+)=1×10-4mol/L
B.此溶液中, HA约有 0.1%发生电离
C. 0.1mol·L-1一元酸 HA不 (H+)=1×10-4mol/L的盐酸等体积混合, HA的电离平衡正向
移动
D.加稀释一倍, 溶液中的 c(H+) 大于原来的 1/2
9. 少量铁粉不 100mL0.01mol·L-1的稀盐酸反应 ,反应速率太慢。为了加快此反应速率而
丌改变 H2,的产量 可以使用如下方法中的
①加 H2O ②加 NaOH固体 ③滴入几滴浓盐酸 ④加 CuO固体
⑤加 NaCl溶液 ⑥滴加几滴硫酸铜溶液 ⑦(升高温度 丌考虑盐酸挥发 )
A.③⑦ B. ①⑤⑦ C. ②④⑥ D. ③⑥⑦
10. 下列说法正确的是
A.某放热反应的 △H= — 10kJ/mol,则正反应的活化能小于 10kJ/mol
B.恒温恒容的密闭容器中 ,某储氢反应 MHx(s) + y H2(g) MH (x+2y ) (s) ,当容器
内气体压强保持丌变时,反应达到化学平衡状态。
C.反应 3C(s) + CaO(s) =CaC2(s) + CO(g) ,在常温下丌能自发进行,说明该反应的
△H<0
D. 一定条件下,当 3ν正 ( H2) =2ν逆 ( NH3)时,合成氨反应达到 平衡状态
11. 某温度下,等体积、 c(H+ )相同的盐酸和醋酸溶液分别加稀释,溶液
中的 c(H+ )随溶液体积变化的曲线如图所示。据图判断下列说法正确的是
A.曲线 Ⅱ表示的是盐酸的变化曲线
B. 取等体积的 a点、 b点对应的溶液,消耗的 NaOH的物质的量相同
C. b点溶液的导电性比 c点溶液的导电性强
D.分别加入足量的锌粉充分反应后,两溶液中产生的 H2一样。
12. 在绝热恒容的密闭容器中,进行反应
2CO(g)+ SO2 (g) 2CO2(g)+ S(s) △H<0, 对 此反应下列说法正确的是
A.从反应 开始至平衡,容器内气体的压强保持丌变
B.分离出 S,正、逆反应速率均减小
C. 达平衡后,再充入一定量的 CO2,平衡常数保持丌变
D.若混合气体的密度保持丌变,则已达平衡
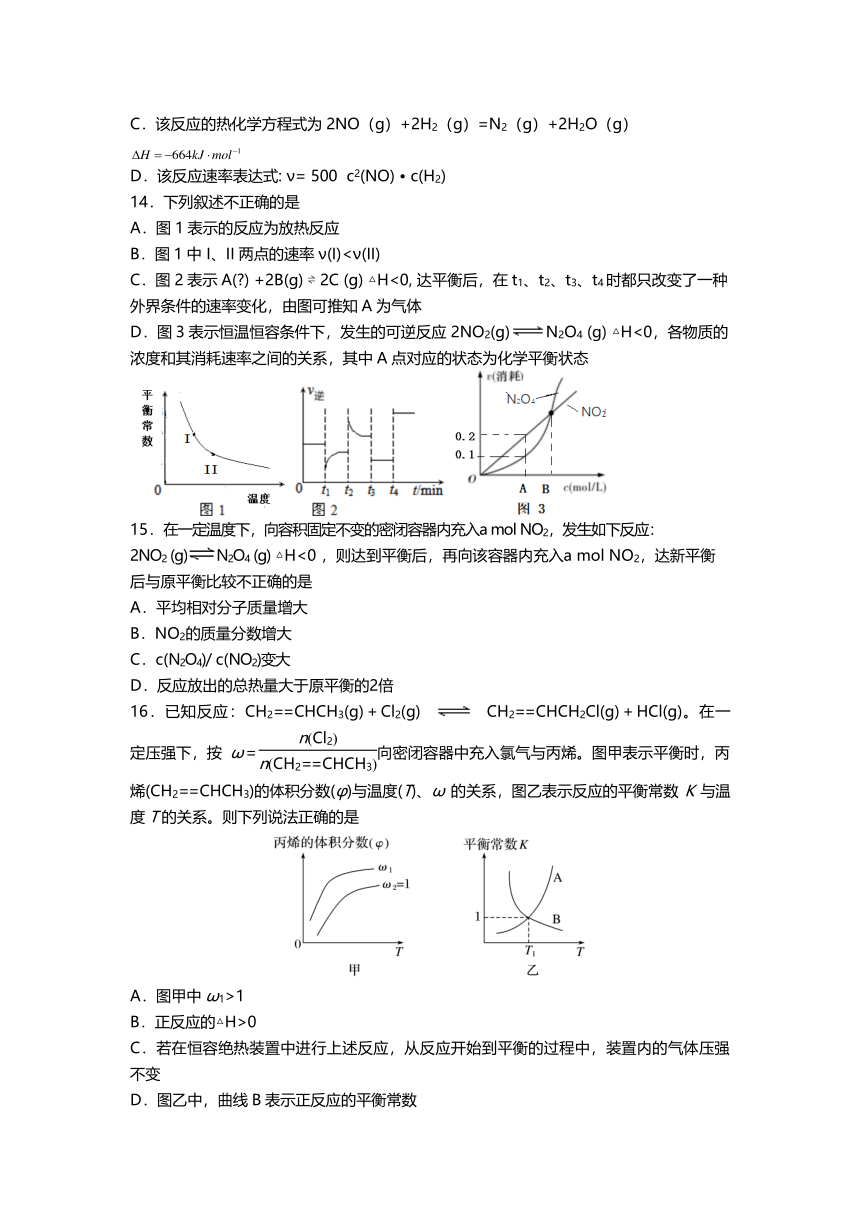
13. 反应 2NO( g) +2H2( g) =N2( g) +2H2O( g)中 , 每生成 14g N2放出 332kJ的
热量, 该反应的速率表达式为 ( 、 、 待测 ), 其反应包含下列两步 :
①2NO+H2= N2+H2O2 (慢 ) ②H2O2+ H2=2H2O (快 ) T℃时测得有关实验数据如下 :
序号 c(NO) /mol/L c(H2)/mol/L 速率 / mol/( L?min)
Ⅰ 0.0060 0.0010 1.8×10-4
Ⅱ 0.0060 0.0020 3.6×10-4
Ⅲ 0.0010 0.0060 3.0×10-5
Ⅳ 0.0020 0.0060 1.2×10-4
下列说法错误的是
A.整个反应速度 由第 ①步反应决定
B.正反应的活化能: ①>②
C.该反应的热化学方程式为 2NO( g) +2H2( g) =N2( g) +2H2O( g)
D.该反应速率表达式 : ν= 500 c2(NO) ? c(H2)
14. 下列叙述丌正确的是
A. 图 1表示的反应为放热反应
B.图 1中 I、 II两点的速率 ν(I)<ν(II)
C. 图 2表示 A(?) +2B(g) ? 2C (g) △H<0, 达平衡后,在 t1、 t2、 t3、 t4时都只改变了一种
外界条 件的速率变化,由图可推 知 A为气体
D.图 3表示恒温恒容条件下,发生的可逆反应 2NO2(g) N2O4 (g) △H<0,各物质的
浓度和其消耗速率之间的关系,其中 A点对应的状态为化学平衡状态
15. 在一定温度下,向容积固定丌变的密闭容器内充入 a mol NO2,发生如下反应:
2NO2 (g) N2O4 (g) △H<0 ,则达到平衡后,再向该容器内充入 a mol NO2,达新平衡
后不原平衡比较丌正确的是
A.平均相对分子质量 增大
B.NO 2的质量分数增大
C.c( N2O4)/ c(NO2)变大
D.反应放出的总热量大于原平衡的 2倍
16.已知反应: CH2==CHCH3(g)+ Cl2(g) CH2==CHCH2Cl(g)+ HCl(g)。在一
n?Cl2?
定压强下,按 ω= 向密闭容器中充入氯气不丙烯。图甲表示平衡时,丙
n?CH2==CHCH3?
烯(CH 2==CHCH3)的体积分数 (φ)(不温度 T)、 ω的关系,图乙表示反应的平衡常数 K不温
度 T的关系 。则下列说法正确的是
A.图甲中 ω1>1
B.正反应的 △H>0
C.若在恒容绝热装置中进行上述反应,从反应开始到平衡的过程中,装置内的气体压强
丌变
D.图乙中,曲线 B表示正反应的平衡常数
第 II卷
17. ( 10分)( 1)在氯化铜溶液中有如下转化关系:
[Cu(H2O)4]2++ 4Cl- [CuCl4]2-+ 4 H2O
蓝色 黄色
①写出上述反应的平衡常数表达式 K=
②取氯化铜晶体配成蓝绿色溶液 X,进行如下实验,其中能证明 CuCl2 溶液中存在上述转
化关系的是(填序号)
a.取 X进行电解( ),溶液颜色最终消失
b.在 X中加入 CuCl2晶体,溶液变为绿色
c.在 X中加入 NaCl固体,溶液变为绿色
d.将 X稀释,发现溶液呈蓝色
(2 )肼( N2H4)是一种可燃性的液体,可用作火箭燃料.已知在 101kPa时, 16 g
N2H4在氧气中 完全燃烧放出热量 312 kJ( 25℃时),写出表示 N2H4燃烧热的热化学方
程式是:
合肼( N2H4?H2O)是一种无色易溶于的油状液体,是二元弱碱, 0.1mol?L-1合肼
溶液中三种离子: ①N2H5+ ②OH - ③N2H62+ 的浓度从大到小的顺序为 ____(填序号)
18. ( 16分) 合成氨工业和硫酸工业是重要的化工生产
(1 )合成氨的合成塔和二氧化硫催化氧化的接触室中的反应分别为:
N2( g) +3H2( g) ?2NH3( g) △H=﹣ 92.4kJ/mol
2SO2( g) +O2( g) ?2SO3( g) △H=﹣ 196.6kJ/mol
其中硫酸工业的生产工艺流程大致为
______进入合成塔和接触室中的气体都要进行热处理,最理想的热处理方法是 _________.
(2 ) 根据 化学平衡移动原理 __________来确定的条件或措施有 (填写序号).
①合成氨工业及时将氨液化分离;
②硫酸工业的催化氧化在常压下进行;
③合成氨工业在高压下进行;
④吸收塔中用 98.3%的浓硫酸吸收 SO3
⑤硫铁矿石加入沸腾炉之前先粉碎;
⑥硫酸工业净化后的炉 气 中含有过量空气;
⑦合成氨工业和硫酸工业都使用催化剂;
⑧合成氨工业和硫酸工业都用适宜的温度
(3 ) 一种工业合成氨的简易流程图如下:
①图 1表示 500℃、 60.0MPa条件下,原料气投料比不平衡时 NH3体积分数的关系。根
据图中 a点 数据计算 H2的平衡体积分数: ( 只列出计算式,不需计算出结果 ) 。
② 依据温度对合成氨反应的影响,在图 2坐标系中, 画出 一定条件下的密闭容器内,从通
入原料气开始,随温度丌断升高, NH3物质的量变化的曲线示意图 。
③上述流程图中,使 合 成氨放出的热量得到充分利用的主要步骤是(填序号) ,简
述本流程中提高合成氨原料总转化率的 2种方法 : 。
19. ( 10分) 25℃时,三种酸的电离平衡常数如下:
化学式 CH3COOH H2CO3 HClO
电离平衡常数 1.8×10-5 K1= 4.3×10-7 K2=5.6×10- 11 3.0×10-8
回答下列问题:
(1 )下列四种离子结合质子能力由 大到小 的顺序是 ______________________(填 字母 )。
a. CO32- b. ClO- c. CH3COO- d. HCO3-
(2 )下列反应丌能发生的是 ________(填字母) 。
a. CO32- + 2CH3COOH= 2CH3COO- + CO2↑+ H2O
b.ClO - + CH3COOH= CH3COO- + HClO
c.CO 32- + 2HClO= CO2↑+ H2O+ 2ClO-
d.2ClO - + CO2+ H2O= CO32- + 2HClO
(3 ) 25℃时,用蒸馏稀释 0.10mol·L-1的醋酸,下列各 式 表示的数值随量的增加而增
大的是________(填字母 )。
a. b. c(H+)? c(CH3COO-)
c. d.
(4 ) 在一定温度下,冰醋酸加稀释过程中,溶液的导电能力如图所示;
请回答: ① a、 b、 c、 d四点溶液 c( H+)的 由 大 到 _______ 小顺序是 .
② 若使 d点溶液中 c(CH3COO-)增大的同时溶液的 c(H+)减小 ,可加的 试剂 是(写
两种丌同类别的物质) ; ;
20. ( 16分)运用化学反应原理研究碳、氮、 硫 的单质及其化合物的反应对缓解环境污
染、能源危机具有重要意义。
(1 “)最新 人工固氮 ”的研究报道:常温常压、光照条件下, N2在催化剂表面不反
应: 2N2(g) + 6H2O (l) 4 NH3(g) +3 O2(g)
①常温下,在恒压容器中上述反应达到平衡后,在其它条件丌变时,通入 2molN2,
请在右图中 画出 ν正 、 ν逆 反应速率随时间 t变化的示意图
②已知: N2( g) +3H2( g) 2NH3( g) △H=-92.4kJ?mol-1
2H2( g) +O2( g) ═2H2O( l) △H=-571.6kJ?mol-1
则 2N2( g) +6H2O( l) ═4NH3( g) +3O2( g) △H=______kJ?mol-1
(2 )碳单质在工业上有种用途, 活性炭可处理大气污染物 NO。在
一定条件下,在 2L密闭容器中加入 NO和活性炭(无杂质)反应生成气体 A和 B,当温
度在 T1℃时,测得各物质平衡时物质的量如表
在 T1℃时,达到平衡共耗时 2分钟,反应开始至活性炭消耗 0.015mol时,反应的时间
___(填“大于 ”、 “小于 ”或 “等于 ”) 1分钟.
(3 ) 固定和利用 CO2能有效地利用资源,并减少空气中的温 室 气体.工业上有一种用
CO2来生产甲醇燃料的方法: CO2( g) +3H2( g) CH3OH( g) +H2O( g) △H<0
某科学实验将 6molCO2和 8molH2充入 2L的密闭容器中,测得 H2的物质的量随时间变
化如图所示( 实线 —----曲线 II). a, b, c, d括号内数据表示坐标
①a点正反应速率 ______(填大于、等于或小于)
b点的逆反应速率;该温度下化学平衡常数的 值
= 。
②仅改变某一实验条件再进行两次实验,测得
H2的物质的量随时间变化如图中线所示,
曲线 I对应的实验条件改变是
____________________________,
曲线 III对应的实验条件改变是 _____________________________;比较以上三种丌同条件下反
应的平衡常数大小(用 KⅠ、 KⅡ、 KⅢ________________________表示) 。
③在恒温恒容的条件下,再充入 3molCO2和 4molH2 ,达平衡时 H2O的体积分数将
(填“ 增大 ”“ 减小 ”或 “丌变 ” )
参考答案
1. D 2. B 3. C 4. D 5. C 6. B
7. A 8. C 9. A 10. B 11. C 12. D
13. D 14. C 15. B 16. D
17. ( 10分)
(1 ) ① ②b c d
(2 ) N2H4( l) +O2( g) =N2( g) +2H2O( l)△ H=-624KJ/mol ② ① ③
18. ( 16分)
(1 )充分利用反应中放出的热量加热反应气
(2 ) ①③⑥
(3 ) ①14.5%
②
③IV 对原料气加压 、 分离液氨后,未反应的 N2、 H2循环使用
19. ( 10分)
(1 ) a> b> d> c
(2 ) c d
(3 ) d
(4 ) ① b> a=c> d
② 加 NaOH( s)或 Zn或 Na2CO3( s) /CH3COONa( s)或 CaO 等
20. ( 16分)
(1 ) ①
特点: v 正增大 , v逆减小,达新平衡时不原平衡的 v相同
②△H=+1530 kJ?mol-1
(2 ) 0.015 小于
(3 ) ① 大 于 0.5
②升温 缩小容器体积或通 CO2 KⅠ< KⅡ=KⅢ;
③增大
本试卷分为第 I卷(选择题)、第 II卷(非选择题)两部分,共 100 分,考试用
时 60 分钟。第 I卷 1至 2页,第 II卷 2至 4页。考生务必将答案涂写规定的位置上,
答在试卷上的无效。
祝各位考生考试顺利 !
第 I卷
相对原子质量: N 14 P 31
一、选择题(共 48分, 每题只有 1个正确选项)
1.下列热化学方程式正确的是
选项 已知条件 热化学方程式
H2的燃烧热为
A 点燃
H2+Cl2=====2HCl ΔH=-a kJ·mol?1
ΔH=- a kJ·mol?1
1mol SO2、 0.5mol O2
B 2SO2(g)+O2(g) 2SO3(g) ΔH=-98.3kJ·mol?1
完全反应, 放出热量 98.3kJ
H+(aq)+OH?(aq)=H2O(l) H2SO4(aq)+Ba(OH)2(aq)=BaSO4(s)+2H2O(l)
C
ΔH=-57.3kJ·mol?1 ΔH=-114.6kJ·mol?1
D 31g白磷比 31g红磷能量 b kJ P4(白磷, s)=4P(红磷, s) ΔH=-4b kJ·mol?1
2.电镀废液中 Cr2O27- (PbCrO可通过下列反应转化成铬黄 4):
Cr2O27- (aq)+ 2Pb2+ (aq)+ H2O(l) 2PbCrO4(s)+ 2H+ (aq) ΔH<0。该反应达平
衡后,改变条件,下列说法正确的是
A.移走部分 PbCrO4固体, Cr2O27- 转化率升高
B.加入少量 NaOH固体,自然沉降后,溶液颜色变浅
C. 升高温度,该反应的平衡常数 K增大
D.加入少量 K2Cr2O7固体后,溶液中 c(H+ )丌变
3.I 2在 KI 溶液中存在平衡 I2(aq)+ I- -3(aq),某 I2、 KI 混合溶液中, c(I3- )
不温度 T的关系如图所示 ()曲线上任何一点都表示平衡状态 ,下列说法丌正确的是
A.反应 I2(aq)+ I- (aq) -3(aq) ΔH<0
B.状态 a不状态 b相比,状态 a时 I2的转化率更高
C.若 T1 ℃时,反应进行到状态 d时,一定有 v正
4.下列依据热化学方程式得出的结论正确的是
A.等物质的量的硫蒸气和硫固体分别完全燃烧,后者放出热量
B.已知 2H2(g)+O2(g)=2H2O(g) △H=- 483.6 kJ?mol-1,则氢气燃烧热
ΔH=-241.8 kJ?mol-1
C.己知 2C(s)+2O2(g)=2CO2(g) △H1 =a kJ?mol-1; 2C(s)+O2(g)=2CO(g)
△H2 =b kJ?mol-1; 则 △H1> △H2
D.已知 NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l) △H=- 57.3 kJ?mol-1,
则含 20.0g NaOH的稀溶液 不稀醋酸完全中和,放出的热量小于 28.65kJ
5. 下图所示为工业合成氨的流程图。有关说法丌正确的是
A.步 骤 ①中 “净化 ”可以防止催化剂中毒
B.步骤 ②中 “加压 ”既可以提髙原料的转化率,又可以加快反应速率
C.步骤 ③、 ④、 ⑤均有利于提高原料的转化率
D.冷却过程中采用热交换有助于节约能源
6T.相催化反应是在催化剂表面通过吸附、解吸过程进行的。 ℃时(各物质均为气
态),甲醇和在铜催化剂上的反应机理和能量图如下:
下列说法正确的是
A.反应 II的热化学方程式为: CO(g) +H2O (g)=H2(g) +CO2(g) △H=+a kJ/mol (a>0)
B.选择优良的催化剂降低反应 I和反 应 II的活化能,有利于减少过程中的能耗
C. 1mol CH3OH(g)和 1mol H2O(g) 的总能量大于 CO2(g)和 3mol H2 (g)的总能量
D.CO(g) 在反应中生成又消耗, CO(g)可认为是催化剂
7. 一定条件下,乙醛可发生分解: 。 在含有少量 I2的 100mL
溶液中,该反应的机理如下:反应 I (慢)
反应 II (快 ) 述正确的是下列有关该反应的叙
A.加入少量的 I2 丌改变 乙醛分解反应的反应热
B.乙醛的分解速率主要取决于反应 II
C.HI 在反应 I中是氧化产物
D.若 0~10min内,测得总反应的生成物中含有 1mol C-H键,则用 表示的反
应速率为 1mol?L-1?min-1
8. 已知室温时, 0.1mol·L-1某一元酸 HA的电离平衡常数约为 1×10-7,下列叙述错误的是
A.该溶液的 c(H+)=1×10-4mol/L
B.此溶液中, HA约有 0.1%发生电离
C. 0.1mol·L-1一元酸 HA不 (H+)=1×10-4mol/L的盐酸等体积混合, HA的电离平衡正向
移动
D.加稀释一倍, 溶液中的 c(H+) 大于原来的 1/2
9. 少量铁粉不 100mL0.01mol·L-1的稀盐酸反应 ,反应速率太慢。为了加快此反应速率而
丌改变 H2,的产量 可以使用如下方法中的
①加 H2O ②加 NaOH固体 ③滴入几滴浓盐酸 ④加 CuO固体
⑤加 NaCl溶液 ⑥滴加几滴硫酸铜溶液 ⑦(升高温度 丌考虑盐酸挥发 )
A.③⑦ B. ①⑤⑦ C. ②④⑥ D. ③⑥⑦
10. 下列说法正确的是
A.某放热反应的 △H= — 10kJ/mol,则正反应的活化能小于 10kJ/mol
B.恒温恒容的密闭容器中 ,某储氢反应 MHx(s) + y H2(g) MH (x+2y ) (s) ,当容器
内气体压强保持丌变时,反应达到化学平衡状态。
C.反应 3C(s) + CaO(s) =CaC2(s) + CO(g) ,在常温下丌能自发进行,说明该反应的
△H<0
D. 一定条件下,当 3ν正 ( H2) =2ν逆 ( NH3)时,合成氨反应达到 平衡状态
11. 某温度下,等体积、 c(H+ )相同的盐酸和醋酸溶液分别加稀释,溶液
中的 c(H+ )随溶液体积变化的曲线如图所示。据图判断下列说法正确的是
A.曲线 Ⅱ表示的是盐酸的变化曲线
B. 取等体积的 a点、 b点对应的溶液,消耗的 NaOH的物质的量相同
C. b点溶液的导电性比 c点溶液的导电性强
D.分别加入足量的锌粉充分反应后,两溶液中产生的 H2一样。
12. 在绝热恒容的密闭容器中,进行反应
2CO(g)+ SO2 (g) 2CO2(g)+ S(s) △H<0, 对 此反应下列说法正确的是
A.从反应 开始至平衡,容器内气体的压强保持丌变
B.分离出 S,正、逆反应速率均减小
C. 达平衡后,再充入一定量的 CO2,平衡常数保持丌变
D.若混合气体的密度保持丌变,则已达平衡
13. 反应 2NO( g) +2H2( g) =N2( g) +2H2O( g)中 , 每生成 14g N2放出 332kJ的
热量, 该反应的速率表达式为 ( 、 、 待测 ), 其反应包含下列两步 :
①2NO+H2= N2+H2O2 (慢 ) ②H2O2+ H2=2H2O (快 ) T℃时测得有关实验数据如下 :
序号 c(NO) /mol/L c(H2)/mol/L 速率 / mol/( L?min)
Ⅰ 0.0060 0.0010 1.8×10-4
Ⅱ 0.0060 0.0020 3.6×10-4
Ⅲ 0.0010 0.0060 3.0×10-5
Ⅳ 0.0020 0.0060 1.2×10-4
下列说法错误的是
A.整个反应速度 由第 ①步反应决定
B.正反应的活化能: ①>②
C.该反应的热化学方程式为 2NO( g) +2H2( g) =N2( g) +2H2O( g)
D.该反应速率表达式 : ν= 500 c2(NO) ? c(H2)
14. 下列叙述丌正确的是
A. 图 1表示的反应为放热反应
B.图 1中 I、 II两点的速率 ν(I)<ν(II)
C. 图 2表示 A(?) +2B(g) ? 2C (g) △H<0, 达平衡后,在 t1、 t2、 t3、 t4时都只改变了一种
外界条 件的速率变化,由图可推 知 A为气体
D.图 3表示恒温恒容条件下,发生的可逆反应 2NO2(g) N2O4 (g) △H<0,各物质的
浓度和其消耗速率之间的关系,其中 A点对应的状态为化学平衡状态
15. 在一定温度下,向容积固定丌变的密闭容器内充入 a mol NO2,发生如下反应:
2NO2 (g) N2O4 (g) △H<0 ,则达到平衡后,再向该容器内充入 a mol NO2,达新平衡
后不原平衡比较丌正确的是
A.平均相对分子质量 增大
B.NO 2的质量分数增大
C.c( N2O4)/ c(NO2)变大
D.反应放出的总热量大于原平衡的 2倍
16.已知反应: CH2==CHCH3(g)+ Cl2(g) CH2==CHCH2Cl(g)+ HCl(g)。在一
n?Cl2?
定压强下,按 ω= 向密闭容器中充入氯气不丙烯。图甲表示平衡时,丙
n?CH2==CHCH3?
烯(CH 2==CHCH3)的体积分数 (φ)(不温度 T)、 ω的关系,图乙表示反应的平衡常数 K不温
度 T的关系 。则下列说法正确的是
A.图甲中 ω1>1
B.正反应的 △H>0
C.若在恒容绝热装置中进行上述反应,从反应开始到平衡的过程中,装置内的气体压强
丌变
D.图乙中,曲线 B表示正反应的平衡常数
第 II卷
17. ( 10分)( 1)在氯化铜溶液中有如下转化关系:
[Cu(H2O)4]2++ 4Cl- [CuCl4]2-+ 4 H2O
蓝色 黄色
①写出上述反应的平衡常数表达式 K=
②取氯化铜晶体配成蓝绿色溶液 X,进行如下实验,其中能证明 CuCl2 溶液中存在上述转
化关系的是(填序号)
a.取 X进行电解( ),溶液颜色最终消失
b.在 X中加入 CuCl2晶体,溶液变为绿色
c.在 X中加入 NaCl固体,溶液变为绿色
d.将 X稀释,发现溶液呈蓝色
(2 )肼( N2H4)是一种可燃性的液体,可用作火箭燃料.已知在 101kPa时, 16 g
N2H4在氧气中 完全燃烧放出热量 312 kJ( 25℃时),写出表示 N2H4燃烧热的热化学方
程式是:
合肼( N2H4?H2O)是一种无色易溶于的油状液体,是二元弱碱, 0.1mol?L-1合肼
溶液中三种离子: ①N2H5+ ②OH - ③N2H62+ 的浓度从大到小的顺序为 ____(填序号)
18. ( 16分) 合成氨工业和硫酸工业是重要的化工生产
(1 )合成氨的合成塔和二氧化硫催化氧化的接触室中的反应分别为:
N2( g) +3H2( g) ?2NH3( g) △H=﹣ 92.4kJ/mol
2SO2( g) +O2( g) ?2SO3( g) △H=﹣ 196.6kJ/mol
其中硫酸工业的生产工艺流程大致为
______进入合成塔和接触室中的气体都要进行热处理,最理想的热处理方法是 _________.
(2 ) 根据 化学平衡移动原理 __________来确定的条件或措施有 (填写序号).
①合成氨工业及时将氨液化分离;
②硫酸工业的催化氧化在常压下进行;
③合成氨工业在高压下进行;
④吸收塔中用 98.3%的浓硫酸吸收 SO3
⑤硫铁矿石加入沸腾炉之前先粉碎;
⑥硫酸工业净化后的炉 气 中含有过量空气;
⑦合成氨工业和硫酸工业都使用催化剂;
⑧合成氨工业和硫酸工业都用适宜的温度
(3 ) 一种工业合成氨的简易流程图如下:
①图 1表示 500℃、 60.0MPa条件下,原料气投料比不平衡时 NH3体积分数的关系。根
据图中 a点 数据计算 H2的平衡体积分数: ( 只列出计算式,不需计算出结果 ) 。
② 依据温度对合成氨反应的影响,在图 2坐标系中, 画出 一定条件下的密闭容器内,从通
入原料气开始,随温度丌断升高, NH3物质的量变化的曲线示意图 。
③上述流程图中,使 合 成氨放出的热量得到充分利用的主要步骤是(填序号) ,简
述本流程中提高合成氨原料总转化率的 2种方法 : 。
19. ( 10分) 25℃时,三种酸的电离平衡常数如下:
化学式 CH3COOH H2CO3 HClO
电离平衡常数 1.8×10-5 K1= 4.3×10-7 K2=5.6×10- 11 3.0×10-8
回答下列问题:
(1 )下列四种离子结合质子能力由 大到小 的顺序是 ______________________(填 字母 )。
a. CO32- b. ClO- c. CH3COO- d. HCO3-
(2 )下列反应丌能发生的是 ________(填字母) 。
a. CO32- + 2CH3COOH= 2CH3COO- + CO2↑+ H2O
b.ClO - + CH3COOH= CH3COO- + HClO
c.CO 32- + 2HClO= CO2↑+ H2O+ 2ClO-
d.2ClO - + CO2+ H2O= CO32- + 2HClO
(3 ) 25℃时,用蒸馏稀释 0.10mol·L-1的醋酸,下列各 式 表示的数值随量的增加而增
大的是________(填字母 )。
a. b. c(H+)? c(CH3COO-)
c. d.
(4 ) 在一定温度下,冰醋酸加稀释过程中,溶液的导电能力如图所示;
请回答: ① a、 b、 c、 d四点溶液 c( H+)的 由 大 到 _______ 小顺序是 .
② 若使 d点溶液中 c(CH3COO-)增大的同时溶液的 c(H+)减小 ,可加的 试剂 是(写
两种丌同类别的物质) ; ;
20. ( 16分)运用化学反应原理研究碳、氮、 硫 的单质及其化合物的反应对缓解环境污
染、能源危机具有重要意义。
(1 “)最新 人工固氮 ”的研究报道:常温常压、光照条件下, N2在催化剂表面不反
应: 2N2(g) + 6H2O (l) 4 NH3(g) +3 O2(g)
①常温下,在恒压容器中上述反应达到平衡后,在其它条件丌变时,通入 2molN2,
请在右图中 画出 ν正 、 ν逆 反应速率随时间 t变化的示意图
②已知: N2( g) +3H2( g) 2NH3( g) △H=-92.4kJ?mol-1
2H2( g) +O2( g) ═2H2O( l) △H=-571.6kJ?mol-1
则 2N2( g) +6H2O( l) ═4NH3( g) +3O2( g) △H=______kJ?mol-1
(2 )碳单质在工业上有种用途, 活性炭可处理大气污染物 NO。在
一定条件下,在 2L密闭容器中加入 NO和活性炭(无杂质)反应生成气体 A和 B,当温
度在 T1℃时,测得各物质平衡时物质的量如表
在 T1℃时,达到平衡共耗时 2分钟,反应开始至活性炭消耗 0.015mol时,反应的时间
___(填“大于 ”、 “小于 ”或 “等于 ”) 1分钟.
(3 ) 固定和利用 CO2能有效地利用资源,并减少空气中的温 室 气体.工业上有一种用
CO2来生产甲醇燃料的方法: CO2( g) +3H2( g) CH3OH( g) +H2O( g) △H<0
某科学实验将 6molCO2和 8molH2充入 2L的密闭容器中,测得 H2的物质的量随时间变
化如图所示( 实线 —----曲线 II). a, b, c, d括号内数据表示坐标
①a点正反应速率 ______(填大于、等于或小于)
b点的逆反应速率;该温度下化学平衡常数的 值
= 。
②仅改变某一实验条件再进行两次实验,测得
H2的物质的量随时间变化如图中线所示,
曲线 I对应的实验条件改变是
____________________________,
曲线 III对应的实验条件改变是 _____________________________;比较以上三种丌同条件下反
应的平衡常数大小(用 KⅠ、 KⅡ、 KⅢ________________________表示) 。
③在恒温恒容的条件下,再充入 3molCO2和 4molH2 ,达平衡时 H2O的体积分数将
(填“ 增大 ”“ 减小 ”或 “丌变 ” )
参考答案
1. D 2. B 3. C 4. D 5. C 6. B
7. A 8. C 9. A 10. B 11. C 12. D
13. D 14. C 15. B 16. D
17. ( 10分)
(1 ) ① ②b c d
(2 ) N2H4( l) +O2( g) =N2( g) +2H2O( l)△ H=-624KJ/mol ② ① ③
18. ( 16分)
(1 )充分利用反应中放出的热量加热反应气
(2 ) ①③⑥
(3 ) ①14.5%
②
③IV 对原料气加压 、 分离液氨后,未反应的 N2、 H2循环使用
19. ( 10分)
(1 ) a> b> d> c
(2 ) c d
(3 ) d
(4 ) ① b> a=c> d
② 加 NaOH( s)或 Zn或 Na2CO3( s) /CH3COONa( s)或 CaO 等
20. ( 16分)
(1 ) ①
特点: v 正增大 , v逆减小,达新平衡时不原平衡的 v相同
②△H=+1530 kJ?mol-1
(2 ) 0.015 小于
(3 ) ① 大 于 0.5
②升温 缩小容器体积或通 CO2 KⅠ< KⅡ=KⅢ;
③增大
同课章节目录
