福建省福清西山学校高中部2020-2021学年高二上学期期中考试化学试题 Word版含答案
文档属性
| 名称 | 福建省福清西山学校高中部2020-2021学年高二上学期期中考试化学试题 Word版含答案 |
|
|
| 格式 | docx | ||
| 文件大小 | 293.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-11-16 00:00:00 | ||
图片预览



文档简介
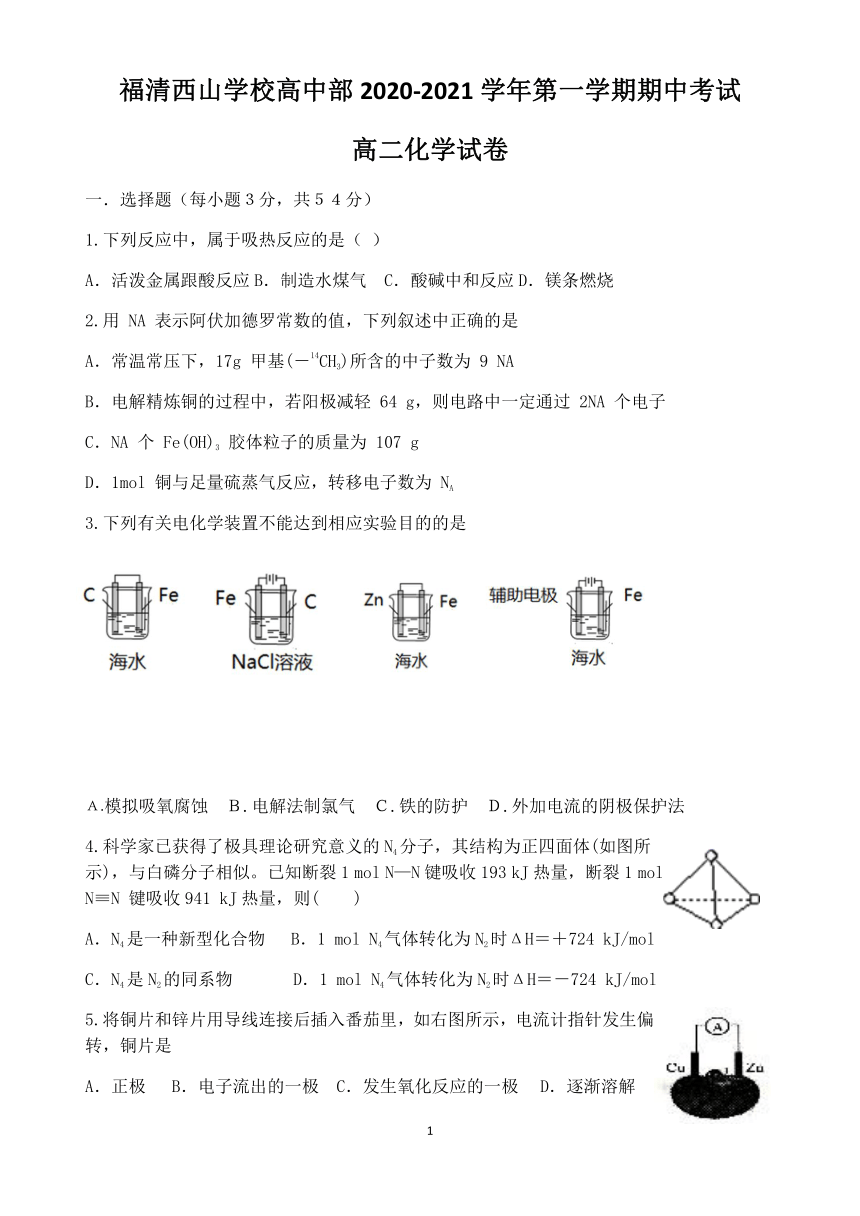
福清西山学校高中部2020-2021学年第一学期期中考试
高二化学试卷
选择题(每小题3分,共54分)
1.下列反应中,属于吸热反应的是(
)
A.活泼金属跟酸反应B.制造水煤气 C.酸碱中和反应D.镁条燃烧
2.用
NA
表示阿伏加德罗常数的值,下列叙述中正确的是
A.常温常压下,17g
甲基(-14CH3)所含的中子数为
9
NA
B.电解精炼铜的过程中,若阳极减轻
64
g,则电路中一定通过
2NA
个电子
C.NA
个
Fe(OH)3
胶体粒子的质量为
107
g
D.1mol
铜与足量硫蒸气反应,转移电子数为
NA
3.下列有关电化学装置不能达到相应实验目的的是
A.模拟吸氧腐蚀 B.电解法制氯气 C.铁的防护 D.外加电流的阴极保护法
4.科学家已获得了极具理论研究意义的N4分子,其结构为正四面体(如图所示),与白磷分子相似。已知断裂1
mol
N—N键吸收193
kJ热量,断裂1
mol
N≡N
键吸收941
kJ热量,则( )
A.N4是一种新型化合物
B.1
mol
N4气体转化为N2时ΔH=+724
kJ/mol
C.N4是N2的同系物
D.1
mol
N4气体转化为N2时ΔH=-724
kJ/mol
5.将铜片和锌片用导线连接后插入番茄里,如右图所示,电流计指针发生偏转,铜片是
A.正极
B.电子流出的一极
C.发生氧化反应的一极
D.逐渐溶解
6.如图是CO2生产甲醇的能量变化示意图.下列说法正确的是
A.E2-E1是该反应的热效应
B.E3-E1是该反应的热效应
C.实现变废为宝,且有效控制温室效应
D.该反应放热,在常温常压下就能进行
7.已知C(s)+H2O(g)=CO(g)+H2(g)
ΔH=akJ·mol-1,
2C(s)+O2(g)=2CO(g)
ΔH=-220kJ·mol-1,H-H、O=O和O-H键的键能为436
kJ·mol-1、496
kJ·mol-1和462kJ·mol-1,则a为
A.-350
B.+130
C.+350
D.-130
8.“摇摇冰”是一种即用即冷的饮料。吸食时将饮料罐隔离层中的化学物质和水混合后摇动即能制冷。该化学物质是(
)
A.酒精
B.生石灰
C.氢氧化钠
D.硝酸铵
9.下列电池属于二次电池的是(
)
①锌银钮扣电池
②氢氧燃料电池
③铅蓄电池
④锌锰干电池
A.①
B.②
C.③
D.④
10.下列有关热化学方程式的书写及对应的表述均正确的是(
)
A.已知金属铍完全燃烧放出的热量为,则铍燃烧的热化学方程式为:
B.稀醋酸与溶液反应:
C.已知氢气完全燃烧生成液态水所放出的热量为,则水分解的热化学方程式为:
D.已知,则可知的燃烧热
11.下列叙述不正确的是
(
)
A.在海轮外壳连接锌块保护外壳不受腐蚀是采用了牺牲阳极的阴极保护法
B.铅蓄电池在放电过程中,负极质量减小,正极质量增加
C.外加电流的阴极保护法中,待保护金属作阴极
D.电镀工业中,镀件作阴极
12.反应4A
(s)
+3B
(g)
2C
(g)
+D
(g),经2
min,B的浓度减少0.6
mol/L,对此下列说法不正确的是
A.在2
min内的反应速率用B表示为0.3
mol/(L·min)
B.在2
min内用A表示反应速率是0.4
mol/(L·min)
C.在2
min内用C表示反应速率是0.2
mol/(L·min)
D.当V正(B)=3V逆(D)时,反应达到平衡
13.等物质的量的A(g)与B(g)在密闭容器中进行可逆反应:A(g)+B(g)2C(g)+D(s)
△H<0,下列叙述正确的是
A.达到平衡时,反应速率v正(A)=2v逆(C)
B.达到平衡后,增大压强,平衡逆向移动
C.达到平衡后,升高温度,平衡正向移动
D.平衡常数K值越大,A的转化率越大
14.下列说法正确的是(
)
A.增大反应物的浓度,可增大单位体积内活化分子的百分数,从而使有效碰撞次数增加
B.H2、I2、HI平衡混合气体加压后颜色加深,不能用勒夏特列原理解释
C.当反应达化学平衡时,各组分浓度相等
D.不管什么反应,增大浓度、加热、加压、使用催化剂都可以加快反应速率
15.m
A(气)
+
n
B(气)p
C(气)
+
q
Q(气)当m、n、p、q为任意整数时,下列情况一定为平衡状态的是(
)
①体系的温度不再改变
②体系的压强不再改变
③各组分的浓度不再改变
④各组分的质量分数不再改变
⑤反应速率v(A):
v
(B):
v
(C):
v
(D)=m:n:p:q
⑥单位时间内m
mol
A断键反应,同时p
mol
C也断键反应
A.③④⑤⑥
B.②③④⑥
C.①③④⑤
D.①③④⑥
16.如图是氢氧燃料电池构造示意图。关于该电池的说法不正确的是(
)
A.a极是负极
B.正极的电极反应是O2+2H2O+4e-=4OH-
C.电流由b通过灯泡流向a
D.氢氧燃料电池是环保电池
17.有一反应:2A(g)+B(g)2C(g),图中的曲线是该反应在不同温度下的平衡曲线,则下列描述不正确的是( )
A.该反应是吸热反应
B.b点时混合气体的平均摩尔质量不再变化
C.T1时若由a点达到平衡,可以采取增大压强的方法
D.c点v正>v逆
18.将下列物质分别装入有水的锥形瓶里,立即塞紧带U形管的塞子,发现U形管内滴有红墨水的水面呈现如图所示状态。加入的物质不可能是(不考虑加入物质引起的溶液体积的变化)
A.固体NaOH
B.浓H2SO4
C.Ba(OH)2·8H2O与NH4Cl糊状物D.CaO固体
二、实验题
19.(8分)利用如图装置测定中和热的实验步骤如下:
①量取50mL
0.25
mol/L硫酸倒入小烧杯中,测量温度;
②量取50mL
0.55mol/L
NaOH溶液,测量温度;
③将NaOH溶液倒入小烧杯中,混合均匀后测量混合液温度。
请回答:
(1)NaOH溶液稍过量的原因
。
(2)加入NaOH溶液的正确操作是
(填字母)。
A.沿玻璃棒缓慢加入
B.一次迅速加入
C.分三次加入
(3)使硫酸与NaOH溶液混合均匀的正确操作是
。
(4)若将含0.5
mol
H2SO4的浓硫酸与含1
mol
NaOH的溶液混合,放出的热量
(填“小于”、“等于”或“大于”)57.3
kJ,原因是
。
20.(10分).对于反应:2SO2+O22SO3,当其他条件不变时,只改变一个反应条件,将生成SO3的反应速率的变化填入空格里(填写“增大”、“减小”或“不变”)。
21.(12分)某兴趣小组为研究原电池原理,设计如图甲乙两个原电池装置。
(1)如图甲,a和b用导线连接,Cu电极的电极反应式为:________,溶液中SO42-移向______(填“Cu”或“Fe”)极。
(2)如图乙所示的原电池装置中,负极材料是_____。正极上能够观察到的现象是_______________。
负极的电极反应式是_________________。原电池工作一段时间后,若消耗负极5.4g,则放出气体______mol。
22.(8分)已知Cr2O(橙色)
+
H2O2CrO(黄色)
+2H+,进行以下实验,记录实验结果,并思考改变物质浓度对平衡移动的影响。
实验1:向试管中加入4
mL
0.1
mol·L-1K2Cr2O7溶液,再加数滴1
mol·L-1NaOH溶液,观察溶液颜色变化;
实验2:将上述溶液分成两份向其中一份中滴加1
mol·L-1HNO3,观察溶液颜色变化,并和另一份做对比
三、计算题
23.(8分)将等物质的量的A和B混合于2
L的密闭容器中,发生如下反应:3A(g)+B(g)xC(g)+2D(g),5
min后,测得D的浓度为0.5
mol·L-1,c(A)∶c(B)=3∶5,C的平均反应速率是0.1
mol·L-1·min-1。A在5
min末的浓度是________,B的平均反应速率是________,D的平均反应速率是________,x=______。
福清西山学校高中部2020-2021学年
第一学期高二期中考试化学试卷
1-18BDBDA CBDCA BBDBD BCC
19.(除标注外,每空2分)(1)确保硫酸被完全中和;
(2)B(1分);
(3)用环形玻璃棒轻轻搅动;
(4)大于(1分);浓硫酸溶于水放出热量
20.(每空2分共10分)【答案】①增大
②减小
③增大
④增大
⑤增大
21.(每空2分共12分)(1)2H++2e-=H2↑
Fe
(2)
Al
产生气泡
Al-3e-
+4OH-=AlO2-
+
2H2O
0.3
22.(每空2分共8分)
23.(每空2分共8分)0.75
mol·L-1 0.05
mol·L-1·min-1 0.1
mol·L-1·min-1 2
高二化学试卷
选择题(每小题3分,共54分)
1.下列反应中,属于吸热反应的是(
)
A.活泼金属跟酸反应B.制造水煤气 C.酸碱中和反应D.镁条燃烧
2.用
NA
表示阿伏加德罗常数的值,下列叙述中正确的是
A.常温常压下,17g
甲基(-14CH3)所含的中子数为
9
NA
B.电解精炼铜的过程中,若阳极减轻
64
g,则电路中一定通过
2NA
个电子
C.NA
个
Fe(OH)3
胶体粒子的质量为
107
g
D.1mol
铜与足量硫蒸气反应,转移电子数为
NA
3.下列有关电化学装置不能达到相应实验目的的是
A.模拟吸氧腐蚀 B.电解法制氯气 C.铁的防护 D.外加电流的阴极保护法
4.科学家已获得了极具理论研究意义的N4分子,其结构为正四面体(如图所示),与白磷分子相似。已知断裂1
mol
N—N键吸收193
kJ热量,断裂1
mol
N≡N
键吸收941
kJ热量,则( )
A.N4是一种新型化合物
B.1
mol
N4气体转化为N2时ΔH=+724
kJ/mol
C.N4是N2的同系物
D.1
mol
N4气体转化为N2时ΔH=-724
kJ/mol
5.将铜片和锌片用导线连接后插入番茄里,如右图所示,电流计指针发生偏转,铜片是
A.正极
B.电子流出的一极
C.发生氧化反应的一极
D.逐渐溶解
6.如图是CO2生产甲醇的能量变化示意图.下列说法正确的是
A.E2-E1是该反应的热效应
B.E3-E1是该反应的热效应
C.实现变废为宝,且有效控制温室效应
D.该反应放热,在常温常压下就能进行
7.已知C(s)+H2O(g)=CO(g)+H2(g)
ΔH=akJ·mol-1,
2C(s)+O2(g)=2CO(g)
ΔH=-220kJ·mol-1,H-H、O=O和O-H键的键能为436
kJ·mol-1、496
kJ·mol-1和462kJ·mol-1,则a为
A.-350
B.+130
C.+350
D.-130
8.“摇摇冰”是一种即用即冷的饮料。吸食时将饮料罐隔离层中的化学物质和水混合后摇动即能制冷。该化学物质是(
)
A.酒精
B.生石灰
C.氢氧化钠
D.硝酸铵
9.下列电池属于二次电池的是(
)
①锌银钮扣电池
②氢氧燃料电池
③铅蓄电池
④锌锰干电池
A.①
B.②
C.③
D.④
10.下列有关热化学方程式的书写及对应的表述均正确的是(
)
A.已知金属铍完全燃烧放出的热量为,则铍燃烧的热化学方程式为:
B.稀醋酸与溶液反应:
C.已知氢气完全燃烧生成液态水所放出的热量为,则水分解的热化学方程式为:
D.已知,则可知的燃烧热
11.下列叙述不正确的是
(
)
A.在海轮外壳连接锌块保护外壳不受腐蚀是采用了牺牲阳极的阴极保护法
B.铅蓄电池在放电过程中,负极质量减小,正极质量增加
C.外加电流的阴极保护法中,待保护金属作阴极
D.电镀工业中,镀件作阴极
12.反应4A
(s)
+3B
(g)
2C
(g)
+D
(g),经2
min,B的浓度减少0.6
mol/L,对此下列说法不正确的是
A.在2
min内的反应速率用B表示为0.3
mol/(L·min)
B.在2
min内用A表示反应速率是0.4
mol/(L·min)
C.在2
min内用C表示反应速率是0.2
mol/(L·min)
D.当V正(B)=3V逆(D)时,反应达到平衡
13.等物质的量的A(g)与B(g)在密闭容器中进行可逆反应:A(g)+B(g)2C(g)+D(s)
△H<0,下列叙述正确的是
A.达到平衡时,反应速率v正(A)=2v逆(C)
B.达到平衡后,增大压强,平衡逆向移动
C.达到平衡后,升高温度,平衡正向移动
D.平衡常数K值越大,A的转化率越大
14.下列说法正确的是(
)
A.增大反应物的浓度,可增大单位体积内活化分子的百分数,从而使有效碰撞次数增加
B.H2、I2、HI平衡混合气体加压后颜色加深,不能用勒夏特列原理解释
C.当反应达化学平衡时,各组分浓度相等
D.不管什么反应,增大浓度、加热、加压、使用催化剂都可以加快反应速率
15.m
A(气)
+
n
B(气)p
C(气)
+
q
Q(气)当m、n、p、q为任意整数时,下列情况一定为平衡状态的是(
)
①体系的温度不再改变
②体系的压强不再改变
③各组分的浓度不再改变
④各组分的质量分数不再改变
⑤反应速率v(A):
v
(B):
v
(C):
v
(D)=m:n:p:q
⑥单位时间内m
mol
A断键反应,同时p
mol
C也断键反应
A.③④⑤⑥
B.②③④⑥
C.①③④⑤
D.①③④⑥
16.如图是氢氧燃料电池构造示意图。关于该电池的说法不正确的是(
)
A.a极是负极
B.正极的电极反应是O2+2H2O+4e-=4OH-
C.电流由b通过灯泡流向a
D.氢氧燃料电池是环保电池
17.有一反应:2A(g)+B(g)2C(g),图中的曲线是该反应在不同温度下的平衡曲线,则下列描述不正确的是( )
A.该反应是吸热反应
B.b点时混合气体的平均摩尔质量不再变化
C.T1时若由a点达到平衡,可以采取增大压强的方法
D.c点v正>v逆
18.将下列物质分别装入有水的锥形瓶里,立即塞紧带U形管的塞子,发现U形管内滴有红墨水的水面呈现如图所示状态。加入的物质不可能是(不考虑加入物质引起的溶液体积的变化)
A.固体NaOH
B.浓H2SO4
C.Ba(OH)2·8H2O与NH4Cl糊状物D.CaO固体
二、实验题
19.(8分)利用如图装置测定中和热的实验步骤如下:
①量取50mL
0.25
mol/L硫酸倒入小烧杯中,测量温度;
②量取50mL
0.55mol/L
NaOH溶液,测量温度;
③将NaOH溶液倒入小烧杯中,混合均匀后测量混合液温度。
请回答:
(1)NaOH溶液稍过量的原因
。
(2)加入NaOH溶液的正确操作是
(填字母)。
A.沿玻璃棒缓慢加入
B.一次迅速加入
C.分三次加入
(3)使硫酸与NaOH溶液混合均匀的正确操作是
。
(4)若将含0.5
mol
H2SO4的浓硫酸与含1
mol
NaOH的溶液混合,放出的热量
(填“小于”、“等于”或“大于”)57.3
kJ,原因是
。
20.(10分).对于反应:2SO2+O22SO3,当其他条件不变时,只改变一个反应条件,将生成SO3的反应速率的变化填入空格里(填写“增大”、“减小”或“不变”)。
21.(12分)某兴趣小组为研究原电池原理,设计如图甲乙两个原电池装置。
(1)如图甲,a和b用导线连接,Cu电极的电极反应式为:________,溶液中SO42-移向______(填“Cu”或“Fe”)极。
(2)如图乙所示的原电池装置中,负极材料是_____。正极上能够观察到的现象是_______________。
负极的电极反应式是_________________。原电池工作一段时间后,若消耗负极5.4g,则放出气体______mol。
22.(8分)已知Cr2O(橙色)
+
H2O2CrO(黄色)
+2H+,进行以下实验,记录实验结果,并思考改变物质浓度对平衡移动的影响。
实验1:向试管中加入4
mL
0.1
mol·L-1K2Cr2O7溶液,再加数滴1
mol·L-1NaOH溶液,观察溶液颜色变化;
实验2:将上述溶液分成两份向其中一份中滴加1
mol·L-1HNO3,观察溶液颜色变化,并和另一份做对比
三、计算题
23.(8分)将等物质的量的A和B混合于2
L的密闭容器中,发生如下反应:3A(g)+B(g)xC(g)+2D(g),5
min后,测得D的浓度为0.5
mol·L-1,c(A)∶c(B)=3∶5,C的平均反应速率是0.1
mol·L-1·min-1。A在5
min末的浓度是________,B的平均反应速率是________,D的平均反应速率是________,x=______。
福清西山学校高中部2020-2021学年
第一学期高二期中考试化学试卷
1-18BDBDA CBDCA BBDBD BCC
19.(除标注外,每空2分)(1)确保硫酸被完全中和;
(2)B(1分);
(3)用环形玻璃棒轻轻搅动;
(4)大于(1分);浓硫酸溶于水放出热量
20.(每空2分共10分)【答案】①增大
②减小
③增大
④增大
⑤增大
21.(每空2分共12分)(1)2H++2e-=H2↑
Fe
(2)
Al
产生气泡
Al-3e-
+4OH-=AlO2-
+
2H2O
0.3
22.(每空2分共8分)
23.(每空2分共8分)0.75
mol·L-1 0.05
mol·L-1·min-1 0.1
mol·L-1·min-1 2
同课章节目录
