山东省邹城市2020-2021学年高二上学期期中质量检测化学试题 Word版含答案
文档属性
| 名称 | 山东省邹城市2020-2021学年高二上学期期中质量检测化学试题 Word版含答案 |

|
|
| 格式 | docx | ||
| 文件大小 | 312.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-11-16 22:02:47 | ||
图片预览



文档简介
邹城市2020~2021学年度第一学期期中教学质量检测
高二化学试题
本试卷分第I卷和第Ⅱ卷,全卷满分100分,考试时间为90分钟。
注意事项:
1.答卷前,考生务必将自己的姓名、考生号等填写在答题卡(纸)指定位置上。
2.答第I卷选择题时,将每小题答案选出后,用2B铅笔把答题卡上对应题目的答案标号涂黑。如需改动,用橡皮擦干净后,再选涂其他答案标号。
3.第Ⅱ卷题目的答案用黑色签字笔,将答案写在答题卡(纸)规定的位置上。写在试卷上无效。
一、选择题:本题共10小题,每小题2分,共20分。每小题只有一个选项符合题目要求。
1.明代诗人于谦在《石灰吟》中写道:“千锤万凿出深山,烈火焚烧若等闲。粉身碎骨浑不怕,要留清白在人间。”这首脍炙人口的诗篇不仅蕴含了深刻的人文精神,还蕴藏了有趣的化学知识,下列有关说法中,错误的是
A.化学反应过程中同时存在着物质变化和能量变化,其中物质变化是基础
B.这首诗说明化学能与热能在一定条件下可以相互转化
C.石灰石的分解是熵增反应,因此在任何条件下都能自发进行
D.“要留清白在人间”涉及反应中的化学物质有强电解质、弱电解质和非电解质
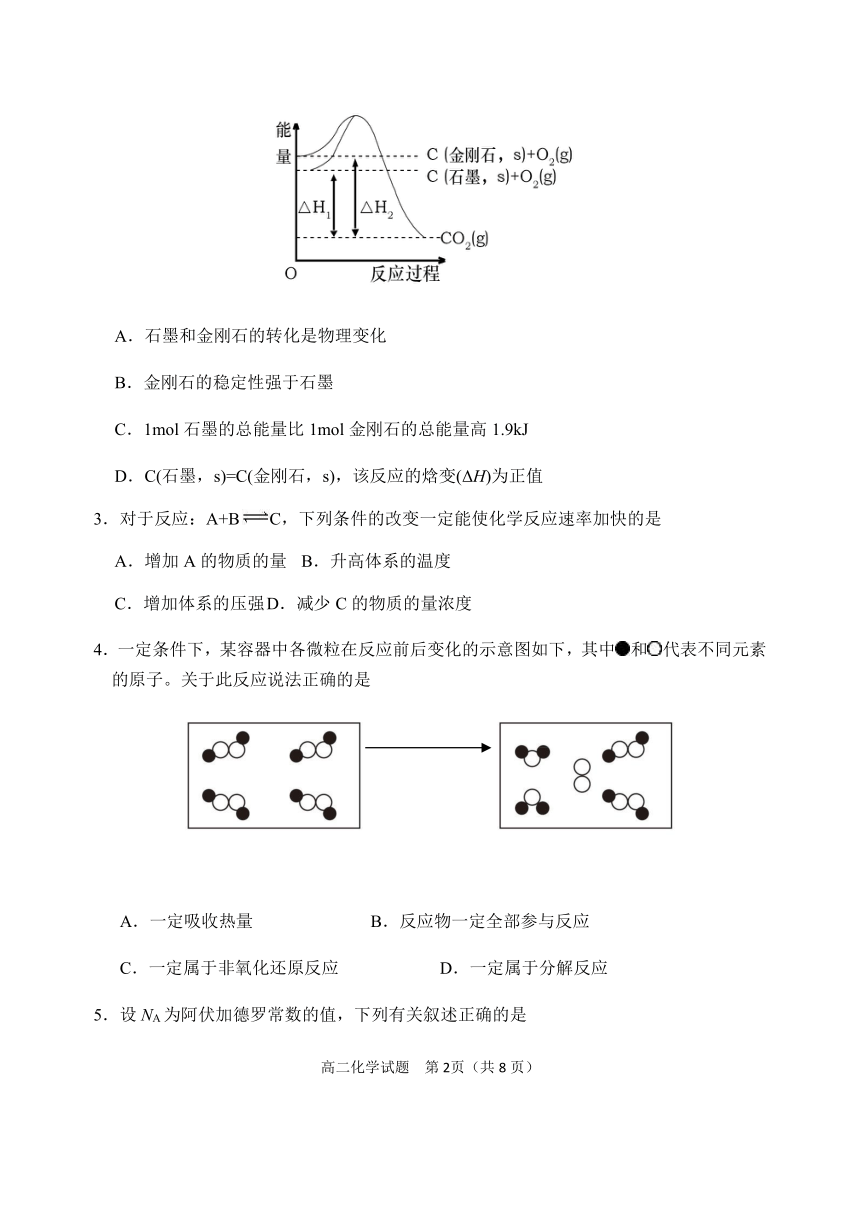
2.如图所示,ΔH1=-393.5kJ·mol-1,ΔH2=-395.4kJ·mol-1,下列说法正确的是
A.石墨和金刚石的转化是物理变化
B.金刚石的稳定性强于石墨
C.1mol石墨的总能量比1mol金刚石的总能量高1.9kJ
D.C(石墨,s)=C(金刚石,s),该反应的焓变(ΔH)为正值
3.对于反应:A+BC,下列条件的改变一定能使化学反应速率加快的是
A.增加A的物质的量 B.升高体系的温度
C.增加体系的压强 D.减少C的物质的量浓度
4.一定条件下,某容器中各微粒在反应前后变化的示意图如下,其中和代表不同元素的原子。关于此反应说法正确的是
充分反应
反应前
反应后
A.一定吸收热量 B.反应物一定全部参与反应
C.一定属于非氧化还原反应 D.一定属于分解反应
5.设NA为阿伏加德罗常数的值,下列有关叙述正确的是
A.1L0.1mol·L-1的NaF溶液中含有0.1NA个F-
B.常温常压下,22.4L Cl2完全溶于水时,转移电子数小于NA
C.标准状况下,44.8L的NO与22.4L 的O2混合后,分子数为2NA
D.25℃时,1L0.01mol·L-1的CH3COOH溶液中,水电离出的OH-的数目为10-12NA
6.某温度下,在一个2 L的密闭容器中,加入4 mol A和2 mol B进行如下反应:
3A(g)+2B(g)4C(s)+2D(g),反应一段时间后达到平衡,测得生成1.6 mol C,且反应的前后压强之比为5∶4(相同的温度下测量),则下列说法正确的是
A.该反应的化学平衡常数表达式是K=
B.此时,B的平衡转化率是40%
C.增大该体系的压强,平衡向右移动,化学平衡常数增大
D.增加B,B的平衡转化率升高
7.2SO2+O22SO3,并达到平衡。在这过程中,甲容器保持体积不变,乙容器保持压强不变,若甲容器中SO2的转化率为p%,则乙容器中SO2的转化率
A.大于p% B.等于p% C.小于p% D.无法判断
8.化学平衡常数(K)电离常数(Ka、Kb)、溶度积常数(Ksp)等常数是表示、判断物质性质的重要常数,下列关于这些常数的说法中,正确的是
A.当温度升高时,弱酸、弱碱的电离常数(Ka、Kb)均变大
B.Ka(HCN)<Ka(CH3COOH)说明相同物质的量浓度时,氢氰酸的酸性比醋酸的强
C.向同浓度的碳酸钠和硫酸钠混合溶液中滴加氯化钡溶液,先产生BaSO4沉淀,则
Ksp(BaSO4)>Ksp(BaCO3)
D.化学平衡常数的大小与温度、浓度、压强有关,与催化剂无关
9.下列表述中,关于“一定”说法正确的个数是
①pH=6的溶液一定是酸性溶液
②c(H+)>c(OH-)一定是酸性溶液
③强电解质溶液的导电能力一定大于弱电解质溶液的导电能力
④25℃时,水溶液中水电离出的c(H+)和水电离出的c(OH-)的乘积一定等于10-14
⑤使用pH试纸测定溶液pH值时,若先润湿,则测得溶液的pH一定有影响
⑥0.2mol/L醋酸溶液加水稀释,电离程度增大,c(H+)一定增大
⑦温度保持不变,向水中加入钠盐对水的电离一定没有影响
A.0 B.1 C.2 D.3
10.已知Ksp(CaCO3)=2.8×10-9及表中有关信息:
弱酸
CH3COOH
H2CO3
电离平衡常数(常温)
Ka=1.8×10-5
Ka1=4.3×10-7;Ka2=5.6×10-11
下列判断正确的是
A.向Na2CO3溶液中滴入酚酞,溶液变红,主要原因是CO32-+2H2OH2CO3+2OH-
B.常温时,CH3COOH与CH3COONa混合溶液的pH=6,则c(CH3COOH)/c(CH3COO-)=18
C.NaHCO3溶液中:c(OH-)-c(H+)=c(H2CO3)-c(CO32-)
D.2×10-4 mol/L的Na2CO3溶液与CaCl2溶液等体积混合出现沉淀,则CaCl2溶液的浓度一定是5.6×10-5 mol/L
二、选择题:本题共5小题,每小题4分,共20分。每小题有一个或两个选项符合题目要求,全部选对得4分,选对但不全的得2分,有选错的得0分。
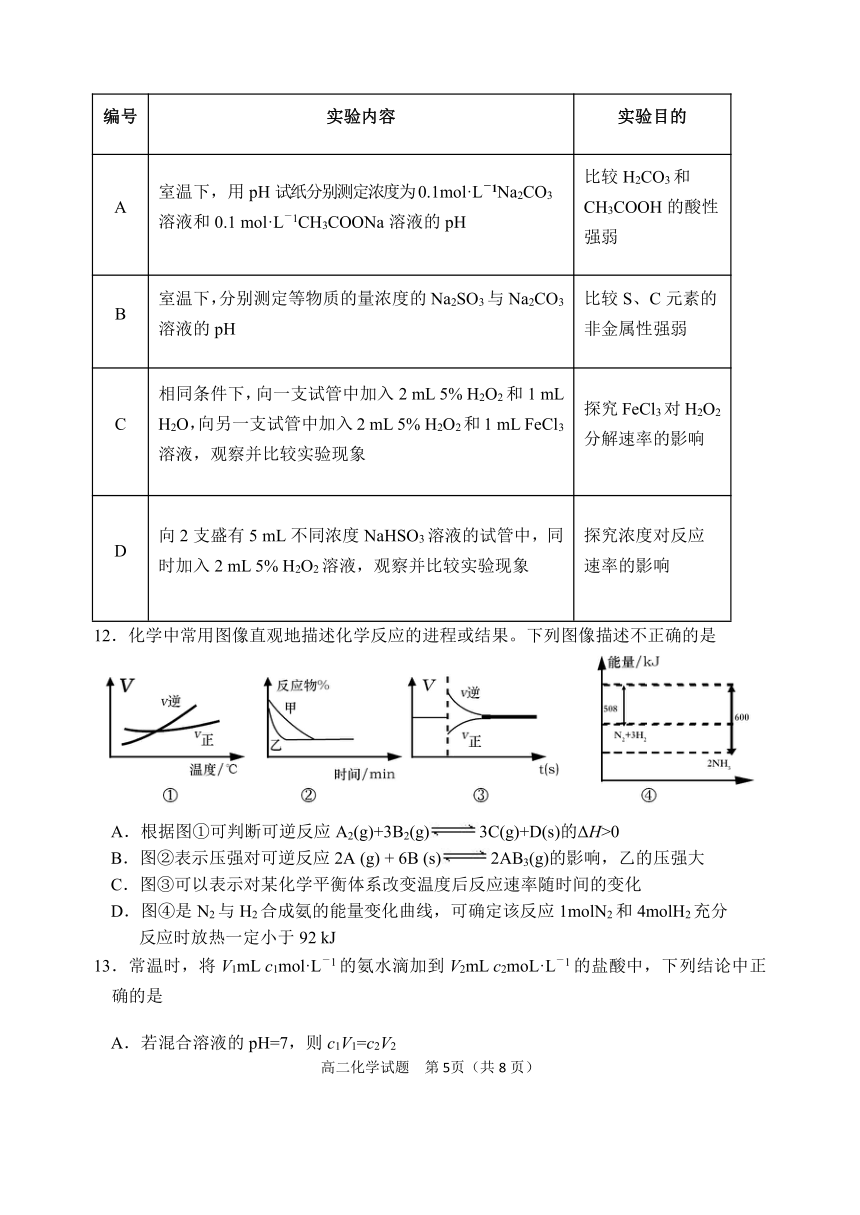
11.下列实验能达到预期目的是
编号
实验内容
实验目的
A
室温下,用pH试纸分别测定浓度为0.1mol·L-1Na2CO3溶液和0.1 mol·L-1CH3COONa溶液的pH
比较H2CO3和CH3COOH的酸性强弱
B
室温下,分别测定等物质的量浓度的Na2SO3与Na2CO3溶液的pH
比较S、C元素的非金属性强弱
C
相同条件下,向一支试管中加入2 mL 5% H2O2和1 mL H2O,向另一支试管中加入2 mL 5% H2O2和1 mL FeCl3溶液,观察并比较实验现象
探究FeCl3对H2O2分解速率的影响
D
向2支盛有5 mL不同浓度NaHSO3溶液的试管中,同时加入2 mL 5% H2O2溶液,观察并比较实验现象
探究浓度对反应速率的影响
12.化学中常用图像直观地描述化学反应的进程或结果。下列图像描述不正确的是
A.根据图①可判断可逆反应A2(g)+3B2(g)3C(g)+D(s)的ΔH>0
B.图②表示压强对可逆反应2A (g) + 6B (s)2AB3(g)的影响,乙的压强大
C.图③可以表示对某化学平衡体系改变温度后反应速率随时间的变化
D.图④是N2与H2合成氨的能量变化曲线,可确定该反应1molN2和4molH2充分反应时放热一定小于92 kJ
13.常温时,将V1mL c1mol·L-1的氨水滴加到V2mL c2moL·L-1的盐酸中,下列结论中正确的是
A.若混合溶液的pH=7,则c1V1=c2V2
B.若V1=V2,c1=c2,则溶液中c (NH4+) =c (Cl-)
C.若混合溶液的pH=7,则溶液中c (NH4+)>c (Cl-)
D.若V1=V2,且混合液的pH<7,则可能有c1 = c2
14.取5等份NO2,分别加入温度不同、容积相同的恒容密闭容器中,发生反应:
2NO2(g)N2O4(g),△H<0反应相同时间后,分别测定体系中NO2的百分量(NO2%),并作出其随反应温度(T)变化的关系图。下列示意图中,可能与实验结果相符的是
10420356350
15.常温下,用0. l00mol/L的HCl分别滴定20. 00mL浓度均为0.l00mol/L的NaOH和氨水溶液(已知:常温下,一水合氨Kb=1.75×10-5),测得滴定过程中溶液的电导率变化曲线如图所示。下列说法正确的是
A.b点溶液:c(NH4+)>c(NH3·H2O)>c(Cl-)>c(OH-)>c(H+)
B.d点溶液:c(NH4+)+c(H+)C.e点溶液中:c(H+)-c(OH-)=c(NH4+)+c(NH3·H2O)
332359039370D.a、b 、c、d点点对应的溶液中,水的电离程度:
三、非选择题:本题共5小题,共60分
16.(11分)现在和将来的社会,对能源和材料的需求是越来越大,我们学习化学就为了认识物质,创造物质,开发新能源,发展人类的新未来。请解决以下有关能源的问题:
(1)未来新能源的特点是资源丰富,在使用时对环境无污染或污染很小,且可以再生。下列属于未来新能源标准的是:
①天然气②煤③核能④石油⑤太阳能⑥生物质能⑦风能⑧氢能
A.①②③④ B.⑤⑥⑦⑧ C.③⑤⑥⑦⑧ D.③④⑤⑥⑦⑧
(2)运动会上使用的火炬的燃料一般是丙烷(C3H8),请根据完成下列题目。
①已知11g丙烷(C3H8)在298K和101Kpa条件下完全燃烧生成CO2和液态水时放出的热量为555kJ,请写出丙烷燃烧热的热化学方程式:______________________________;
②丙烷在一定条件下发生脱氢反应可以得到丙烯。
已知:C3H8(g)→CH4(g)+HC≡CH(g)+H2(g) △H1=+156.6kJ·mol-1
CH3CH=CH2(g)→CH4(g)+HC≡CH(g) △H2=+32.4kJ·mol-1
则相同条件下,反应C3H8(g)→CH3CH=CH2(g)+H2(g)的△H=_______
(3)已知:H—H键的键能为436kJ/mol,H—N键的键能为391kJ/mol,根据化学方程式:N2+3H2?2NH3 ΔH = - 92.4kJ/mol。
①请计算出N≡N键的键能为________________。
②若向处于上述热化学方程式相同温度和体积一定的容器中,通入1molN2和3molH2,充分反应后,恢复原温度时放出的热量_______________92.4KJ(填大于或小于或等于)。
17.(11分)研究NOx之间的转化具有重要意义。
(1)已知:N2O4(g) 2NO2(g) ΔH>0 将一定量N2O4气体充入恒容密闭容器中,控制反应温度为T1。
①下列可以作为反应达到平衡的判据是________。
A.气体的压强不变 B.v正(N2O4)=2v逆(NO2) C.K不变
D.容器内气体的密度不变 E.容器内颜色不变
②反应温度T1时,c(N2O4)随t(时间)变化曲线如图,画出0~t2时段,c(NO2)随t变化曲线。保持其它条件不变,改变反应温度为T2(T2>T1),再次画出0~t2时段,c(NO2)随t变化趋势的曲线________。
(2) NO氧化反应:2NO(g)+O2(g)=2NO2(g)分两步进行,其反应过程能量变化示意图如图。
Ⅰ 2NO(g)=N2O2(g) ΔH1 Ⅱ N2O2(g)+O2(g)→2NO2(g) ΔH2
①决定NO氧化反应速率的步骤是__________(填“Ⅰ”或“Ⅱ”)。
②在恒容的密闭容器中充入一定量的NO和O2气体,保持其它条件不变,控制反应温度分别为T3和T4(T4>T3),测得c(NO)随t(时间)的变化曲线如图。转化相同量的NO,在温度_____(填“T3”或“T4”)下消耗的时间较长,试结合反应过程能量图分析其原因_____________________________________________________________________________。
1748155157480I
O
18.(12分)(I)工业上过氧化氢是重要的氧化剂和还原剂。常用于消毒、杀菌、漂白等。某化学兴趣小组的同学围绕过氧化氢开展了调查研究与实验,请你参与其中一起完成下列学习任务:
(1)该兴趣小组的同学查阅资料后发现H2O2为二元弱酸,其酸性比碳酸弱。请写出H2O2在水溶液中的电离方程式:_______________________________________。
(2)同学们用0.1000 mol·L-1的酸性高锰酸钾标准溶液滴定某试样中过氧化氢的含量,反应原理为2MnO4-+5H2O2?+6H+=2Mn2++8H2O+5O2↑。
①在该反应中,H2O2被_____________(填“氧化”或“还原”)。
②滴定到达终点的现象是________________________________。
③用移液管吸取25.00 mL?试样置于锥形瓶中,重复滴定四次,每次消耗的酸性KMnO4标准溶液体积如下表所示:
第一次
第二次
第三次
第四次
体积(mL)
17.10
18.10
17.00
16.90
则试样中过氧化氢的浓度为__________mol/L。
(II)医学上常用酸性高锰酸钾溶液和草酸溶液的反应来测定血钙的含量。测定含量如下:取2mL血液用蒸馏水稀释后,向其中加入足量(NH4)2C2O4溶液,反应生成CaC2O4沉淀,将沉淀用稀硫酸溶解得到H2C2O4后,再用KMnO4溶液滴定。
(1)滴定时,用________(填酸或碱)式滴定管装KMnO4溶液(填“酸”或“碱”)。
(2)下列操作会引起测定结果偏高的是_________。
A.滴定管在盛装高锰酸钾前未润洗
B.滴定过程中,锥形瓶震荡的太剧烈,以致部分液体溅出
C.滴定前读数正确,滴定终点时俯视读数
D.锥形瓶未用待测液润洗
19.(10分)氨是重要的工业原料,在农业、医药、国防和化工等领域有重要应用;NH4Al(SO4)2是食品加工中最为快捷的食品添加剂,用于焙烤食品;NH4HSO4在分析试剂、医药、电子工业中用途广泛。回答下列问题:
(1)NH4Al(SO4)2可用作做净水剂的原因是________ (用离子方程式表示)。
(2)相同条件下,0.1 mol·L-1NH4Al(SO4)2中c(NH)________0.1 mol·L-1NH4HSO4中c(NH)。(填“>”“<”或“=”)
(3)图所示是0.1 mol·L-1电解质溶液的pH随温度变化的图像。图中符合
0.1mol·L-1 NH4Al(SO4)2溶液的pH随温度变化的曲线是________(填序号);25℃时,
0.1 mol·L-1 NH4Al(SO4)2溶液中2 c(SO)-c(NH)-3 c(Al3+)= mol·L-1。
(填精确的表达式)
(4)常温下,NH4HSO4溶液中各离子的浓度由大到小的顺序是:___________________
20.(16分)(1)已知在一定温度下的可逆反应N2O4(g)2NO2(g) ΔH>0中,v正=k正c(N2O4),v逆=k逆c2(NO2)(k正、k逆只是温度的函数)。若该温度下的平衡常数K=10,则k正=________k逆。升高温度,k正增大的倍数________(填“大于”“小于”或“等于”)k逆增大的倍数。
(2)某温度下,N2O5 气体在一体积固定的容器中发生如下反应:2N2O5(g)===4NO2(g)+O2(g)(慢反应) ΔH<0,2NO2(g)N2O4(g)(快反应) ΔH<0,体系的总压强p总和p(O2)随时间的变化如下图所示:
①上图中表示O2压强变化的曲线是______________________(填“甲”或“乙”)。
②已知N2O5 分解的反应速率v=0.12P(N2O5)(kPa·h-1),t=10 h时,P(N2O5)=_________kPa,v=_________kPa·h-1(结果保留两位小数,下同)。
③该温度下2NO2N2O4 反应的平衡常数Kp=__________kPa-1(Kp为以平衡分压代替平衡浓度的平衡常数,分压=总压×物质的量分数)。
(3)反应Ag2SO4(s)+2Cl-(aq)===2AgCl(s)+SO42-(aq),常温下,Ag2SO4、AgCl的饱和溶液中阳离子和阴离子的浓度关系如图1所示。则该反应的化学平衡常数的数量级为________。
(4)室温下,H2SeO3溶液中H2SeO3、HSeO3-、SeO32-的物质的量分数随pH的变化如图2所示,则室温下Ka2(H2SeO3)=________。
高二期中教学质量检测答案及评分标准2020.11
一、选择题:本题共10小题,每小题2分,共20分。
1~5 C D B D B 6~10 B A A B C
二、选择题:本题共5小题,每小题4分,共20分。每小题有一个或两个选项符合题目要求,全部选对得4分,选对但不全的得2分,有选错的得0分。
11 C 12 AC 13 D 14BD 15 BD
填空题除标注外,每空2分
16.(11分)
(1)B(2)①C3H8(g)+5O2(g)=3CO2(g)+4H2O(l) △H=-2220kJ·mol-1 (3分)
②+124.2kJ·mol-1 (无+也给分,没单位不得分)
(3)① 945.6KJ/mol (没单位扣1分) ②小于
17.(11分)
(1)①AE (漏写1分,错写多写0分) ②(两条线各1分)
(2)①Ⅱ ② T4; ΔH1<0,温度升高,反应Ⅰ平衡逆移,c(N2O2)减小,浓度降低的影响大于温度对反应Ⅱ速率的影响(3分)(酌情得分)
18.(12分)
(I) (1)H2O2H++HO2- HO2-H++O22-(每空1分)
(2)①氧化 ②当滴加最后一滴溶液时,锥形瓶内溶液颜色恰好由无色变为浅红色,且30秒内不褪色(半滴也给分,三段话缺一段均不得分) ③ 0.1700 (0.17不得分)
(II) (1) 酸 (2) A
19.(10分)
(1) Al3++3H2OAl(OH)3(胶体)+3H+ (不写胶体也得分)
(2) < (3)I , 10-3-10-11(不写不得分)
(4)c(H+)>c(SO42-)>c(NH4+)>c(OH-)
20.(共16分)
(1) 10 大于
(2)① 乙 ②28.2 3.38 ③0.05
(3) 1014
(4) 10-7.30
高二化学试题
本试卷分第I卷和第Ⅱ卷,全卷满分100分,考试时间为90分钟。
注意事项:
1.答卷前,考生务必将自己的姓名、考生号等填写在答题卡(纸)指定位置上。
2.答第I卷选择题时,将每小题答案选出后,用2B铅笔把答题卡上对应题目的答案标号涂黑。如需改动,用橡皮擦干净后,再选涂其他答案标号。
3.第Ⅱ卷题目的答案用黑色签字笔,将答案写在答题卡(纸)规定的位置上。写在试卷上无效。
一、选择题:本题共10小题,每小题2分,共20分。每小题只有一个选项符合题目要求。
1.明代诗人于谦在《石灰吟》中写道:“千锤万凿出深山,烈火焚烧若等闲。粉身碎骨浑不怕,要留清白在人间。”这首脍炙人口的诗篇不仅蕴含了深刻的人文精神,还蕴藏了有趣的化学知识,下列有关说法中,错误的是
A.化学反应过程中同时存在着物质变化和能量变化,其中物质变化是基础
B.这首诗说明化学能与热能在一定条件下可以相互转化
C.石灰石的分解是熵增反应,因此在任何条件下都能自发进行
D.“要留清白在人间”涉及反应中的化学物质有强电解质、弱电解质和非电解质
2.如图所示,ΔH1=-393.5kJ·mol-1,ΔH2=-395.4kJ·mol-1,下列说法正确的是
A.石墨和金刚石的转化是物理变化
B.金刚石的稳定性强于石墨
C.1mol石墨的总能量比1mol金刚石的总能量高1.9kJ
D.C(石墨,s)=C(金刚石,s),该反应的焓变(ΔH)为正值
3.对于反应:A+BC,下列条件的改变一定能使化学反应速率加快的是
A.增加A的物质的量 B.升高体系的温度
C.增加体系的压强 D.减少C的物质的量浓度
4.一定条件下,某容器中各微粒在反应前后变化的示意图如下,其中和代表不同元素的原子。关于此反应说法正确的是
充分反应
反应前
反应后
A.一定吸收热量 B.反应物一定全部参与反应
C.一定属于非氧化还原反应 D.一定属于分解反应
5.设NA为阿伏加德罗常数的值,下列有关叙述正确的是
A.1L0.1mol·L-1的NaF溶液中含有0.1NA个F-
B.常温常压下,22.4L Cl2完全溶于水时,转移电子数小于NA
C.标准状况下,44.8L的NO与22.4L 的O2混合后,分子数为2NA
D.25℃时,1L0.01mol·L-1的CH3COOH溶液中,水电离出的OH-的数目为10-12NA
6.某温度下,在一个2 L的密闭容器中,加入4 mol A和2 mol B进行如下反应:
3A(g)+2B(g)4C(s)+2D(g),反应一段时间后达到平衡,测得生成1.6 mol C,且反应的前后压强之比为5∶4(相同的温度下测量),则下列说法正确的是
A.该反应的化学平衡常数表达式是K=
B.此时,B的平衡转化率是40%
C.增大该体系的压强,平衡向右移动,化学平衡常数增大
D.增加B,B的平衡转化率升高
7.2SO2+O22SO3,并达到平衡。在这过程中,甲容器保持体积不变,乙容器保持压强不变,若甲容器中SO2的转化率为p%,则乙容器中SO2的转化率
A.大于p% B.等于p% C.小于p% D.无法判断
8.化学平衡常数(K)电离常数(Ka、Kb)、溶度积常数(Ksp)等常数是表示、判断物质性质的重要常数,下列关于这些常数的说法中,正确的是
A.当温度升高时,弱酸、弱碱的电离常数(Ka、Kb)均变大
B.Ka(HCN)<Ka(CH3COOH)说明相同物质的量浓度时,氢氰酸的酸性比醋酸的强
C.向同浓度的碳酸钠和硫酸钠混合溶液中滴加氯化钡溶液,先产生BaSO4沉淀,则
Ksp(BaSO4)>Ksp(BaCO3)
D.化学平衡常数的大小与温度、浓度、压强有关,与催化剂无关
9.下列表述中,关于“一定”说法正确的个数是
①pH=6的溶液一定是酸性溶液
②c(H+)>c(OH-)一定是酸性溶液
③强电解质溶液的导电能力一定大于弱电解质溶液的导电能力
④25℃时,水溶液中水电离出的c(H+)和水电离出的c(OH-)的乘积一定等于10-14
⑤使用pH试纸测定溶液pH值时,若先润湿,则测得溶液的pH一定有影响
⑥0.2mol/L醋酸溶液加水稀释,电离程度增大,c(H+)一定增大
⑦温度保持不变,向水中加入钠盐对水的电离一定没有影响
A.0 B.1 C.2 D.3
10.已知Ksp(CaCO3)=2.8×10-9及表中有关信息:
弱酸
CH3COOH
H2CO3
电离平衡常数(常温)
Ka=1.8×10-5
Ka1=4.3×10-7;Ka2=5.6×10-11
下列判断正确的是
A.向Na2CO3溶液中滴入酚酞,溶液变红,主要原因是CO32-+2H2OH2CO3+2OH-
B.常温时,CH3COOH与CH3COONa混合溶液的pH=6,则c(CH3COOH)/c(CH3COO-)=18
C.NaHCO3溶液中:c(OH-)-c(H+)=c(H2CO3)-c(CO32-)
D.2×10-4 mol/L的Na2CO3溶液与CaCl2溶液等体积混合出现沉淀,则CaCl2溶液的浓度一定是5.6×10-5 mol/L
二、选择题:本题共5小题,每小题4分,共20分。每小题有一个或两个选项符合题目要求,全部选对得4分,选对但不全的得2分,有选错的得0分。
11.下列实验能达到预期目的是
编号
实验内容
实验目的
A
室温下,用pH试纸分别测定浓度为0.1mol·L-1Na2CO3溶液和0.1 mol·L-1CH3COONa溶液的pH
比较H2CO3和CH3COOH的酸性强弱
B
室温下,分别测定等物质的量浓度的Na2SO3与Na2CO3溶液的pH
比较S、C元素的非金属性强弱
C
相同条件下,向一支试管中加入2 mL 5% H2O2和1 mL H2O,向另一支试管中加入2 mL 5% H2O2和1 mL FeCl3溶液,观察并比较实验现象
探究FeCl3对H2O2分解速率的影响
D
向2支盛有5 mL不同浓度NaHSO3溶液的试管中,同时加入2 mL 5% H2O2溶液,观察并比较实验现象
探究浓度对反应速率的影响
12.化学中常用图像直观地描述化学反应的进程或结果。下列图像描述不正确的是
A.根据图①可判断可逆反应A2(g)+3B2(g)3C(g)+D(s)的ΔH>0
B.图②表示压强对可逆反应2A (g) + 6B (s)2AB3(g)的影响,乙的压强大
C.图③可以表示对某化学平衡体系改变温度后反应速率随时间的变化
D.图④是N2与H2合成氨的能量变化曲线,可确定该反应1molN2和4molH2充分反应时放热一定小于92 kJ
13.常温时,将V1mL c1mol·L-1的氨水滴加到V2mL c2moL·L-1的盐酸中,下列结论中正确的是
A.若混合溶液的pH=7,则c1V1=c2V2
B.若V1=V2,c1=c2,则溶液中c (NH4+) =c (Cl-)
C.若混合溶液的pH=7,则溶液中c (NH4+)>c (Cl-)
D.若V1=V2,且混合液的pH<7,则可能有c1 = c2
14.取5等份NO2,分别加入温度不同、容积相同的恒容密闭容器中,发生反应:
2NO2(g)N2O4(g),△H<0反应相同时间后,分别测定体系中NO2的百分量(NO2%),并作出其随反应温度(T)变化的关系图。下列示意图中,可能与实验结果相符的是
10420356350
15.常温下,用0. l00mol/L的HCl分别滴定20. 00mL浓度均为0.l00mol/L的NaOH和氨水溶液(已知:常温下,一水合氨Kb=1.75×10-5),测得滴定过程中溶液的电导率变化曲线如图所示。下列说法正确的是
A.b点溶液:c(NH4+)>c(NH3·H2O)>c(Cl-)>c(OH-)>c(H+)
B.d点溶液:c(NH4+)+c(H+)
332359039370D.a、b 、c、d点点对应的溶液中,水的电离程度:
三、非选择题:本题共5小题,共60分
16.(11分)现在和将来的社会,对能源和材料的需求是越来越大,我们学习化学就为了认识物质,创造物质,开发新能源,发展人类的新未来。请解决以下有关能源的问题:
(1)未来新能源的特点是资源丰富,在使用时对环境无污染或污染很小,且可以再生。下列属于未来新能源标准的是:
①天然气②煤③核能④石油⑤太阳能⑥生物质能⑦风能⑧氢能
A.①②③④ B.⑤⑥⑦⑧ C.③⑤⑥⑦⑧ D.③④⑤⑥⑦⑧
(2)运动会上使用的火炬的燃料一般是丙烷(C3H8),请根据完成下列题目。
①已知11g丙烷(C3H8)在298K和101Kpa条件下完全燃烧生成CO2和液态水时放出的热量为555kJ,请写出丙烷燃烧热的热化学方程式:______________________________;
②丙烷在一定条件下发生脱氢反应可以得到丙烯。
已知:C3H8(g)→CH4(g)+HC≡CH(g)+H2(g) △H1=+156.6kJ·mol-1
CH3CH=CH2(g)→CH4(g)+HC≡CH(g) △H2=+32.4kJ·mol-1
则相同条件下,反应C3H8(g)→CH3CH=CH2(g)+H2(g)的△H=_______
(3)已知:H—H键的键能为436kJ/mol,H—N键的键能为391kJ/mol,根据化学方程式:N2+3H2?2NH3 ΔH = - 92.4kJ/mol。
①请计算出N≡N键的键能为________________。
②若向处于上述热化学方程式相同温度和体积一定的容器中,通入1molN2和3molH2,充分反应后,恢复原温度时放出的热量_______________92.4KJ(填大于或小于或等于)。
17.(11分)研究NOx之间的转化具有重要意义。
(1)已知:N2O4(g) 2NO2(g) ΔH>0 将一定量N2O4气体充入恒容密闭容器中,控制反应温度为T1。
①下列可以作为反应达到平衡的判据是________。
A.气体的压强不变 B.v正(N2O4)=2v逆(NO2) C.K不变
D.容器内气体的密度不变 E.容器内颜色不变
②反应温度T1时,c(N2O4)随t(时间)变化曲线如图,画出0~t2时段,c(NO2)随t变化曲线。保持其它条件不变,改变反应温度为T2(T2>T1),再次画出0~t2时段,c(NO2)随t变化趋势的曲线________。
(2) NO氧化反应:2NO(g)+O2(g)=2NO2(g)分两步进行,其反应过程能量变化示意图如图。
Ⅰ 2NO(g)=N2O2(g) ΔH1 Ⅱ N2O2(g)+O2(g)→2NO2(g) ΔH2
①决定NO氧化反应速率的步骤是__________(填“Ⅰ”或“Ⅱ”)。
②在恒容的密闭容器中充入一定量的NO和O2气体,保持其它条件不变,控制反应温度分别为T3和T4(T4>T3),测得c(NO)随t(时间)的变化曲线如图。转化相同量的NO,在温度_____(填“T3”或“T4”)下消耗的时间较长,试结合反应过程能量图分析其原因_____________________________________________________________________________。
1748155157480I
O
18.(12分)(I)工业上过氧化氢是重要的氧化剂和还原剂。常用于消毒、杀菌、漂白等。某化学兴趣小组的同学围绕过氧化氢开展了调查研究与实验,请你参与其中一起完成下列学习任务:
(1)该兴趣小组的同学查阅资料后发现H2O2为二元弱酸,其酸性比碳酸弱。请写出H2O2在水溶液中的电离方程式:_______________________________________。
(2)同学们用0.1000 mol·L-1的酸性高锰酸钾标准溶液滴定某试样中过氧化氢的含量,反应原理为2MnO4-+5H2O2?+6H+=2Mn2++8H2O+5O2↑。
①在该反应中,H2O2被_____________(填“氧化”或“还原”)。
②滴定到达终点的现象是________________________________。
③用移液管吸取25.00 mL?试样置于锥形瓶中,重复滴定四次,每次消耗的酸性KMnO4标准溶液体积如下表所示:
第一次
第二次
第三次
第四次
体积(mL)
17.10
18.10
17.00
16.90
则试样中过氧化氢的浓度为__________mol/L。
(II)医学上常用酸性高锰酸钾溶液和草酸溶液的反应来测定血钙的含量。测定含量如下:取2mL血液用蒸馏水稀释后,向其中加入足量(NH4)2C2O4溶液,反应生成CaC2O4沉淀,将沉淀用稀硫酸溶解得到H2C2O4后,再用KMnO4溶液滴定。
(1)滴定时,用________(填酸或碱)式滴定管装KMnO4溶液(填“酸”或“碱”)。
(2)下列操作会引起测定结果偏高的是_________。
A.滴定管在盛装高锰酸钾前未润洗
B.滴定过程中,锥形瓶震荡的太剧烈,以致部分液体溅出
C.滴定前读数正确,滴定终点时俯视读数
D.锥形瓶未用待测液润洗
19.(10分)氨是重要的工业原料,在农业、医药、国防和化工等领域有重要应用;NH4Al(SO4)2是食品加工中最为快捷的食品添加剂,用于焙烤食品;NH4HSO4在分析试剂、医药、电子工业中用途广泛。回答下列问题:
(1)NH4Al(SO4)2可用作做净水剂的原因是________ (用离子方程式表示)。
(2)相同条件下,0.1 mol·L-1NH4Al(SO4)2中c(NH)________0.1 mol·L-1NH4HSO4中c(NH)。(填“>”“<”或“=”)
(3)图所示是0.1 mol·L-1电解质溶液的pH随温度变化的图像。图中符合
0.1mol·L-1 NH4Al(SO4)2溶液的pH随温度变化的曲线是________(填序号);25℃时,
0.1 mol·L-1 NH4Al(SO4)2溶液中2 c(SO)-c(NH)-3 c(Al3+)= mol·L-1。
(填精确的表达式)
(4)常温下,NH4HSO4溶液中各离子的浓度由大到小的顺序是:___________________
20.(16分)(1)已知在一定温度下的可逆反应N2O4(g)2NO2(g) ΔH>0中,v正=k正c(N2O4),v逆=k逆c2(NO2)(k正、k逆只是温度的函数)。若该温度下的平衡常数K=10,则k正=________k逆。升高温度,k正增大的倍数________(填“大于”“小于”或“等于”)k逆增大的倍数。
(2)某温度下,N2O5 气体在一体积固定的容器中发生如下反应:2N2O5(g)===4NO2(g)+O2(g)(慢反应) ΔH<0,2NO2(g)N2O4(g)(快反应) ΔH<0,体系的总压强p总和p(O2)随时间的变化如下图所示:
①上图中表示O2压强变化的曲线是______________________(填“甲”或“乙”)。
②已知N2O5 分解的反应速率v=0.12P(N2O5)(kPa·h-1),t=10 h时,P(N2O5)=_________kPa,v=_________kPa·h-1(结果保留两位小数,下同)。
③该温度下2NO2N2O4 反应的平衡常数Kp=__________kPa-1(Kp为以平衡分压代替平衡浓度的平衡常数,分压=总压×物质的量分数)。
(3)反应Ag2SO4(s)+2Cl-(aq)===2AgCl(s)+SO42-(aq),常温下,Ag2SO4、AgCl的饱和溶液中阳离子和阴离子的浓度关系如图1所示。则该反应的化学平衡常数的数量级为________。
(4)室温下,H2SeO3溶液中H2SeO3、HSeO3-、SeO32-的物质的量分数随pH的变化如图2所示,则室温下Ka2(H2SeO3)=________。
高二期中教学质量检测答案及评分标准2020.11
一、选择题:本题共10小题,每小题2分,共20分。
1~5 C D B D B 6~10 B A A B C
二、选择题:本题共5小题,每小题4分,共20分。每小题有一个或两个选项符合题目要求,全部选对得4分,选对但不全的得2分,有选错的得0分。
11 C 12 AC 13 D 14BD 15 BD
填空题除标注外,每空2分
16.(11分)
(1)B(2)①C3H8(g)+5O2(g)=3CO2(g)+4H2O(l) △H=-2220kJ·mol-1 (3分)
②+124.2kJ·mol-1 (无+也给分,没单位不得分)
(3)① 945.6KJ/mol (没单位扣1分) ②小于
17.(11分)
(1)①AE (漏写1分,错写多写0分) ②(两条线各1分)
(2)①Ⅱ ② T4; ΔH1<0,温度升高,反应Ⅰ平衡逆移,c(N2O2)减小,浓度降低的影响大于温度对反应Ⅱ速率的影响(3分)(酌情得分)
18.(12分)
(I) (1)H2O2H++HO2- HO2-H++O22-(每空1分)
(2)①氧化 ②当滴加最后一滴溶液时,锥形瓶内溶液颜色恰好由无色变为浅红色,且30秒内不褪色(半滴也给分,三段话缺一段均不得分) ③ 0.1700 (0.17不得分)
(II) (1) 酸 (2) A
19.(10分)
(1) Al3++3H2OAl(OH)3(胶体)+3H+ (不写胶体也得分)
(2) < (3)I , 10-3-10-11(不写不得分)
(4)c(H+)>c(SO42-)>c(NH4+)>c(OH-)
20.(共16分)
(1) 10 大于
(2)① 乙 ②28.2 3.38 ③0.05
(3) 1014
(4) 10-7.30
同课章节目录
