新教材2020-2021学年化学人教版(2019)选择性必修2单元测试:第二章 分子结构与性质
文档属性
| 名称 | 新教材2020-2021学年化学人教版(2019)选择性必修2单元测试:第二章 分子结构与性质 |  | |
| 格式 | doc | ||
| 文件大小 | 419.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-11-18 11:26:25 | ||
图片预览



文档简介
第二章 单元测试题
(时间:90分钟,满分:100分)
一、选择题(本题包括16小题,每小题3分,共48分)
1.下列关于σ键与π键的说法正确的是( )
A.σ键是以“头碰头”方式形成的共价键,π键是以“肩并肩”方式形成的共价键
B.气态单质中一定存在σ键,可能存在π键
C.原子轨道以“头碰头”方式相互重叠比以“肩并肩”方式相互重叠的程度小,所以σ键比π键活泼
D.由于π键总是比σ键重叠程度小,故化学反应一般先断裂π键
2.下表中各粒子、粒子对应的立体结构及解释均正确的是( )
选项 粒子 立体结构 解释
A 氨基负离子(NH) 直线形 N原子采用sp杂化
B 二氧化硫(SO2) V形 S原子采用sp3杂化
C 碳酸根离子(CO) 三角锥形 C原子采用sp3杂化
D 乙炔(C2H2) 直线形 C原子采用sp杂化且C原子的价电子均参与成键
3.科学家最近研制出有望成为高效火箭推进剂的N(NO2)3,(如图所示)。已知该分子中N—N—N键角都是108.1°,下列有关N(NO2)3的说法正确的是( )
A.分子中N、O间形成的共价键是非极性键
B.分子中4个氮原子共平面
C.该分子中的中心氮原子还有一对孤电子对
D.15.2 g该物质含有6.02×1022个原子
4.用NA表示阿伏加德罗常数,则下列说法正确的是( )
A.1 mol NH3分子中含有3NA个σ键和4NA个sp3杂化轨道
B.1 mol CO2分子中含有2NA个σ键和2NA个sp2杂化轨道
C.1 mol C2H2分子中含有2NA个σ键、2NA个π键
D.1 mol C2H4分子中含有4NA个σ键、2NA个π键
5.化合物NH3与BF3可以通过配位键形成NH3·BF3(),下列说法正确的是( )
A.NH3与BF3都是三角锥形结构
B.NH3与BF3都是极性分子
C.NH3·BF3中N、B分别为sp3杂化、sp2杂化
D.NH3在水中溶解度大于BF3
6.已知HNO3、H2SO4的结构式如图所示。
下列说法不正确的是( )
A.NO、SO的立体构型分别为平面三角形、正四面体形
B.HNO3、H2SO4分子中N、S的杂化类型分别为sp2、sp3
C.等物质的量的NO、SO含σ键个数之比为2?3
D.HNO3、H2SO4都能与水分子形成分子间氢键
7.下列关于丙烯(CH3—CH===CH2)的说法错误的是( )
A.丙烯分子有8个σ键,1个π键
B.丙烯分子中3个碳原子都是sp3杂化
C.丙烯分子存在非极性键
D.丙烯分子中最多有7个原子在同一平面上
8.“冰面为什么滑?”,这与冰层表面的结构有关(如图)。下列有关说法错误的是( )
A.由于氢键的存在,水分子的稳定性好,高温下也很难分解
B.第一层固态冰中,水分子间通过氢键形成空间网状结构
C.第二层“准液体”中,水分子间形成氢键的机会比固态冰中少
D.当高于一定温度时,“准液体”中的水分子与下层冰连接的氢键断裂,产生“流动性的水分子”,使冰面变滑
9.在半导体生产及灭火剂的使用过程中,会向空气中逸散气体,如NF3、CHClFCF3、C3F8等。它们虽然是微量的,但有些却是强温室气体。下列推测不正确的是( )
A.NF3分子呈三角锥形
B.C3F8在CCl4中的溶解度比在水中的大
C.CHClFCF3存在手性异构
D.CHClFCF3中没有非极性键
10.某一化合物的分子式为AB2,A属第ⅥA族元素,B属第ⅦA族元素,A和B在同一周期,它们的电负性值分别为3.44和3.98,已知AB2分子的键角为103.3°。下列推断不正确的是( )
A.AB2分子的空间构型为“V”形
B.A-B键为极性共价键,AB2分子为非极性分子
C.AB2与H2O相比,AB2的熔点、沸点比H2O的低
D.AB2分子中无H原子,分子间不能形成氢键,而H2O分子间能形成氢键
11.下列图像正确的是( )
12.由短周期前10号元素组成的物质T和X,有如图所示的转化。X不稳定,易分解。下列有关说法正确的是( )
A.为使该转化成功进行,Y可以是酸性KMnO4溶液
B.等物质的量的T、X分子中含有π键的数目均为NA
C.X分子中含有的σ键个数是T分子中含有的σ键个数的2倍
D.T分子中只含有极性键,X分子中既含有极性键又含有非极性键
13.CO2 的资源化利用是解决温室效应的重要途径。以下是在一定条件下用 NH3捕获 CO2生成重要化工产品三聚氰胺的反应:3NH3+3CO2→+3H2O。下列说法正确的是( )
A.三聚氰胺中C、N、O 原子采用相同的杂化方式
B.三聚氰胺分子中既含极性键,又含非极性键
C.该反应的四种物质的分子均能形成氢键
D.除三聚氰胺外,其他三种物质的沸点由高到低顺序为:H2O>NH3>CO2
14.(多选)下列有关叙述正确的是( )
A.利用手性催化剂合成可只得到一种或主要得到一种手性分子
B.氢键是一种特殊化学键,它广泛地存在于自然界中
C.互为手性异构体的分子互为镜像,且分子组成相同,性质和用途也相同
D.由酸性FCH2COOH>CH3COOH,可知酸性ClCH2COOH>CH3COOH
15.短周期主族元素W、X、Y、Z的原子序数依次增大 ,W、X原子的最外层电子数之比为4?3,Z原子比X原子的核外电子数多4。下列说法正确的是( )
A.W、Y、Z的电负性大小顺序一定是Z>Y>W
B.Z的氢化物分子间存在氢键
C.Y、Z形成的分子的中心原子可能采取sp3杂化
D.WY2分子中σ键与π键的个数之比是2:1
16.第VA族元素的原子R与A原子结合形成RA3气态分子,其立体结构呈三角锥形。PCl5在气态和液态时,分子结构如下图所示,下列关于PCl5分子的说法中不正确的是( )
RCl5的分子结构
A.每个原子都达到8电子稳定结构
B.键角(Cl—R—Cl)有90°、120°、180°几种
C.RCl5受热后会分解生成分子立体结构呈三角锥形的RCl3
D.分子中5个R—Cl键键能不都相同
二、非选择题(本题包括5小题,共52分)
17.(10分)今有aX、bY、cZ三种元素。已知:①各原子序数a、b、c均小于20,且a+b+c=25;②元素Y的原子价电子构型为ns2npn+2;③X和Y在不同条件下可形成X2Y和X2Y2两种化合物,Y和Z在不同条件下可形成ZY和ZY2两种化合物;④Z的硫化物的相对分子质量与Z的氯化物的相对分子质量之比为38?77。
回答下列问题:
(1)Z的价电子排布图为________________。
(2)X2Y2的电子式为________,该晶体中含微粒间的作用有________。
(3)Y的最常见氢化物的VSEPR模型为________,其中Y原子以________杂化轨道成键;Z的氯化物的分子空间构型是________;根据原子轨道成键方式分,Z的硫化物分子中含有的键的种类及数目是________、________。
18.(10分)已知X、Y、Z、W四种元素是短周期元素,且原子序数依次增大。
相关信息
1 X、W同主族,Y、Z为同周期的相邻元素
2 W为地壳中含量最多的金属元素
3 Y基态原子最外层有3个未成对电子
4 Z原子最外层电子数是次外层电子数的3倍
试推断:
(1)X是制造超硬材料的元素之一,其基态原子核外电子排布式为________;
(2)由以上元素形成的气态氢化物中,溶于水显碱性的分子的空间构型为________,它的共价键属于________(填“极性”或“非极性”)键;
(3)写出W与Z形成的化合物与强碱反应的离子方程式:________________________;
(4)已知:
化学键 Y—Z Z===Z Y≡Y
键能(kJ/mol) 632 498 946
写出Y2(g)和Z2(g)生成YZ(g)的热化学方程式:__________________________。
19.(8分)根据下列数据回答问题:
化学键 Si—Si C—C C===C C≡C N—N N≡N P—P
键长(pm) 235 154 133 120 148 116 228
(1)试推测:C—Si键长范围为__________________、N===N键长范围为________________。
(2)试从键长的角度解释,为何C原子间能形成C===C、C≡C,N原子间也可形成N===N、N≡N,而Si和P均难形成稳定的Si===Si、Si≡Si、P===P、P≡P键?
________________________________________________________________________
________________________________________________________________________
(3)碳和硅的有关化学键键能如下表所示,简要分析和解释下列有关事实:
化学键 C—C C—H C—O Si—Si Si—H Si—O
键能 /kJ·mol-1 356 413 336 226 318 452
①硅与碳同族,也有系列氢化物,但硅烷在种类和数量上都远不如烷烃多,原因是________________________________________________________________________
________________________________________________________________________
________________________________________________________________________。
②SiH4的稳定性小于CH4,更易生成氧化物,原因是________________________________________________________________________
________________________________________________________________________
________________________________________________________________________。
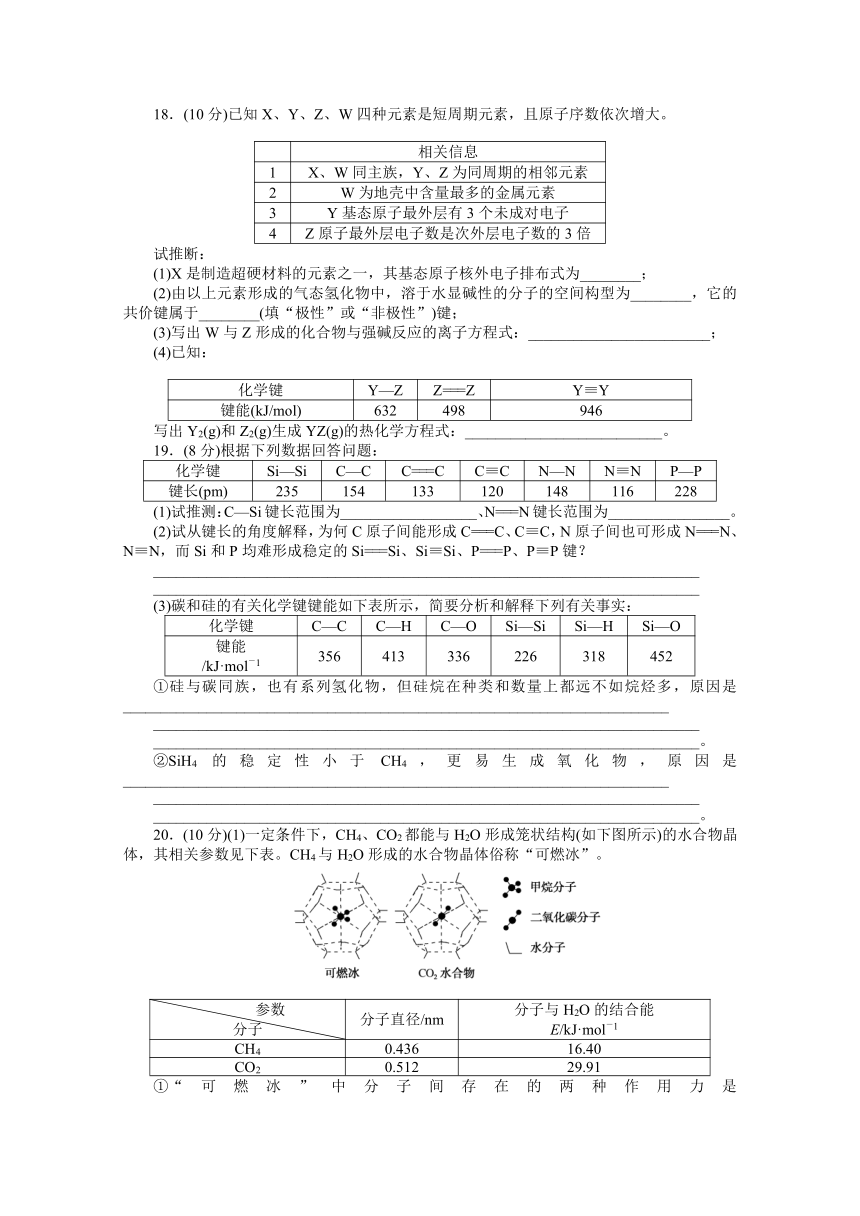
20.(10分)(1)一定条件下,CH4、CO2都能与H2O形成笼状结构(如下图所示)的水合物晶体,其相关参数见下表。CH4与H2O形成的水合物晶体俗称“可燃冰”。
参数 分子 分子直径/nm 分子与H2O的结合能
E/kJ·mol-1
CH4 0.436 16.40
CO2 0.512 29.91
①“可燃冰”中分子间存在的两种作用力是________________________________________________________________________
________________________________________________________________________。
②为开采深海海底的“可燃冰”,有科学家提出用CO2置换CH4的设想。已知上图中笼状结构的空腔直径为0.586 nm,根据上述图表,从物质结构及性质的角度分析,该设想的依据是________________________________________________________________________
________________________________________________________________________
________________________________________________________________________。
(2)甲表示某种含氮有机化合物的结构,其分子内4个氮原子分别位于正四面体的4个顶点(见乙),分子内存在空腔,能嵌入某离子或分子并形成4个氢键予以识别。下列分子或离子中,能被该有机化合物识别的是________(填标号)。
a.CF4 b.CH4
c.NH d.H2O
(3)已知S4O的结构为,其中S原子的杂化方式是________。键长a________b(填“>”“<”或“=”)。分析并比较物质A:与B: 的沸点高低及其原因:________________________________________________________________________
________________________________________________________________________。
21.(14分)(1)下列各组物质性质的比较,结论正确的是________。
A.分子的极性:BCl3B.Mn的+2价比Fe的+2价稳定
C.物质的沸点:HFD.在CS2中的溶解度:CCl4<H2O
(2)下列叙述正确的有________。
A.某元素原子核外电子总数是最外层电子数的5倍,则其最高正价为+7
B.钠元素的第一、第二电离能分别小于镁元素的第一、第二电离能
C.CH2Cl—COOH酸性大于CH3CH2COOH酸性
D.邻羟基苯甲醛的熔点低于对羟基苯甲醛的熔点
(3)磷酸根离子的空间构型为________,其中P的价层电子对数为________,杂化轨道类型为:________。
(4)苯胺()与甲苯()的相对分子质量相近,但苯胺的熔点(-5.9℃)、沸点(184.4℃)分别高于甲苯的熔点(-95.0℃)、沸点(110.6℃),原因是________________________________________________________________________。
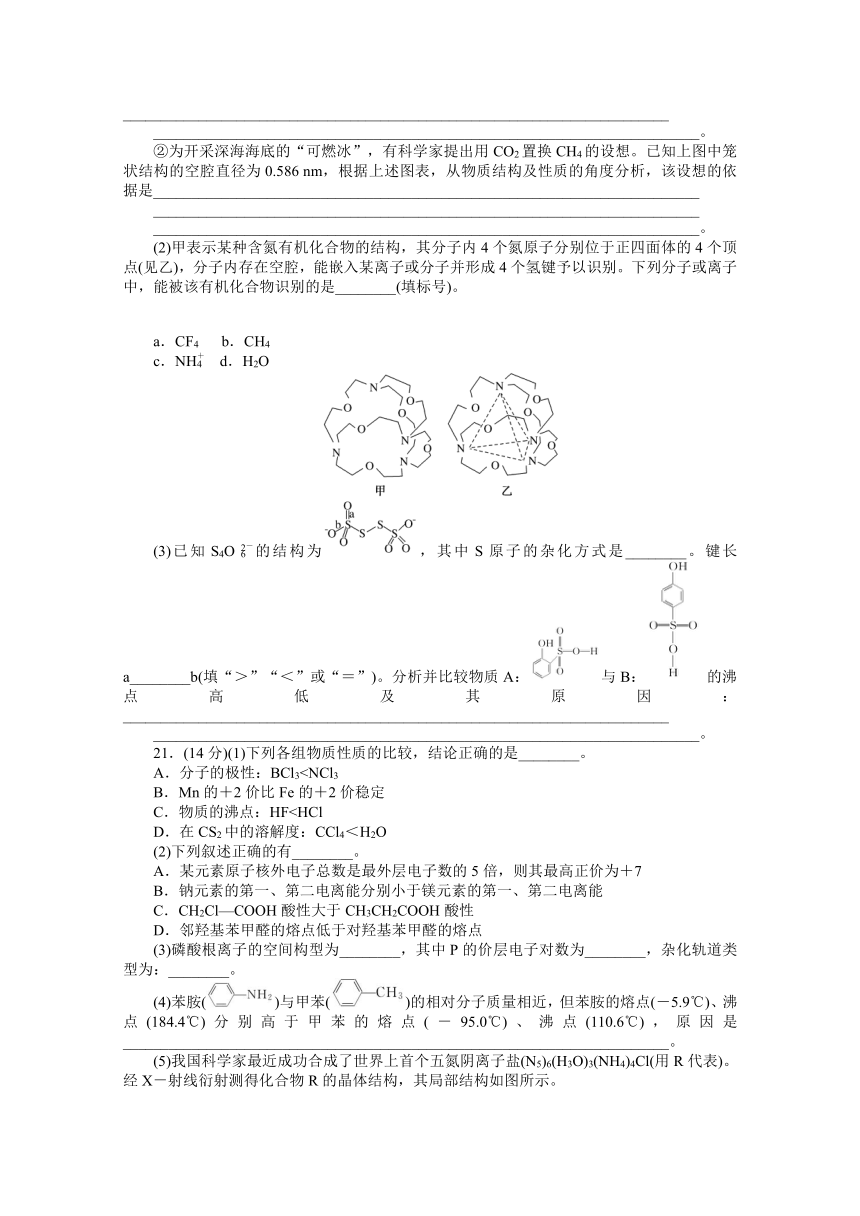
(5)我国科学家最近成功合成了世界上首个五氮阴离子盐(N5)6(H3O)3(NH4)4Cl(用R代表)。经X-射线衍射测得化合物R的晶体结构,其局部结构如图所示。
①从结构角度分析,R中两种阳离子的相同之处为________,不同之处为________。(填标号)
A.中心原子的杂化轨道类型
B.中心原子的价层电子对数
C.立体结构
D.共价键类型
②R中阴离子N中的σ键总数为________个。
③图中虚线代表氢键,其表示式为(NH)N—H…Cl、________________________________、________________________________。
第二章 单元测试题
1.解析:稀有气体分子中不存在化学键,故B错误;σ键的相互重叠程度大于π键,所以σ键更稳定,C项错误;一般情况下π键不如σ键稳定,但也存在π键比σ键稳定的情况,故D错误。
答案:A
2.解析:NH中N原子采用sp3杂化,且孤电子对数为2,分子的立体构型为V形,A项错误;SO2中S原子的价层电子对数=σ键数+孤电子对数=2+×(6-2×2)=3,含孤电子对数为1,杂化轨道数为3,采取sp2杂化,结构为V形,B项错误;CO中,价层电子对数=3+×(4+2-3×2)=3,不含孤电子对,杂化轨道数为3,采取sp2杂化,立体构型为平面三角形,C项错误;C2H2中C原子采用sp杂化,且C原子的价电子均参与成键,所以分子的立体构型为直线形,D项正确。
答案:D
3.解析:
选项 具体分析 结论
A 分子中N、O间形成的共价键为不同元素原子之间形成的共价键,属于极性键 错误
B N(NO2)3的分子结构与NH3相似,分子中四个N原子构成三角锥形 错误
C 该分子中N—N—N键角都是108.1°,分子构型为三角锥形,中心氮原子还有一对孤电子对 正确
D 因为1个N(NO2)3分了含有10个原子,15.2 g该物质,即0.1 mol含有6.02×1023个原子 错误
答案:C
4.解析:CO2分子中碳原子是sp杂化,B项不正确;碳碳三键是由1个σ键和2个π键构成的,乙炔分子中含有1个碳碳三键和2个C—H键,所以C项不正确;碳碳双键是由1个σ键和1个π键构成的,乙烯分子中含有1个碳碳双键和4个C—H键,因此D项不正确,答案选A。
答案:A
5.解析:NH3是三角锥形,而BF3是平面三角形结构,B位于中心,因此,NH3是极性分子,BF3是非极性分子,A、B两项都错误;NH3·BF3中N、B均为sp3杂化,C项错误;NH3分子中有1对孤电子对,BF3中B原子最外层只有6个电子,正好有1个空轨道,二者通过配位键结合而使每个原子最外层都达到稳定结构,D项正确。
答案:D
6.解析:双键中含1个σ键,等物质的量的NO、SO含σ键个数之比为3:4。
答案:C
7.解析:丙烯(CH3—CH===CH2)中存在6个C—H σ键和2个C—C σ键,还有1个π键,则共有8个σ键,1个π键,A项正确;甲基中的C为sp3杂化,中的C为sp2杂化,丙烯中只有1个C原子为sp3杂化,B项错误;C、C之间形成的共价键为非极性键,则丙烯分子存在非极性键,C项正确;为平面结构,—CH3中最多有一个H原子在该平面上,故共有7个原子共平面,D正确。
答案:B
8.解析:水分子的稳定性好,是由水分子内氢氧共价键的键能决定的,与分子间形成的氢键无关,A错误;固态冰中,1个水分子与周围的4个水分子通过氢键相连接,从而形成空间网状结构,B正确;“准液体”中,水分子间的距离不完全相等,所以1个水分子与少于4个的水分子间距离适合形成氢键,形成氢键的机会比固态冰中少,C正确;当温度达到一定数值时,“准液体”中的水分子与下层冰连接的氢键被破坏,使一部分水分子能够自由流动,从而产生“流动性的水分子”,造成冰面变滑,D正确。
答案:A
9.解析:在NF3分子中,N原子上有1对孤对电子,有3个N—F键,类似NH3分子的结构,NF3分子中N原子采取sp3杂化,分子呈三角锥形,A项正确;有机物易溶于有机物,而水为无机物,故C3F8在CCl4中的溶解度比在水中的大,B项正确;若碳原子连有四个不同的基团,则该碳原子具有手性,故CHClFCF3存在手性异构,C项正确;CHClFCF3中存在C—C非极性键,D项错误。
答案:D
10.解析:根据A、B的电负性值,可判断A元素为O,B元素为F,该分子为OF2,由已知AB2分子的键角为103.3°可知OF2分子中键的极性不能抵消,为极性分子。
答案:B
11.解析:氟、氯、溴的原子半径依次增大,氢卤键键长增长,键能减小,A项错误;硒化氢的相对分子质量大于硫化氢,硒化氢的沸点高于硫化氢,B项错误;非金属元素原子与氢形成共价键,元素的非金属性越强,键的极性越强,C项正确;SiH4、NH3、H2O的中心原子价层电子对数均为4,但孤电子对数分别为0、1、2,故键角变小,D项错误。
答案:C
12.解析:由球棍模型可知,T为HCHO,X不稳定,易分解,则X为H2CO3,则Y为氧化剂,可以选择氧化性较强的酸性KMnO4溶液,A项正确;等物质的量并不一定是1 mol,B项错误;X分子中含有的σ键个数为5,T分子中含有的σ键个数为3,C项错误;T、X分子中均只含有极性键,无非极性键,D项错误。
答案:A
13.解析:三聚氰胺分子中C原子采用sp2杂化、N原子采用sp2杂化、氧原子则采用sp3杂化,三种原子杂化方式不同,故A错误;三聚氰胺分子中不存在同种元素之间形成的共价键,则分子内不含非极性键,只含极性键,故B错误;二氧化碳分子间不能形成氢键,C错误;由于H2O、NH3、CO2均为分子晶体,其中H2O、NH3分子间能形成氢键,所以H2O、NH3沸点高于二氧化碳,又由于水分子间氢键数目比氨气分子间的氢键数目多,所以水的沸点比氨气高,D正确。
答案:D
14.解析:利用手性催化剂可选择性生成手性分子,A项正确;氢键是一种分子间作用力,不是化学键,故B项错误;互为手性异构体的分子其结构不同,性质相似而不是相同,C项错误;由提示可知,F原子的存在使得酸性增强,故同族元素的Cl也有类似的作用,D项正确。
答案:AD
15.解析:由题意知,W为C,X为Al,Z为Cl,Y可能为Si、P、S。A项,若Y为Si,则C的电负性大于Si,错误;B项,HCl分子间不存在氢键,错误;C项,若Y为Si,则Y、Z形成的SiCl4为正四面体形分子,Si原子采取sp3杂化,正确;D项,若Y为S,则WY2为CS2的结构式为S===C===S,所含σ键、π键的个数相等,错误。
答案:C
16.解析:从RCl5的分子结构图可知键角正确;R—Cl有两类键长可知键能不完全相同;
RCl5 RCl3(三角锥形)+Cl2↑,则RCl5受热后会分解生成分子立体结构呈三角锥形的RCl3。
答案:A
17.解析:根据Y的价电子排布式确定Y的价电子排布式可能为2s22p4或3s23p6,为O元素或Cl元素;再结合Y与X能形成X2Y和X2Y2两种化合物,可确定Y、X分别为O和Na,根据原子序数之和为25,可确定Z为C。(1)C原子最外层有4个电子,根据泡利原理和洪特规则可写出其价电子排布图。
(2)X2Y2为Na2O2,该离子化合物中既含有离子键又含有非极性键。
(3)氧元素最常见的氢化物是H2O,中心原子O上有2个σ键电子对和2个孤电子对,其VSEPR构型为四面体形,中心原子采取sp3杂化;CCl4分子的空间构型为正四面体形,CS2的结构类似于CO2,该分子中含有2个C===S,即从原子轨道成键方式看,CS2分子中有2个σ键和2个π键。
答案:(1)
(2) 离子键和非极性键
(3)四面体形 sp3 正四面体 2个σ键 2个π键
18.答案:(1)1s22s22p1
(2)三角锥形 极性键
(3)Al2O3+2OH-===2AlO+H2O
(4)N2(g)+O2(g)===2NO(g)
ΔH=+180 kJ·mol
19.答案:(1)大于154,小于235 大于116小于148 (2)Si—Si、P—P 单键较长,p-p轨道肩并肩重叠程度很小或几乎不能重叠,难以形成π键 (3)①C—C键和C—H键较强,所以形成的烷烃较稳定,而硅烷中Si—Si键和Si—H键的键能较小,易断裂,导致长链硅烷难形成 ②C—H键的键能大于C—O键,C—H键比C—O键稳定,而Si—H键的键能小于Si—O键,所以,Si—H键不稳定而倾向于形成稳定性更强的Si—O键
20.解析:(1)①“可燃冰”中分子间存在的两种作用力是分子间作用力和氢键。②根据表格数据可知,笼状空腔的直径是0.586 nm,而CO2分子的直径是0.512 nm,笼状空腔直径大于CO2分子的直径,而且CO2与水分子之间的结合能大于CH4,因此可以实现用CO2置换CH4的设想。
(2)要能被该有机化合物识别,则应能与N原子形成氢键,则该微粒中应含有4个N—H或O—H或F—H键,可见只有c符合要求。
(3)S4O的结构中两边的S原子均形成4个σ键且无孤对电子,中间的两个S原子均形成两个单键,且均有两对孤对电子;原子间形成的共价键数目越大,键长就越短;A邻羟基苯磺酸能形成分子内氢键,B对羟基苯磺酸能形成分子间氢键,所以沸点B>A。
答案:(1)①氢键、范德华力 ②CO2的分子直径小于笼状空腔直径,且与H2O的结合能大于CH4
(2)c (3)sp3杂化 < B>A,因为B可以形成分子间氢键
21.解析:(1)BCl3是平面正三角形,分子中正负电中心重合,是非极性分子;而NCl3的N原子上有一对孤电子对,是三角锥形,分子中正负电中心不重合,是极性分子,所以分子极性:BCl3H2O,D错误。
(2)某元素原子核外电子总数是最外层电子数的5倍,此元素是Br,位于VⅡA族,最高正价为+7价,故A项正确;金属钠比镁活泼,容易失去电子,因此钠的第一电离能小于Mg的第一电离能,Na最外层只有一个电子,再失去一个电子,出现能层的变化,需要的能量增大,Mg最外层有2个电子,因此Na的第二电离能大于Mg的第二电离能,故B项错误;由于Cl电负性大于H,故酸性CH2Cl—COOH比CH3CH2COOH强,C正确。邻羟基苯甲醛形成分子内氢键,降低物质熔点,对羟基苯甲醛形成分子间氢键,增大物质熔点,因此邻羟基苯甲醛的熔点低于对羟基苯甲醛的熔点,故D项正确。
(3)PO中P的价层电子对数为4,故杂化方式为sp3杂化,空间构型为正四面体。
(4)苯胺比甲苯的熔沸点都高,苯胺中存在电负性较强的N所以可以形成氢键,因此比甲苯的熔沸点高。
(5)①根据图可知阳离子是NH和H3O+,NH中心原子是N,含有4个σ键,孤电子对数为(5-1-4×1)/2=0,价层电子对数为4,杂化类型为sp3,空间构型为正四面体形;H3O+中心原子是O,含有3个σ键,孤电子对数为(6-1-3)/2=1,价层电子对数为4,杂化类型为sp3,空间构型为三角锥形,因此相同之处为ABD,不同之处为C;②由图可知N中σ键总数为5个;
③根据图(b)还有的氢键是:(H3O+)O—H…N (NH)N—H…N。
答案:(1)AB (2)ACD (3)正四面体 4 sp3杂化 (4)苯胺分子之间存在氢键 (5)①ABD C ②5 ③(H3O+)O—H…N (NH)N—H…N
(时间:90分钟,满分:100分)
一、选择题(本题包括16小题,每小题3分,共48分)
1.下列关于σ键与π键的说法正确的是( )
A.σ键是以“头碰头”方式形成的共价键,π键是以“肩并肩”方式形成的共价键
B.气态单质中一定存在σ键,可能存在π键
C.原子轨道以“头碰头”方式相互重叠比以“肩并肩”方式相互重叠的程度小,所以σ键比π键活泼
D.由于π键总是比σ键重叠程度小,故化学反应一般先断裂π键
2.下表中各粒子、粒子对应的立体结构及解释均正确的是( )
选项 粒子 立体结构 解释
A 氨基负离子(NH) 直线形 N原子采用sp杂化
B 二氧化硫(SO2) V形 S原子采用sp3杂化
C 碳酸根离子(CO) 三角锥形 C原子采用sp3杂化
D 乙炔(C2H2) 直线形 C原子采用sp杂化且C原子的价电子均参与成键
3.科学家最近研制出有望成为高效火箭推进剂的N(NO2)3,(如图所示)。已知该分子中N—N—N键角都是108.1°,下列有关N(NO2)3的说法正确的是( )
A.分子中N、O间形成的共价键是非极性键
B.分子中4个氮原子共平面
C.该分子中的中心氮原子还有一对孤电子对
D.15.2 g该物质含有6.02×1022个原子
4.用NA表示阿伏加德罗常数,则下列说法正确的是( )
A.1 mol NH3分子中含有3NA个σ键和4NA个sp3杂化轨道
B.1 mol CO2分子中含有2NA个σ键和2NA个sp2杂化轨道
C.1 mol C2H2分子中含有2NA个σ键、2NA个π键
D.1 mol C2H4分子中含有4NA个σ键、2NA个π键
5.化合物NH3与BF3可以通过配位键形成NH3·BF3(),下列说法正确的是( )
A.NH3与BF3都是三角锥形结构
B.NH3与BF3都是极性分子
C.NH3·BF3中N、B分别为sp3杂化、sp2杂化
D.NH3在水中溶解度大于BF3
6.已知HNO3、H2SO4的结构式如图所示。
下列说法不正确的是( )
A.NO、SO的立体构型分别为平面三角形、正四面体形
B.HNO3、H2SO4分子中N、S的杂化类型分别为sp2、sp3
C.等物质的量的NO、SO含σ键个数之比为2?3
D.HNO3、H2SO4都能与水分子形成分子间氢键
7.下列关于丙烯(CH3—CH===CH2)的说法错误的是( )
A.丙烯分子有8个σ键,1个π键
B.丙烯分子中3个碳原子都是sp3杂化
C.丙烯分子存在非极性键
D.丙烯分子中最多有7个原子在同一平面上
8.“冰面为什么滑?”,这与冰层表面的结构有关(如图)。下列有关说法错误的是( )
A.由于氢键的存在,水分子的稳定性好,高温下也很难分解
B.第一层固态冰中,水分子间通过氢键形成空间网状结构
C.第二层“准液体”中,水分子间形成氢键的机会比固态冰中少
D.当高于一定温度时,“准液体”中的水分子与下层冰连接的氢键断裂,产生“流动性的水分子”,使冰面变滑
9.在半导体生产及灭火剂的使用过程中,会向空气中逸散气体,如NF3、CHClFCF3、C3F8等。它们虽然是微量的,但有些却是强温室气体。下列推测不正确的是( )
A.NF3分子呈三角锥形
B.C3F8在CCl4中的溶解度比在水中的大
C.CHClFCF3存在手性异构
D.CHClFCF3中没有非极性键
10.某一化合物的分子式为AB2,A属第ⅥA族元素,B属第ⅦA族元素,A和B在同一周期,它们的电负性值分别为3.44和3.98,已知AB2分子的键角为103.3°。下列推断不正确的是( )
A.AB2分子的空间构型为“V”形
B.A-B键为极性共价键,AB2分子为非极性分子
C.AB2与H2O相比,AB2的熔点、沸点比H2O的低
D.AB2分子中无H原子,分子间不能形成氢键,而H2O分子间能形成氢键
11.下列图像正确的是( )
12.由短周期前10号元素组成的物质T和X,有如图所示的转化。X不稳定,易分解。下列有关说法正确的是( )
A.为使该转化成功进行,Y可以是酸性KMnO4溶液
B.等物质的量的T、X分子中含有π键的数目均为NA
C.X分子中含有的σ键个数是T分子中含有的σ键个数的2倍
D.T分子中只含有极性键,X分子中既含有极性键又含有非极性键
13.CO2 的资源化利用是解决温室效应的重要途径。以下是在一定条件下用 NH3捕获 CO2生成重要化工产品三聚氰胺的反应:3NH3+3CO2→+3H2O。下列说法正确的是( )
A.三聚氰胺中C、N、O 原子采用相同的杂化方式
B.三聚氰胺分子中既含极性键,又含非极性键
C.该反应的四种物质的分子均能形成氢键
D.除三聚氰胺外,其他三种物质的沸点由高到低顺序为:H2O>NH3>CO2
14.(多选)下列有关叙述正确的是( )
A.利用手性催化剂合成可只得到一种或主要得到一种手性分子
B.氢键是一种特殊化学键,它广泛地存在于自然界中
C.互为手性异构体的分子互为镜像,且分子组成相同,性质和用途也相同
D.由酸性FCH2COOH>CH3COOH,可知酸性ClCH2COOH>CH3COOH
15.短周期主族元素W、X、Y、Z的原子序数依次增大 ,W、X原子的最外层电子数之比为4?3,Z原子比X原子的核外电子数多4。下列说法正确的是( )
A.W、Y、Z的电负性大小顺序一定是Z>Y>W
B.Z的氢化物分子间存在氢键
C.Y、Z形成的分子的中心原子可能采取sp3杂化
D.WY2分子中σ键与π键的个数之比是2:1
16.第VA族元素的原子R与A原子结合形成RA3气态分子,其立体结构呈三角锥形。PCl5在气态和液态时,分子结构如下图所示,下列关于PCl5分子的说法中不正确的是( )
RCl5的分子结构
A.每个原子都达到8电子稳定结构
B.键角(Cl—R—Cl)有90°、120°、180°几种
C.RCl5受热后会分解生成分子立体结构呈三角锥形的RCl3
D.分子中5个R—Cl键键能不都相同
二、非选择题(本题包括5小题,共52分)
17.(10分)今有aX、bY、cZ三种元素。已知:①各原子序数a、b、c均小于20,且a+b+c=25;②元素Y的原子价电子构型为ns2npn+2;③X和Y在不同条件下可形成X2Y和X2Y2两种化合物,Y和Z在不同条件下可形成ZY和ZY2两种化合物;④Z的硫化物的相对分子质量与Z的氯化物的相对分子质量之比为38?77。
回答下列问题:
(1)Z的价电子排布图为________________。
(2)X2Y2的电子式为________,该晶体中含微粒间的作用有________。
(3)Y的最常见氢化物的VSEPR模型为________,其中Y原子以________杂化轨道成键;Z的氯化物的分子空间构型是________;根据原子轨道成键方式分,Z的硫化物分子中含有的键的种类及数目是________、________。
18.(10分)已知X、Y、Z、W四种元素是短周期元素,且原子序数依次增大。
相关信息
1 X、W同主族,Y、Z为同周期的相邻元素
2 W为地壳中含量最多的金属元素
3 Y基态原子最外层有3个未成对电子
4 Z原子最外层电子数是次外层电子数的3倍
试推断:
(1)X是制造超硬材料的元素之一,其基态原子核外电子排布式为________;
(2)由以上元素形成的气态氢化物中,溶于水显碱性的分子的空间构型为________,它的共价键属于________(填“极性”或“非极性”)键;
(3)写出W与Z形成的化合物与强碱反应的离子方程式:________________________;
(4)已知:
化学键 Y—Z Z===Z Y≡Y
键能(kJ/mol) 632 498 946
写出Y2(g)和Z2(g)生成YZ(g)的热化学方程式:__________________________。
19.(8分)根据下列数据回答问题:
化学键 Si—Si C—C C===C C≡C N—N N≡N P—P
键长(pm) 235 154 133 120 148 116 228
(1)试推测:C—Si键长范围为__________________、N===N键长范围为________________。
(2)试从键长的角度解释,为何C原子间能形成C===C、C≡C,N原子间也可形成N===N、N≡N,而Si和P均难形成稳定的Si===Si、Si≡Si、P===P、P≡P键?
________________________________________________________________________
________________________________________________________________________
(3)碳和硅的有关化学键键能如下表所示,简要分析和解释下列有关事实:
化学键 C—C C—H C—O Si—Si Si—H Si—O
键能 /kJ·mol-1 356 413 336 226 318 452
①硅与碳同族,也有系列氢化物,但硅烷在种类和数量上都远不如烷烃多,原因是________________________________________________________________________
________________________________________________________________________
________________________________________________________________________。
②SiH4的稳定性小于CH4,更易生成氧化物,原因是________________________________________________________________________
________________________________________________________________________
________________________________________________________________________。
20.(10分)(1)一定条件下,CH4、CO2都能与H2O形成笼状结构(如下图所示)的水合物晶体,其相关参数见下表。CH4与H2O形成的水合物晶体俗称“可燃冰”。
参数 分子 分子直径/nm 分子与H2O的结合能
E/kJ·mol-1
CH4 0.436 16.40
CO2 0.512 29.91
①“可燃冰”中分子间存在的两种作用力是________________________________________________________________________
________________________________________________________________________。
②为开采深海海底的“可燃冰”,有科学家提出用CO2置换CH4的设想。已知上图中笼状结构的空腔直径为0.586 nm,根据上述图表,从物质结构及性质的角度分析,该设想的依据是________________________________________________________________________
________________________________________________________________________
________________________________________________________________________。
(2)甲表示某种含氮有机化合物的结构,其分子内4个氮原子分别位于正四面体的4个顶点(见乙),分子内存在空腔,能嵌入某离子或分子并形成4个氢键予以识别。下列分子或离子中,能被该有机化合物识别的是________(填标号)。
a.CF4 b.CH4
c.NH d.H2O
(3)已知S4O的结构为,其中S原子的杂化方式是________。键长a________b(填“>”“<”或“=”)。分析并比较物质A:与B: 的沸点高低及其原因:________________________________________________________________________
________________________________________________________________________。
21.(14分)(1)下列各组物质性质的比较,结论正确的是________。
A.分子的极性:BCl3
C.物质的沸点:HF
(2)下列叙述正确的有________。
A.某元素原子核外电子总数是最外层电子数的5倍,则其最高正价为+7
B.钠元素的第一、第二电离能分别小于镁元素的第一、第二电离能
C.CH2Cl—COOH酸性大于CH3CH2COOH酸性
D.邻羟基苯甲醛的熔点低于对羟基苯甲醛的熔点
(3)磷酸根离子的空间构型为________,其中P的价层电子对数为________,杂化轨道类型为:________。
(4)苯胺()与甲苯()的相对分子质量相近,但苯胺的熔点(-5.9℃)、沸点(184.4℃)分别高于甲苯的熔点(-95.0℃)、沸点(110.6℃),原因是________________________________________________________________________。
(5)我国科学家最近成功合成了世界上首个五氮阴离子盐(N5)6(H3O)3(NH4)4Cl(用R代表)。经X-射线衍射测得化合物R的晶体结构,其局部结构如图所示。
①从结构角度分析,R中两种阳离子的相同之处为________,不同之处为________。(填标号)
A.中心原子的杂化轨道类型
B.中心原子的价层电子对数
C.立体结构
D.共价键类型
②R中阴离子N中的σ键总数为________个。
③图中虚线代表氢键,其表示式为(NH)N—H…Cl、________________________________、________________________________。
第二章 单元测试题
1.解析:稀有气体分子中不存在化学键,故B错误;σ键的相互重叠程度大于π键,所以σ键更稳定,C项错误;一般情况下π键不如σ键稳定,但也存在π键比σ键稳定的情况,故D错误。
答案:A
2.解析:NH中N原子采用sp3杂化,且孤电子对数为2,分子的立体构型为V形,A项错误;SO2中S原子的价层电子对数=σ键数+孤电子对数=2+×(6-2×2)=3,含孤电子对数为1,杂化轨道数为3,采取sp2杂化,结构为V形,B项错误;CO中,价层电子对数=3+×(4+2-3×2)=3,不含孤电子对,杂化轨道数为3,采取sp2杂化,立体构型为平面三角形,C项错误;C2H2中C原子采用sp杂化,且C原子的价电子均参与成键,所以分子的立体构型为直线形,D项正确。
答案:D
3.解析:
选项 具体分析 结论
A 分子中N、O间形成的共价键为不同元素原子之间形成的共价键,属于极性键 错误
B N(NO2)3的分子结构与NH3相似,分子中四个N原子构成三角锥形 错误
C 该分子中N—N—N键角都是108.1°,分子构型为三角锥形,中心氮原子还有一对孤电子对 正确
D 因为1个N(NO2)3分了含有10个原子,15.2 g该物质,即0.1 mol含有6.02×1023个原子 错误
答案:C
4.解析:CO2分子中碳原子是sp杂化,B项不正确;碳碳三键是由1个σ键和2个π键构成的,乙炔分子中含有1个碳碳三键和2个C—H键,所以C项不正确;碳碳双键是由1个σ键和1个π键构成的,乙烯分子中含有1个碳碳双键和4个C—H键,因此D项不正确,答案选A。
答案:A
5.解析:NH3是三角锥形,而BF3是平面三角形结构,B位于中心,因此,NH3是极性分子,BF3是非极性分子,A、B两项都错误;NH3·BF3中N、B均为sp3杂化,C项错误;NH3分子中有1对孤电子对,BF3中B原子最外层只有6个电子,正好有1个空轨道,二者通过配位键结合而使每个原子最外层都达到稳定结构,D项正确。
答案:D
6.解析:双键中含1个σ键,等物质的量的NO、SO含σ键个数之比为3:4。
答案:C
7.解析:丙烯(CH3—CH===CH2)中存在6个C—H σ键和2个C—C σ键,还有1个π键,则共有8个σ键,1个π键,A项正确;甲基中的C为sp3杂化,中的C为sp2杂化,丙烯中只有1个C原子为sp3杂化,B项错误;C、C之间形成的共价键为非极性键,则丙烯分子存在非极性键,C项正确;为平面结构,—CH3中最多有一个H原子在该平面上,故共有7个原子共平面,D正确。
答案:B
8.解析:水分子的稳定性好,是由水分子内氢氧共价键的键能决定的,与分子间形成的氢键无关,A错误;固态冰中,1个水分子与周围的4个水分子通过氢键相连接,从而形成空间网状结构,B正确;“准液体”中,水分子间的距离不完全相等,所以1个水分子与少于4个的水分子间距离适合形成氢键,形成氢键的机会比固态冰中少,C正确;当温度达到一定数值时,“准液体”中的水分子与下层冰连接的氢键被破坏,使一部分水分子能够自由流动,从而产生“流动性的水分子”,造成冰面变滑,D正确。
答案:A
9.解析:在NF3分子中,N原子上有1对孤对电子,有3个N—F键,类似NH3分子的结构,NF3分子中N原子采取sp3杂化,分子呈三角锥形,A项正确;有机物易溶于有机物,而水为无机物,故C3F8在CCl4中的溶解度比在水中的大,B项正确;若碳原子连有四个不同的基团,则该碳原子具有手性,故CHClFCF3存在手性异构,C项正确;CHClFCF3中存在C—C非极性键,D项错误。
答案:D
10.解析:根据A、B的电负性值,可判断A元素为O,B元素为F,该分子为OF2,由已知AB2分子的键角为103.3°可知OF2分子中键的极性不能抵消,为极性分子。
答案:B
11.解析:氟、氯、溴的原子半径依次增大,氢卤键键长增长,键能减小,A项错误;硒化氢的相对分子质量大于硫化氢,硒化氢的沸点高于硫化氢,B项错误;非金属元素原子与氢形成共价键,元素的非金属性越强,键的极性越强,C项正确;SiH4、NH3、H2O的中心原子价层电子对数均为4,但孤电子对数分别为0、1、2,故键角变小,D项错误。
答案:C
12.解析:由球棍模型可知,T为HCHO,X不稳定,易分解,则X为H2CO3,则Y为氧化剂,可以选择氧化性较强的酸性KMnO4溶液,A项正确;等物质的量并不一定是1 mol,B项错误;X分子中含有的σ键个数为5,T分子中含有的σ键个数为3,C项错误;T、X分子中均只含有极性键,无非极性键,D项错误。
答案:A
13.解析:三聚氰胺分子中C原子采用sp2杂化、N原子采用sp2杂化、氧原子则采用sp3杂化,三种原子杂化方式不同,故A错误;三聚氰胺分子中不存在同种元素之间形成的共价键,则分子内不含非极性键,只含极性键,故B错误;二氧化碳分子间不能形成氢键,C错误;由于H2O、NH3、CO2均为分子晶体,其中H2O、NH3分子间能形成氢键,所以H2O、NH3沸点高于二氧化碳,又由于水分子间氢键数目比氨气分子间的氢键数目多,所以水的沸点比氨气高,D正确。
答案:D
14.解析:利用手性催化剂可选择性生成手性分子,A项正确;氢键是一种分子间作用力,不是化学键,故B项错误;互为手性异构体的分子其结构不同,性质相似而不是相同,C项错误;由提示可知,F原子的存在使得酸性增强,故同族元素的Cl也有类似的作用,D项正确。
答案:AD
15.解析:由题意知,W为C,X为Al,Z为Cl,Y可能为Si、P、S。A项,若Y为Si,则C的电负性大于Si,错误;B项,HCl分子间不存在氢键,错误;C项,若Y为Si,则Y、Z形成的SiCl4为正四面体形分子,Si原子采取sp3杂化,正确;D项,若Y为S,则WY2为CS2的结构式为S===C===S,所含σ键、π键的个数相等,错误。
答案:C
16.解析:从RCl5的分子结构图可知键角正确;R—Cl有两类键长可知键能不完全相同;
RCl5 RCl3(三角锥形)+Cl2↑,则RCl5受热后会分解生成分子立体结构呈三角锥形的RCl3。
答案:A
17.解析:根据Y的价电子排布式确定Y的价电子排布式可能为2s22p4或3s23p6,为O元素或Cl元素;再结合Y与X能形成X2Y和X2Y2两种化合物,可确定Y、X分别为O和Na,根据原子序数之和为25,可确定Z为C。(1)C原子最外层有4个电子,根据泡利原理和洪特规则可写出其价电子排布图。
(2)X2Y2为Na2O2,该离子化合物中既含有离子键又含有非极性键。
(3)氧元素最常见的氢化物是H2O,中心原子O上有2个σ键电子对和2个孤电子对,其VSEPR构型为四面体形,中心原子采取sp3杂化;CCl4分子的空间构型为正四面体形,CS2的结构类似于CO2,该分子中含有2个C===S,即从原子轨道成键方式看,CS2分子中有2个σ键和2个π键。
答案:(1)
(2) 离子键和非极性键
(3)四面体形 sp3 正四面体 2个σ键 2个π键
18.答案:(1)1s22s22p1
(2)三角锥形 极性键
(3)Al2O3+2OH-===2AlO+H2O
(4)N2(g)+O2(g)===2NO(g)
ΔH=+180 kJ·mol
19.答案:(1)大于154,小于235 大于116小于148 (2)Si—Si、P—P 单键较长,p-p轨道肩并肩重叠程度很小或几乎不能重叠,难以形成π键 (3)①C—C键和C—H键较强,所以形成的烷烃较稳定,而硅烷中Si—Si键和Si—H键的键能较小,易断裂,导致长链硅烷难形成 ②C—H键的键能大于C—O键,C—H键比C—O键稳定,而Si—H键的键能小于Si—O键,所以,Si—H键不稳定而倾向于形成稳定性更强的Si—O键
20.解析:(1)①“可燃冰”中分子间存在的两种作用力是分子间作用力和氢键。②根据表格数据可知,笼状空腔的直径是0.586 nm,而CO2分子的直径是0.512 nm,笼状空腔直径大于CO2分子的直径,而且CO2与水分子之间的结合能大于CH4,因此可以实现用CO2置换CH4的设想。
(2)要能被该有机化合物识别,则应能与N原子形成氢键,则该微粒中应含有4个N—H或O—H或F—H键,可见只有c符合要求。
(3)S4O的结构中两边的S原子均形成4个σ键且无孤对电子,中间的两个S原子均形成两个单键,且均有两对孤对电子;原子间形成的共价键数目越大,键长就越短;A邻羟基苯磺酸能形成分子内氢键,B对羟基苯磺酸能形成分子间氢键,所以沸点B>A。
答案:(1)①氢键、范德华力 ②CO2的分子直径小于笼状空腔直径,且与H2O的结合能大于CH4
(2)c (3)sp3杂化 < B>A,因为B可以形成分子间氢键
21.解析:(1)BCl3是平面正三角形,分子中正负电中心重合,是非极性分子;而NCl3的N原子上有一对孤电子对,是三角锥形,分子中正负电中心不重合,是极性分子,所以分子极性:BCl3
(2)某元素原子核外电子总数是最外层电子数的5倍,此元素是Br,位于VⅡA族,最高正价为+7价,故A项正确;金属钠比镁活泼,容易失去电子,因此钠的第一电离能小于Mg的第一电离能,Na最外层只有一个电子,再失去一个电子,出现能层的变化,需要的能量增大,Mg最外层有2个电子,因此Na的第二电离能大于Mg的第二电离能,故B项错误;由于Cl电负性大于H,故酸性CH2Cl—COOH比CH3CH2COOH强,C正确。邻羟基苯甲醛形成分子内氢键,降低物质熔点,对羟基苯甲醛形成分子间氢键,增大物质熔点,因此邻羟基苯甲醛的熔点低于对羟基苯甲醛的熔点,故D项正确。
(3)PO中P的价层电子对数为4,故杂化方式为sp3杂化,空间构型为正四面体。
(4)苯胺比甲苯的熔沸点都高,苯胺中存在电负性较强的N所以可以形成氢键,因此比甲苯的熔沸点高。
(5)①根据图可知阳离子是NH和H3O+,NH中心原子是N,含有4个σ键,孤电子对数为(5-1-4×1)/2=0,价层电子对数为4,杂化类型为sp3,空间构型为正四面体形;H3O+中心原子是O,含有3个σ键,孤电子对数为(6-1-3)/2=1,价层电子对数为4,杂化类型为sp3,空间构型为三角锥形,因此相同之处为ABD,不同之处为C;②由图可知N中σ键总数为5个;
③根据图(b)还有的氢键是:(H3O+)O—H…N (NH)N—H…N。
答案:(1)AB (2)ACD (3)正四面体 4 sp3杂化 (4)苯胺分子之间存在氢键 (5)①ABD C ②5 ③(H3O+)O—H…N (NH)N—H…N
