九年级化学上册教学课题 1 质量守恒定律课件(29张PPT)
文档属性
| 名称 | 九年级化学上册教学课题 1 质量守恒定律课件(29张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 4.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-11-17 00:00:00 | ||
图片预览







文档简介
第五单元
课题1 质量守恒定律
通过情境探究与合作交流,培养学生的思考、动手、协作、反思以及定量研究问题的能力;
情感态度
价值观
过程与方法
知识与技能
认识质量守恒定律,并能了解质量守恒的微观实质;
培养学生实事求是的科学态度、勇于探索的科学精神和合作交流的集体意识;让学生学会研究问题的科学方法,同时激发学习兴趣,渗透唯物主义世界观。
学习目标
学习重点
知识重点
质量守恒定律的意义
能力重点
认识质量守恒定律的微观本质
引入
物质能不能
“无中生有,化为乌有”
物质是否会消无?
假如你是一位十八世纪的科学爱好者,你会赞成谁,你会如何研究和解释?
穿越视角
自主探究
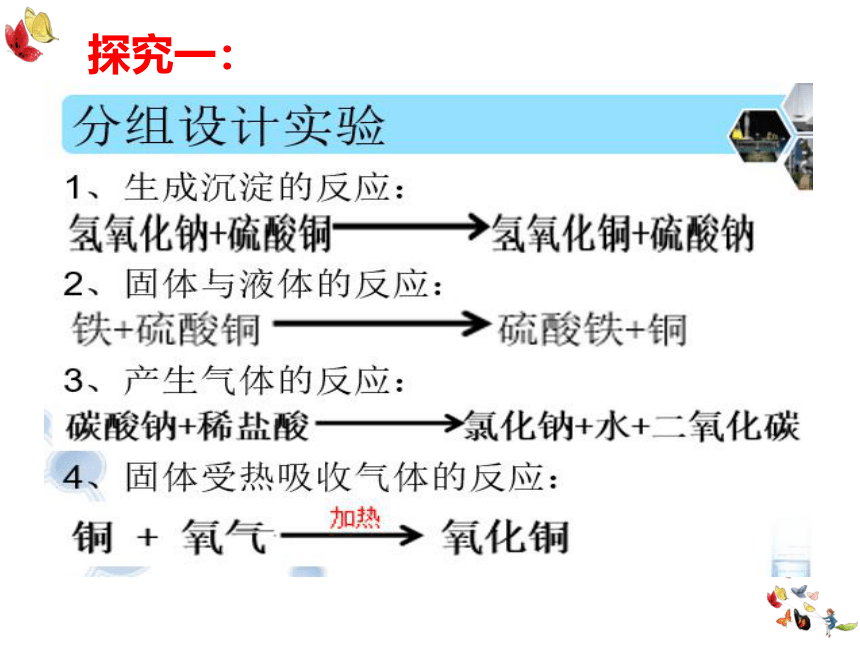
探究一:
★ 各小组实验主要的操作步骤
1. 调节托盘天平至平衡
2. 称量反应前物质的总质量
3. 使反应前的物质之间接触并发生反应
4. 称量反应后物质的总质量
(看指针是否偏转)
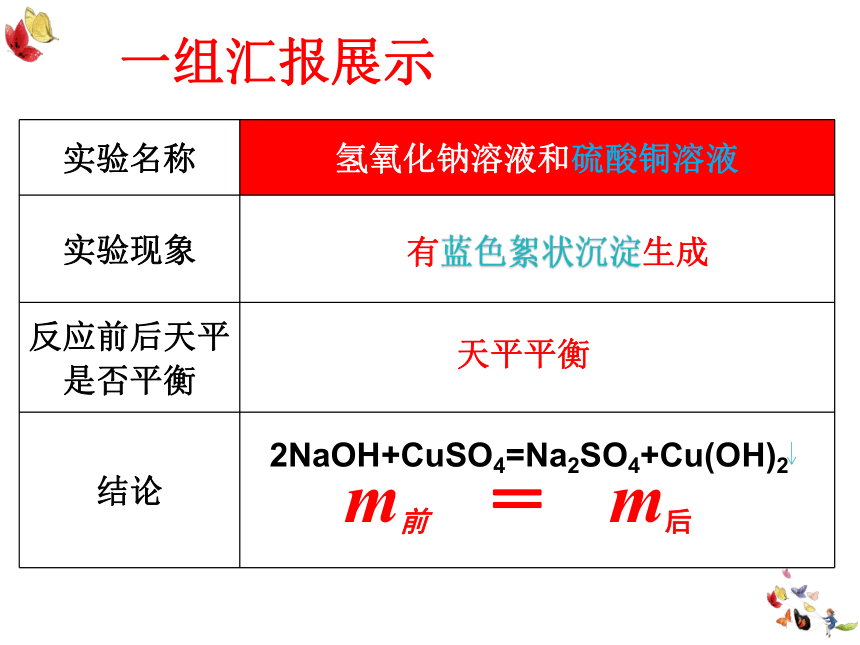
实验名称
氢氧化钠溶液和硫酸铜溶液
实验现象
反应前后天平是否平衡
结论
有蓝色絮状沉淀生成
天平平衡
m前 = m后
一组汇报展示
2NaOH+CuSO4=Na2SO4+Cu(OH)2
二组汇报展示
实验名称
铁和硫酸铜溶液
实验现象
反应前后天平是否平衡
结论
铁钉表面有一层红色物质,溶液由蓝色变成浅绿色
天平平衡
m前 = m后
Fe+CuSO4=FeSO4+Cu
三组汇报展示
实验名称
碳酸钠和稀盐酸溶液
实验现象
反应前后天平是否平衡
结论
有大量气泡产生
天平不平衡
Na2CO3 + 2 HCl = 2 NaCl+ H2O+CO2
?
m前 =? m后
四组汇报展示
实验名称
实验现象
红色变成
反应前后天平是否平衡
结论
铜的加热
红色变成黑色
天平不平衡
m前 =?m后
2Cu + O2 2 CuO
加热
质量总和
为什么没能得出结论?
借用
历史
突破
难点
注意:
验证质量守恒定律时,若有气体参与或者生成,一定要在密闭容器中进行。
探究二:
【数据分析】
锥形瓶(及细沙)
单孔橡皮塞
(连气球和玻璃管)
红磷
氧气
氮气、稀有气体等
反应前
锥形瓶(及细沙)
单孔橡皮塞
(连气球和玻璃管)
五氧化二磷
氮气、稀有气体等
【数据分析】
反应后
剩余的红磷
氧气
五氧化二磷
锥形瓶(及细沙)
单孔橡皮塞
(连气球和玻璃管)
氮气、稀有气体等
锥形瓶(及细沙)
单孔橡皮塞
(连气球和玻璃管)
氮气、稀有气体等
=
红磷
剩余的红磷
=
参加反应的红磷
反应前质量总和
反应后质量总和
剩余的红磷
=
19
氧 气
五氧化二磷
参加反应的红磷
参加反应的磷和氧气的质量总和
等于生成的五氧化二磷的质量。
P + O2 P2O5
点燃
【数据分析】
质量守恒定律:
参加化学反应的各物质的质量总和等于反应后生成的各物质的质量总和。这个规律就叫做质量守恒定律。
关键词1:“化学反应”(判断)
“1g水由气态变成液态质量不变,符合质量守恒定律”这种说法是否正确?为什么?
关键词2:“参加”
未参加化学反应的那部分物质的质量不计算在内。
(练习) 1、12克碳在32克氧气中燃烧,恰好完全反应后,生成二氧化碳 克;
2、若是12克碳在40克氧气中燃烧,完全反应后有8克氧气剩余,则生成二氧化碳 克
44
44
关键词3:“”
“总和”意味着把各种状态的反应物和生成物都算在内。如肉眼看不见的气体也应考虑。
关键词3:各、总和
提问讨论
深入微观
“质量为什么守恒?”“我们能不能从理论上进行推导,有没有办法证明?”
1、学生摆弄碳和氧气生成二氧化碳的模型
2、学生观察水分子分解的过程
思考、总结:
化学反应前后宏、微观的变化情况?
点燃
2H2O 2H2↑+O2↑
C + O2 CO2
通电
(独立思考)
(合作意识)
原子数目
原子质量
原子种类
微观
元素质量
元素种类
不 变
物质的种类
分子的种类
改变
宏观
可能
改变
分子数目
物质的总质量
归纳:在化学反应前后
1.有人说他能点石(主要成分CaCO3)成金(Au),他的说法是否有科学道理?
课堂检测:
8
课后作业
思考:
镁条燃烧,质量如何改变,如何解释?
动手:
自制装置检验碳酸钠和酸的反应符合质量守恒定律。
第五单元 课题1 质量守恒定律
在化学变化中:
理论推测
微观解释
宏观表现
质量守恒定律
m参加=m生成
实验验证
m前=m后
原子种类、数目和质量不变
板书设计
谢谢聆听,
请批评指正!
课题1 质量守恒定律
通过情境探究与合作交流,培养学生的思考、动手、协作、反思以及定量研究问题的能力;
情感态度
价值观
过程与方法
知识与技能
认识质量守恒定律,并能了解质量守恒的微观实质;
培养学生实事求是的科学态度、勇于探索的科学精神和合作交流的集体意识;让学生学会研究问题的科学方法,同时激发学习兴趣,渗透唯物主义世界观。
学习目标
学习重点
知识重点
质量守恒定律的意义
能力重点
认识质量守恒定律的微观本质
引入
物质能不能
“无中生有,化为乌有”
物质是否会消无?
假如你是一位十八世纪的科学爱好者,你会赞成谁,你会如何研究和解释?
穿越视角
自主探究
探究一:
★ 各小组实验主要的操作步骤
1. 调节托盘天平至平衡
2. 称量反应前物质的总质量
3. 使反应前的物质之间接触并发生反应
4. 称量反应后物质的总质量
(看指针是否偏转)
实验名称
氢氧化钠溶液和硫酸铜溶液
实验现象
反应前后天平是否平衡
结论
有蓝色絮状沉淀生成
天平平衡
m前 = m后
一组汇报展示
2NaOH+CuSO4=Na2SO4+Cu(OH)2
二组汇报展示
实验名称
铁和硫酸铜溶液
实验现象
反应前后天平是否平衡
结论
铁钉表面有一层红色物质,溶液由蓝色变成浅绿色
天平平衡
m前 = m后
Fe+CuSO4=FeSO4+Cu
三组汇报展示
实验名称
碳酸钠和稀盐酸溶液
实验现象
反应前后天平是否平衡
结论
有大量气泡产生
天平不平衡
Na2CO3 + 2 HCl = 2 NaCl+ H2O+CO2
?
m前 =? m后
四组汇报展示
实验名称
实验现象
红色变成
反应前后天平是否平衡
结论
铜的加热
红色变成黑色
天平不平衡
m前 =?m后
2Cu + O2 2 CuO
加热
质量总和
为什么没能得出结论?
借用
历史
突破
难点
注意:
验证质量守恒定律时,若有气体参与或者生成,一定要在密闭容器中进行。
探究二:
【数据分析】
锥形瓶(及细沙)
单孔橡皮塞
(连气球和玻璃管)
红磷
氧气
氮气、稀有气体等
反应前
锥形瓶(及细沙)
单孔橡皮塞
(连气球和玻璃管)
五氧化二磷
氮气、稀有气体等
【数据分析】
反应后
剩余的红磷
氧气
五氧化二磷
锥形瓶(及细沙)
单孔橡皮塞
(连气球和玻璃管)
氮气、稀有气体等
锥形瓶(及细沙)
单孔橡皮塞
(连气球和玻璃管)
氮气、稀有气体等
=
红磷
剩余的红磷
=
参加反应的红磷
反应前质量总和
反应后质量总和
剩余的红磷
=
19
氧 气
五氧化二磷
参加反应的红磷
参加反应的磷和氧气的质量总和
等于生成的五氧化二磷的质量。
P + O2 P2O5
点燃
【数据分析】
质量守恒定律:
参加化学反应的各物质的质量总和等于反应后生成的各物质的质量总和。这个规律就叫做质量守恒定律。
关键词1:“化学反应”(判断)
“1g水由气态变成液态质量不变,符合质量守恒定律”这种说法是否正确?为什么?
关键词2:“参加”
未参加化学反应的那部分物质的质量不计算在内。
(练习) 1、12克碳在32克氧气中燃烧,恰好完全反应后,生成二氧化碳 克;
2、若是12克碳在40克氧气中燃烧,完全反应后有8克氧气剩余,则生成二氧化碳 克
44
44
关键词3:“”
“总和”意味着把各种状态的反应物和生成物都算在内。如肉眼看不见的气体也应考虑。
关键词3:各、总和
提问讨论
深入微观
“质量为什么守恒?”“我们能不能从理论上进行推导,有没有办法证明?”
1、学生摆弄碳和氧气生成二氧化碳的模型
2、学生观察水分子分解的过程
思考、总结:
化学反应前后宏、微观的变化情况?
点燃
2H2O 2H2↑+O2↑
C + O2 CO2
通电
(独立思考)
(合作意识)
原子数目
原子质量
原子种类
微观
元素质量
元素种类
不 变
物质的种类
分子的种类
改变
宏观
可能
改变
分子数目
物质的总质量
归纳:在化学反应前后
1.有人说他能点石(主要成分CaCO3)成金(Au),他的说法是否有科学道理?
课堂检测:
8
课后作业
思考:
镁条燃烧,质量如何改变,如何解释?
动手:
自制装置检验碳酸钠和酸的反应符合质量守恒定律。
第五单元 课题1 质量守恒定律
在化学变化中:
理论推测
微观解释
宏观表现
质量守恒定律
m参加=m生成
实验验证
m前=m后
原子种类、数目和质量不变
板书设计
谢谢聆听,
请批评指正!
同课章节目录
- 绪言 化学使世界变得更加绚丽多彩
- 第一单元 走进化学世界
- 课题1 物质的变化和性质
- 课题2 化学是一门以实验为基础的科学
- 课题3 走进化学实验室
- 第二单元 我们周围的空气
- 课题1 空气
- 课题2 氧气
- 课题3 制取氧气
- 实验活动1 氧气的实验室制取与性质
- 第三单元 物质构成的奥秘
- 课题1 分子和原子
- 课题2 原子的结构
- 课题3 元素
- 第四单元 自然界的水
- 课题1 爱护水资源
- 课题2 水的净化
- 课题3 水的组成
- 课题4 化学式与化合价
- 第五单元 化学方程式
- 课题 1 质量守恒定律
- 课题 2 如何正确书写化学方程式
- 课题 3 利用化学方程式的简单计算
- 第六单元 碳和碳的氧化物
- 课题1 金刚石、石墨和C60
- 课题2 二氧化碳制取的研究
- 课题3 二氧化碳和一氧化碳
- 实验活动2 二氧化碳的实验室制取与性质
- 第七单元 燃料及其利用
- 课题 1 燃烧和灭火
- 课题2 燃料的合理利用与开发
- 实验活动 3 燃烧的条件
