沪教版九上化学 3.1.2 原子 课件 (16张PPT)
文档属性
| 名称 | 沪教版九上化学 3.1.2 原子 课件 (16张PPT) |  | |
| 格式 | ppt | ||
| 文件大小 | 1.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 沪教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-11-17 22:31:05 | ||
图片预览




文档简介
复习提问
1.常见的物质中由分子和原子直接
构成的物质有哪些呢?
2.在化学变化中,分子和原子有什么
区别呢?
原子还可以再分吗?
原子究竟是什么样子呢?
今天,咱们就来畅游原子的世界!
【情景激活】
英国化学家
道尔顿
英国物理学家
汤姆生
英国科学家
卢瑟福
英国物理学家 查德维克
1803年
实心球模型
1918-1932年 发现质子中子
1897年
枣糕模型
1911年
行星式有核模型
一、原子的构成
原子核
高速
运动
的电子
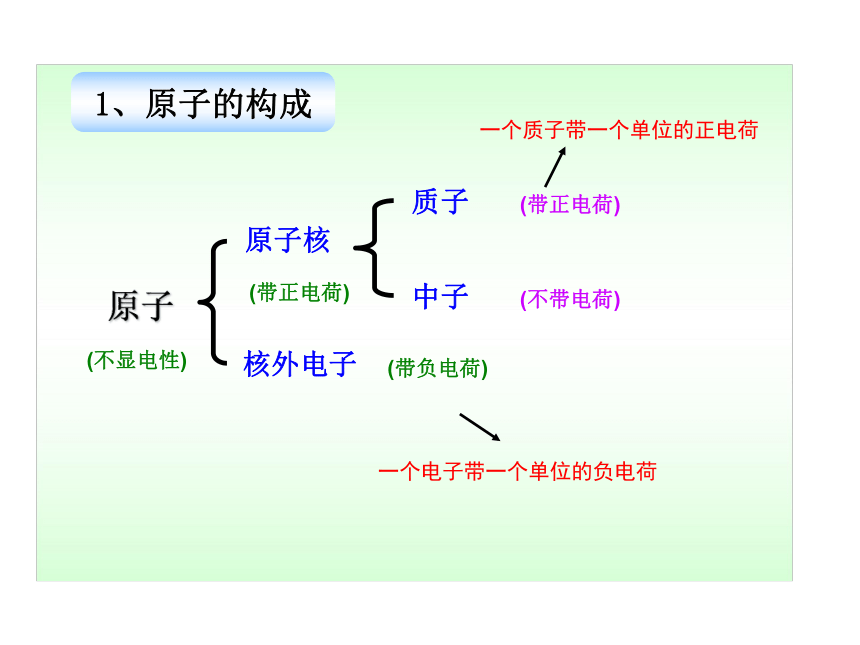
原子
原子核
核外电子
质子
中子
1、原子的构成
(不显电性)
(带正电荷)
(带负电荷)
(带正电荷)
(不带电荷)
一个质子带一个单位的正电荷
一个电子带一个单位的负电荷
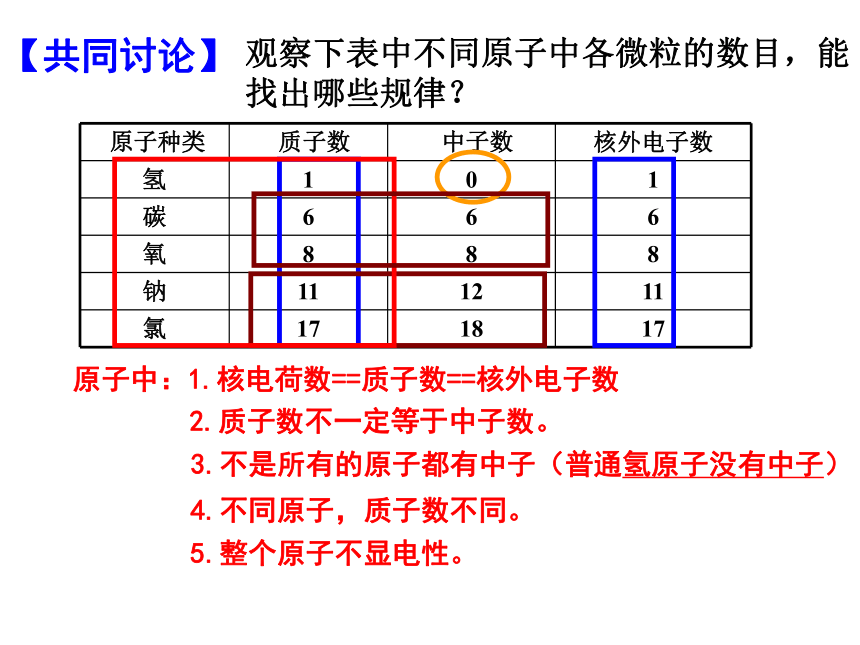
原子种类
质子数
中子数
核外电子数
氢
1
0
1
碳
6
6
6
氧
8
8
8
钠
11
12
11
氯
17
18
17
观察下表中不同原子中各微粒的数目,能找出哪些规律?
原子中:1.核电荷数==质子数==核外电子数
3.不是所有的原子都有中子(普通氢原子没有中子)
4.不同原子,质子数不同。
2.质子数不一定等于中子数。
5.整个原子不显电性。
【共同讨论】
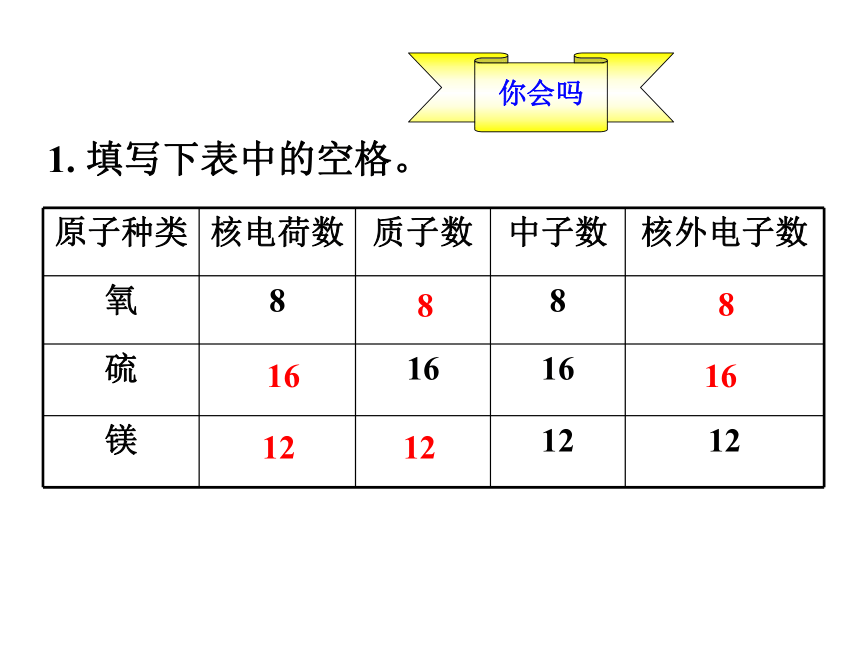
原子种类
核电荷数
质子数
中子数
核外电子数
氧
8
8
硫
16
16
镁
12
12
1. 填写下表中的空格。
8
8
16
16
12
12
你会吗
2、原子结构中,下列等式成立的是( )
①中子数=质子数 ②核电荷数=电子数
③质子数=电子数 ④核电荷数=中子数
A、①②④ B、①③ C、②③ D、①②③
C
3、原子结构中一定含有的微粒是( )
A、质子、中子、电子 B、质子、电子
C、质子、中子 D、中子、电子
B
你会吗
第一层
第二层
第三层
钠原子的结构
(11个电子)
二.原子核外电子的排布
1. 核外电子的分层排布
1 2 3 4 5 6 7
能量低的在离核近的区域运动,
能量高的在离核远的区域运动。
核外电子分层排布规律
近 远
低 高
核外电子分层排布示意图
电子层:
离 核:
能 量:
第一层(2个)
第二层(8个)
第三层(1个)
(最外层)
钠原子的结构
(11个电子)
+11
2. 原子结构示意图:
电子层
原子核
质子数
各电子层上的电子数
圆圈表示
圈内数字表示
弧线表示
原子核带正电
“+”表示
最外层电子数
数字1可以表示
2 8 1
弧线上的数字表示
第一层
第二层
第三层(最外层)
4. 某原子的原子结构示意图为 ,该原子的
核电荷数为 ,核外有 个电子层,第二层上
有 个电子,最外电子层上有 个电子。
13
3
8
3
⑴第一层最多容纳___个电子,第二层最多容纳___个电子。
2
(2)最外层不超过 个电子,只有1层的不超过___个电子。
8
8
⑶电子先排满第___层,再排第___层,排满第___层,再排第___层。(按照能量由低到高的顺序分层排布)
2
3
2
3. 核外电子的排布规律:
1
2
6. 下列原子结构示意图书写正确的是( )
A B C D
+3
3
2
6
4
2
+14
7
5
2
+10
8
C
5.请写出氧,镁,氯的原子结构示意图?
1.常见的物质中由分子和原子直接
构成的物质有哪些呢?
2.在化学变化中,分子和原子有什么
区别呢?
原子还可以再分吗?
原子究竟是什么样子呢?
今天,咱们就来畅游原子的世界!
【情景激活】
英国化学家
道尔顿
英国物理学家
汤姆生
英国科学家
卢瑟福
英国物理学家 查德维克
1803年
实心球模型
1918-1932年 发现质子中子
1897年
枣糕模型
1911年
行星式有核模型
一、原子的构成
原子核
高速
运动
的电子
原子
原子核
核外电子
质子
中子
1、原子的构成
(不显电性)
(带正电荷)
(带负电荷)
(带正电荷)
(不带电荷)
一个质子带一个单位的正电荷
一个电子带一个单位的负电荷
原子种类
质子数
中子数
核外电子数
氢
1
0
1
碳
6
6
6
氧
8
8
8
钠
11
12
11
氯
17
18
17
观察下表中不同原子中各微粒的数目,能找出哪些规律?
原子中:1.核电荷数==质子数==核外电子数
3.不是所有的原子都有中子(普通氢原子没有中子)
4.不同原子,质子数不同。
2.质子数不一定等于中子数。
5.整个原子不显电性。
【共同讨论】
原子种类
核电荷数
质子数
中子数
核外电子数
氧
8
8
硫
16
16
镁
12
12
1. 填写下表中的空格。
8
8
16
16
12
12
你会吗
2、原子结构中,下列等式成立的是( )
①中子数=质子数 ②核电荷数=电子数
③质子数=电子数 ④核电荷数=中子数
A、①②④ B、①③ C、②③ D、①②③
C
3、原子结构中一定含有的微粒是( )
A、质子、中子、电子 B、质子、电子
C、质子、中子 D、中子、电子
B
你会吗
第一层
第二层
第三层
钠原子的结构
(11个电子)
二.原子核外电子的排布
1. 核外电子的分层排布
1 2 3 4 5 6 7
能量低的在离核近的区域运动,
能量高的在离核远的区域运动。
核外电子分层排布规律
近 远
低 高
核外电子分层排布示意图
电子层:
离 核:
能 量:
第一层(2个)
第二层(8个)
第三层(1个)
(最外层)
钠原子的结构
(11个电子)
+11
2. 原子结构示意图:
电子层
原子核
质子数
各电子层上的电子数
圆圈表示
圈内数字表示
弧线表示
原子核带正电
“+”表示
最外层电子数
数字1可以表示
2 8 1
弧线上的数字表示
第一层
第二层
第三层(最外层)
4. 某原子的原子结构示意图为 ,该原子的
核电荷数为 ,核外有 个电子层,第二层上
有 个电子,最外电子层上有 个电子。
13
3
8
3
⑴第一层最多容纳___个电子,第二层最多容纳___个电子。
2
(2)最外层不超过 个电子,只有1层的不超过___个电子。
8
8
⑶电子先排满第___层,再排第___层,排满第___层,再排第___层。(按照能量由低到高的顺序分层排布)
2
3
2
3. 核外电子的排布规律:
1
2
6. 下列原子结构示意图书写正确的是( )
A B C D
+3
3
2
6
4
2
+14
7
5
2
+10
8
C
5.请写出氧,镁,氯的原子结构示意图?
同课章节目录
- 第1章 开启化学之门
- 第1节 化学给我们带来什么
- 第2节 化学研究些什么
- 第3节 怎样学习和研究化学
- 第2章 身边的化学物质
- 第1节 性质活泼的氧气
- 第2节 奇妙的二氧化碳
- 第3节 自然界中的水
- 基础实验1 氧气的制取与性质
- 基础实验2 二氧化碳的制取与性质
- 第3章 物质构成的奥秘
- 第1节 构成物质的基本微粒
- 第2节 组成物质的化学元素
- 第3节 物质的组成
- 第4章 认识化学变化
- 第1节 常见的化学反应——燃烧
- 第2节 化学反应中的质量关系
- 第3节 化学方程式的书写与运用
- 基础实验3 物质燃烧的条件
- 第5章 金属的冶炼与利用
- 第1节 金属的性质和利用
- 第2节 金属矿物 铁的冶炼
- 第3节 金属防护和废金属回收
- 基础实验4 常见金属的性质
