2020-2021学年北京市丰台区高三(上)期中化学试卷 含答案解析
文档属性
| 名称 | 2020-2021学年北京市丰台区高三(上)期中化学试卷 含答案解析 |  | |
| 格式 | zip | ||
| 文件大小 | 514.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-11-19 16:11:54 | ||
图片预览


文档简介
2020-2021学年北京市丰台区高三(上)期中化学试卷
一、下列各题的四个选项中,只有一个选项符合题意。(每小题3分,共42分)
1.用于制备下列物质的材料中,主要成分不属于有机高分子的是( )
A.有机玻璃
B.橡胶
C.聚丙烯
D.铜
A.A
B.B
C.C
D.D
2.下列应用不涉及氧化还原反应的是( )
A.用硫磺为原料制备硫酸
B.用合成氨实现人工固氮
C.用NaHCO3治疗胃酸过多
D.电解饱和食盐水制备NaOH
3.下列物质的应用中,利用了物质氧化性的是( )
A.氨﹣﹣作制冷剂
B.漂粉精﹣﹣作游泳池消毒剂
C.甘油﹣﹣作护肤保湿剂
D.二氧化硫﹣﹣作红酒添加剂
4.已知8838Sr位于IIA族,下列有关Sr的说法不正确的是( )
A.8838Sr的中子数为38
B.最高化合价为+2
C.原子半径:Sr>Ca
D.氢氧化物为强碱
5.反应2Na2O2+2H2O═4NaOH+O2↑,是潜艇中氧气来源之一。用NA表示阿伏加德罗常数,下列说法正确的是( )
A.22.4L
O2含2NA个氧原子
B.1.8g
H2O含有的质子数为NA
C.反应中每生成1mol
O2转移4mol电子
D.4g
NaOH溶于100mL水中,所得溶液的物质的量浓度为1mol/L
6.下列解释事实的方程式正确的是( )
A.钢铁发生吸氧腐蚀,负极反应为:Fe﹣3e﹣═Fe3+
B.用浓硝酸除去试管内壁上附着的铜:3Cu+8H++2NO3﹣═3Cu2++2NO↑+4H2O
C.酸性条件下,用H2O2将I﹣转化为I2:H2O2+2I﹣═I2+2OH﹣
D.利用明矾做混凝剂净水:Al3++3H2O?Al(OH)3+3H+
7.关于一定条件下的化学平衡:H2(g)+I2(g)?2HI(g)△H<0。下列说法正确的是( )
A.恒温恒容时充入H2,正反应速率增大,平衡右移
B.恒温恒容时充入He,正反应速率增大,平衡右移
C.压缩体积加压,正、逆反应速率不变,平衡不移动
D.升温,正反应速率减小、逆反应速率增大,平衡右移
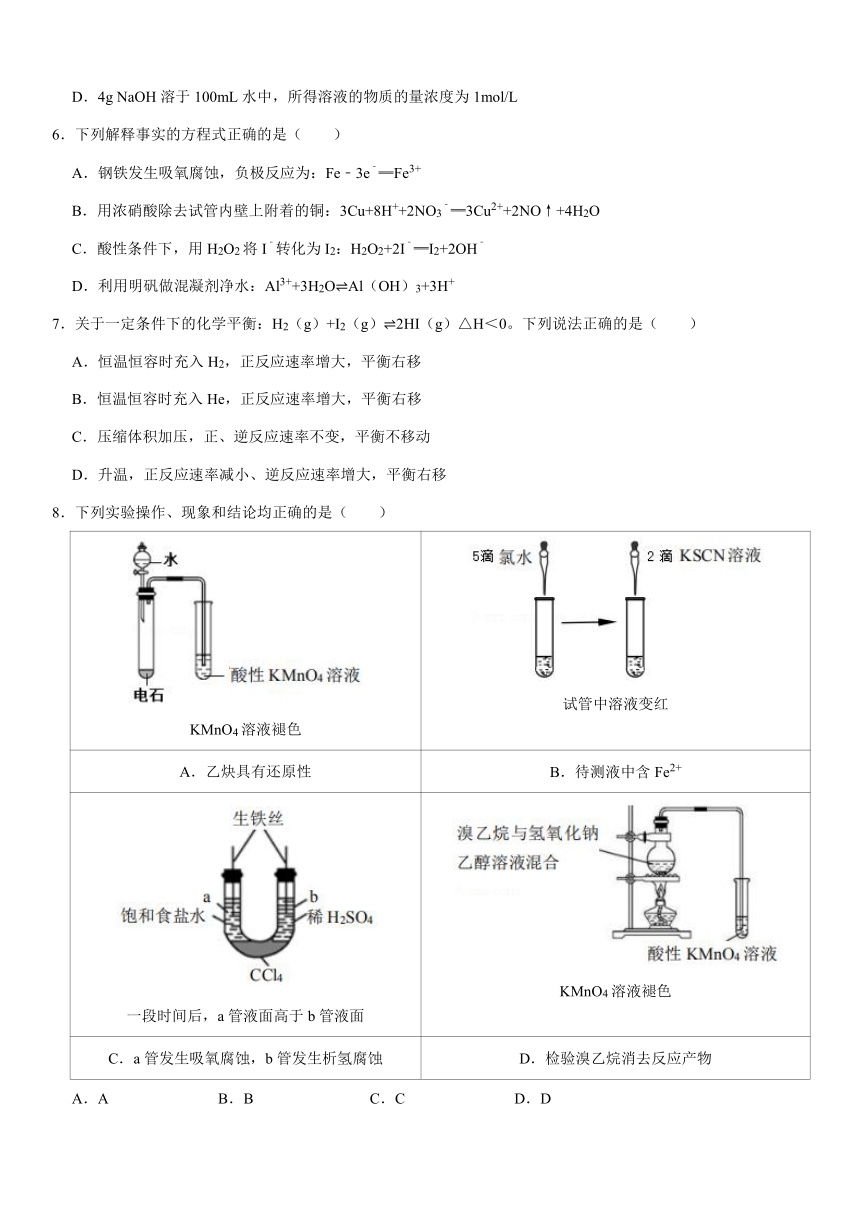
8.下列实验操作、现象和结论均正确的是( )
KMnO4溶液褪色
试管中溶液变红
A.乙炔具有还原性
B.待测液中含Fe2+
一段时间后,a管液面高于b管液面
KMnO4溶液褪色
C.a管发生吸氧腐蚀,b管发生析氢腐蚀
D.检验溴乙烷消去反应产物
A.A
B.B
C.C
D.D
9.氮及其化合物的转化过程如图所示。下列分析合理的是( )
A.催化剂a、b能提高反应的平衡转化率
B.在催化剂b表面形成氮氧键时不涉及电子转移
C.催化剂a表面发生了非极性共价键的断裂和极性共价键的形成
D.如果向容器中放入1mol
N2和3mol
H2,最终可以生成2mol
NH3
10.已知化学反应A2(g)+B2(g)═2AB(g)的能量变化如图所示,判断下列叙述中正确的是( )
A.该反应热△H=+(a﹣b)
kJ?mol﹣1
B.每生成2mol
AB(g)吸收b
kJ
C.该反应中反应物的总能量高于生成物的总能量
D.断裂1mol
A﹣A和1mol
B﹣B键,放出a
kJ能量
11.有机物分子中原子间(或原子与原子团间)的相互影响会导致物质化学性质的不同。下列事实不能说明上述观点的是( )
A.苯酚能跟NaOH溶液反应,乙醇不能与NaOH溶液反应
B.乙烯能与溴水发生加成反应,而乙烷不能与溴水发生加成反应
C.苯与硝酸在50﹣60℃发生取代反应,甲苯与硝酸在30℃就能发生取代反应
D.甲苯能使酸性
KMnO4
溶液褪色,而甲基环己烷不能使酸性
KMnO4
溶液褪色
12.25℃时,下列有关电解质溶液的说法正确的是( )
A.加水稀释0.1mol/L氨水,溶液中c(H+)?c(OH﹣)和均不变
B.配制Fe(NO3)2溶液时,为了防止Fe2+水解可向溶液中加入适量的稀硝酸
C.向盐酸中滴加氨水至溶液呈中性,所得溶液中c(NH4+)=c(Cl﹣)
D.向CH3COOH溶液中加入少量CH3COONa固体,溶液的pH降低
13.中国科学院上海有机化学研究所人工合成青蒿素,其部分合成路线如图,下列说法正确的是( )
A.“乙→丙”发生了消去反应
B.香茅醛不存在顺反异构现象
C.甲分子遇浓溴水产生白色沉淀
D.香茅醛能与1mol氢气发生加成反应
14.室温下,某兴趣小组用如图装置在通风橱中进行如下实验:下列说法正确的是( )
实验
现象
试管Ⅰ中开始无明显现象,逐渐有微小气泡生成,越来越剧烈,液面上方出现浅红棕色气体,溶液呈蓝色。
试管Ⅱ中剧烈反应,迅速生成大量红棕色气体,溶液呈绿色;之后向绿色溶液中持续通入N2,溶液变为蓝色。
A.试管Ⅰ中浅红棕色气体为NO2,由硝酸还原生成
B.等质量的Cu完全溶解时,Ⅱ中消耗的HNO3更多
C.换成Fe之后重复实验,依然是试管Ⅱ中反应更剧烈
D.试管Ⅱ中反应后溶液颜色与试管Ⅰ中的不同,是由于溶有NO2
二、非选择题(共5小题,满分58分)
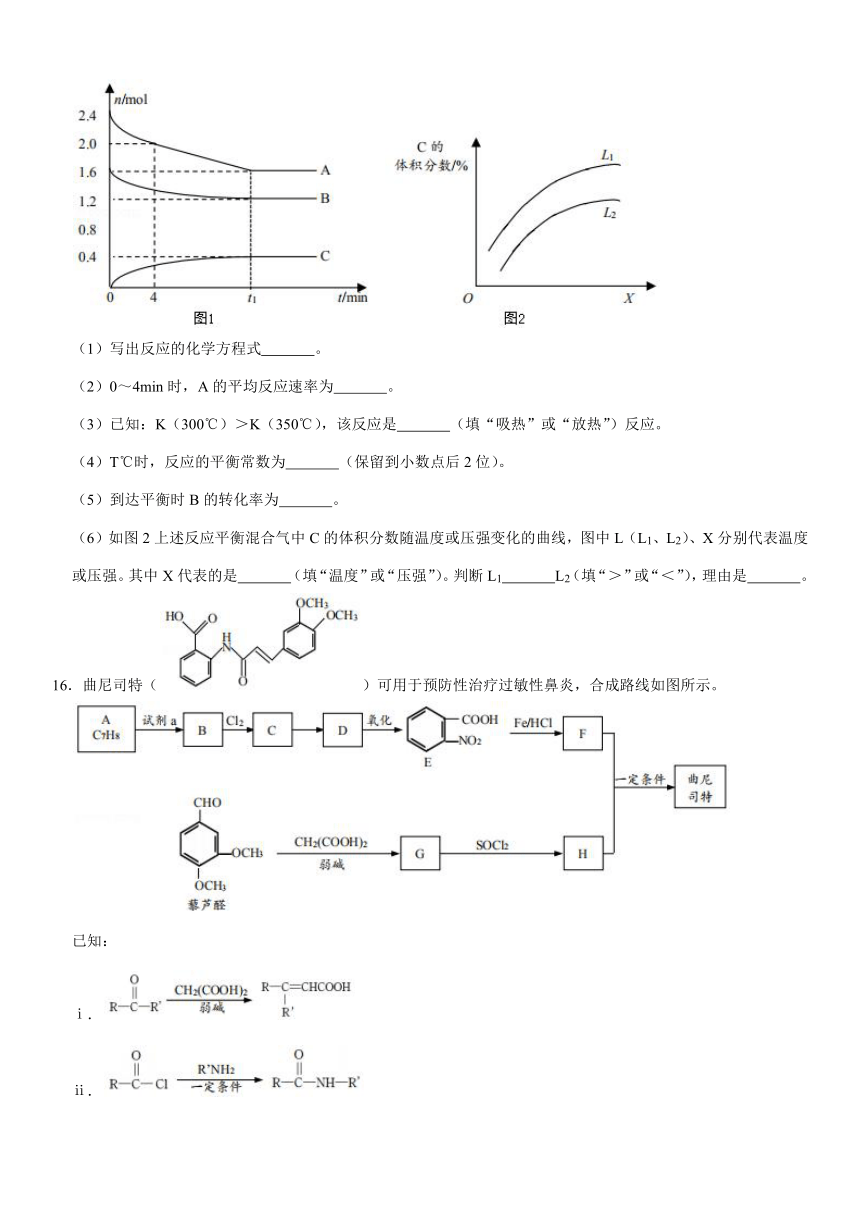
15.T℃时,在一个体积为2L的容器中,A气体与B气体反应生成C气体,反应过程中A、B、C的变化如图1。
(1)写出反应的化学方程式
。
(2)0~4min时,A的平均反应速率为
。
(3)已知:K(300℃)>K(350℃),该反应是
(填“吸热”或“放热”)反应。
(4)T℃时,反应的平衡常数为
(保留到小数点后2位)。
(5)到达平衡时B的转化率为
。
(6)如图2上述反应平衡混合气中C的体积分数随温度或压强变化的曲线,图中L(L1、L2)、X分别代表温度或压强。其中X代表的是
(填“温度”或“压强”)。判断L1
L2(填“>”或“<”),理由是
。
16.曲尼司特()可用于预防性治疗过敏性鼻炎,合成路线如图所示。
已知:
ⅰ.
ⅱ.
(1)E分子中的含氧官能团名称是
。
(2)试剂a是
。
(3)C→D的反应方程式为
。
(4)写出一定条件下用F制备高分子的反应方程式
。
(5)H具有顺反异构,写出H的顺式异构体的结构简式
。
(6)H是重要的有机合成中间体,以H为原料合成伊曲茶碱的路线如图。
K的结构简式为
。中间产物的结构简式为
。
17.减少CO2的排放,合理利用CO2使其资源化具有重要意义。
(1)CO2和H2在一定条件下反应生成甲醇等产物,工业上利用该反应合成甲醇。
已知:25℃,101KPa下:
H2(g)+O2(g)═H2O(g)△H1=﹣242kJ/mol
CH3OH(g)+O2(g)═CO2(g)+2H2O(g)△H2=﹣676kJ/mol
①写出CO2和H2生成气态甲醇等产物的热化学方程式
。
②下面表示合成甲醇反应的能量变化示意图,正确的是
(填字母)。
③工业上用合成得到的甲醇制成微生物燃料电池,结构示意图如图1。
该电池外电路电子的流动方向为
(填写“从A到B”或“从B到A”)。A电极附近甲醇发生的电极反应式为
。
(2)工业上常用高浓度的K2CO3溶液吸收CO2,得溶液X,再利用电解法使K2CO3溶液再生,其装置示意图如图2。
①写出X的化学式
。
②在阳极区发生的反应为:
和H++HCO3﹣═H2O+CO2↑。
③简述K2CO3在阴极区再生的原理
。
18.某研究小组探究饮用水中铁锰的来源和去除原理。
Ⅰ.铁锰来源
某地区地下水铁锰含量和国家标准对比
某些地区地下水常见微粒含量(mg/L)
国家饮用水标准(mg/L)
Fe2+
Mn2+
HCO3﹣
CO2
Fe2+
Mn2+
pH
4~20
0.4~3
1~1.5
30~70
0.3
0.1
6.5~8.5
(1)利用FeCO3溶解度计算溶出的Fe2+为1.1mg/L,依据如表数据结合平衡移动原理解释地下水中Fe2+含量远大于1.1mg/L的原因
。
Ⅱ.去除原理
(2)自然氧化法:
①曝气池中使水呈“沸腾”状的作用
。
②补全曝气池中氧化Fe2+时发生反应的离子方程式:
Fe2++
O2+
H2O═
Fe(OH)3+
。
此方法铁去除时间长,锰去除率低。
(3)药剂氧化法:工业上可以采用强氧化剂(ClO2、液氯、双氧水等),直接氧化Fe2+、Mn2+生成Fe(OH)3和MnO2除去。某实验中pH=6.5时,Fe2+、Mn2+浓度随ClO2投加量的变化曲线如图。
①ClO2投加量小于1.2mg/L时,可以得出Fe2+、Mn2+性质差异的结论是
。
②分析图中数据ClO2氧化Mn2+是可逆反应。写出反应的离子方程式
。
③写出两种提高锰去除率的方法
。
19.实验小组对Cr(Ⅲ)与过氧化氢反应的影响因素进行了探究,实验过程如下:
实验1:探究pH对Cr(Ⅲ)与过氧化氢反应的影响
①室温下,加酸或碱调节0.1mol/L
Cr2(SO4)3溶液pH分别为2.00、4.10、6.75、8.43、10.03、13.37。
②各取5mL上述溶液分置于6支试管中,分别向其中逐滴加入30%
H2O2溶液,直至溶液不再发生变化,观察并记录现象。
试管
①
②
③
④
⑤
⑥
pH
2.00
4.10
6.75
8.43
10.03
13.37
起始现象
墨绿色溶液
墨绿色溶液
蓝色浑浊液
蓝色浑浊液
蓝色浑浊液
亮绿色溶液
终点现象
墨绿色
墨绿色
黄绿色
亮黄色
橙红色
砖红色
查阅资料:
①Cr3+为绿色,CrO2﹣为亮绿色,CrO42﹣为黄色。
②Cr3+较稳定,需用较强氧化剂才能将其氧化;CrO2﹣在碱性溶液中是较强的还原剂。
(1)Cr(OH)3为蓝色固体。写出⑤中生成蓝色沉淀的离子方程式
。
(2)试管①②中溶液未发生明显变化,可能的原因是
。
(3)④中沉淀溶解,溶液变为亮黄色,可能发生反应的离子方程式是
。
(4)Cr(OH)3与Al(OH)3类似,具有两性。存在如下关系:Cr3++3OH﹣?Cr(OH)3?CrO2﹣+H++H2O。解释随着溶液pH升高,终点溶液颜色变化的原因
。
实验2:探究温度对Cr(Ⅲ)与过氧化氢反应的影响
各取5mL
pH=13.50
Cr2(SO4)3溶液分置于5支试管中,将其分别置于0℃、25℃、50℃、75℃、100℃的水浴中,然后向试管中各滴加过量30%
H2O2溶液,观察并记录实验现象:
反应温度
0℃
25℃
50℃
75℃
100℃
起始现象
墨绿色
终点现象
红棕色
砖红色
橙红色
亮黄色
亮黄色
(5)随着反应温度的升高,反应后溶液颜色由红棕色向亮黄色转变,是因为生成的红色物质CrO83﹣(Cr为+5价)不稳定,自身发生氧化还原反应,随着温度升高会逐渐转化为亮黄色的CrO42﹣,同时生成氧气。写出反应的离子方程式
。
(6)反应物浓度也是影响反应的因素之一。请利用实验1给出的试剂,设计实验进行验证
。
(7)综上所述,Cr(Ⅲ)与过氧化氢的反应产物与
密切相关。
2020-2021学年北京市丰台区高三(上)期中化学试卷
参考答案与试题解析
一、下列各题的四个选项中,只有一个选项符合题意。(每小题3分,共42分)
1.【答案】D
【解答】解:A.有机玻璃的成分是聚甲基丙烯酸甲酯,为有机高分子化合物,故A不选;
B.汽车轮胎主要成分为橡胶,为常见的有机高分子化合物,故B不选;
C.聚丙烯是由丙烯经过加聚反应生成的,属于有机高分子,故C不选;
D.铜是金属材料,不属于高分子化合物,故D选;
故选:D。
2.【答案】C
【解答】解:A.用硫磺为原料制备硫酸,该反应中S元素化合价变化,属于氧化还原反应,故A不选;
B.用合成氨实现人工固氮,该反应中N元素化合价发生变化,所以属于氧化还原反应,故B不选;
C.用NaHCO3治疗胃酸过多,碳酸氢钠与HCl发生复分解反应,没有元素化合价的变化,不属于氧化还原反应,故C选;
D.电解饱和食盐水制备NaOH,该反应中H、Cl元素化合价发生变化,所以属于氧化还原反应,故D不选;
故选:C。
3.【答案】B
【解答】解:A.液氨气化吸热,所以用作制冷剂,该过程中没有元素化合价变化,所以为非氧化还原反应,故A错误;
B.漂粉精具有强氧化性,利用其强氧化性作游泳池消毒剂,故B正确;
C.甘油作护肤保湿剂,是利用的其物理性质,没有元素化合价的变化,所以为非氧化还原反应,故C错误;
D.二氧化硫具有还原性,作红酒添加剂可以防止红酒中的营养物质被氧化,所以利用了二氧化硫的还原性,故D错误;
故选:B。
4.【答案】A
【解答】解:A.8838Sr的中子数为88﹣38=50,故A错误;
B.位于IIA族,可知最外层有2个电子,则最高化合价为+2,故B正确;
C.同主族从上到下原子半径增大,则原子半径:Sr>Ca,故C正确;
D.同主族从上到下金属性增强,金属性越强,对应碱的碱性越强,则氢氧化物为强碱,故D正确;
故选:A。
5.【答案】B
【解答】解:A.22.4LO2没有说明是在标况下,无法计算O2的物质的量,故A错误;
B.1.8gH2O的物质的量为:=0.1mol,每个H2O分子中有10个质子,则1.8gH2O中含有1mol质子,含有的质子数为NA,故B正确;
C.对于反应2Na2O2+2H2O=4NaOH+O2↑,Na2O2中﹣1价的O歧化为0价和﹣2价,则每生成1molO2转移2mol电子,故C错误;
D.先计算NaOH的物质的量n===0.1mol,C===1mol/L,注意体积为溶液的体积,但题目是溶于100mL水时,无法进行计算,故D错误;
故选:B。
6.【答案】D
【解答】解:A.钢铁发生吸氧腐蚀,负极反应为:Fe﹣2e﹣═Fe2+,故A错误;
B.用浓硝酸除去试管内壁上附着的铜,离子方程式:Cu+4H++2NO3﹣═3Cu2++2NO2↑+2H2O,故B错误;
C.酸性条件下,用H2O2将I﹣氧化为I2,反应的离子方程式为:H2O2+2I﹣+2H+═I2+2H2O,故C错误;
D.利用明矾做混凝剂净水,离子方程式:Al3++3H2O?Al(OH)3+3H+,故D正确。
故选:D。
7.【答案】A
【解答】解:A.恒温恒容条件下,充入氢气导致氢气浓度增大,正反应速率增大,平衡向右移动,故A正确;
B.恒温恒容充入He,反应物和生成物浓度都不变,反应速率不变,平衡不移动,故B错误;
C.该反应前后气体计量数之和不变,压强不影响平衡移动,则压缩体积加压,反应物和生成物浓度都增大,所以正逆反应速率都增大,但平衡不移动,故C错误;
D.升高温度活化分子百分数增大,则正逆反应速率都增大,升高温度平衡向左移动,故D错误;
故选:A。
8.【答案】C
【解答】解:A.乙炔中可能有硫化氢,均可被高锰酸钾氧化,不能说明乙炔具有还原性,故A错误;
B.先加氯水可氧化亚铁离子,铁离子遇KSCN溶液变为血红色,没有排出铁离子的干扰,不能检验亚铁离子,故B错误;
C.食盐水为中性,左侧发生吸氧腐蚀,右侧发生析氢腐蚀,则一段时间后,a管液面高于b管液面,故C正确;
D.生成的乙烯及挥发的醇均使高锰酸钾褪色,则不能检验消去反应的产物,故D错误;
故选:C。
9.【答案】C
【解答】A.催化剂a、b只能改变化学反应的速率,不改变化学平衡,所以不能提高反应的平衡转化率,故A错误;
B.氨气中氮元素的化合价为﹣3,一氧化氮中氮元素的化合价为+2,所以在催化剂b表面形成氮氧键时,涉及了电子转移,故B错误;
C.催化剂a表面是氢气和氮气反应生成氨气,氮气、氢气断裂的是非极性共价键,生成氨气是极性共价键的形成,所以催化剂a表面发生了非极性共价键的断裂和极性共价键的形成,故C正确;
D.如果向容器中放入1mol
N2和3mol
H2,该反应为可逆反应,不能进行到底,转化率达不到100%,最终生成的
NH3小于2mol,故D错误;
故选:C。
10.【答案】A
【解答】解:A、反应热△H=反应物能量总和﹣生成物能量总和,所以反应热△H=+(a﹣b)kJ?mol﹣1,故A正确;
B、依据图象分析判断1molA2和1molB2反应生成2molAB,每生成2molAB吸收(a﹣b)
kJ热量,故B错误;
C、依据能量图象分析可知反应物能量低于生成物能量,故C错误;
D、断裂1
mol
A﹣A和1
mol
B﹣B键,吸收a
kJ能量,故D错误;
故选:A。
11.【答案】B
【解答】解:A.在苯酚中,由于苯环对﹣OH的影响,酚羟基具有酸性,所以苯酚能跟NaOH溶液反应,对比乙醇,虽含有﹣OH,但不具有酸性,能说明上述观点,故A不选;
B.乙烯和乙烷结构不同,乙烯含有C=C,可发生加成反应,乙烷不能发生加成反应,二者性质不同是因为官能团不同,不是原子间(或原子与原子团间)的相互影响会导致的,故B选;
C.甲基连接在苯环上,使苯环上的H原子容易被取代,所以甲苯与硝酸更容易发生取代反应,二者性质不同是原子间(或原子与原子团间)的相互影响会导致的,故C不选;
D.甲基连接在苯环上,可被氧化,说明苯环对甲基影响,二者性质不同是原子间(或原子与原子团间)的相互影响会导致的,故D不选;
故选:B。
12.【答案】C
【解答】解:A.加水稀释0.1mol/L氨水,c(H+)增大,c(OH﹣)减小,则溶液中增大,故A错误;
B.加入稀硝酸,可氧化亚铁离子,不能加入酸抑制亚铁离子的水解,故B错误;
C.向盐酸中滴加氨水至溶液呈中性,溶液中存在c(H+)+c(NH4+)=c(Cl﹣)+c(OH﹣),因c(H+)=(OH﹣),则c(NH4+)=c(Cl﹣),故C正确;
D.向CH3COOH溶液中加入少量CH3COONa固体,醋酸根离子浓度增大,抑制醋酸的电离,则溶液的pH增大,故D错误。
故选:C。
13.【答案】B
【解答】解:A.乙含有羟基,发生氧化反应生成羰基,为氧化反应,故A错误;
B.如存在顺反异构,碳碳双键的碳原子应连接不同的原子或原子团,香茅醛碳碳双键连接2个甲基,则不存在顺反异构现象,故B正确;
C.甲不含酚羟基,遇浓溴水不产生白色沉淀,故C错误;
D.碳碳双键和醛基都可与氢气发生加成反应,则香茅醛能与2mol氢气发生加成反应,故D错误。
故选:B。
14.【答案】BD
【解答】解:A.试管Ⅰ中Cu与稀硝酸反应生成NO,然后NO与氧气反应生成浅红棕色气体NO2,试管Ⅱ中红棕色气体为NO2,由硝酸还原生成,故A错误;
B.3molCu消耗8mol稀硝酸,1molCu消耗4mol浓硝酸,则等质量的
Cu
完全溶解时,II中消耗的
HNO3
更多,故B正确;
C.常温下Fe遇浓硝酸发生钝化,则试管
II
中反应不明显,故C错误;
D.二氧化氮为红棕色气体,则II
中反应后溶液颜色与试管
I
中的不同,是由于溶有
NO2,故D正确;
故选:BD。
二、非选择题(共5小题,满分58分)
15.【答案】(1)2A(g)+B(g)?C(g);
(2)0.05mol?L﹣1?min﹣1;
(3)放热;
(4)0.52;
(5)25%;
(6)压强;<;恒压条件下,升高温度平衡逆向移动,C的体积百分数逐渐减小。
【解答】解:(1)由图象可以看出,反应中A、B的物质的量减小,C的物质的量增多,则A、B为反应物,C为生成物,
且△n(A):△n(B):△n(C)=0.8mol:0.4mol:0.4mol=2:1:1,则反应的化学方程式为:2A+B?C,
故答案为:2A(g)+B(g)?C(g);
(2)0~4分钟时,A的平均反应速率为:v(A)==0.05mol?L﹣1?min﹣1,
故答案为:0.05mol?L﹣1?min﹣1;
(3)K(300℃)>K(350℃),说明温度升高,平衡向逆反应方向移动,则正反应为放热反应,
故答案为:放热;
(4)反应2A(g)+B(g)?C(g)的平衡常数K===0.52(mol/L)﹣2,
故答案为:0.52;
(5)到达平衡时B的转化率为:×100%=25%,
故答案为:25%;
(6)对2A(g)+B(g)?C(g)△H<0,恒压条件下,升高温度平衡逆向移动,C的体积百分数逐渐减小,而在恒温条件下,增大压强,平衡正向移动,C的体积百分数逐渐增大,则X代表的是压强,且L1<L2,
故答案为:压强;<;恒压条件下,升高温度平衡逆向移动,C的体积百分数逐渐减小。
16.【答案】(1)硝基、羧基;
(2)浓硝酸、浓硫酸;
(3)+NaOH+NaCl(或+2NaOH+2NaCl+H2O);
(4)n+(n﹣1)H2O;
(5);
(6);。
【解答】解:(1)由结构简式可知,E分子中的含氧官能团名称是:硝基、羧基,
故答案为:硝基、羧基;
(2)由分析可知,A→B发生硝化反应,故试剂a是浓硝酸、浓硫酸,
故答案为:浓硝酸、浓硫酸;
(3)C→D的反应方程式为:+NaOH+NaCl,或者为+2NaOH+2NaCl+H2O,
故答案为:+NaOH+NaCl(或+2NaOH+2NaCl+H2O);
(4)一定条件下用F制备高分子的反应方程式:n+(n﹣1)H2O,
故答案为:n+(n﹣1)H2O;
(5)H为,H具有顺反异构,H的顺式异构体的结构简式为:,
故答案为:;
(6)与K发生信息ii中反应,结合二者反应产物结构简式,可知K的结构简式为,对比中间产物前后物质结构可知,中氨基与羰基之间发生加成反应生成中间产物,中间产物再发生消去反应生成,故中间产物结构简式为,
故答案为:;。
17.【答案】(1)①CO2(g)+3H2(g)═CH3OH(g)+H2O(g)△H=﹣50kJ/mol;
②a;
③从A到B;CH3OH+H2O﹣6e﹣═6H++CO2↑;
(2)①KHCO3;
②4OH﹣﹣4e﹣═2H2O+O2↑;
③HCO3﹣存在电离平衡:HCO3﹣?H++CO32﹣,阴极H+放电,浓度减小使平衡右移,CO32﹣再生。
【解答】解:(1)①已知:25℃,101kPa下:
①H2(g)O2(g)═H2O(g)△H1=﹣242kJ/mol
②CH3OH(g)+O2(g)═CO2(g)+2H2O(g)△H2=﹣676kJ/mol
根据盖斯定律:3×①﹣②得CO2(g)+3H2(g)═CH3OH(g)+H2O(g)△H=3×(﹣242kJ/mol)﹣(﹣676kJ/mol)=﹣50kJ/mol,
故答案为:CO2(g)+3H2(g)═CH3OH(g)+H2O(g)△H=﹣50kJ/mol;
②该反应是放热反应,反应物总能量大于生成物总能量,物质越稳定,其能量越小,所以液态物质的能量小于气态物质,则符合条件的图象是a,
故答案为:a;
③该燃料电池中,甲醇失电子发生氧化反应,所以A是负极,B是正极,电子从负极A流向正极B;A电极上甲醇失电子和水反应生成氢离子和二氧化碳,电极反应式为:CH3OH+H2O﹣6e﹣═6H++CO2↑,
故答案为:从A到B;CH3OH+H2O﹣6e﹣═6H++CO2↑;
(2)①工业上常用高浓度的K2CO3溶液吸收CO2,得溶液KHCO3溶液,
故答案为:KHCO3;
②阳极上氢氧根离子放电生成氧气和水,电极反应式为4OH﹣﹣4e﹣═2H2O+O2↑,
故答案为:4OH﹣﹣4e﹣═2H2O+O2↑;
③由于HCO3﹣存在电离平衡:HCO3﹣?H++CO32﹣,阴极H+放电,浓度减小使平衡右移,CO32﹣再生,
故答案为:HCO3﹣存在电离平衡:HCO3﹣?H++CO32﹣,阴极H+放电,浓度减小使平衡右移,CO32﹣再生。
18.【答案】I.(1)FeCO3难溶于水,在溶液中存在沉淀溶解平衡:FeCO3(s)?Fe2+(aq)+CO32﹣(aq),酸雨中含有H+浓度较大,H+结合CO32﹣形成HCO3﹣,使得溶液中c(CO32﹣)浓度降低,沉淀溶解平衡正向移动,最终使地下水中Fe2+的浓度增大;
II.(2)①加快反应速率;
②4;1;10;4;8;H+;
(3)①Mn2+的浓度越大,ClO2投加量小于1.2mg/L时几乎没影响,Fe2+的浓度小,ClO2降解的速率更快;
②2ClO2+5Mn2++6H2O=2Cl﹣+5MnO2+12H+;
③适当增加ClO2的投料量,升高温度。
【解答】解:I.(1)FeCO3难溶于水,在溶液中存在沉淀溶解平衡:FeCO3(s)?Fe2+(aq)+CO32﹣(aq),酸雨中含有H+浓度较大,H+结合CO32﹣形成HCO3﹣,使得溶液中c(CO32﹣)浓度降低,沉淀溶解平衡正向移动,最终使地下水中Fe2+的浓度增大,
故答案为:FeCO3难溶于水,在溶液中存在沉淀溶解平衡:FeCO3(s)?Fe2+(aq)+CO32﹣(aq),酸雨中含有H+浓度较大,H+结合CO32﹣形成HCO3﹣,使得溶液中c(CO32﹣)浓度降低,沉淀溶解平衡正向移动,最终使地下水中Fe2+的浓度增大;
II.(2)①曝气池中使水呈“沸腾”状的作用温度越高,反应速率越快,
故答案为:加快反应速率;
②根据电子守恒,电荷守恒,原子守恒,配平化学方程得:4Fe2++O2+10H2O=4Fe(OH)3+8H+,
故答案为:4;1;10;4;8;H+;
(3)①ClO2投加量小于1.2mg/L时,可以得出Fe2+、Mn2+性质差异的结论是Mn2+的浓度越大,ClO2投加量小于1.2mg/L时几乎没影响,Fe2+的浓度小,ClO2降解的速率更快,
故答案为:Mn2+的浓度越大,ClO2投加量小于1.2mg/L时几乎没影响,Fe2+的浓度小,ClO2降解的速率更快;
②分析图中数据ClO2氧化Mn2+是可逆反应;ClO2氧化Mn2+生成二氧化锰和氯离子,离子方程式为2ClO2+5Mn2++6H2O=2Cl﹣+5MnO2+12H+,
故答案为:2ClO2+5Mn2++6H2O=2Cl﹣+5MnO2+12H+;
③写出两种提高锰去除率的方法:适当增加ClO2的投料量,升高温度,适当降低pH等,
故答案为:适当增加ClO2的投料量,升高温度。
19.【答案】(1)Cr3++3OH﹣=Cr(OH)3↓;
(2)Cr3+较稳定,不能被过氧化氢氧化;
(3)2Cr(OH)3+3H2O2+4OH﹣=2CrO42﹣+8H2O;
(4)pH较低时,溶液中存在Cr3+,而Cr3+不易被氧化,故溶液为Cr3+的颜色,为墨绿色;pH较高时,根据分析,混合物中存在Cr(OH)3和CrO2﹣,两者都可被过氧化氢氧化,得到CrO42﹣或Cr2O72﹣,故溶液颜色逐渐变为黄色或砖红色;
(5)H2O2+2CrO83﹣=2CrO42﹣+4O2↑+2OH﹣;
(6)在一定温度和pH下,用不同浓度的Cr2(SO4)3溶液与H2O2反应,观察反应后的现象;
(7)pH、温度、浓度。
【解答】解:(1)⑤为碱性环境,生成蓝色沉淀的离子方程式为Cr3++3OH﹣=Cr(OH)3↓,
故答案为:Cr3++3OH﹣=Cr(OH)3↓;
(2)试管①②溶液为酸性,酸性条件下为Cr3+,Cr3+较稳定,不能被过氧化氢氧化,
故答案为:Cr3+较稳定,不能被过氧化氢氧化;
(3)④中溶液偏碱性,沉淀溶解,溶液变为亮黄色,是Cr(OH)3被氧化为CrO42﹣,离子方程式为2Cr(OH)3+3H2O2+4OH﹣=2CrO42﹣+8H2O,
故答案为:2Cr(OH)3+3H2O2+4OH﹣=2CrO42﹣+8H2O;
(4)根据分析,pH较低时,溶液中存在Cr3+,而Cr3+不易被氧化,故溶液为Cr3+的颜色,为墨绿色;pH较高时,根据分析,混合物中存在Cr(OH)3和CrO2﹣,两者都可被过氧化氢氧化,得到CrO42﹣或Cr2O72﹣,故溶液颜色逐渐变为黄色或砖红色,
故答案为:pH较低时,溶液中存在Cr3+,而Cr3+不易被氧化,故溶液为Cr3+的颜色,为墨绿色;pH较高时,根据分析,混合物中存在Cr(OH)3和CrO2﹣,两者都可被过氧化氢氧化,得到CrO42﹣或Cr2O72﹣,故溶液颜色逐渐变为黄色或砖红色;
(5)根据分析,在碱性环境中,生成的红色物质CrO83﹣不稳定,该物质中O的化合价为﹣1价,自身的Cr与O发生氧化还原反应,反应后的物质再被H2O2氧化,得到亮黄色的CrO42﹣和O2,总反应为H2O2+2CrO83﹣=2CrO42﹣+4O2↑+2OH﹣,
故答案为:H2O2+2CrO83﹣=2CrO42﹣+4O2↑+2OH﹣;
(6)根据分析,探究浓度的影响时,需保证pH和温度不变,通过稀释,改变Cr3+浓度,观察反应后的现象,
故答案为:在一定温度和pH下,用不同浓度的Cr2(SO4)3溶液与H2O2反应,观察反应后的现象;
(7)根据分析,本实验探究了pH、温度、浓度不同时,对Cr(Ⅲ)与过氧化氢反应的影响,
故答案为:pH、温度、浓度。
一、下列各题的四个选项中,只有一个选项符合题意。(每小题3分,共42分)
1.用于制备下列物质的材料中,主要成分不属于有机高分子的是( )
A.有机玻璃
B.橡胶
C.聚丙烯
D.铜
A.A
B.B
C.C
D.D
2.下列应用不涉及氧化还原反应的是( )
A.用硫磺为原料制备硫酸
B.用合成氨实现人工固氮
C.用NaHCO3治疗胃酸过多
D.电解饱和食盐水制备NaOH
3.下列物质的应用中,利用了物质氧化性的是( )
A.氨﹣﹣作制冷剂
B.漂粉精﹣﹣作游泳池消毒剂
C.甘油﹣﹣作护肤保湿剂
D.二氧化硫﹣﹣作红酒添加剂
4.已知8838Sr位于IIA族,下列有关Sr的说法不正确的是( )
A.8838Sr的中子数为38
B.最高化合价为+2
C.原子半径:Sr>Ca
D.氢氧化物为强碱
5.反应2Na2O2+2H2O═4NaOH+O2↑,是潜艇中氧气来源之一。用NA表示阿伏加德罗常数,下列说法正确的是( )
A.22.4L
O2含2NA个氧原子
B.1.8g
H2O含有的质子数为NA
C.反应中每生成1mol
O2转移4mol电子
D.4g
NaOH溶于100mL水中,所得溶液的物质的量浓度为1mol/L
6.下列解释事实的方程式正确的是( )
A.钢铁发生吸氧腐蚀,负极反应为:Fe﹣3e﹣═Fe3+
B.用浓硝酸除去试管内壁上附着的铜:3Cu+8H++2NO3﹣═3Cu2++2NO↑+4H2O
C.酸性条件下,用H2O2将I﹣转化为I2:H2O2+2I﹣═I2+2OH﹣
D.利用明矾做混凝剂净水:Al3++3H2O?Al(OH)3+3H+
7.关于一定条件下的化学平衡:H2(g)+I2(g)?2HI(g)△H<0。下列说法正确的是( )
A.恒温恒容时充入H2,正反应速率增大,平衡右移
B.恒温恒容时充入He,正反应速率增大,平衡右移
C.压缩体积加压,正、逆反应速率不变,平衡不移动
D.升温,正反应速率减小、逆反应速率增大,平衡右移
8.下列实验操作、现象和结论均正确的是( )
KMnO4溶液褪色
试管中溶液变红
A.乙炔具有还原性
B.待测液中含Fe2+
一段时间后,a管液面高于b管液面
KMnO4溶液褪色
C.a管发生吸氧腐蚀,b管发生析氢腐蚀
D.检验溴乙烷消去反应产物
A.A
B.B
C.C
D.D
9.氮及其化合物的转化过程如图所示。下列分析合理的是( )
A.催化剂a、b能提高反应的平衡转化率
B.在催化剂b表面形成氮氧键时不涉及电子转移
C.催化剂a表面发生了非极性共价键的断裂和极性共价键的形成
D.如果向容器中放入1mol
N2和3mol
H2,最终可以生成2mol
NH3
10.已知化学反应A2(g)+B2(g)═2AB(g)的能量变化如图所示,判断下列叙述中正确的是( )
A.该反应热△H=+(a﹣b)
kJ?mol﹣1
B.每生成2mol
AB(g)吸收b
kJ
C.该反应中反应物的总能量高于生成物的总能量
D.断裂1mol
A﹣A和1mol
B﹣B键,放出a
kJ能量
11.有机物分子中原子间(或原子与原子团间)的相互影响会导致物质化学性质的不同。下列事实不能说明上述观点的是( )
A.苯酚能跟NaOH溶液反应,乙醇不能与NaOH溶液反应
B.乙烯能与溴水发生加成反应,而乙烷不能与溴水发生加成反应
C.苯与硝酸在50﹣60℃发生取代反应,甲苯与硝酸在30℃就能发生取代反应
D.甲苯能使酸性
KMnO4
溶液褪色,而甲基环己烷不能使酸性
KMnO4
溶液褪色
12.25℃时,下列有关电解质溶液的说法正确的是( )
A.加水稀释0.1mol/L氨水,溶液中c(H+)?c(OH﹣)和均不变
B.配制Fe(NO3)2溶液时,为了防止Fe2+水解可向溶液中加入适量的稀硝酸
C.向盐酸中滴加氨水至溶液呈中性,所得溶液中c(NH4+)=c(Cl﹣)
D.向CH3COOH溶液中加入少量CH3COONa固体,溶液的pH降低
13.中国科学院上海有机化学研究所人工合成青蒿素,其部分合成路线如图,下列说法正确的是( )
A.“乙→丙”发生了消去反应
B.香茅醛不存在顺反异构现象
C.甲分子遇浓溴水产生白色沉淀
D.香茅醛能与1mol氢气发生加成反应
14.室温下,某兴趣小组用如图装置在通风橱中进行如下实验:下列说法正确的是( )
实验
现象
试管Ⅰ中开始无明显现象,逐渐有微小气泡生成,越来越剧烈,液面上方出现浅红棕色气体,溶液呈蓝色。
试管Ⅱ中剧烈反应,迅速生成大量红棕色气体,溶液呈绿色;之后向绿色溶液中持续通入N2,溶液变为蓝色。
A.试管Ⅰ中浅红棕色气体为NO2,由硝酸还原生成
B.等质量的Cu完全溶解时,Ⅱ中消耗的HNO3更多
C.换成Fe之后重复实验,依然是试管Ⅱ中反应更剧烈
D.试管Ⅱ中反应后溶液颜色与试管Ⅰ中的不同,是由于溶有NO2
二、非选择题(共5小题,满分58分)
15.T℃时,在一个体积为2L的容器中,A气体与B气体反应生成C气体,反应过程中A、B、C的变化如图1。
(1)写出反应的化学方程式
。
(2)0~4min时,A的平均反应速率为
。
(3)已知:K(300℃)>K(350℃),该反应是
(填“吸热”或“放热”)反应。
(4)T℃时,反应的平衡常数为
(保留到小数点后2位)。
(5)到达平衡时B的转化率为
。
(6)如图2上述反应平衡混合气中C的体积分数随温度或压强变化的曲线,图中L(L1、L2)、X分别代表温度或压强。其中X代表的是
(填“温度”或“压强”)。判断L1
L2(填“>”或“<”),理由是
。
16.曲尼司特()可用于预防性治疗过敏性鼻炎,合成路线如图所示。
已知:
ⅰ.
ⅱ.
(1)E分子中的含氧官能团名称是
。
(2)试剂a是
。
(3)C→D的反应方程式为
。
(4)写出一定条件下用F制备高分子的反应方程式
。
(5)H具有顺反异构,写出H的顺式异构体的结构简式
。
(6)H是重要的有机合成中间体,以H为原料合成伊曲茶碱的路线如图。
K的结构简式为
。中间产物的结构简式为
。
17.减少CO2的排放,合理利用CO2使其资源化具有重要意义。
(1)CO2和H2在一定条件下反应生成甲醇等产物,工业上利用该反应合成甲醇。
已知:25℃,101KPa下:
H2(g)+O2(g)═H2O(g)△H1=﹣242kJ/mol
CH3OH(g)+O2(g)═CO2(g)+2H2O(g)△H2=﹣676kJ/mol
①写出CO2和H2生成气态甲醇等产物的热化学方程式
。
②下面表示合成甲醇反应的能量变化示意图,正确的是
(填字母)。
③工业上用合成得到的甲醇制成微生物燃料电池,结构示意图如图1。
该电池外电路电子的流动方向为
(填写“从A到B”或“从B到A”)。A电极附近甲醇发生的电极反应式为
。
(2)工业上常用高浓度的K2CO3溶液吸收CO2,得溶液X,再利用电解法使K2CO3溶液再生,其装置示意图如图2。
①写出X的化学式
。
②在阳极区发生的反应为:
和H++HCO3﹣═H2O+CO2↑。
③简述K2CO3在阴极区再生的原理
。
18.某研究小组探究饮用水中铁锰的来源和去除原理。
Ⅰ.铁锰来源
某地区地下水铁锰含量和国家标准对比
某些地区地下水常见微粒含量(mg/L)
国家饮用水标准(mg/L)
Fe2+
Mn2+
HCO3﹣
CO2
Fe2+
Mn2+
pH
4~20
0.4~3
1~1.5
30~70
0.3
0.1
6.5~8.5
(1)利用FeCO3溶解度计算溶出的Fe2+为1.1mg/L,依据如表数据结合平衡移动原理解释地下水中Fe2+含量远大于1.1mg/L的原因
。
Ⅱ.去除原理
(2)自然氧化法:
①曝气池中使水呈“沸腾”状的作用
。
②补全曝气池中氧化Fe2+时发生反应的离子方程式:
Fe2++
O2+
H2O═
Fe(OH)3+
。
此方法铁去除时间长,锰去除率低。
(3)药剂氧化法:工业上可以采用强氧化剂(ClO2、液氯、双氧水等),直接氧化Fe2+、Mn2+生成Fe(OH)3和MnO2除去。某实验中pH=6.5时,Fe2+、Mn2+浓度随ClO2投加量的变化曲线如图。
①ClO2投加量小于1.2mg/L时,可以得出Fe2+、Mn2+性质差异的结论是
。
②分析图中数据ClO2氧化Mn2+是可逆反应。写出反应的离子方程式
。
③写出两种提高锰去除率的方法
。
19.实验小组对Cr(Ⅲ)与过氧化氢反应的影响因素进行了探究,实验过程如下:
实验1:探究pH对Cr(Ⅲ)与过氧化氢反应的影响
①室温下,加酸或碱调节0.1mol/L
Cr2(SO4)3溶液pH分别为2.00、4.10、6.75、8.43、10.03、13.37。
②各取5mL上述溶液分置于6支试管中,分别向其中逐滴加入30%
H2O2溶液,直至溶液不再发生变化,观察并记录现象。
试管
①
②
③
④
⑤
⑥
pH
2.00
4.10
6.75
8.43
10.03
13.37
起始现象
墨绿色溶液
墨绿色溶液
蓝色浑浊液
蓝色浑浊液
蓝色浑浊液
亮绿色溶液
终点现象
墨绿色
墨绿色
黄绿色
亮黄色
橙红色
砖红色
查阅资料:
①Cr3+为绿色,CrO2﹣为亮绿色,CrO42﹣为黄色。
②Cr3+较稳定,需用较强氧化剂才能将其氧化;CrO2﹣在碱性溶液中是较强的还原剂。
(1)Cr(OH)3为蓝色固体。写出⑤中生成蓝色沉淀的离子方程式
。
(2)试管①②中溶液未发生明显变化,可能的原因是
。
(3)④中沉淀溶解,溶液变为亮黄色,可能发生反应的离子方程式是
。
(4)Cr(OH)3与Al(OH)3类似,具有两性。存在如下关系:Cr3++3OH﹣?Cr(OH)3?CrO2﹣+H++H2O。解释随着溶液pH升高,终点溶液颜色变化的原因
。
实验2:探究温度对Cr(Ⅲ)与过氧化氢反应的影响
各取5mL
pH=13.50
Cr2(SO4)3溶液分置于5支试管中,将其分别置于0℃、25℃、50℃、75℃、100℃的水浴中,然后向试管中各滴加过量30%
H2O2溶液,观察并记录实验现象:
反应温度
0℃
25℃
50℃
75℃
100℃
起始现象
墨绿色
终点现象
红棕色
砖红色
橙红色
亮黄色
亮黄色
(5)随着反应温度的升高,反应后溶液颜色由红棕色向亮黄色转变,是因为生成的红色物质CrO83﹣(Cr为+5价)不稳定,自身发生氧化还原反应,随着温度升高会逐渐转化为亮黄色的CrO42﹣,同时生成氧气。写出反应的离子方程式
。
(6)反应物浓度也是影响反应的因素之一。请利用实验1给出的试剂,设计实验进行验证
。
(7)综上所述,Cr(Ⅲ)与过氧化氢的反应产物与
密切相关。
2020-2021学年北京市丰台区高三(上)期中化学试卷
参考答案与试题解析
一、下列各题的四个选项中,只有一个选项符合题意。(每小题3分,共42分)
1.【答案】D
【解答】解:A.有机玻璃的成分是聚甲基丙烯酸甲酯,为有机高分子化合物,故A不选;
B.汽车轮胎主要成分为橡胶,为常见的有机高分子化合物,故B不选;
C.聚丙烯是由丙烯经过加聚反应生成的,属于有机高分子,故C不选;
D.铜是金属材料,不属于高分子化合物,故D选;
故选:D。
2.【答案】C
【解答】解:A.用硫磺为原料制备硫酸,该反应中S元素化合价变化,属于氧化还原反应,故A不选;
B.用合成氨实现人工固氮,该反应中N元素化合价发生变化,所以属于氧化还原反应,故B不选;
C.用NaHCO3治疗胃酸过多,碳酸氢钠与HCl发生复分解反应,没有元素化合价的变化,不属于氧化还原反应,故C选;
D.电解饱和食盐水制备NaOH,该反应中H、Cl元素化合价发生变化,所以属于氧化还原反应,故D不选;
故选:C。
3.【答案】B
【解答】解:A.液氨气化吸热,所以用作制冷剂,该过程中没有元素化合价变化,所以为非氧化还原反应,故A错误;
B.漂粉精具有强氧化性,利用其强氧化性作游泳池消毒剂,故B正确;
C.甘油作护肤保湿剂,是利用的其物理性质,没有元素化合价的变化,所以为非氧化还原反应,故C错误;
D.二氧化硫具有还原性,作红酒添加剂可以防止红酒中的营养物质被氧化,所以利用了二氧化硫的还原性,故D错误;
故选:B。
4.【答案】A
【解答】解:A.8838Sr的中子数为88﹣38=50,故A错误;
B.位于IIA族,可知最外层有2个电子,则最高化合价为+2,故B正确;
C.同主族从上到下原子半径增大,则原子半径:Sr>Ca,故C正确;
D.同主族从上到下金属性增强,金属性越强,对应碱的碱性越强,则氢氧化物为强碱,故D正确;
故选:A。
5.【答案】B
【解答】解:A.22.4LO2没有说明是在标况下,无法计算O2的物质的量,故A错误;
B.1.8gH2O的物质的量为:=0.1mol,每个H2O分子中有10个质子,则1.8gH2O中含有1mol质子,含有的质子数为NA,故B正确;
C.对于反应2Na2O2+2H2O=4NaOH+O2↑,Na2O2中﹣1价的O歧化为0价和﹣2价,则每生成1molO2转移2mol电子,故C错误;
D.先计算NaOH的物质的量n===0.1mol,C===1mol/L,注意体积为溶液的体积,但题目是溶于100mL水时,无法进行计算,故D错误;
故选:B。
6.【答案】D
【解答】解:A.钢铁发生吸氧腐蚀,负极反应为:Fe﹣2e﹣═Fe2+,故A错误;
B.用浓硝酸除去试管内壁上附着的铜,离子方程式:Cu+4H++2NO3﹣═3Cu2++2NO2↑+2H2O,故B错误;
C.酸性条件下,用H2O2将I﹣氧化为I2,反应的离子方程式为:H2O2+2I﹣+2H+═I2+2H2O,故C错误;
D.利用明矾做混凝剂净水,离子方程式:Al3++3H2O?Al(OH)3+3H+,故D正确。
故选:D。
7.【答案】A
【解答】解:A.恒温恒容条件下,充入氢气导致氢气浓度增大,正反应速率增大,平衡向右移动,故A正确;
B.恒温恒容充入He,反应物和生成物浓度都不变,反应速率不变,平衡不移动,故B错误;
C.该反应前后气体计量数之和不变,压强不影响平衡移动,则压缩体积加压,反应物和生成物浓度都增大,所以正逆反应速率都增大,但平衡不移动,故C错误;
D.升高温度活化分子百分数增大,则正逆反应速率都增大,升高温度平衡向左移动,故D错误;
故选:A。
8.【答案】C
【解答】解:A.乙炔中可能有硫化氢,均可被高锰酸钾氧化,不能说明乙炔具有还原性,故A错误;
B.先加氯水可氧化亚铁离子,铁离子遇KSCN溶液变为血红色,没有排出铁离子的干扰,不能检验亚铁离子,故B错误;
C.食盐水为中性,左侧发生吸氧腐蚀,右侧发生析氢腐蚀,则一段时间后,a管液面高于b管液面,故C正确;
D.生成的乙烯及挥发的醇均使高锰酸钾褪色,则不能检验消去反应的产物,故D错误;
故选:C。
9.【答案】C
【解答】A.催化剂a、b只能改变化学反应的速率,不改变化学平衡,所以不能提高反应的平衡转化率,故A错误;
B.氨气中氮元素的化合价为﹣3,一氧化氮中氮元素的化合价为+2,所以在催化剂b表面形成氮氧键时,涉及了电子转移,故B错误;
C.催化剂a表面是氢气和氮气反应生成氨气,氮气、氢气断裂的是非极性共价键,生成氨气是极性共价键的形成,所以催化剂a表面发生了非极性共价键的断裂和极性共价键的形成,故C正确;
D.如果向容器中放入1mol
N2和3mol
H2,该反应为可逆反应,不能进行到底,转化率达不到100%,最终生成的
NH3小于2mol,故D错误;
故选:C。
10.【答案】A
【解答】解:A、反应热△H=反应物能量总和﹣生成物能量总和,所以反应热△H=+(a﹣b)kJ?mol﹣1,故A正确;
B、依据图象分析判断1molA2和1molB2反应生成2molAB,每生成2molAB吸收(a﹣b)
kJ热量,故B错误;
C、依据能量图象分析可知反应物能量低于生成物能量,故C错误;
D、断裂1
mol
A﹣A和1
mol
B﹣B键,吸收a
kJ能量,故D错误;
故选:A。
11.【答案】B
【解答】解:A.在苯酚中,由于苯环对﹣OH的影响,酚羟基具有酸性,所以苯酚能跟NaOH溶液反应,对比乙醇,虽含有﹣OH,但不具有酸性,能说明上述观点,故A不选;
B.乙烯和乙烷结构不同,乙烯含有C=C,可发生加成反应,乙烷不能发生加成反应,二者性质不同是因为官能团不同,不是原子间(或原子与原子团间)的相互影响会导致的,故B选;
C.甲基连接在苯环上,使苯环上的H原子容易被取代,所以甲苯与硝酸更容易发生取代反应,二者性质不同是原子间(或原子与原子团间)的相互影响会导致的,故C不选;
D.甲基连接在苯环上,可被氧化,说明苯环对甲基影响,二者性质不同是原子间(或原子与原子团间)的相互影响会导致的,故D不选;
故选:B。
12.【答案】C
【解答】解:A.加水稀释0.1mol/L氨水,c(H+)增大,c(OH﹣)减小,则溶液中增大,故A错误;
B.加入稀硝酸,可氧化亚铁离子,不能加入酸抑制亚铁离子的水解,故B错误;
C.向盐酸中滴加氨水至溶液呈中性,溶液中存在c(H+)+c(NH4+)=c(Cl﹣)+c(OH﹣),因c(H+)=(OH﹣),则c(NH4+)=c(Cl﹣),故C正确;
D.向CH3COOH溶液中加入少量CH3COONa固体,醋酸根离子浓度增大,抑制醋酸的电离,则溶液的pH增大,故D错误。
故选:C。
13.【答案】B
【解答】解:A.乙含有羟基,发生氧化反应生成羰基,为氧化反应,故A错误;
B.如存在顺反异构,碳碳双键的碳原子应连接不同的原子或原子团,香茅醛碳碳双键连接2个甲基,则不存在顺反异构现象,故B正确;
C.甲不含酚羟基,遇浓溴水不产生白色沉淀,故C错误;
D.碳碳双键和醛基都可与氢气发生加成反应,则香茅醛能与2mol氢气发生加成反应,故D错误。
故选:B。
14.【答案】BD
【解答】解:A.试管Ⅰ中Cu与稀硝酸反应生成NO,然后NO与氧气反应生成浅红棕色气体NO2,试管Ⅱ中红棕色气体为NO2,由硝酸还原生成,故A错误;
B.3molCu消耗8mol稀硝酸,1molCu消耗4mol浓硝酸,则等质量的
Cu
完全溶解时,II中消耗的
HNO3
更多,故B正确;
C.常温下Fe遇浓硝酸发生钝化,则试管
II
中反应不明显,故C错误;
D.二氧化氮为红棕色气体,则II
中反应后溶液颜色与试管
I
中的不同,是由于溶有
NO2,故D正确;
故选:BD。
二、非选择题(共5小题,满分58分)
15.【答案】(1)2A(g)+B(g)?C(g);
(2)0.05mol?L﹣1?min﹣1;
(3)放热;
(4)0.52;
(5)25%;
(6)压强;<;恒压条件下,升高温度平衡逆向移动,C的体积百分数逐渐减小。
【解答】解:(1)由图象可以看出,反应中A、B的物质的量减小,C的物质的量增多,则A、B为反应物,C为生成物,
且△n(A):△n(B):△n(C)=0.8mol:0.4mol:0.4mol=2:1:1,则反应的化学方程式为:2A+B?C,
故答案为:2A(g)+B(g)?C(g);
(2)0~4分钟时,A的平均反应速率为:v(A)==0.05mol?L﹣1?min﹣1,
故答案为:0.05mol?L﹣1?min﹣1;
(3)K(300℃)>K(350℃),说明温度升高,平衡向逆反应方向移动,则正反应为放热反应,
故答案为:放热;
(4)反应2A(g)+B(g)?C(g)的平衡常数K===0.52(mol/L)﹣2,
故答案为:0.52;
(5)到达平衡时B的转化率为:×100%=25%,
故答案为:25%;
(6)对2A(g)+B(g)?C(g)△H<0,恒压条件下,升高温度平衡逆向移动,C的体积百分数逐渐减小,而在恒温条件下,增大压强,平衡正向移动,C的体积百分数逐渐增大,则X代表的是压强,且L1<L2,
故答案为:压强;<;恒压条件下,升高温度平衡逆向移动,C的体积百分数逐渐减小。
16.【答案】(1)硝基、羧基;
(2)浓硝酸、浓硫酸;
(3)+NaOH+NaCl(或+2NaOH+2NaCl+H2O);
(4)n+(n﹣1)H2O;
(5);
(6);。
【解答】解:(1)由结构简式可知,E分子中的含氧官能团名称是:硝基、羧基,
故答案为:硝基、羧基;
(2)由分析可知,A→B发生硝化反应,故试剂a是浓硝酸、浓硫酸,
故答案为:浓硝酸、浓硫酸;
(3)C→D的反应方程式为:+NaOH+NaCl,或者为+2NaOH+2NaCl+H2O,
故答案为:+NaOH+NaCl(或+2NaOH+2NaCl+H2O);
(4)一定条件下用F制备高分子的反应方程式:n+(n﹣1)H2O,
故答案为:n+(n﹣1)H2O;
(5)H为,H具有顺反异构,H的顺式异构体的结构简式为:,
故答案为:;
(6)与K发生信息ii中反应,结合二者反应产物结构简式,可知K的结构简式为,对比中间产物前后物质结构可知,中氨基与羰基之间发生加成反应生成中间产物,中间产物再发生消去反应生成,故中间产物结构简式为,
故答案为:;。
17.【答案】(1)①CO2(g)+3H2(g)═CH3OH(g)+H2O(g)△H=﹣50kJ/mol;
②a;
③从A到B;CH3OH+H2O﹣6e﹣═6H++CO2↑;
(2)①KHCO3;
②4OH﹣﹣4e﹣═2H2O+O2↑;
③HCO3﹣存在电离平衡:HCO3﹣?H++CO32﹣,阴极H+放电,浓度减小使平衡右移,CO32﹣再生。
【解答】解:(1)①已知:25℃,101kPa下:
①H2(g)O2(g)═H2O(g)△H1=﹣242kJ/mol
②CH3OH(g)+O2(g)═CO2(g)+2H2O(g)△H2=﹣676kJ/mol
根据盖斯定律:3×①﹣②得CO2(g)+3H2(g)═CH3OH(g)+H2O(g)△H=3×(﹣242kJ/mol)﹣(﹣676kJ/mol)=﹣50kJ/mol,
故答案为:CO2(g)+3H2(g)═CH3OH(g)+H2O(g)△H=﹣50kJ/mol;
②该反应是放热反应,反应物总能量大于生成物总能量,物质越稳定,其能量越小,所以液态物质的能量小于气态物质,则符合条件的图象是a,
故答案为:a;
③该燃料电池中,甲醇失电子发生氧化反应,所以A是负极,B是正极,电子从负极A流向正极B;A电极上甲醇失电子和水反应生成氢离子和二氧化碳,电极反应式为:CH3OH+H2O﹣6e﹣═6H++CO2↑,
故答案为:从A到B;CH3OH+H2O﹣6e﹣═6H++CO2↑;
(2)①工业上常用高浓度的K2CO3溶液吸收CO2,得溶液KHCO3溶液,
故答案为:KHCO3;
②阳极上氢氧根离子放电生成氧气和水,电极反应式为4OH﹣﹣4e﹣═2H2O+O2↑,
故答案为:4OH﹣﹣4e﹣═2H2O+O2↑;
③由于HCO3﹣存在电离平衡:HCO3﹣?H++CO32﹣,阴极H+放电,浓度减小使平衡右移,CO32﹣再生,
故答案为:HCO3﹣存在电离平衡:HCO3﹣?H++CO32﹣,阴极H+放电,浓度减小使平衡右移,CO32﹣再生。
18.【答案】I.(1)FeCO3难溶于水,在溶液中存在沉淀溶解平衡:FeCO3(s)?Fe2+(aq)+CO32﹣(aq),酸雨中含有H+浓度较大,H+结合CO32﹣形成HCO3﹣,使得溶液中c(CO32﹣)浓度降低,沉淀溶解平衡正向移动,最终使地下水中Fe2+的浓度增大;
II.(2)①加快反应速率;
②4;1;10;4;8;H+;
(3)①Mn2+的浓度越大,ClO2投加量小于1.2mg/L时几乎没影响,Fe2+的浓度小,ClO2降解的速率更快;
②2ClO2+5Mn2++6H2O=2Cl﹣+5MnO2+12H+;
③适当增加ClO2的投料量,升高温度。
【解答】解:I.(1)FeCO3难溶于水,在溶液中存在沉淀溶解平衡:FeCO3(s)?Fe2+(aq)+CO32﹣(aq),酸雨中含有H+浓度较大,H+结合CO32﹣形成HCO3﹣,使得溶液中c(CO32﹣)浓度降低,沉淀溶解平衡正向移动,最终使地下水中Fe2+的浓度增大,
故答案为:FeCO3难溶于水,在溶液中存在沉淀溶解平衡:FeCO3(s)?Fe2+(aq)+CO32﹣(aq),酸雨中含有H+浓度较大,H+结合CO32﹣形成HCO3﹣,使得溶液中c(CO32﹣)浓度降低,沉淀溶解平衡正向移动,最终使地下水中Fe2+的浓度增大;
II.(2)①曝气池中使水呈“沸腾”状的作用温度越高,反应速率越快,
故答案为:加快反应速率;
②根据电子守恒,电荷守恒,原子守恒,配平化学方程得:4Fe2++O2+10H2O=4Fe(OH)3+8H+,
故答案为:4;1;10;4;8;H+;
(3)①ClO2投加量小于1.2mg/L时,可以得出Fe2+、Mn2+性质差异的结论是Mn2+的浓度越大,ClO2投加量小于1.2mg/L时几乎没影响,Fe2+的浓度小,ClO2降解的速率更快,
故答案为:Mn2+的浓度越大,ClO2投加量小于1.2mg/L时几乎没影响,Fe2+的浓度小,ClO2降解的速率更快;
②分析图中数据ClO2氧化Mn2+是可逆反应;ClO2氧化Mn2+生成二氧化锰和氯离子,离子方程式为2ClO2+5Mn2++6H2O=2Cl﹣+5MnO2+12H+,
故答案为:2ClO2+5Mn2++6H2O=2Cl﹣+5MnO2+12H+;
③写出两种提高锰去除率的方法:适当增加ClO2的投料量,升高温度,适当降低pH等,
故答案为:适当增加ClO2的投料量,升高温度。
19.【答案】(1)Cr3++3OH﹣=Cr(OH)3↓;
(2)Cr3+较稳定,不能被过氧化氢氧化;
(3)2Cr(OH)3+3H2O2+4OH﹣=2CrO42﹣+8H2O;
(4)pH较低时,溶液中存在Cr3+,而Cr3+不易被氧化,故溶液为Cr3+的颜色,为墨绿色;pH较高时,根据分析,混合物中存在Cr(OH)3和CrO2﹣,两者都可被过氧化氢氧化,得到CrO42﹣或Cr2O72﹣,故溶液颜色逐渐变为黄色或砖红色;
(5)H2O2+2CrO83﹣=2CrO42﹣+4O2↑+2OH﹣;
(6)在一定温度和pH下,用不同浓度的Cr2(SO4)3溶液与H2O2反应,观察反应后的现象;
(7)pH、温度、浓度。
【解答】解:(1)⑤为碱性环境,生成蓝色沉淀的离子方程式为Cr3++3OH﹣=Cr(OH)3↓,
故答案为:Cr3++3OH﹣=Cr(OH)3↓;
(2)试管①②溶液为酸性,酸性条件下为Cr3+,Cr3+较稳定,不能被过氧化氢氧化,
故答案为:Cr3+较稳定,不能被过氧化氢氧化;
(3)④中溶液偏碱性,沉淀溶解,溶液变为亮黄色,是Cr(OH)3被氧化为CrO42﹣,离子方程式为2Cr(OH)3+3H2O2+4OH﹣=2CrO42﹣+8H2O,
故答案为:2Cr(OH)3+3H2O2+4OH﹣=2CrO42﹣+8H2O;
(4)根据分析,pH较低时,溶液中存在Cr3+,而Cr3+不易被氧化,故溶液为Cr3+的颜色,为墨绿色;pH较高时,根据分析,混合物中存在Cr(OH)3和CrO2﹣,两者都可被过氧化氢氧化,得到CrO42﹣或Cr2O72﹣,故溶液颜色逐渐变为黄色或砖红色,
故答案为:pH较低时,溶液中存在Cr3+,而Cr3+不易被氧化,故溶液为Cr3+的颜色,为墨绿色;pH较高时,根据分析,混合物中存在Cr(OH)3和CrO2﹣,两者都可被过氧化氢氧化,得到CrO42﹣或Cr2O72﹣,故溶液颜色逐渐变为黄色或砖红色;
(5)根据分析,在碱性环境中,生成的红色物质CrO83﹣不稳定,该物质中O的化合价为﹣1价,自身的Cr与O发生氧化还原反应,反应后的物质再被H2O2氧化,得到亮黄色的CrO42﹣和O2,总反应为H2O2+2CrO83﹣=2CrO42﹣+4O2↑+2OH﹣,
故答案为:H2O2+2CrO83﹣=2CrO42﹣+4O2↑+2OH﹣;
(6)根据分析,探究浓度的影响时,需保证pH和温度不变,通过稀释,改变Cr3+浓度,观察反应后的现象,
故答案为:在一定温度和pH下,用不同浓度的Cr2(SO4)3溶液与H2O2反应,观察反应后的现象;
(7)根据分析,本实验探究了pH、温度、浓度不同时,对Cr(Ⅲ)与过氧化氢反应的影响,
故答案为:pH、温度、浓度。
同课章节目录
