2020-2021学年人教版必修1第三章金属及其化合物第二节几种重要的金属化合物同步训练
文档属性
| 名称 | 2020-2021学年人教版必修1第三章金属及其化合物第二节几种重要的金属化合物同步训练 |  | |
| 格式 | docx | ||
| 文件大小 | 318.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-11-19 18:29:58 | ||
图片预览



文档简介
本卷由系统自动生成,请仔细校对后使用,答案仅供参考。
2020-2021学年人教版必修1第三章金属及其化合物第二节几种重要的金属化合物同步训练
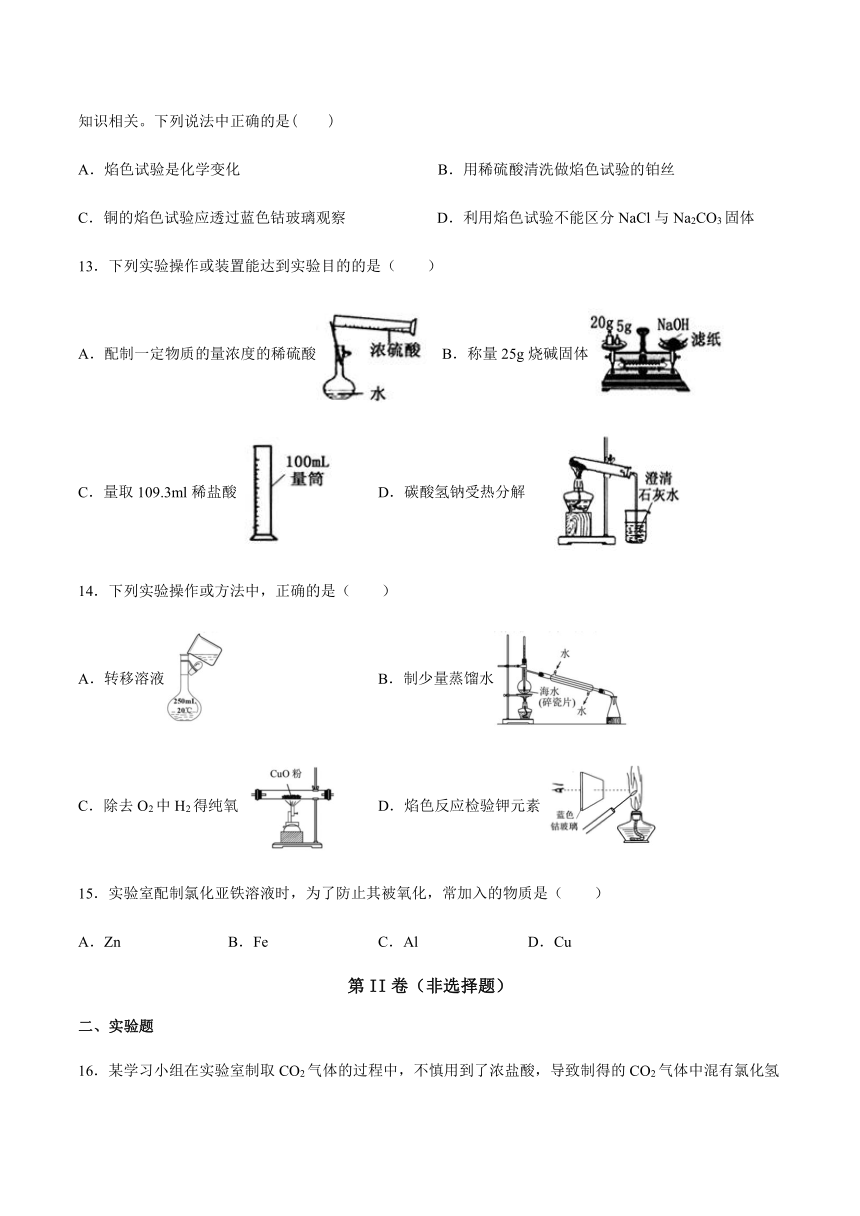
第I卷(选择题)
一、单选题
1.下列所示实验合理的是( )
A.氢氧化钠的称量
B.点燃酒精灯
C.配制硫酸溶液
D.制取并观察Fe?(OH)2沉淀
2.下列有关钠元素等的叙述中,错误的是( )
A.单质钠熔点低于100℃
B.Na与Na+都具有强的还原性
C.钠元素只能以化合态存在于自然界
D.金属钠具有好的导电性,但日常中不用作导线
3.实验室中,要使AlCl3溶液中的Al3+离子全部沉淀出来,适宜用的试剂是(
)
A.NaOH溶液
B.Ba(OH)2溶液
C.盐酸
D.氨水
4.下列有关焰色反应操作的描述正确的是( )
A.取一根洁净的细铂丝,放在酒精灯上灼烧至无色,再蘸取少量NaCl溶液,进行焰色反应
B.观察焰色反应时均要透过蓝色钴玻璃片,以便排除钠元素黄光的干扰
C.铂丝在做完氯化钠溶液的焰色反应后,用稀硫酸洗净,再蘸取少量的K2SO4溶液,重复以上实验
D.用洁净的铂丝蘸取某溶液,放在火焰上灼烧,观察到黄色火焰,则证明该溶液中一定有Na+,没有K+
5.下列反应与Na2O2+SO2=Na2SO4相比较,Na2O2的作用相同的是(
)
A.2Na2O2+2CO2=2Na2CO3
B.2Na2O2+SO3=2Na2SO4+O2↑
C.Na2O2+H2SO4=Na2SO4+H2O2
D.3Na2O2+Cr2O3=2Na2CrO4+
Na2O
6.下列关于Na2O2的叙述中正确的是( )
A.将过量Na2O2粉末加入紫色石蕊试液中振荡,溶液变为蓝色,且有气泡产生
B.将过量Na2O2粉末加入FeCl3溶液中并振荡,产生红褐色沉淀,且有气泡产生
C.凡是有Na2O2参与的反应,均能产生O2
D.Na2O2粉末在空气中长期放置不变质
7.在给定条件下,NaHCO3(溶液)Na2CO3(溶液)
NaOH(溶液),针对上述转化,下列说法正确的是( )
A.两步都能实现
B.第一步能实现,第二步不能实现
C.第一步不能实现,第二步能实现
D.两步都不能实现
8.2.3g
金属钠在一定温度的干燥氧气中被氧化后得到
3.7
g
固体,由此可判断其氧化物是(
)
A.只有Na2O
B.只有Na2O2
C.Na2O
和Na2O2
D.无法判断
9.下列实验操作正确的是(
)
选项
实验
操作
A
观察钠与水反应的现象
用镊子从煤油中取出金属钠,切下绿豆大的一块,小心放入装满水的烧杯中
B
除去NaHCO3
固体中的
Na2CO3
对固体混合物进行加热
C
证明
Na2O2
与水反应放出热量
Na2O2
用棉花包裹后滴几滴水,棉花燃烧说明该反应放出热量
D
检验
Na2CO3
与K2CO3
溶液
用铂丝分别蘸取溶液,在酒精灯外焰上灼烧,观察火焰的颜色
A.A
B.B
C.C
D.D
10.表格中,对陈述I、II的正确性及两者间是否具有因果关系的判断都正确的是(
)
选项
陈述Ⅰ
陈述Ⅱ
判断
A
苏打可用于治疗胃病
NaHCO3可与盐酸反应
Ⅰ对,Ⅱ对,有
B
向Na2O2的水溶液中滴入酚酞变红色
Na2O2与水反应生成氢氧化钠
Ⅰ对,Ⅱ错,无
C
金属钠具有强还原性
高压钠灯发出透雾性强的黄光
Ⅰ对,Ⅱ对,有
D
过氧化钠可用于航天员的供氧剂
Na2O2能和CO2、H2O反应生成O2
Ⅰ对,Ⅱ对,有
A.A
B.B
C.C
D.D
11.和溶液混合后,实际参加反应的离子是( )
A.、
B.、
C.、
D.、
12.焰火“脚印”“笑脸”“五环”,让北京奥运会开幕式更加辉煌、浪漫,这与高中化学中“焰色试验”知识相关。下列说法中正确的是( )
A.焰色试验是化学变化
B.用稀硫酸清洗做焰色试验的铂丝
C.铜的焰色试验应透过蓝色钴玻璃观察
D.利用焰色试验不能区分NaCl与Na2CO3固体
13.下列实验操作或装置能达到实验目的的是(
)
A.配制一定物质的量浓度的稀硫酸
B.称量25g烧碱固体
C.量取109.3ml稀盐酸
D.碳酸氢钠受热分解
14.下列实验操作或方法中,正确的是( )
A.转移溶液
B.制少量蒸馏水
C.除去O2中H2得纯氧
D.焰色反应检验钾元素
15.实验室配制氯化亚铁溶液时,为了防止其被氧化,常加入的物质是(
)
A.Zn
B.Fe
C.Al
D.Cu
第II卷(非选择题)
二、实验题
16.某学习小组在实验室制取CO2气体的过程中,不慎用到了浓盐酸,导致制得的CO2气体中混有氯化氢气体,他们设计了如下除去氯化氢气体并探究CO2与过氧化钠(Na2O2)反应的实验。查阅资料得知:过氧化钠(Na2O2)是一种淡黄色固体,能与CO2、H2O发生反应:2Na2O2+2CO2=2Na2CO3+O2
,2Na2O2+2H2O=4NaOH+O2
↑
请回答下列问题:
(1)装置A的作用是________。
(2)为确定反应后装置B硬质玻璃管中固体的成分,小组同学取适量固体于试管中,加入足量的蒸馏水溶解形成溶液M,无气泡产生,则该固体中不含_______,该小组同学继续进行探究。
(提出问题)反应后硬质玻璃管中固体的成分是什么?
(做出猜想)猜想一:Na2CO3;猜想二:NaOH;猜想三:Na2CO3和NaOH;
经过讨论,大家一致认为猜想______不合理,理由是________。
(实验验证)小组同学取上述形成的溶液M于试管中,向其中加入过量的_______溶液,若产生白色沉淀,过滤,向滤液中滴加几滴酚酞试液,溶液变红,则证明猜想三成立。
(交流反思)小组中有同学认为,将上述滤液中滴加的酚酞试液换成硝酸铜溶液,也能得出同样的结论,你认为该同学的观点_____
(填“正确”或“错误”),理由是_____
。
(拓展延伸)在盛有氯化铵(NH4Cl)浓溶液的试管中,加入足量的过氧化钠(Na2O2)固体,有气泡产生,产生的气体是_______和______
。
17.用脱脂棉包住约
0.2g
过氧化钠粉末,置于石棉网上,向脱脂棉上滴水,观察到脱脂棉剧烈燃烧起来。
(1)上述实验所利用的过氧化钠跟水反应的特点是:
第一,有氧气生成,第二,_________。Na2O2
跟水反应的离子方程式是_________。
(2)某研究性学习小组拟用如图所示装置(气密性良好)进行实验,以证明上述特点。用以验证反应的第一个特点的实验操作及现象是:_________。
用以验证第二个反应特点的实验操作及现象是:_________。
(3)实验(2)向试管中加水至固体完全溶解且不再有气泡生成后,取出试管,向试管中滴入酚酞试液,发现溶液先变红后褪色,为探究其原因,该小组同学从查阅有关资料中得知:Na2O2
与水反应可生成
H2O2,H2O2
具有强氧化性和漂白性。
请设计一个简单的实验,验证
Na2O2
跟足量水充分反应后的溶液中有
H2O2
存在。(只要求写出实验所用的试剂及观察到的现象)试剂:_________;现象:_________。
(4)该小组同学提出用定量的方法探究
Na2O2
跟水反应后的溶液中是否含有
H2O2,其实验方法为:
称取
2.6gNa2O2
固体,使之与足量的水反应,测量产生
O2
的体积并与理论值比较,即可得出结论:
测量气体体积时,必须等到试管和量筒内的气体都冷却至室温时进行,应选用如图装置中的(忽略导管在量筒中所占的体积,导管伸入量筒的长度不同)_________(填字母)
18.某化学兴趣小组用下图所示的装置做有关CO2气体的实验:
(1)甲同学将收集满CO2气体的试管倒插入紫色石蕊试液中(见装置A),并轻轻振荡试管。
①描述产生的现象:____。
②写出反应的化学方程式:______。
(2)乙同学挤压装置B中滴管的胶头,使其中的NaOH溶液滴入烧瓶,并轻轻振荡,系在导气管一端的气球慢慢胀大。产生这一现象的原因是____。
(3)滴加酚酞的Ba(OH)2溶液显红色,在上述溶液中分别滴加X溶液后有下列现象。下列说法不正确的是_________。
序号
装置
X溶液
现象
Ⅰ
盐酸
溶液红色褪去,无沉淀,灯泡亮度没有明显变化
Ⅱ
Na2SO4溶液
溶液红色不变,有白色沉淀生成,灯泡亮度没有明显变化
Ⅲ
H2SO4溶液
溶液红色褪去,有白色沉淀生成,灯泡逐渐变暗
A.实验Ⅰ中溶液红色褪去,说明发生了反应H++OH-=H2O
B.实验Ⅱ中溶液红色不变,且灯泡亮度没有明显变化,说明溶液中存在大量的Na+与OH-
C.实验Ⅲ中溶液红色褪去,有白色沉淀生成,灯泡逐渐变暗,说明发生了反应Ba2++2OH-+2H++=BaSO4↓+2H2O
D.将实验Ⅱ中Na2SO4溶液换成CuSO4溶液,现象与原实验Ⅱ中的现象相同
参考答案
1.D2.C3.D4.A5.D6.B7.A8.C9.C10.D11.D12.D13.D14.D15.B
16.吸收CO2中混有的HCl
Na2O2
二
根据质量守恒定律,反应前后元素的种类不变,反应前有碳元素,反应后也应有碳元素
BaCl2
正确
因为氢氧化钠和硫酸铜反应生成氢氧化铜蓝色沉淀,如果有蓝色沉淀生成,说明固体中含有氢氧化钠
O2
NH3
17.放出大量的热
2Na2O2+2H2O=4Na++4OH-+O2↑
将带火星的木条放在P口处,木条复燃
将Q口插入到盛水的烧杯中,有气泡产生
MnO2
使带火星的木条复燃
B
18.试管内形成一段液柱,溶液变浅红色
CO2+H2O
H2CO3
瓶内因发生CO2+NaOH=NaHCO3,使瓶内气体压强减小
D
2020-2021学年人教版必修1第三章金属及其化合物第二节几种重要的金属化合物同步训练
第I卷(选择题)
一、单选题
1.下列所示实验合理的是( )
A.氢氧化钠的称量
B.点燃酒精灯
C.配制硫酸溶液
D.制取并观察Fe?(OH)2沉淀
2.下列有关钠元素等的叙述中,错误的是( )
A.单质钠熔点低于100℃
B.Na与Na+都具有强的还原性
C.钠元素只能以化合态存在于自然界
D.金属钠具有好的导电性,但日常中不用作导线
3.实验室中,要使AlCl3溶液中的Al3+离子全部沉淀出来,适宜用的试剂是(
)
A.NaOH溶液
B.Ba(OH)2溶液
C.盐酸
D.氨水
4.下列有关焰色反应操作的描述正确的是( )
A.取一根洁净的细铂丝,放在酒精灯上灼烧至无色,再蘸取少量NaCl溶液,进行焰色反应
B.观察焰色反应时均要透过蓝色钴玻璃片,以便排除钠元素黄光的干扰
C.铂丝在做完氯化钠溶液的焰色反应后,用稀硫酸洗净,再蘸取少量的K2SO4溶液,重复以上实验
D.用洁净的铂丝蘸取某溶液,放在火焰上灼烧,观察到黄色火焰,则证明该溶液中一定有Na+,没有K+
5.下列反应与Na2O2+SO2=Na2SO4相比较,Na2O2的作用相同的是(
)
A.2Na2O2+2CO2=2Na2CO3
B.2Na2O2+SO3=2Na2SO4+O2↑
C.Na2O2+H2SO4=Na2SO4+H2O2
D.3Na2O2+Cr2O3=2Na2CrO4+
Na2O
6.下列关于Na2O2的叙述中正确的是( )
A.将过量Na2O2粉末加入紫色石蕊试液中振荡,溶液变为蓝色,且有气泡产生
B.将过量Na2O2粉末加入FeCl3溶液中并振荡,产生红褐色沉淀,且有气泡产生
C.凡是有Na2O2参与的反应,均能产生O2
D.Na2O2粉末在空气中长期放置不变质
7.在给定条件下,NaHCO3(溶液)Na2CO3(溶液)
NaOH(溶液),针对上述转化,下列说法正确的是( )
A.两步都能实现
B.第一步能实现,第二步不能实现
C.第一步不能实现,第二步能实现
D.两步都不能实现
8.2.3g
金属钠在一定温度的干燥氧气中被氧化后得到
3.7
g
固体,由此可判断其氧化物是(
)
A.只有Na2O
B.只有Na2O2
C.Na2O
和Na2O2
D.无法判断
9.下列实验操作正确的是(
)
选项
实验
操作
A
观察钠与水反应的现象
用镊子从煤油中取出金属钠,切下绿豆大的一块,小心放入装满水的烧杯中
B
除去NaHCO3
固体中的
Na2CO3
对固体混合物进行加热
C
证明
Na2O2
与水反应放出热量
Na2O2
用棉花包裹后滴几滴水,棉花燃烧说明该反应放出热量
D
检验
Na2CO3
与K2CO3
溶液
用铂丝分别蘸取溶液,在酒精灯外焰上灼烧,观察火焰的颜色
A.A
B.B
C.C
D.D
10.表格中,对陈述I、II的正确性及两者间是否具有因果关系的判断都正确的是(
)
选项
陈述Ⅰ
陈述Ⅱ
判断
A
苏打可用于治疗胃病
NaHCO3可与盐酸反应
Ⅰ对,Ⅱ对,有
B
向Na2O2的水溶液中滴入酚酞变红色
Na2O2与水反应生成氢氧化钠
Ⅰ对,Ⅱ错,无
C
金属钠具有强还原性
高压钠灯发出透雾性强的黄光
Ⅰ对,Ⅱ对,有
D
过氧化钠可用于航天员的供氧剂
Na2O2能和CO2、H2O反应生成O2
Ⅰ对,Ⅱ对,有
A.A
B.B
C.C
D.D
11.和溶液混合后,实际参加反应的离子是( )
A.、
B.、
C.、
D.、
12.焰火“脚印”“笑脸”“五环”,让北京奥运会开幕式更加辉煌、浪漫,这与高中化学中“焰色试验”知识相关。下列说法中正确的是( )
A.焰色试验是化学变化
B.用稀硫酸清洗做焰色试验的铂丝
C.铜的焰色试验应透过蓝色钴玻璃观察
D.利用焰色试验不能区分NaCl与Na2CO3固体
13.下列实验操作或装置能达到实验目的的是(
)
A.配制一定物质的量浓度的稀硫酸
B.称量25g烧碱固体
C.量取109.3ml稀盐酸
D.碳酸氢钠受热分解
14.下列实验操作或方法中,正确的是( )
A.转移溶液
B.制少量蒸馏水
C.除去O2中H2得纯氧
D.焰色反应检验钾元素
15.实验室配制氯化亚铁溶液时,为了防止其被氧化,常加入的物质是(
)
A.Zn
B.Fe
C.Al
D.Cu
第II卷(非选择题)
二、实验题
16.某学习小组在实验室制取CO2气体的过程中,不慎用到了浓盐酸,导致制得的CO2气体中混有氯化氢气体,他们设计了如下除去氯化氢气体并探究CO2与过氧化钠(Na2O2)反应的实验。查阅资料得知:过氧化钠(Na2O2)是一种淡黄色固体,能与CO2、H2O发生反应:2Na2O2+2CO2=2Na2CO3+O2
,2Na2O2+2H2O=4NaOH+O2
↑
请回答下列问题:
(1)装置A的作用是________。
(2)为确定反应后装置B硬质玻璃管中固体的成分,小组同学取适量固体于试管中,加入足量的蒸馏水溶解形成溶液M,无气泡产生,则该固体中不含_______,该小组同学继续进行探究。
(提出问题)反应后硬质玻璃管中固体的成分是什么?
(做出猜想)猜想一:Na2CO3;猜想二:NaOH;猜想三:Na2CO3和NaOH;
经过讨论,大家一致认为猜想______不合理,理由是________。
(实验验证)小组同学取上述形成的溶液M于试管中,向其中加入过量的_______溶液,若产生白色沉淀,过滤,向滤液中滴加几滴酚酞试液,溶液变红,则证明猜想三成立。
(交流反思)小组中有同学认为,将上述滤液中滴加的酚酞试液换成硝酸铜溶液,也能得出同样的结论,你认为该同学的观点_____
(填“正确”或“错误”),理由是_____
。
(拓展延伸)在盛有氯化铵(NH4Cl)浓溶液的试管中,加入足量的过氧化钠(Na2O2)固体,有气泡产生,产生的气体是_______和______
。
17.用脱脂棉包住约
0.2g
过氧化钠粉末,置于石棉网上,向脱脂棉上滴水,观察到脱脂棉剧烈燃烧起来。
(1)上述实验所利用的过氧化钠跟水反应的特点是:
第一,有氧气生成,第二,_________。Na2O2
跟水反应的离子方程式是_________。
(2)某研究性学习小组拟用如图所示装置(气密性良好)进行实验,以证明上述特点。用以验证反应的第一个特点的实验操作及现象是:_________。
用以验证第二个反应特点的实验操作及现象是:_________。
(3)实验(2)向试管中加水至固体完全溶解且不再有气泡生成后,取出试管,向试管中滴入酚酞试液,发现溶液先变红后褪色,为探究其原因,该小组同学从查阅有关资料中得知:Na2O2
与水反应可生成
H2O2,H2O2
具有强氧化性和漂白性。
请设计一个简单的实验,验证
Na2O2
跟足量水充分反应后的溶液中有
H2O2
存在。(只要求写出实验所用的试剂及观察到的现象)试剂:_________;现象:_________。
(4)该小组同学提出用定量的方法探究
Na2O2
跟水反应后的溶液中是否含有
H2O2,其实验方法为:
称取
2.6gNa2O2
固体,使之与足量的水反应,测量产生
O2
的体积并与理论值比较,即可得出结论:
测量气体体积时,必须等到试管和量筒内的气体都冷却至室温时进行,应选用如图装置中的(忽略导管在量筒中所占的体积,导管伸入量筒的长度不同)_________(填字母)
18.某化学兴趣小组用下图所示的装置做有关CO2气体的实验:
(1)甲同学将收集满CO2气体的试管倒插入紫色石蕊试液中(见装置A),并轻轻振荡试管。
①描述产生的现象:____。
②写出反应的化学方程式:______。
(2)乙同学挤压装置B中滴管的胶头,使其中的NaOH溶液滴入烧瓶,并轻轻振荡,系在导气管一端的气球慢慢胀大。产生这一现象的原因是____。
(3)滴加酚酞的Ba(OH)2溶液显红色,在上述溶液中分别滴加X溶液后有下列现象。下列说法不正确的是_________。
序号
装置
X溶液
现象
Ⅰ
盐酸
溶液红色褪去,无沉淀,灯泡亮度没有明显变化
Ⅱ
Na2SO4溶液
溶液红色不变,有白色沉淀生成,灯泡亮度没有明显变化
Ⅲ
H2SO4溶液
溶液红色褪去,有白色沉淀生成,灯泡逐渐变暗
A.实验Ⅰ中溶液红色褪去,说明发生了反应H++OH-=H2O
B.实验Ⅱ中溶液红色不变,且灯泡亮度没有明显变化,说明溶液中存在大量的Na+与OH-
C.实验Ⅲ中溶液红色褪去,有白色沉淀生成,灯泡逐渐变暗,说明发生了反应Ba2++2OH-+2H++=BaSO4↓+2H2O
D.将实验Ⅱ中Na2SO4溶液换成CuSO4溶液,现象与原实验Ⅱ中的现象相同
参考答案
1.D2.C3.D4.A5.D6.B7.A8.C9.C10.D11.D12.D13.D14.D15.B
16.吸收CO2中混有的HCl
Na2O2
二
根据质量守恒定律,反应前后元素的种类不变,反应前有碳元素,反应后也应有碳元素
BaCl2
正确
因为氢氧化钠和硫酸铜反应生成氢氧化铜蓝色沉淀,如果有蓝色沉淀生成,说明固体中含有氢氧化钠
O2
NH3
17.放出大量的热
2Na2O2+2H2O=4Na++4OH-+O2↑
将带火星的木条放在P口处,木条复燃
将Q口插入到盛水的烧杯中,有气泡产生
MnO2
使带火星的木条复燃
B
18.试管内形成一段液柱,溶液变浅红色
CO2+H2O
H2CO3
瓶内因发生CO2+NaOH=NaHCO3,使瓶内气体压强减小
D
