2020学年高中化学人教版必修1第4章《非金属及其化合物》测试卷 (含解析)
文档属性
| 名称 | 2020学年高中化学人教版必修1第4章《非金属及其化合物》测试卷 (含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 92.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-11-19 18:34:27 | ||
图片预览




文档简介
第4章《非金属及其化合物》测试卷
一、单选题(共15小题)
1.在一定温度和压强下,把装有NO和NO2的混合气体的试管倒立于水中,充分反应后,试管内气体的体积缩小为原气体体积的,则原混合气体中NO和NO2的体积比为( )
A.
3∶l
B.
1∶3
C.
2∶3
D.
3∶2
2.宁夏的硒砂瓜现今已享誉区内外,西瓜富含硒元素,有延年益寿、抗衰老、抗癌作用,因之得名“硒砂瓜”。二氧化硒(SeO2)是一种氧化剂,其被还原后的单质硒可能成为环境污染物,通过与浓硝酸或浓硫酸反应生成二氧化硒以回收硒。
在回收过程当中涉及到如下化学反应:
①SeO2+4KI+4HNO3===Se+2I2+4KNO3+2H2O;
②Se+2H2SO4(浓)===2SO2↑+SeO2+2H2O。
下列有关叙述正确的是( )
A.
二氧化硒、浓硫酸、碘的氧化性由强到弱的顺序是浓硫酸>二氧化硒>碘
B.
①中硒是氧化产物,碘是还原产物
C.
反应①中碘化钾是氧化剂,二氧化硒是还原剂
D.
反应①中每有0.6
mol
碘生成,转移电子数目为2.4NA
3.能证明硅酸的酸性弱于碳酸酸性的实验事实是( )
A.
二氧化碳通入可溶性硅酸盐溶液中析出硅酸沉淀
B.
二氧化碳溶于水形成碳酸,二氧化硅难溶于水
C.
高温下,二氧化硅与碳酸盐反应生成二氧化碳
D.
在可溶性硅酸盐溶液中加入盐酸会析出硅酸沉淀
4.自来水厂常使用氯气消毒,市场上有些小商小贩用自来水充当纯净水出售。下列试剂中,可用来辨其真伪的是( )
A.
酚酞溶液
B.
氯化钡溶液
C.
氢氧化钠溶液
D.
硝酸银溶液
5.工业上用洗净的废铜屑作原料来制备硝酸铜,为节约原料和防止环境污染,宜采用的方法是( )
A.
Cu+HNO3(稀)―→Cu(NO3)2
B.
Cu+HNO3(浓)―→Cu(NO3)2
C.
CuCuSO4Cu(NO3)2
D.
CuCuOCu(NO3)2
6.下列有关SiO2的叙述不正确的是( )
A.
沙子、石英、水晶的主要成分都是SiO2
B.
SiO2是制作光导纤维的主要原料
C.
H2SiO3可由SiO2直接制得
D.
SiO2是酸性氧化物,一定条件下可与碱性氧化物或碱反应
7.实验室收集①一氧化氮、②二氧化氮两种气体,下列收集方法正确的是( )
A.
①和②都用排水法
B.
①和②都用向上排空气法
C.
①用向上排空气法,②用排水法
D.
①用排水法,②向上排空气法
8.用加热的方法可以分离的一组物质是( )
A.
氯化铵和消石灰
B.
碳酸氢铵和过氧化钠
C.
氯化铵和氯化钠
D.
碘和氯化铵
9.关于下列反应的叙述正确的是( )
A.
由SiO2+2CSi+2CO↑可推知硅的非金属性比碳强
B.
由CaCO3+SiO2CaSiO3+CO2↑可推知H2SiO3的酸性比H2CO3强
C.
由Na2SiO3+CO2+H2O===Na2CO3+H2SiO3↓可推知碳的非金属性比硅强
D.
由Na2CO3+SiO2Na2SiO3+CO2↑可推知H2SiO3的酸性比H2CO3强
10.我国已跨入“互联网+”时代,而“互联网+”的建设离不开无机非金属材料硅。下列物品中用到硅单质的是( )
A.
陶瓷餐具
B.
石英钟表
C.
计算机芯片
D.
光导纤维
11.下列过程没有起到氮的固定作用的是( )
A.
氮气与氧气反应生成一氧化氮
B.
氮气与氢气在一定条件下合成氨
C.
氨催化氧化生成一氧化氮
D.
豆科植物根瘤菌将空气中氮气转化为含氮化合物
12.下列关于硅酸盐材料的说法错误的是( )
A.
生活中常见的硅酸盐材料有玻璃、水泥、陶瓷
B.
普通玻璃的主要成分是二氧化硅
C.
陶瓷的主要原料是黏土
D.
硅酸盐水泥以石灰石和黏土为主要原料
13.下列关于漂白粉的叙述正确的是( )
A.
漂白粉的有效成分是次氯酸钙和氯化钙
B.
漂白粉在空气中久置后会变质
C.
漂白粉是将氯气通入石灰水中制得
D.
漂白粉的主要成分是氯化钙
14.下列关于二氧化硅和二氧化碳的说法中不正确的是( )
A.
都是酸性氧化物
B.
都能与水反应
C.
都与氢氧化钠溶液反应
D.
高温下都与单质碳反应
15.下列关于液氯和氯水的说法不正确的是( )
A.
常温常压下液氯是一种黄绿色的液体
B.
在加压条件下氯气转化为液氯,可用干燥的钢瓶储存液氯
C.
新制氯水在光照条件下放出气体的主要成分是氧气
D.
新制氯水可以使蓝色石蕊试纸先变红后褪色
二、实验题(共3小题)
16.(1)实验室用金属铜和稀硝酸制取NO的离子方程式为______________________。
(2)NO是有毒气体,某学生为防止污染,用分液漏斗和烧杯装配了一套简易的、能随开随用、随关随停的NO气体发生装置,如图甲所示。
①实验室若没有铜丝,而只有小铜粒,在使用上述装置进行实验时,可用丝状材料包裹铜粒以代替铜丝进行实验,这种丝状材料的成分可以是________(填序号)。
A.铁
B.铝
C.铂
D.玻璃
②打开分液漏斗的活塞使反应进行,在分液漏斗中实际看到的气体是红棕色的,原因是______________(填化学方程式)。
(3)为证明铜丝与稀硝酸反应生成的确实是NO,某学生另设计了一套如图乙所示的装置制取NO。反应开始后,可以在U形管右端观察到无色的NO气体。
①长玻璃管的作用是______________________________________________________。
②让反应停止的操作方法及原因是__________________________________________。
(4)以下收集NO气体的装置,合理的是________(填序号)。
(5)将32.64
g铜与140
mL一定浓度的硝酸反应,铜完全溶解产生的NO和NO2混合气体在标准状况下的体积为11.2
L。请回答:
①NO的体积为________
L,NO2的体积为________
L。
②待产生的气体全部释放后,向溶液中加入VmLamol·L-1的NaOH溶液,恰好使溶液中的Cu2+全部转化成沉淀,则原硝酸溶液的浓度为________
mol·L-1。
17.科学的实验方法为我们探索物质世界提供了一把金钥匙,下列实验方法或操作正确的是________。
A.两种互不相溶的液体,如汽油和水,可通过分液方法分离
B.因为碘易溶于酒精,所以常用酒精萃取碘水中的碘
C.观察钾元素焰色反应的操作:先将铂丝放在稀硫酸中洗涤,然后蘸取固体氯化钾,置于酒精灯的外焰上进行灼烧,透过蓝色钴玻璃进行观察
D.将饱和FeCl3溶液滴入沸水中可得Fe(OH)3胶体,区别溶液和胶体的方法是丁达尔效应
E.分液时,先打开分液漏斗活塞,放出下层液体,再关闭活塞,从漏斗上口倒出上层液体
F.向新制的FeSO4溶液中滴入适量的NaOH溶液,放置片刻,整个反应过程的颜色变化:浅绿色溶液→白色沉淀→灰绿色沉淀→红褐色沉淀
G.为除粗盐中的可溶性杂质,先加氯化钡后加碳酸钠,最后加盐酸后过滤
H.在天平左右两盘中各放一张白纸后,即可将NaOH固体放在白纸上称量
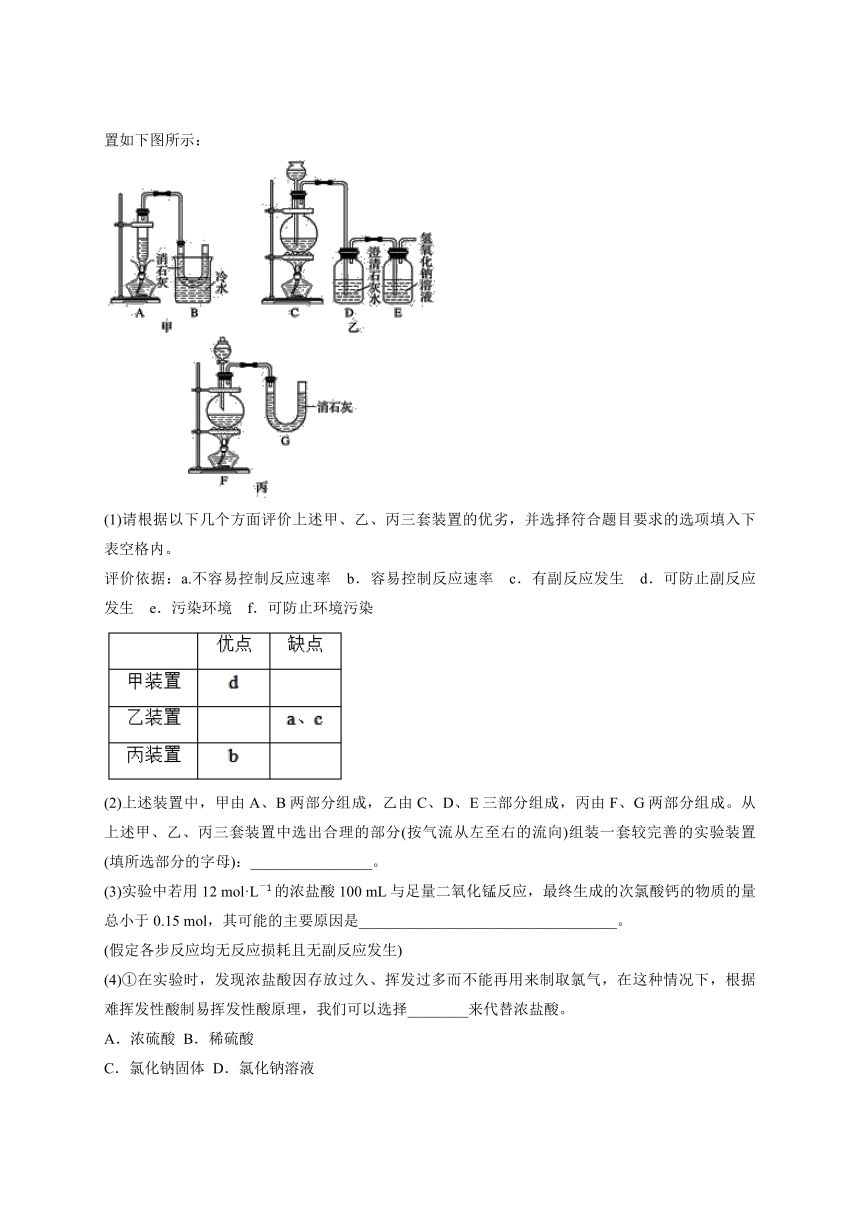
18.使用浓盐酸、二氧化锰共热制氯气,并用氯气和氢氧化钙反应制取少量漂白粉。已知:常温下,2Cl2+2Ca(OH)2===CaCl2+Ca(ClO)2+2H2O;温度稍高,即发生副反应:6Cl2+6Ca(OH)2△,5CaCl2+Ca(ClO3)2+6H2O;3Ca(ClO)2△,2CaCl2+Ca(ClO3)2。甲、乙、丙三位同学分别设计了三个实验装置如下图所示:
(1)请根据以下几个方面评价上述甲、乙、丙三套装置的优劣,并选择符合题目要求的选项填入下表空格内。
评价依据:a.不容易控制反应速率 b.容易控制反应速率 c.有副反应发生 d.可防止副反应发生 e.污染环境 f.可防止环境污染
(2)上述装置中,甲由A、B两部分组成,乙由C、D、E三部分组成,丙由F、G两部分组成。从上述甲、乙、丙三套装置中选出合理的部分(按气流从左至右的流向)组装一套较完善的实验装置(填所选部分的字母):________________。
(3)实验中若用12
mol·L-1的浓盐酸100
mL与足量二氧化锰反应,最终生成的次氯酸钙的物质的量总小于0.15
mol,其可能的主要原因是__________________________________。
(假定各步反应均无反应损耗且无副反应发生)
(4)①在实验时,发现浓盐酸因存放过久、挥发过多而不能再用来制取氯气,在这种情况下,根据难挥发性酸制易挥发性酸原理,我们可以选择________来代替浓盐酸。
A.浓硫酸
B.稀硫酸
C.氯化钠固体
D.氯化钠溶液
②依据实验室制氯气原理,还可有以下方式来制取氯气,如果要制得等物质的量的氯气,消耗盐酸量最小的是________。
A.MnO2+4HCl(浓)△,MnCl2+Cl2↑+2H2O
B.2KMnO4+16HCl(浓)===2KCl+2MnCl2+5Cl2↑+8H2O
C.KClO3+6HCl(浓)===KCl+3Cl2↑+3H2O
D.Ca(ClO)2+4HCl(浓)===CaCl2+2Cl2↑+2H2O
(5)从发生装置出来的氯气常混有氯化氢,氯化氢消耗氢氧化钙。为了降低损耗,必须除去氯气中混有的氯化氢,下列装置符合实验要求的是________。
三、计算题(共3小题)
19.将充满二氧化氮和氧气的混合气体的量筒倒置于水中,充分反应后,保持气体压强不变,水进入至量筒体积的一半处停止了,则原混合气体中二氧化氮和氧气的体积比是多少?
20.将10
mL充满NO2和O2的混合气体的试管,倒置在水槽中,反应停止后试管内剩余2
mL的无色气体,求原混合气体中NO2和O2各多少毫升?
21.某硫酸厂使用含杂质25%的黄铁矿制取硫酸,在反应过程中有3%的硫元素损失。1
t黄铁矿可制取98%的硫酸多少吨?
四、填空题(共3小题)
22.用滴管把新制的氯水逐滴加到含有酚酞的氢氧化钠溶液中,当加到最后一滴时,溶液的红色突然消失。对产生实验现象的原因有两种推测:
①是氯水中的次氯酸的漂白性使它由红色变成无色;
②是氯水的酸性(H+)使它由红色变成无色。
假设其中一种是正确的,请你设计一个实验,由实验现象对以上的推测作出判断。
(1)要使用的实验用品:______________________________________;
(2)要进行的实验操作:________________________________________________________;
(3)实验现象和结论:______________________________________________________。
23.将盛有氮气和二氧化氮混合气体的试管(试管容积为VL)倒立于水中,经过足够长的时间后,试管内气体的体积变为aL。请回答下列问题:
(1)该混合气体倒立于水中发生反应的化学方程式是______________________。
(2)若a=V,则原混合气体中氮气与二氧化氮的体积之比是__________。
(3)结合第(2)小题,向aL气体中通入氧气至试管中刚好只有一种气体时,停止通入氧气。
①试管中最终剩余的气体是____________,其体积是____________。
②该过程中总反应的化学方程式是__________________。
24.有MgO、Al2O3、SiO2、Fe2O3组成的混合粉末。现取两份该混合粉末试样进行实验。
(1)将一份混合粉末溶于过量的盐酸,得到沉淀X和滤液Y,
①沉淀X为_______(填化学式,下同),
滤液Y中含有的阳离子主要是________________。
②向滤液Y中加入过量氢氧化钠溶液,得到的沉淀是______________________。
(2)将另一份混合粉末溶于过量氢氧化钠溶液,发生反应的离子方程式为_______________。
答案解析
1.【答案】B
【解析】NO2和NO的混合气体通入倒立于水槽中的试管中发生反应为3NO2+H2O2HNO3+
NO。
设原混合的气体的体积是2,则反应后的气体体积是1,
V(NO2)==
原气体中V(NO)=2-﹣==
所以原混合气体中NO2和NO的体积比=V(NO)∶V(NO2)==∶:=1∶3,B正确。
2.【答案】A
【解析】氧化还原反应中,氧化剂氧化性强于氧化产物的氧化性,由反应①可知二氧化硒的氧化性强于碘,由反应②可知浓硫酸的氧化性强于二氧化硒;在反应①中二氧化硒是氧化剂,硒是还原产物;碘化钾是还原剂,碘是氧化产物;当有0.6
mol碘生成时,转移电子的数目为1.2NA。
3.【答案】A
【解析】二氧化碳通入可溶性硅酸盐中,析出硅酸沉淀,符合较强酸制取较弱酸的反应原理,可以证明硅酸的酸性比碳酸的酸性弱;可溶性硅酸盐溶液能与盐酸反应生成硅酸沉淀,能说明硅酸的酸性比盐酸弱,不能说明硅酸的酸性比碳酸弱;物质的酸性强弱与相应的氧化物的物理性质(如溶解性、熔点等)无关;高温下,二氧化硅能与碳酸盐反应,是因为生成了二氧化碳气体逸出,使反应持续进行。
4.【答案】D
【解析】辨其真伪的关键是检验氯元素的残留。Cl2+H2O===HCl+HClO,氯水中存在氢离子显酸性,遇酚酞不变色,A不符合题意;与氯化钡溶液不反应,B不符合题意;与氢氧化钠发生中和反应无明显现象,C不符合题意;氯水中存在氯离子,能与硝酸银反应生成白色沉淀,D符合题意。
5.【答案】D
【解析】制备等量的硝酸铜,D项消耗的硝酸最少,且不产生大气污染物(SO2、NO、NO2等)。
6.【答案】C
【解析】沙子、石英、水晶的主要成分都是SiO2,A项正确;SiO2可用来制造光导纤维,B项正确;SiO2不能与水反应直接生成H2SiO3,C项不正确;SiO2是酸性氧化物,一定条件下可与碱性氧化物或碱反应,例如SiO2与NaOH溶液反应生成Na2SiO3和H2O,在高温条件下SiO2与生石灰反应生成CaSiO3,D项正确。
7.【答案】D
【解析】一氧化氮不溶于水,易与空气中的氧气反应,一氧化氮不能用向上排空气法收集,应用排水法收集;二氧化氮易溶于水且与水反应,不能用排水法收集,二氧化氮的密度比空气大,应用向上排空气法收集。
8.【答案】C
【解析】用加热的方法不能分离A、B、D组物质:氯化铵与消石灰加热时可反应生成氯化钙、氨气和水;碳酸氢铵受热时分解生成氨气、二氧化碳和水,二氧化碳和水都能与过氧化钠反应;受热时碘变为蒸气,氯化铵分解生成氨气和氯化氢,同时逸出,冷却时重新变为固体碘和氯化铵混合在一起。氯化钠固体受热无变化,氯化铵受热分解,生成的氨气和氯化氢从混合物中逸出,温度降低时氨气与氯化氢又迅速化合生成氯化铵,
C组物质可用加热、冷却的方法分离。
9.【答案】C
【解析】本题的易错之处一是根据反应式SiO2+2CSi+2CO↑认为硅的非金属性比碳强,错选A;二是根据反应式CaCO3+SiO2CaSiO3+CO2↑、Na2CO3+SiO2Na2SiO3+CO2↑认为H2SiO3的酸性比H2CO3强,错选B、D。A项,硅的非金属性比碳弱;B、D项,反应均是在非溶液状态下进行的,因此无法判断H2SiO3与H2CO3的酸性强弱;C项,碳酸与硅酸钠溶液反应生成硅酸说明H2CO3的酸性比H2SiO3强,由此可知碳的非金属性比硅强,C项正确。
10.【答案】C
【解析】陶瓷餐具是硅酸盐产品,主要成分为硅酸盐,故A错误;
石英主要成分为二氧化硅,不是单质硅,故B错误;
硅单质是半导体材料,可以制计算机芯片,故C正确;
光导纤维成分为二氧化硅,是硅的氧化物,不是单质硅,故D错误;
故选C。
11.【答案】C
【解析】氮的固定指游离态的氮反应生成化合态的氮,即将氮气转化为含氮化合物的过程。
氨气和一氧化氮都是化合物,它们间的转化不是氮的固定。
12.【答案】B
【解析】普通玻璃主要成分为Na2SiO3、CaSiO3和SiO2,组成用氧化物可表示为Na2O·CaO·6SiO2,B错误。
13.【答案】B
【解析】漂白粉是由氯气和石灰乳反应制得,它的主要成分是次氯酸钙和氯化钙,有效成分是次氯酸钙,
A、C、D不正确;次氯酸钙易与空气中的二氧化碳、水反应而失效,故B正确。
14.【答案】B
【解析】二氧化硅和二氧化碳都是酸性氧化物,都能与碱性氧化物(如氧化钙)、碱(如氢氧化钠)溶液反应;二氧化碳能溶于水,与水能反应生成碳酸,而二氧化硅不溶于水,与水不反应;高温下,二氧化硅能与碳反应生成硅和一氧化碳(或碳化硅和一氧化碳),二氧化碳与碳反应生成一氧化碳。
15.【答案】A
【解析】常温常压下,液氯气化为氯气;新制的氯水中含有氢离子和次氯酸,能使蓝色石蕊试纸先变红后褪色;光照条件下次氯酸分解生成盐酸和氧气。
16.【答案】(1)3Cu+8H++2NO===3Cu2++4H2O+2NO↑
(2)①CD
②2NO+O2===2NO2
(3)①接收被气体压出U形管的液体,防止稀硝酸溢出 ②关闭U形管右端导气管上的活塞;反应产生的气体将U形管右端管内的稀硝酸向下压,使铜丝与稀硝酸分开,反应就会停止
(4)CD
(5)①5.8 5.4 ②
【解析】(1)离子方程式的书写,要注意电荷守恒。(2)①包裹铜粒的丝状材料不能与稀硝酸反应,所以A、B项不行;②红棕色的气体是NO2,原因是生成的NO与空气中的氧气反应。(3)该实验装置是防止产生的气体与空气接触,长玻璃管的作用是接收被气体压出U形管的稀硝酸,防止稀硝酸溢出;关闭活塞,产生的气体使稀硝酸液面下降,从而铜丝与稀硝酸分开,反应停止。(4)不能用排空气法收集NO,因为NO与空气中的氧气反应,只能用排水法,C和D装置符合题意,E装置是洗气装置。(5)①设混合气体中NO的物质的量为x,NO2物质的量为y。可得:x+y=0.5
mol 3x+y=0.51
mol×2,解方程组得:x=0.26
mol,y=0.24
mol.所以NO的体积为0.26
mol×22.4
L·mol-1≈5.8
L;NO2的体积为11.2
L-5.8
L=5.4
L。②根据质量守恒定律进行考虑。HNO3在反应中要么变成气体,要么以NO的形式留在溶液中。容易算出变成气体的HNO3的物质的量为0.5
mol;加入NaOH溶液至正好使溶液中Cu2+全部转化为沉淀,则溶液中只有NaNO3,其物质的量为10-3aVmol,也就是以NO形式留在溶液中的HNO3的物质的量为10-3aVmol。所以,HNO3的浓度为mol·L-1。
17.【答案】ADEF
【解析】两种互不相溶的液体分层,选择分液法分离,如汽油和水,故A选;酒精与水互溶,则酒精不能作萃取剂,故B不选;在稀硫酸中洗涤,硫酸不挥发,干扰实验,则应选盐酸洗涤,故C不选;饱和FeCl3溶液滴入沸水,水解可制备胶体,且丁达尔效应为胶体特有的性质,则区别溶液和胶体的方法是丁达尔效应,故D选;分液时避免上下层液体混合,则先打开分液漏斗活塞,放出下层液体,再关闭活塞,从漏斗上口倒出上层液体,故E选;生成的氢氧化亚铁易被氧化,则向新制的FeSO4溶液中滴入适量的NaOH溶液,放置片刻,整个反应过程的颜色变化:浅绿色溶液→白色沉淀→灰绿色沉淀→红褐色沉淀,故F选;除杂试剂过量,碳酸钠在氯化钡之后可除去过量的钡离子,则为除粗盐中的可溶性杂质,先加氯化钡后加碳酸钠,过滤后,再加盐酸蒸发,故G不选;NaOH潮解,具有腐蚀性,应在小烧杯中称量,NaOH固体放在左盘的小烧杯中称量,故H不选。
18.【答案】 (1)甲:a、e 乙:f 丙:c、e (2)F、B、E (3)二氧化锰只能氧化浓盐酸,随着反应的进行,盐酸浓度减小,最后成为稀盐酸,反应不能进行,即氯化氢不能完全反应 (4)①AC ②CD (5)A
【解析】 (1)根据装置分析差异,对照评价依据对号入座。甲装置缺点:制氯气时,直接将浓盐酸与二氧化锰混合,不容易控制反应速率,没有处理尾气,会污染环境;乙装置优点:用氢氧化钠溶液吸收尾气,不会污染环境;丙装置缺点是没有控制氯气与氢氧化钙反应的温度,有副反应发生,没有处理尾气,氯气排入空气中污染环境。(2)氯气的发生装置选择F,能控制反应速率;氯气与氢氧化钙的反应装置选择B,用冷水冷却,减少副反应发生;尾气处理装置选择E。(3)不考虑副反应,n(HCl)=0.1
L×12
mol·L-1=1.2
mol,假设氯化氢完全反应,生成氯气为n(Cl2)=0.3
mol,全部与氢氧化钙反应,生成次氯酸钙为n[Ca(ClO)2]=0.15
mol。实际上,浓盐酸变成稀盐酸时,反应停止,即盐酸中氯化氢不能完全反应,故产生氯气量比理论值(按盐酸制氯气量)少,制得漂白粉质量偏少。(4)浓硫酸是高沸点酸,浓盐酸是易挥发酸,实验室可以用浓硫酸与氯化钠固体代替浓盐酸。根据化学方程式,比较生成1
mol氯气需要氯化氢的物质的量。(5)除去氯气中的氯化氢,不能损失氯气,没有必要干燥氯气,应选饱和食盐水,碱石灰和氢氧化钠溶液都会吸收Cl2,故A装置符合题意。
19.【答案】2∶3
【解析】3NO2+H2O===2HNO3+NO
①
,2NO+O2===2NO2②,由方程式①×2+②得4NO2+O2+2H2O===4HNO3③;由方程式①×2+②×3得4NO+3O2+2H2O===4HNO3④。二氧化氮和氧气的体积比不等于4∶1,需讨论二氧化氮和氧气分别过量时的两种情况。设混合气体的体积为1,混合气体中二氧化氮的体积为x,则氧气为1-x。
(1)假定原混合气体中V(NO2)∶V(O2)<4∶1
=
解得y=,剩余氧气:(1-x)-=
解得x=
V(NO2)∶V(O2)=∶(1-)=2∶3。
(2)假定原混合气体中V(NO2)∶V(O2)>4∶1
=
解得y=4(1-x)
暂时剩余二氧化氮:1-[4(1-x)+(1-x)]=5x-4
由3NO2+H2O===2HNO3+NO可知,最后剩余一氧化氮为
由=得x=(x>1,不合题意,舍去)。
20.【答案】 若剩余的气体是NO,则NO2和O2的体积分别为9.2
mL和0.8
mL;若剩余的气体是O2,则NO2和O2的体积分别为6.4
mL和3.6
mL。
【解析】 剩余2
mL气体可能是NO或O2,分两种情况讨论:
(1)剩余的是NO,可以看成先发生了反应:4NO2+O2+2H2O===4HNO3剩余的NO2又与水作用,最终有2
mL
NO
产生。由反应3NO2+H2O===2HNO3+NO得,剩余的NO2体积为2
mL×3=6
mL。则原有O2体积为(10
mL-6
mL)×=0.8
mL,NO2体积为10
mL-0.8
mL=9.2
mL。
(2)剩余的是O2,则有10
mL-2
mL=8
mL
NO2和O2的混合气体按反应4NO2+O2+2H2O===4HNO3进行。所以NO2的体积为8
mL×=6.4
mL,O2体积为10
mL-6.4
mL=3.6
mL。
21.【答案】1.21吨
【解析】4FeS2+11O22Fe2O3+8SO2、2SO2+O22SO3、SO3+H2O===H2SO4
根据硫元素质量守恒可知FeS2~2H2SO4
根据关系式,设可制取98%的硫酸x吨。
x≈1.21
t
22.【答案】(1)氢氧化钠溶液、pH试纸、玻璃棒 (2)向已褪色的溶液中滴加氢氧化钠溶液至溶液呈碱性 (3)滴加氢氧化钠溶液,若溶液恢复红色说明推测②正确;若溶液仍为无色说明推测①正确
【解析】若①的推测正确,说明酚酞被次氯酸氧化;若②的推测正确,说明氢氧化钠被酸中和;可见验证原理只需证明溶液中是否还存在酚酞。向褪色后的溶液中加入氢氧化钠溶液,至溶液呈碱性,若不再变红色,证明推测①正确;若溶液呈红色,证明推测②正确。
23.【答案】(1)
3NO2+H2O===2HNO3+NO
(2)1∶3
(3)①N2 V ②4NO+3O2+2H2O===4HNO3
【解析】根据反应前后气体体积差量计算。混合气体倒立于水中后体积减少VL,由3NO2+H2O===2HNO3+NO可知二氧化氮的体积为×VL=VL,氮气的体积为VL-VL=VL,原混合气体氮气与二氧化氮体积比为1∶3。aL原混合气体溶于水时通入氧气时,4NO+3O2+2H2O===4HNO3,最后剩余一种气体为氮气,其体积为V。
24.【答案】(1)①SiO2 Al3+、Mg2+、Fe3+、H+ ②Mg(OH)2、Fe(OH)3
(2)SiO2+2OH-===+H2O、Al2O3+2OH-===2+H2O
【解析】常见氧化物的性质。SiO2为酸性氧化物,只能与碱溶液反应而溶解;MgO、Fe2O3为碱性氧化物,只能与酸反应而溶解;Al2O3为两性氧化物,与酸、碱溶液都能反应而溶解。
一、单选题(共15小题)
1.在一定温度和压强下,把装有NO和NO2的混合气体的试管倒立于水中,充分反应后,试管内气体的体积缩小为原气体体积的,则原混合气体中NO和NO2的体积比为( )
A.
3∶l
B.
1∶3
C.
2∶3
D.
3∶2
2.宁夏的硒砂瓜现今已享誉区内外,西瓜富含硒元素,有延年益寿、抗衰老、抗癌作用,因之得名“硒砂瓜”。二氧化硒(SeO2)是一种氧化剂,其被还原后的单质硒可能成为环境污染物,通过与浓硝酸或浓硫酸反应生成二氧化硒以回收硒。
在回收过程当中涉及到如下化学反应:
①SeO2+4KI+4HNO3===Se+2I2+4KNO3+2H2O;
②Se+2H2SO4(浓)===2SO2↑+SeO2+2H2O。
下列有关叙述正确的是( )
A.
二氧化硒、浓硫酸、碘的氧化性由强到弱的顺序是浓硫酸>二氧化硒>碘
B.
①中硒是氧化产物,碘是还原产物
C.
反应①中碘化钾是氧化剂,二氧化硒是还原剂
D.
反应①中每有0.6
mol
碘生成,转移电子数目为2.4NA
3.能证明硅酸的酸性弱于碳酸酸性的实验事实是( )
A.
二氧化碳通入可溶性硅酸盐溶液中析出硅酸沉淀
B.
二氧化碳溶于水形成碳酸,二氧化硅难溶于水
C.
高温下,二氧化硅与碳酸盐反应生成二氧化碳
D.
在可溶性硅酸盐溶液中加入盐酸会析出硅酸沉淀
4.自来水厂常使用氯气消毒,市场上有些小商小贩用自来水充当纯净水出售。下列试剂中,可用来辨其真伪的是( )
A.
酚酞溶液
B.
氯化钡溶液
C.
氢氧化钠溶液
D.
硝酸银溶液
5.工业上用洗净的废铜屑作原料来制备硝酸铜,为节约原料和防止环境污染,宜采用的方法是( )
A.
Cu+HNO3(稀)―→Cu(NO3)2
B.
Cu+HNO3(浓)―→Cu(NO3)2
C.
CuCuSO4Cu(NO3)2
D.
CuCuOCu(NO3)2
6.下列有关SiO2的叙述不正确的是( )
A.
沙子、石英、水晶的主要成分都是SiO2
B.
SiO2是制作光导纤维的主要原料
C.
H2SiO3可由SiO2直接制得
D.
SiO2是酸性氧化物,一定条件下可与碱性氧化物或碱反应
7.实验室收集①一氧化氮、②二氧化氮两种气体,下列收集方法正确的是( )
A.
①和②都用排水法
B.
①和②都用向上排空气法
C.
①用向上排空气法,②用排水法
D.
①用排水法,②向上排空气法
8.用加热的方法可以分离的一组物质是( )
A.
氯化铵和消石灰
B.
碳酸氢铵和过氧化钠
C.
氯化铵和氯化钠
D.
碘和氯化铵
9.关于下列反应的叙述正确的是( )
A.
由SiO2+2CSi+2CO↑可推知硅的非金属性比碳强
B.
由CaCO3+SiO2CaSiO3+CO2↑可推知H2SiO3的酸性比H2CO3强
C.
由Na2SiO3+CO2+H2O===Na2CO3+H2SiO3↓可推知碳的非金属性比硅强
D.
由Na2CO3+SiO2Na2SiO3+CO2↑可推知H2SiO3的酸性比H2CO3强
10.我国已跨入“互联网+”时代,而“互联网+”的建设离不开无机非金属材料硅。下列物品中用到硅单质的是( )
A.
陶瓷餐具
B.
石英钟表
C.
计算机芯片
D.
光导纤维
11.下列过程没有起到氮的固定作用的是( )
A.
氮气与氧气反应生成一氧化氮
B.
氮气与氢气在一定条件下合成氨
C.
氨催化氧化生成一氧化氮
D.
豆科植物根瘤菌将空气中氮气转化为含氮化合物
12.下列关于硅酸盐材料的说法错误的是( )
A.
生活中常见的硅酸盐材料有玻璃、水泥、陶瓷
B.
普通玻璃的主要成分是二氧化硅
C.
陶瓷的主要原料是黏土
D.
硅酸盐水泥以石灰石和黏土为主要原料
13.下列关于漂白粉的叙述正确的是( )
A.
漂白粉的有效成分是次氯酸钙和氯化钙
B.
漂白粉在空气中久置后会变质
C.
漂白粉是将氯气通入石灰水中制得
D.
漂白粉的主要成分是氯化钙
14.下列关于二氧化硅和二氧化碳的说法中不正确的是( )
A.
都是酸性氧化物
B.
都能与水反应
C.
都与氢氧化钠溶液反应
D.
高温下都与单质碳反应
15.下列关于液氯和氯水的说法不正确的是( )
A.
常温常压下液氯是一种黄绿色的液体
B.
在加压条件下氯气转化为液氯,可用干燥的钢瓶储存液氯
C.
新制氯水在光照条件下放出气体的主要成分是氧气
D.
新制氯水可以使蓝色石蕊试纸先变红后褪色
二、实验题(共3小题)
16.(1)实验室用金属铜和稀硝酸制取NO的离子方程式为______________________。
(2)NO是有毒气体,某学生为防止污染,用分液漏斗和烧杯装配了一套简易的、能随开随用、随关随停的NO气体发生装置,如图甲所示。
①实验室若没有铜丝,而只有小铜粒,在使用上述装置进行实验时,可用丝状材料包裹铜粒以代替铜丝进行实验,这种丝状材料的成分可以是________(填序号)。
A.铁
B.铝
C.铂
D.玻璃
②打开分液漏斗的活塞使反应进行,在分液漏斗中实际看到的气体是红棕色的,原因是______________(填化学方程式)。
(3)为证明铜丝与稀硝酸反应生成的确实是NO,某学生另设计了一套如图乙所示的装置制取NO。反应开始后,可以在U形管右端观察到无色的NO气体。
①长玻璃管的作用是______________________________________________________。
②让反应停止的操作方法及原因是__________________________________________。
(4)以下收集NO气体的装置,合理的是________(填序号)。
(5)将32.64
g铜与140
mL一定浓度的硝酸反应,铜完全溶解产生的NO和NO2混合气体在标准状况下的体积为11.2
L。请回答:
①NO的体积为________
L,NO2的体积为________
L。
②待产生的气体全部释放后,向溶液中加入VmLamol·L-1的NaOH溶液,恰好使溶液中的Cu2+全部转化成沉淀,则原硝酸溶液的浓度为________
mol·L-1。
17.科学的实验方法为我们探索物质世界提供了一把金钥匙,下列实验方法或操作正确的是________。
A.两种互不相溶的液体,如汽油和水,可通过分液方法分离
B.因为碘易溶于酒精,所以常用酒精萃取碘水中的碘
C.观察钾元素焰色反应的操作:先将铂丝放在稀硫酸中洗涤,然后蘸取固体氯化钾,置于酒精灯的外焰上进行灼烧,透过蓝色钴玻璃进行观察
D.将饱和FeCl3溶液滴入沸水中可得Fe(OH)3胶体,区别溶液和胶体的方法是丁达尔效应
E.分液时,先打开分液漏斗活塞,放出下层液体,再关闭活塞,从漏斗上口倒出上层液体
F.向新制的FeSO4溶液中滴入适量的NaOH溶液,放置片刻,整个反应过程的颜色变化:浅绿色溶液→白色沉淀→灰绿色沉淀→红褐色沉淀
G.为除粗盐中的可溶性杂质,先加氯化钡后加碳酸钠,最后加盐酸后过滤
H.在天平左右两盘中各放一张白纸后,即可将NaOH固体放在白纸上称量
18.使用浓盐酸、二氧化锰共热制氯气,并用氯气和氢氧化钙反应制取少量漂白粉。已知:常温下,2Cl2+2Ca(OH)2===CaCl2+Ca(ClO)2+2H2O;温度稍高,即发生副反应:6Cl2+6Ca(OH)2△,5CaCl2+Ca(ClO3)2+6H2O;3Ca(ClO)2△,2CaCl2+Ca(ClO3)2。甲、乙、丙三位同学分别设计了三个实验装置如下图所示:
(1)请根据以下几个方面评价上述甲、乙、丙三套装置的优劣,并选择符合题目要求的选项填入下表空格内。
评价依据:a.不容易控制反应速率 b.容易控制反应速率 c.有副反应发生 d.可防止副反应发生 e.污染环境 f.可防止环境污染
(2)上述装置中,甲由A、B两部分组成,乙由C、D、E三部分组成,丙由F、G两部分组成。从上述甲、乙、丙三套装置中选出合理的部分(按气流从左至右的流向)组装一套较完善的实验装置(填所选部分的字母):________________。
(3)实验中若用12
mol·L-1的浓盐酸100
mL与足量二氧化锰反应,最终生成的次氯酸钙的物质的量总小于0.15
mol,其可能的主要原因是__________________________________。
(假定各步反应均无反应损耗且无副反应发生)
(4)①在实验时,发现浓盐酸因存放过久、挥发过多而不能再用来制取氯气,在这种情况下,根据难挥发性酸制易挥发性酸原理,我们可以选择________来代替浓盐酸。
A.浓硫酸
B.稀硫酸
C.氯化钠固体
D.氯化钠溶液
②依据实验室制氯气原理,还可有以下方式来制取氯气,如果要制得等物质的量的氯气,消耗盐酸量最小的是________。
A.MnO2+4HCl(浓)△,MnCl2+Cl2↑+2H2O
B.2KMnO4+16HCl(浓)===2KCl+2MnCl2+5Cl2↑+8H2O
C.KClO3+6HCl(浓)===KCl+3Cl2↑+3H2O
D.Ca(ClO)2+4HCl(浓)===CaCl2+2Cl2↑+2H2O
(5)从发生装置出来的氯气常混有氯化氢,氯化氢消耗氢氧化钙。为了降低损耗,必须除去氯气中混有的氯化氢,下列装置符合实验要求的是________。
三、计算题(共3小题)
19.将充满二氧化氮和氧气的混合气体的量筒倒置于水中,充分反应后,保持气体压强不变,水进入至量筒体积的一半处停止了,则原混合气体中二氧化氮和氧气的体积比是多少?
20.将10
mL充满NO2和O2的混合气体的试管,倒置在水槽中,反应停止后试管内剩余2
mL的无色气体,求原混合气体中NO2和O2各多少毫升?
21.某硫酸厂使用含杂质25%的黄铁矿制取硫酸,在反应过程中有3%的硫元素损失。1
t黄铁矿可制取98%的硫酸多少吨?
四、填空题(共3小题)
22.用滴管把新制的氯水逐滴加到含有酚酞的氢氧化钠溶液中,当加到最后一滴时,溶液的红色突然消失。对产生实验现象的原因有两种推测:
①是氯水中的次氯酸的漂白性使它由红色变成无色;
②是氯水的酸性(H+)使它由红色变成无色。
假设其中一种是正确的,请你设计一个实验,由实验现象对以上的推测作出判断。
(1)要使用的实验用品:______________________________________;
(2)要进行的实验操作:________________________________________________________;
(3)实验现象和结论:______________________________________________________。
23.将盛有氮气和二氧化氮混合气体的试管(试管容积为VL)倒立于水中,经过足够长的时间后,试管内气体的体积变为aL。请回答下列问题:
(1)该混合气体倒立于水中发生反应的化学方程式是______________________。
(2)若a=V,则原混合气体中氮气与二氧化氮的体积之比是__________。
(3)结合第(2)小题,向aL气体中通入氧气至试管中刚好只有一种气体时,停止通入氧气。
①试管中最终剩余的气体是____________,其体积是____________。
②该过程中总反应的化学方程式是__________________。
24.有MgO、Al2O3、SiO2、Fe2O3组成的混合粉末。现取两份该混合粉末试样进行实验。
(1)将一份混合粉末溶于过量的盐酸,得到沉淀X和滤液Y,
①沉淀X为_______(填化学式,下同),
滤液Y中含有的阳离子主要是________________。
②向滤液Y中加入过量氢氧化钠溶液,得到的沉淀是______________________。
(2)将另一份混合粉末溶于过量氢氧化钠溶液,发生反应的离子方程式为_______________。
答案解析
1.【答案】B
【解析】NO2和NO的混合气体通入倒立于水槽中的试管中发生反应为3NO2+H2O2HNO3+
NO。
设原混合的气体的体积是2,则反应后的气体体积是1,
V(NO2)==
原气体中V(NO)=2-﹣==
所以原混合气体中NO2和NO的体积比=V(NO)∶V(NO2)==∶:=1∶3,B正确。
2.【答案】A
【解析】氧化还原反应中,氧化剂氧化性强于氧化产物的氧化性,由反应①可知二氧化硒的氧化性强于碘,由反应②可知浓硫酸的氧化性强于二氧化硒;在反应①中二氧化硒是氧化剂,硒是还原产物;碘化钾是还原剂,碘是氧化产物;当有0.6
mol碘生成时,转移电子的数目为1.2NA。
3.【答案】A
【解析】二氧化碳通入可溶性硅酸盐中,析出硅酸沉淀,符合较强酸制取较弱酸的反应原理,可以证明硅酸的酸性比碳酸的酸性弱;可溶性硅酸盐溶液能与盐酸反应生成硅酸沉淀,能说明硅酸的酸性比盐酸弱,不能说明硅酸的酸性比碳酸弱;物质的酸性强弱与相应的氧化物的物理性质(如溶解性、熔点等)无关;高温下,二氧化硅能与碳酸盐反应,是因为生成了二氧化碳气体逸出,使反应持续进行。
4.【答案】D
【解析】辨其真伪的关键是检验氯元素的残留。Cl2+H2O===HCl+HClO,氯水中存在氢离子显酸性,遇酚酞不变色,A不符合题意;与氯化钡溶液不反应,B不符合题意;与氢氧化钠发生中和反应无明显现象,C不符合题意;氯水中存在氯离子,能与硝酸银反应生成白色沉淀,D符合题意。
5.【答案】D
【解析】制备等量的硝酸铜,D项消耗的硝酸最少,且不产生大气污染物(SO2、NO、NO2等)。
6.【答案】C
【解析】沙子、石英、水晶的主要成分都是SiO2,A项正确;SiO2可用来制造光导纤维,B项正确;SiO2不能与水反应直接生成H2SiO3,C项不正确;SiO2是酸性氧化物,一定条件下可与碱性氧化物或碱反应,例如SiO2与NaOH溶液反应生成Na2SiO3和H2O,在高温条件下SiO2与生石灰反应生成CaSiO3,D项正确。
7.【答案】D
【解析】一氧化氮不溶于水,易与空气中的氧气反应,一氧化氮不能用向上排空气法收集,应用排水法收集;二氧化氮易溶于水且与水反应,不能用排水法收集,二氧化氮的密度比空气大,应用向上排空气法收集。
8.【答案】C
【解析】用加热的方法不能分离A、B、D组物质:氯化铵与消石灰加热时可反应生成氯化钙、氨气和水;碳酸氢铵受热时分解生成氨气、二氧化碳和水,二氧化碳和水都能与过氧化钠反应;受热时碘变为蒸气,氯化铵分解生成氨气和氯化氢,同时逸出,冷却时重新变为固体碘和氯化铵混合在一起。氯化钠固体受热无变化,氯化铵受热分解,生成的氨气和氯化氢从混合物中逸出,温度降低时氨气与氯化氢又迅速化合生成氯化铵,
C组物质可用加热、冷却的方法分离。
9.【答案】C
【解析】本题的易错之处一是根据反应式SiO2+2CSi+2CO↑认为硅的非金属性比碳强,错选A;二是根据反应式CaCO3+SiO2CaSiO3+CO2↑、Na2CO3+SiO2Na2SiO3+CO2↑认为H2SiO3的酸性比H2CO3强,错选B、D。A项,硅的非金属性比碳弱;B、D项,反应均是在非溶液状态下进行的,因此无法判断H2SiO3与H2CO3的酸性强弱;C项,碳酸与硅酸钠溶液反应生成硅酸说明H2CO3的酸性比H2SiO3强,由此可知碳的非金属性比硅强,C项正确。
10.【答案】C
【解析】陶瓷餐具是硅酸盐产品,主要成分为硅酸盐,故A错误;
石英主要成分为二氧化硅,不是单质硅,故B错误;
硅单质是半导体材料,可以制计算机芯片,故C正确;
光导纤维成分为二氧化硅,是硅的氧化物,不是单质硅,故D错误;
故选C。
11.【答案】C
【解析】氮的固定指游离态的氮反应生成化合态的氮,即将氮气转化为含氮化合物的过程。
氨气和一氧化氮都是化合物,它们间的转化不是氮的固定。
12.【答案】B
【解析】普通玻璃主要成分为Na2SiO3、CaSiO3和SiO2,组成用氧化物可表示为Na2O·CaO·6SiO2,B错误。
13.【答案】B
【解析】漂白粉是由氯气和石灰乳反应制得,它的主要成分是次氯酸钙和氯化钙,有效成分是次氯酸钙,
A、C、D不正确;次氯酸钙易与空气中的二氧化碳、水反应而失效,故B正确。
14.【答案】B
【解析】二氧化硅和二氧化碳都是酸性氧化物,都能与碱性氧化物(如氧化钙)、碱(如氢氧化钠)溶液反应;二氧化碳能溶于水,与水能反应生成碳酸,而二氧化硅不溶于水,与水不反应;高温下,二氧化硅能与碳反应生成硅和一氧化碳(或碳化硅和一氧化碳),二氧化碳与碳反应生成一氧化碳。
15.【答案】A
【解析】常温常压下,液氯气化为氯气;新制的氯水中含有氢离子和次氯酸,能使蓝色石蕊试纸先变红后褪色;光照条件下次氯酸分解生成盐酸和氧气。
16.【答案】(1)3Cu+8H++2NO===3Cu2++4H2O+2NO↑
(2)①CD
②2NO+O2===2NO2
(3)①接收被气体压出U形管的液体,防止稀硝酸溢出 ②关闭U形管右端导气管上的活塞;反应产生的气体将U形管右端管内的稀硝酸向下压,使铜丝与稀硝酸分开,反应就会停止
(4)CD
(5)①5.8 5.4 ②
【解析】(1)离子方程式的书写,要注意电荷守恒。(2)①包裹铜粒的丝状材料不能与稀硝酸反应,所以A、B项不行;②红棕色的气体是NO2,原因是生成的NO与空气中的氧气反应。(3)该实验装置是防止产生的气体与空气接触,长玻璃管的作用是接收被气体压出U形管的稀硝酸,防止稀硝酸溢出;关闭活塞,产生的气体使稀硝酸液面下降,从而铜丝与稀硝酸分开,反应停止。(4)不能用排空气法收集NO,因为NO与空气中的氧气反应,只能用排水法,C和D装置符合题意,E装置是洗气装置。(5)①设混合气体中NO的物质的量为x,NO2物质的量为y。可得:x+y=0.5
mol 3x+y=0.51
mol×2,解方程组得:x=0.26
mol,y=0.24
mol.所以NO的体积为0.26
mol×22.4
L·mol-1≈5.8
L;NO2的体积为11.2
L-5.8
L=5.4
L。②根据质量守恒定律进行考虑。HNO3在反应中要么变成气体,要么以NO的形式留在溶液中。容易算出变成气体的HNO3的物质的量为0.5
mol;加入NaOH溶液至正好使溶液中Cu2+全部转化为沉淀,则溶液中只有NaNO3,其物质的量为10-3aVmol,也就是以NO形式留在溶液中的HNO3的物质的量为10-3aVmol。所以,HNO3的浓度为mol·L-1。
17.【答案】ADEF
【解析】两种互不相溶的液体分层,选择分液法分离,如汽油和水,故A选;酒精与水互溶,则酒精不能作萃取剂,故B不选;在稀硫酸中洗涤,硫酸不挥发,干扰实验,则应选盐酸洗涤,故C不选;饱和FeCl3溶液滴入沸水,水解可制备胶体,且丁达尔效应为胶体特有的性质,则区别溶液和胶体的方法是丁达尔效应,故D选;分液时避免上下层液体混合,则先打开分液漏斗活塞,放出下层液体,再关闭活塞,从漏斗上口倒出上层液体,故E选;生成的氢氧化亚铁易被氧化,则向新制的FeSO4溶液中滴入适量的NaOH溶液,放置片刻,整个反应过程的颜色变化:浅绿色溶液→白色沉淀→灰绿色沉淀→红褐色沉淀,故F选;除杂试剂过量,碳酸钠在氯化钡之后可除去过量的钡离子,则为除粗盐中的可溶性杂质,先加氯化钡后加碳酸钠,过滤后,再加盐酸蒸发,故G不选;NaOH潮解,具有腐蚀性,应在小烧杯中称量,NaOH固体放在左盘的小烧杯中称量,故H不选。
18.【答案】 (1)甲:a、e 乙:f 丙:c、e (2)F、B、E (3)二氧化锰只能氧化浓盐酸,随着反应的进行,盐酸浓度减小,最后成为稀盐酸,反应不能进行,即氯化氢不能完全反应 (4)①AC ②CD (5)A
【解析】 (1)根据装置分析差异,对照评价依据对号入座。甲装置缺点:制氯气时,直接将浓盐酸与二氧化锰混合,不容易控制反应速率,没有处理尾气,会污染环境;乙装置优点:用氢氧化钠溶液吸收尾气,不会污染环境;丙装置缺点是没有控制氯气与氢氧化钙反应的温度,有副反应发生,没有处理尾气,氯气排入空气中污染环境。(2)氯气的发生装置选择F,能控制反应速率;氯气与氢氧化钙的反应装置选择B,用冷水冷却,减少副反应发生;尾气处理装置选择E。(3)不考虑副反应,n(HCl)=0.1
L×12
mol·L-1=1.2
mol,假设氯化氢完全反应,生成氯气为n(Cl2)=0.3
mol,全部与氢氧化钙反应,生成次氯酸钙为n[Ca(ClO)2]=0.15
mol。实际上,浓盐酸变成稀盐酸时,反应停止,即盐酸中氯化氢不能完全反应,故产生氯气量比理论值(按盐酸制氯气量)少,制得漂白粉质量偏少。(4)浓硫酸是高沸点酸,浓盐酸是易挥发酸,实验室可以用浓硫酸与氯化钠固体代替浓盐酸。根据化学方程式,比较生成1
mol氯气需要氯化氢的物质的量。(5)除去氯气中的氯化氢,不能损失氯气,没有必要干燥氯气,应选饱和食盐水,碱石灰和氢氧化钠溶液都会吸收Cl2,故A装置符合题意。
19.【答案】2∶3
【解析】3NO2+H2O===2HNO3+NO
①
,2NO+O2===2NO2②,由方程式①×2+②得4NO2+O2+2H2O===4HNO3③;由方程式①×2+②×3得4NO+3O2+2H2O===4HNO3④。二氧化氮和氧气的体积比不等于4∶1,需讨论二氧化氮和氧气分别过量时的两种情况。设混合气体的体积为1,混合气体中二氧化氮的体积为x,则氧气为1-x。
(1)假定原混合气体中V(NO2)∶V(O2)<4∶1
=
解得y=,剩余氧气:(1-x)-=
解得x=
V(NO2)∶V(O2)=∶(1-)=2∶3。
(2)假定原混合气体中V(NO2)∶V(O2)>4∶1
=
解得y=4(1-x)
暂时剩余二氧化氮:1-[4(1-x)+(1-x)]=5x-4
由3NO2+H2O===2HNO3+NO可知,最后剩余一氧化氮为
由=得x=(x>1,不合题意,舍去)。
20.【答案】 若剩余的气体是NO,则NO2和O2的体积分别为9.2
mL和0.8
mL;若剩余的气体是O2,则NO2和O2的体积分别为6.4
mL和3.6
mL。
【解析】 剩余2
mL气体可能是NO或O2,分两种情况讨论:
(1)剩余的是NO,可以看成先发生了反应:4NO2+O2+2H2O===4HNO3剩余的NO2又与水作用,最终有2
mL
NO
产生。由反应3NO2+H2O===2HNO3+NO得,剩余的NO2体积为2
mL×3=6
mL。则原有O2体积为(10
mL-6
mL)×=0.8
mL,NO2体积为10
mL-0.8
mL=9.2
mL。
(2)剩余的是O2,则有10
mL-2
mL=8
mL
NO2和O2的混合气体按反应4NO2+O2+2H2O===4HNO3进行。所以NO2的体积为8
mL×=6.4
mL,O2体积为10
mL-6.4
mL=3.6
mL。
21.【答案】1.21吨
【解析】4FeS2+11O22Fe2O3+8SO2、2SO2+O22SO3、SO3+H2O===H2SO4
根据硫元素质量守恒可知FeS2~2H2SO4
根据关系式,设可制取98%的硫酸x吨。
x≈1.21
t
22.【答案】(1)氢氧化钠溶液、pH试纸、玻璃棒 (2)向已褪色的溶液中滴加氢氧化钠溶液至溶液呈碱性 (3)滴加氢氧化钠溶液,若溶液恢复红色说明推测②正确;若溶液仍为无色说明推测①正确
【解析】若①的推测正确,说明酚酞被次氯酸氧化;若②的推测正确,说明氢氧化钠被酸中和;可见验证原理只需证明溶液中是否还存在酚酞。向褪色后的溶液中加入氢氧化钠溶液,至溶液呈碱性,若不再变红色,证明推测①正确;若溶液呈红色,证明推测②正确。
23.【答案】(1)
3NO2+H2O===2HNO3+NO
(2)1∶3
(3)①N2 V ②4NO+3O2+2H2O===4HNO3
【解析】根据反应前后气体体积差量计算。混合气体倒立于水中后体积减少VL,由3NO2+H2O===2HNO3+NO可知二氧化氮的体积为×VL=VL,氮气的体积为VL-VL=VL,原混合气体氮气与二氧化氮体积比为1∶3。aL原混合气体溶于水时通入氧气时,4NO+3O2+2H2O===4HNO3,最后剩余一种气体为氮气,其体积为V。
24.【答案】(1)①SiO2 Al3+、Mg2+、Fe3+、H+ ②Mg(OH)2、Fe(OH)3
(2)SiO2+2OH-===+H2O、Al2O3+2OH-===2+H2O
【解析】常见氧化物的性质。SiO2为酸性氧化物,只能与碱溶液反应而溶解;MgO、Fe2O3为碱性氧化物,只能与酸反应而溶解;Al2O3为两性氧化物,与酸、碱溶液都能反应而溶解。
