人教版高中化学必修1第三章《金属及其化合物》检测题(含答案)
文档属性
| 名称 | 人教版高中化学必修1第三章《金属及其化合物》检测题(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 117.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-11-19 18:39:06 | ||
图片预览


文档简介
本卷由系统自动生成,请仔细校对后使用,答案仅供参考。
《金属及其化合物》检测题
一、单选题
1.下列离子在无色溶液中能大量共存的是
A.Na+、Ba2+、
B.K+、Cu2+、Cl-
C.Al3+、、
D.Fe3+、K+、
2.某白色粉末由两种物质组成,为鉴别其成分进行如下实验:①取少量样品加入足量水仍有部分固体未溶解;再加入足量稀盐酸,有气泡产生,固体全部溶解;②取少量样品加入足量稀硫酸有气泡产生,振荡后仍有固体存在。该白色粉末可能为
A.NaHCO3、Al(OH)3
B.AgCl、NaHCO3
C.Na2SO3、BaCO3
D.Na2CO3、CuSO4
3.下列物质转化在一定条件下不能一步实现的是
A.Na→Na2O2→Na2CO3
B.Cu→CuO→CuSO4
C.Al2O3→Al(OH)3→Al3+
D.Fe(OH)3→Fe2O3→
Fe3+
4.下列各组物质互相作用时,生成物不随反应条件或反应物的量变化而变化的是
A.Na2CO3和HCl
B.NaOH和CO2
C.Na和O2
D.NaHCO3和NaOH
5.下列说法正确的是
A.能通过化合反应制得FeCl3和Fe(OH)3
B.7.8gNa2O2与CO2完全反应,转移0.2mol电子
C.2.7gAl与足量的氢氧化钠溶液完全反应,生成3.36L气体
D.NaHCO3、Na2CO3、(NH4)2CO3三种固体受热后均能生成气体
6.处理锂离子二次电池正极废料铝钴膜(含有LiCoO2、Al等)的一种工艺如下:
下列有关说法不正确的是
A.碱浸的目的是溶解铝
B.酸溶时H2
O2被还原
C.H2SO4/H2O2可改用浓盐酸
D.铝、钴产物可再利用
7.某元素R
的单质1.8
g与足量盐酸反应,生成标准状况下的氢气2.24
L。此单质与氧形成的化合物的化学式为R2O3,又知R
元素原子核内质子数比中子数少1。R是(
)
A.Ga
B.B
C.Fe
D.Al
8.在25℃,101kpa下由甲醛蒸气(HCHO),H2和CO组成的混合气体共6.72g,其相对H2的密度为14.将该气体与2.24LO2(标况下)充分反应后的产物通过足量的Na2O2粉末,Na2O2粉末增重的质量(
)
A.<6.72g
B.=6.72g
C.>6.72g
D.无法计算
9.下列说法正确的是(
)
A.Na2O2与水反应时,生成0.1
mol
O2,转移的电子数为0.2NA
B.钠与CuSO4溶液反应:2Na+Cu2+===Cu↓+2Na+
C.Na2O2遇到湿润的紫色石蕊试纸后,石蕊试纸最终变成蓝色
D.在酒精灯加热条件下,Na2CO3和NaHCO3固体都能发生分解
10.用铝箔包装0.1mol金属钠,用针扎一些小孔,放入水中,完全反应后,用排水取气法收集产生的气体,则收集到的气体为
A.O2和H2的混合气体
B.小于0.05molH2
C.0.05molH2
D.大于0.05molH2
11.分类是学习和研究化学的一种重要方法,下列分类合理的是
A.烧碱和纯碱都属于碱
B.硫酸和盐酸都属于含氧酸
C.Na2SiO3和Na2SO4都属于钠盐
D.Fe2O3和Al2O3都属于碱性氧化物
12.港珠澳大桥的设计使用寿命高达120年,主要的防腐方法有:①钢梁上安装铝片;②使用高性能富锌(富含锌粉)底漆;③使用高附着性防腐涂料;④预留钢铁腐蚀量。下列分析不合理的是(
)
A.防腐涂料可以防水、隔离O2,降低吸氧腐蚀速率
B.防腐过程中铝和锌均作为牺牲阳极,失去电子
C.方法①②③只能减缓钢铁腐蚀,未能完全消除
D.钢铁发生吸氧腐蚀时的正极反应式为:O2-
4e-
+
2H2O
=4
OH-
13.下列离子方程式书写正确的是
A.向明矾溶液中滴加Ba(OH)2溶液,使沉淀质量达到最大值:2Al3++3+3Ba2++6OH-=2Al(OH)3↓+3BaSO4↓
B.将少量氯化铁溶液滴入硫化钠溶液中:2Fe3++S2-=2Fe2++S↓
C.向Fe(NO3)3溶液中加入过量的HI溶液:2+8H++6I-=3I2+2NO↑+4H2O
D.1mol·L-1的NaAlO2溶液和2.5mol·L-1的HCl等体积混合:2+5H+=Al(OH)3↓+Al3++H2O
14.甲、乙两烧杯中各盛有
100
mL
2
mol·L-1
的盐酸和氢氧化钠溶液,向两烧杯中分别加入一定量的铝粉,反应结束后生成的气体的体积比为
2:3
时,加入铝粉的质量
A.2.7
克
B.1.8
克
C.4.5
克
D.5.4
克
二、实验题
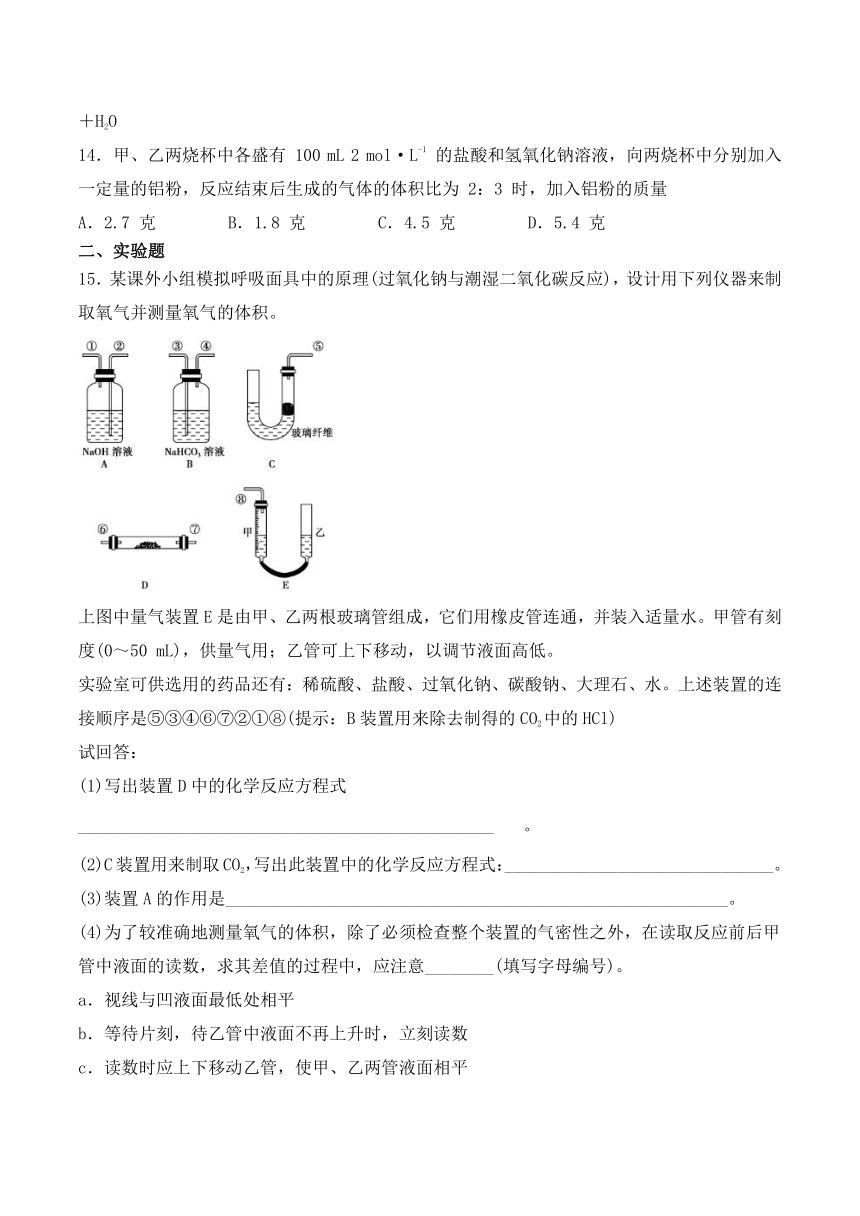
15.某课外小组模拟呼吸面具中的原理(过氧化钠与潮湿二氧化碳反应),设计用下列仪器来制取氧气并测量氧气的体积。
上图中量气装置E是由甲、乙两根玻璃管组成,它们用橡皮管连通,并装入适量水。甲管有刻度(0~50
mL),供量气用;乙管可上下移动,以调节液面高低。
实验室可供选用的药品还有:稀硫酸、盐酸、过氧化钠、碳酸钠、大理石、水。上述装置的连接顺序是⑤③④⑥⑦②①⑧(提示:B装置用来除去制得的CO2中的HCl)
试回答:
(1)写出装置D中的化学反应方程式
________________________________________________。
(2)C装置用来制取CO2,写出此装置中的化学反应方程式:_______________________________。
(3)装置A的作用是__________________________________________________________。
(4)为了较准确地测量氧气的体积,除了必须检查整个装置的气密性之外,在读取反应前后甲管中液面的读数,求其差值的过程中,应注意________(填写字母编号)。
a.视线与凹液面最低处相平
b.等待片刻,待乙管中液面不再上升时,立刻读数
c.读数时应上下移动乙管,使甲、乙两管液面相平
d.读数时不一定使甲、乙两管液面相平
16.某化学研究性学习小组设计了如图所示的实验装置,目的是做钠与水反应的实脸并验证①钠的物理性质;②钠和水反应的产物.请回答下列问题:
(1)实验开始时,欲使钠与水接触反应,应如何操作?________.
(2)反应开始后,试管中能观察到的实验现象是:_______(填写代号)
A.?钠在水层中反应熔成小球并四处游动??????????????????
B.?钠在两液体界面处反应熔成小球并可能作上下跳动
C.?钠在水层中反应熔成小球并四处游动??????????????????
D.?钠不断地减小至消失
E.?钠停留在煤油层中不反应
(3)通过上述现象,能够验证钠的哪些物理性质:________
(4)100mL
容量瓶中盛有100mL0.101mol/L的BaCl2溶液,现欲将其稀释成浓度为0.100mol/L的BaCl2溶液(体积仍保持为100mL),所选用的仪器有:10mL量筒、1mL移液管(可准确移取0.10~1.00mL溶液)、胶头滴管.其简单的操作步骤是________.
三、元素或物质推断题
17.中学常见单质A、B和甲、乙、丙三种化合物有如图所示的转换关系(部分产物未列出),单质A常作为食品包装材料,甲是两性氧化物。
根据图示转化关系回答:
(1)写出单质A与Fe2O3反应的化学方程式__________________________________
(2)写出电解甲制单质A的化学方程式__________________________________
(3)实验室完成单质A与Fe2O3反应实验,需要的试剂还有_______。
a.KCl
b.KClO
3
c.MnO2
d.Mg
(4)利用单质A与Fe2O3反应的原理,工业上可用于___________
18.下图为元索周期表的一部分,参照元素①~⑧在周期表中的位置,回答下列问题:
(1)④⑥⑦的离子半径由大到小的顺序为______(填离子符号)。
(2)②⑦⑧的最高价含氧酸的酸性由强到弱的顺序为_____(用化学式表示)。
(3)由元素①~⑧形成的物质可发生图中的反应,其中A含有离子键,D、F是单质,?E是⑦的最高价氧化物对应的水化物,B是温室气体的主要成分。
①A的电子式为______________;
②反应II的反应类型为_______________;
③反应I中消耗标准状况下1.12L
B时,转移的电子数约为______________
。
(4)⑧的某种氧化物是常见的消毒剂,等物质的量时其消毒能力是单质⑧的2.5倍,实验室制取该消毒剂的常用方法为向含元素⑧的含氧酸钠盐中加入甲醇和稀硫酸,生成67.5
g该消毒剂时,转移NA个电子,则该反应的化学方程式为________。
四、计算题
19.在MgCl2和AlCl3的混和溶液中,逐滴加入NaOH溶液直至过量,经测定,加入NaOH的物质的量和所得沉淀的物质的量的关系如右图所示,则:
(1)图中C点表示当加入________mol
NaOH时,Al3+已完全转化为____________(填微粒符号)
(2)图中线段OA和AB两段NaOH的物质的量之比为
____________。
(3)写出AB段发生反应的离子方程式___________________________________。
20.将6.5g锌放入一定量稀硫酸中恰好完全反应,得到80mL密度为1.25g/mL的溶液。
试计算:
(1)生成标准状况下的H2的体积_______;
(2)所得溶液中硫酸锌的物质的量浓度_______;
(3)所用稀硫酸的质量分数_______。
21.为测定某种镁铝合金的成分,将样品粉末分成等质量的两份,一份放入到过量的氢氧化钠溶液中,得到6.72LH2(标准状况下)、另一份放入到过量的盐酸11.2LH2(标准状况下),试计算:
(1)每份合金中铝的质量。
(2)该合金中铝和镁的物质的量之比(请写出详细的解答过程)。
参考答案
1.C
2.C
3.C
4.D
5.A
6.B
7.D
8.A
9.A
10.D
11.C
12.D
13.D
14.A
15.
2Na2O2+2CO2===2Na2CO3+O2
CaCO3+2HCl===CaCl2+CO2↑+H2O
吸收混在O2中未反应的CO2
ac
16.按住橡皮塞,将大头针向上抽,使钠块掉入水中
B,D,F
熔点低,密度比水小
用1mL移液管移出0.99mL的0.1010mol?L﹣1的BaCl2溶液,然后用胶头滴管向剩下的99.01mL
0.1010mol?L﹣1的BaCl2溶液中加水至刻度线,即可配制得0.100mol?L﹣1的BaCl2溶液
17.2Al+Fe2O32Fe
+Al2O3
2Al2O3(熔融)4Al+3O2↑
bd
焊接钢轨等
18.S2->O2->Na+
HClO4>H2SO4>H2CO3
复分解反应
19.0.6
AlO2-
5:1
Al(OH)3
+OH-
=
AlO2-+
2H2O
20.2.24L
1.25mol/L
10.5%
21.(1)5.4g
(2)1:1
答案第1页,总2页
《金属及其化合物》检测题
一、单选题
1.下列离子在无色溶液中能大量共存的是
A.Na+、Ba2+、
B.K+、Cu2+、Cl-
C.Al3+、、
D.Fe3+、K+、
2.某白色粉末由两种物质组成,为鉴别其成分进行如下实验:①取少量样品加入足量水仍有部分固体未溶解;再加入足量稀盐酸,有气泡产生,固体全部溶解;②取少量样品加入足量稀硫酸有气泡产生,振荡后仍有固体存在。该白色粉末可能为
A.NaHCO3、Al(OH)3
B.AgCl、NaHCO3
C.Na2SO3、BaCO3
D.Na2CO3、CuSO4
3.下列物质转化在一定条件下不能一步实现的是
A.Na→Na2O2→Na2CO3
B.Cu→CuO→CuSO4
C.Al2O3→Al(OH)3→Al3+
D.Fe(OH)3→Fe2O3→
Fe3+
4.下列各组物质互相作用时,生成物不随反应条件或反应物的量变化而变化的是
A.Na2CO3和HCl
B.NaOH和CO2
C.Na和O2
D.NaHCO3和NaOH
5.下列说法正确的是
A.能通过化合反应制得FeCl3和Fe(OH)3
B.7.8gNa2O2与CO2完全反应,转移0.2mol电子
C.2.7gAl与足量的氢氧化钠溶液完全反应,生成3.36L气体
D.NaHCO3、Na2CO3、(NH4)2CO3三种固体受热后均能生成气体
6.处理锂离子二次电池正极废料铝钴膜(含有LiCoO2、Al等)的一种工艺如下:
下列有关说法不正确的是
A.碱浸的目的是溶解铝
B.酸溶时H2
O2被还原
C.H2SO4/H2O2可改用浓盐酸
D.铝、钴产物可再利用
7.某元素R
的单质1.8
g与足量盐酸反应,生成标准状况下的氢气2.24
L。此单质与氧形成的化合物的化学式为R2O3,又知R
元素原子核内质子数比中子数少1。R是(
)
A.Ga
B.B
C.Fe
D.Al
8.在25℃,101kpa下由甲醛蒸气(HCHO),H2和CO组成的混合气体共6.72g,其相对H2的密度为14.将该气体与2.24LO2(标况下)充分反应后的产物通过足量的Na2O2粉末,Na2O2粉末增重的质量(
)
A.<6.72g
B.=6.72g
C.>6.72g
D.无法计算
9.下列说法正确的是(
)
A.Na2O2与水反应时,生成0.1
mol
O2,转移的电子数为0.2NA
B.钠与CuSO4溶液反应:2Na+Cu2+===Cu↓+2Na+
C.Na2O2遇到湿润的紫色石蕊试纸后,石蕊试纸最终变成蓝色
D.在酒精灯加热条件下,Na2CO3和NaHCO3固体都能发生分解
10.用铝箔包装0.1mol金属钠,用针扎一些小孔,放入水中,完全反应后,用排水取气法收集产生的气体,则收集到的气体为
A.O2和H2的混合气体
B.小于0.05molH2
C.0.05molH2
D.大于0.05molH2
11.分类是学习和研究化学的一种重要方法,下列分类合理的是
A.烧碱和纯碱都属于碱
B.硫酸和盐酸都属于含氧酸
C.Na2SiO3和Na2SO4都属于钠盐
D.Fe2O3和Al2O3都属于碱性氧化物
12.港珠澳大桥的设计使用寿命高达120年,主要的防腐方法有:①钢梁上安装铝片;②使用高性能富锌(富含锌粉)底漆;③使用高附着性防腐涂料;④预留钢铁腐蚀量。下列分析不合理的是(
)
A.防腐涂料可以防水、隔离O2,降低吸氧腐蚀速率
B.防腐过程中铝和锌均作为牺牲阳极,失去电子
C.方法①②③只能减缓钢铁腐蚀,未能完全消除
D.钢铁发生吸氧腐蚀时的正极反应式为:O2-
4e-
+
2H2O
=4
OH-
13.下列离子方程式书写正确的是
A.向明矾溶液中滴加Ba(OH)2溶液,使沉淀质量达到最大值:2Al3++3+3Ba2++6OH-=2Al(OH)3↓+3BaSO4↓
B.将少量氯化铁溶液滴入硫化钠溶液中:2Fe3++S2-=2Fe2++S↓
C.向Fe(NO3)3溶液中加入过量的HI溶液:2+8H++6I-=3I2+2NO↑+4H2O
D.1mol·L-1的NaAlO2溶液和2.5mol·L-1的HCl等体积混合:2+5H+=Al(OH)3↓+Al3++H2O
14.甲、乙两烧杯中各盛有
100
mL
2
mol·L-1
的盐酸和氢氧化钠溶液,向两烧杯中分别加入一定量的铝粉,反应结束后生成的气体的体积比为
2:3
时,加入铝粉的质量
A.2.7
克
B.1.8
克
C.4.5
克
D.5.4
克
二、实验题
15.某课外小组模拟呼吸面具中的原理(过氧化钠与潮湿二氧化碳反应),设计用下列仪器来制取氧气并测量氧气的体积。
上图中量气装置E是由甲、乙两根玻璃管组成,它们用橡皮管连通,并装入适量水。甲管有刻度(0~50
mL),供量气用;乙管可上下移动,以调节液面高低。
实验室可供选用的药品还有:稀硫酸、盐酸、过氧化钠、碳酸钠、大理石、水。上述装置的连接顺序是⑤③④⑥⑦②①⑧(提示:B装置用来除去制得的CO2中的HCl)
试回答:
(1)写出装置D中的化学反应方程式
________________________________________________。
(2)C装置用来制取CO2,写出此装置中的化学反应方程式:_______________________________。
(3)装置A的作用是__________________________________________________________。
(4)为了较准确地测量氧气的体积,除了必须检查整个装置的气密性之外,在读取反应前后甲管中液面的读数,求其差值的过程中,应注意________(填写字母编号)。
a.视线与凹液面最低处相平
b.等待片刻,待乙管中液面不再上升时,立刻读数
c.读数时应上下移动乙管,使甲、乙两管液面相平
d.读数时不一定使甲、乙两管液面相平
16.某化学研究性学习小组设计了如图所示的实验装置,目的是做钠与水反应的实脸并验证①钠的物理性质;②钠和水反应的产物.请回答下列问题:
(1)实验开始时,欲使钠与水接触反应,应如何操作?________.
(2)反应开始后,试管中能观察到的实验现象是:_______(填写代号)
A.?钠在水层中反应熔成小球并四处游动??????????????????
B.?钠在两液体界面处反应熔成小球并可能作上下跳动
C.?钠在水层中反应熔成小球并四处游动??????????????????
D.?钠不断地减小至消失
E.?钠停留在煤油层中不反应
(3)通过上述现象,能够验证钠的哪些物理性质:________
(4)100mL
容量瓶中盛有100mL0.101mol/L的BaCl2溶液,现欲将其稀释成浓度为0.100mol/L的BaCl2溶液(体积仍保持为100mL),所选用的仪器有:10mL量筒、1mL移液管(可准确移取0.10~1.00mL溶液)、胶头滴管.其简单的操作步骤是________.
三、元素或物质推断题
17.中学常见单质A、B和甲、乙、丙三种化合物有如图所示的转换关系(部分产物未列出),单质A常作为食品包装材料,甲是两性氧化物。
根据图示转化关系回答:
(1)写出单质A与Fe2O3反应的化学方程式__________________________________
(2)写出电解甲制单质A的化学方程式__________________________________
(3)实验室完成单质A与Fe2O3反应实验,需要的试剂还有_______。
a.KCl
b.KClO
3
c.MnO2
d.Mg
(4)利用单质A与Fe2O3反应的原理,工业上可用于___________
18.下图为元索周期表的一部分,参照元素①~⑧在周期表中的位置,回答下列问题:
(1)④⑥⑦的离子半径由大到小的顺序为______(填离子符号)。
(2)②⑦⑧的最高价含氧酸的酸性由强到弱的顺序为_____(用化学式表示)。
(3)由元素①~⑧形成的物质可发生图中的反应,其中A含有离子键,D、F是单质,?E是⑦的最高价氧化物对应的水化物,B是温室气体的主要成分。
①A的电子式为______________;
②反应II的反应类型为_______________;
③反应I中消耗标准状况下1.12L
B时,转移的电子数约为______________
。
(4)⑧的某种氧化物是常见的消毒剂,等物质的量时其消毒能力是单质⑧的2.5倍,实验室制取该消毒剂的常用方法为向含元素⑧的含氧酸钠盐中加入甲醇和稀硫酸,生成67.5
g该消毒剂时,转移NA个电子,则该反应的化学方程式为________。
四、计算题
19.在MgCl2和AlCl3的混和溶液中,逐滴加入NaOH溶液直至过量,经测定,加入NaOH的物质的量和所得沉淀的物质的量的关系如右图所示,则:
(1)图中C点表示当加入________mol
NaOH时,Al3+已完全转化为____________(填微粒符号)
(2)图中线段OA和AB两段NaOH的物质的量之比为
____________。
(3)写出AB段发生反应的离子方程式___________________________________。
20.将6.5g锌放入一定量稀硫酸中恰好完全反应,得到80mL密度为1.25g/mL的溶液。
试计算:
(1)生成标准状况下的H2的体积_______;
(2)所得溶液中硫酸锌的物质的量浓度_______;
(3)所用稀硫酸的质量分数_______。
21.为测定某种镁铝合金的成分,将样品粉末分成等质量的两份,一份放入到过量的氢氧化钠溶液中,得到6.72LH2(标准状况下)、另一份放入到过量的盐酸11.2LH2(标准状况下),试计算:
(1)每份合金中铝的质量。
(2)该合金中铝和镁的物质的量之比(请写出详细的解答过程)。
参考答案
1.C
2.C
3.C
4.D
5.A
6.B
7.D
8.A
9.A
10.D
11.C
12.D
13.D
14.A
15.
2Na2O2+2CO2===2Na2CO3+O2
CaCO3+2HCl===CaCl2+CO2↑+H2O
吸收混在O2中未反应的CO2
ac
16.按住橡皮塞,将大头针向上抽,使钠块掉入水中
B,D,F
熔点低,密度比水小
用1mL移液管移出0.99mL的0.1010mol?L﹣1的BaCl2溶液,然后用胶头滴管向剩下的99.01mL
0.1010mol?L﹣1的BaCl2溶液中加水至刻度线,即可配制得0.100mol?L﹣1的BaCl2溶液
17.2Al+Fe2O32Fe
+Al2O3
2Al2O3(熔融)4Al+3O2↑
bd
焊接钢轨等
18.S2->O2->Na+
HClO4>H2SO4>H2CO3
复分解反应
19.0.6
AlO2-
5:1
Al(OH)3
+OH-
=
AlO2-+
2H2O
20.2.24L
1.25mol/L
10.5%
21.(1)5.4g
(2)1:1
答案第1页,总2页
