人教版高中化学必修1第三章《金属及其化合物》检测题(含答案)
文档属性
| 名称 | 人教版高中化学必修1第三章《金属及其化合物》检测题(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 127.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-11-19 18:39:26 | ||
图片预览


文档简介
《金属及其化合物》检测题
一、单选题
1.铁元素在地壳中含量丰富,下列有关说法不正确的是
A.不锈钢属于铁合金
B.用KSCN溶液可检验溶液中的Fe3+
C.铁制品腐蚀过程中铁被还原
D.铁矿石炼铁过程中涉及化学变化
2.下列反应的离子方程式正确的是( )
A.少量的碳酸氢钠溶液与澄清石灰水混合:2+2OH-+Ca2+=CaCO3↓++2H2O
B.过量的碳酸氢钠溶液与澄清石灰水混合:+OH-+Ca2+=CaCO3↓+H2O
C.碳酸氢钠溶液与少量的盐酸溶液混合:+H+=CO2↑+H2O
D.碳酸钠溶液与过量的盐酸溶液混合:Na2CO3+2H+=2Na++CO2↑+H2O
3.合金是常用的材料。下列产品不属于合金制品的是
A.铁锅
B.金属门窗
C.不锈钢餐具
D.水银温度计
4.将过氧化钠分别投入下列溶液中,有气体放出且溶液质量可能减少的是(
)
A.溶液
B.溶液
C.溶液
D.NaCl溶液
5.下列有关说法不正确的是(
)
A.沿海城市建筑时直接从海洋里取用海沙,可以大大降低成本
B.“地沟油”禁止使用,但处理后可以制生物柴油和肥皂
C.乙醇溶液、双氧水均可用于杀菌消毒,但原理不同
D.维生素C和铁粉是常用的抗氧化剂
6.以下进行性质比较的实验设计,不合理的是
A.比较镁、铝金属性:镁、铝(除氧化膜)分别放入4mol·L?1NaOH溶液中
B.比较氯、溴非金属性:氯气通入溴化钠溶液中
C.比较Cu、Fe2+的还原性:Cu加入FeCl3溶液中
D.比较高锰酸钾、氯气的氧化性:高锰酸钾中加入浓盐酸
7.下列有关物质应用的说法中,不正确的是(
)
A.Na2CO3是发酵粉的主要成分之一
B.MgO常用作耐高温材料
C.碘化银可用于人工降雨
D.氯气可用于自来水消毒
8.下列物质既能与盐酸反应,又能与NaOH?反应的是(
)
A.SiO2
B.(NH4)2CO3
C.Na2SO3
D.NH4Cl
9.下列反应的离子方程式正确的是
A.过氧化钠固体与水反应制氧气:2O22—+2H2O=4OH-+O2↑
B.在100ml浓度为1
mol
·
L-1
的Fe(NO3)3的溶液中通入足量SO22Fe3++SO2+2H2O==2Fe2++SO42+4H+
C.1mo·L-1
的
NaAlO2
溶液和2.5mol·
L-1
的盐酸等体积混合:2AlO2-
+
5
H+=Al(OH)3
↓+
Al3+
+
H2
O
D.向碳酸钠溶液中逐滴加入与之等体积等物质的量浓度的稀醋酸:CO+H+
===
HCO
10.下列有关金属镁的说法不正确的是( )
A.Mg在CO2中燃烧生成MgO和C,是放热反应
B.工业上通过电解MgCl2溶液制取金属镁
C.Mg和稀硫酸反应时,滴加少量硫酸铜溶液,能加快反应速率
D.镁可以用来制造信号弹和焰火,MgO可以作耐高温材料
11.氯化铁溶液的颜色是
A.无色
B.粉红色
C.棕黄色
D.浅绿色
12.在100mL
0.1mol/L的Al2(SO4)3溶液中加入0.5mol/L的NaOH溶液得到1.56g沉淀,加入NaOH溶液的体积是
A.130mL
B.120mL
C.90mL
D.50mL
13.铁是一种应用广泛的金属。下列有关铁的说法正确的是
A.铁与盐酸反应生成氯化铁和氢气
B.常温下铁在浓硫酸中钝化
C.铁在氧气中燃烧生成物为三氧化二铁
D.纯铁(块状)是黑色金属
14.把少量废铁屑溶于过量稀硫酸中,过滤,除去杂质,在滤液中加入过量氯水,再加入过量的氨水,有沉淀生成。过滤,加热沉淀物至质量不再发生变化,得到固体残渣。上述沉淀和残渣分别为
A.Fe(OH)2
;Fe2O3
B.Fe(OH)2;FeO
C.Fe(OH)2、Fe(OH)3;Fe2O3
D.Fe(OH)3;Fe2O3
二、实验题
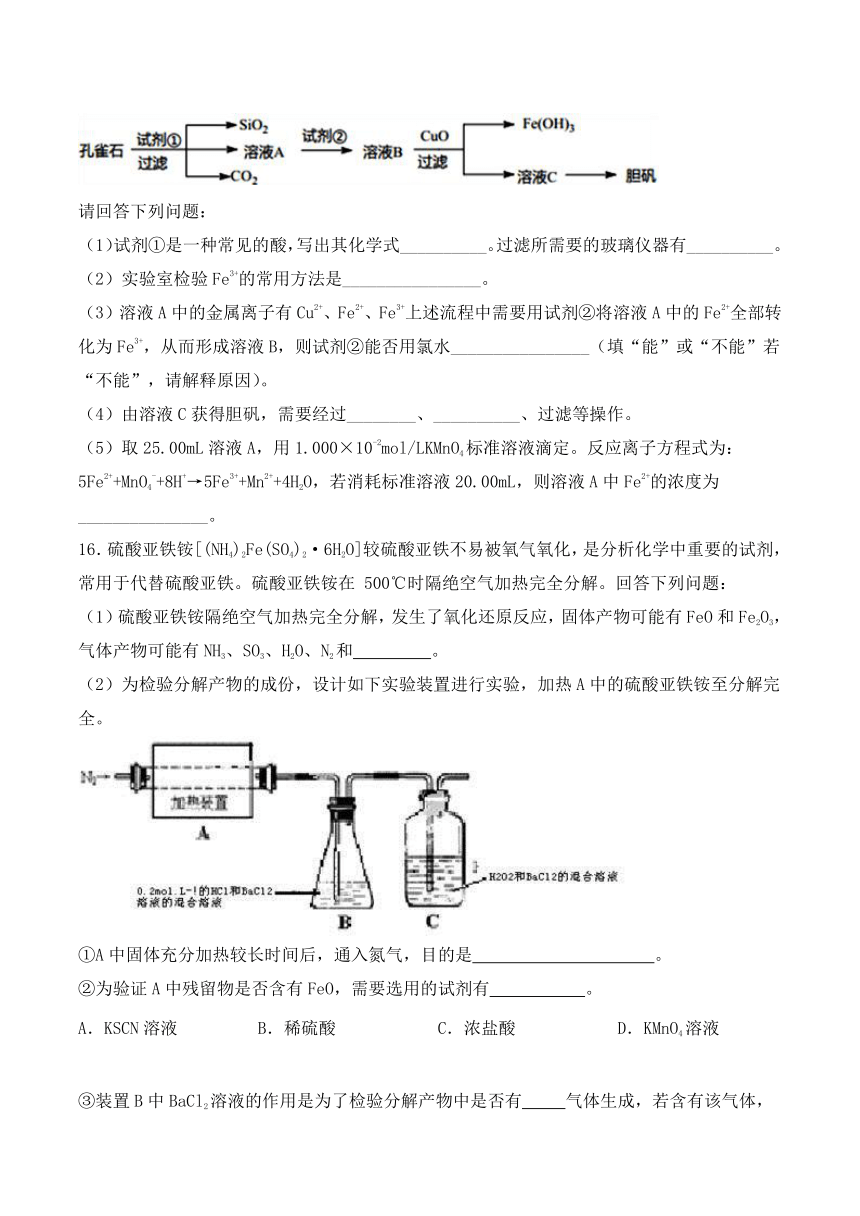
15.孔雀石主要含Cu2(OH)2CO3以及少量Fe、Si的化合物。可以用孔雀石为原料制备胆矾(CuSO4·5H2O)
步骤如下:
请回答下列问题:
(1)试剂①是一种常见的酸,写出其化学式__________。过滤所需要的玻璃仪器有__________。
(2)实验室检验Fe3+的常用方法是________________。
(3)溶液A中的金属离子有Cu2+、Fe2+、Fe3+上述流程中需要用试剂②将溶液A中的Fe2+全部转化为Fe3+,从而形成溶液B,则试剂②能否用氯水________________(填“能”或“不能”若“不能”,请解释原因)。
(4)由溶液C获得胆矾,需要经过________、__________、过滤等操作。
(5)取25.00mL溶液A,用1.000×10-2mol/LKMnO4标准溶液滴定。反应离子方程式为:5Fe2++MnO4-+8H+→5Fe3++Mn2++4H2O,若消耗标准溶液20.00mL,则溶液A中Fe2+的浓度为_______________。
16.硫酸亚铁铵[(NH4)2Fe(SO4)2·6H2O]较硫酸亚铁不易被氧气氧化,是分析化学中重要的试剂,常用于代替硫酸亚铁。硫酸亚铁铵在
500℃时隔绝空气加热完全分解。回答下列问题:
(1)硫酸亚铁铵隔绝空气加热完全分解,发生了氧化还原反应,固体产物可能有FeO和Fe2O3,气体产物可能有NH3、SO3、H2O、N2和
。
(2)为检验分解产物的成份,设计如下实验装置进行实验,加热A中的硫酸亚铁铵至分解完全。
①A中固体充分加热较长时间后,通入氮气,目的是
。
②为验证A中残留物是否含有FeO,需要选用的试剂有
。
A.KSCN溶液
B.稀硫酸
C.浓盐酸
D.KMnO4溶液
③装置B中BaCl2溶液的作用是为了检验分解产物中是否有
气体生成,若含有该气体,观察到的现象为
。
④若A中分解产物有N2,固体残留物只有Fe2O3,Fe2O3的物质的量为bmol,C中沉淀物质的量为amol,则
b
a(填“大于”、“小于”或“等于”)
⑤实验中,观察到C中有白色沉淀生成,则C中发生的反应为
(用离子方程式表示)。
(3)已知亚铁离子被氧气氧化的反应是:4Fe2++
O2+
(4+2x)
H2O2Fe2O3?xH2O
+
8H+,硫酸亚铁铵
溶液较硫酸亚铁溶液不易被氧气氧化,其原因是
。
三、元素或物质推断题
17.A、B、C、D、F五种物质的焰色反应均为黄色,A、B、C、D与盐酸反应均生成E,此外B还生成一种可燃气体。而C、D还生成一种无色无味气体
H,该气体能使澄清石灰水变浑浊。D和A可反应生成C,F和H也可反应生成C和另一种无色无味气体。请回答下列问题:
(1)写出A、B、C、D、E、F的化学式_______________________________。
(2)写出F和H反应的化学方程式______________________________
。
(3)写出下列反应的化学方程式:①D
+
盐酸________________。②B
+
水________________。
18.下列图示中,A为一种常见的单质,B、C、D、E是含A元素的常见化合物,它们的焰色实验均为黄色。
请填写下列空白:
(1)写出下列化学式:A____________,D____________
(2)以上反应中,不属于氧化还原反应的有________________(填序号)。
(3)完成方程式
①A→C反应的离子方程式:______________________________________________,
②B→D反应的化学方程式:______________________________________________________。
19.已知A为常见的金属单质,根据如图所示的转化关系回答下列问题。
(1)写出下列各物质的化学式:A_______,B________,C_______,D______,E______,F________。
(2)反应④的离子方程式为___________,反应⑤的离子方程式为____________;反应⑧的化学方程式为________________。
四、计算题
20.有一硫酸和硝酸的混合溶液,取出其中的10mL,加入足量的BaCl2溶液,过滤、洗涤、烘干后得到9.32g沉淀,滤液跟4mol/LNaOH溶液反应,用去25mL碱液时恰好中和。求混合溶液中硫酸和硝酸的物质的量浓度
21.取表面有铁锈(Fe2O3)的铁片22.0
g,将其投入足量稀硫酸中,铁片完全溶解,产生氢气4.48
L(标准状况)。试计算:
(1)产生氢气的物质的量是________________
mol。
(2)铁片中铁的质量是__________________
g。
参考答案
1.C
2.C
3.D
4.B
5.A
6.A
7.A
8.B
9.C
10.B
11.C
12.B
13.B
14.D
15.H2SO4
漏斗、烧杯、玻璃棒
取样,向其中滴加KSCN溶液,溶液呈血红色,则含有Fe3+
不能,会引入新的杂质
蒸发浓缩
冷却结晶
0.040mol/L
16.(每空2分)(1)SO2
(2)
①使分解产生的气体在B、C中被充分吸收
②CD
③SO3溶液变浑浊
④小于
⑤SO2+H2O2+Ba2+=BaSO4↓+2H+
(3)硫酸亚铁铵溶液中NH4+发生水解增大c(H+),抑制了上述氧化还原反应的进行
17.A、NaOH
B、Na
C、Na2CO3
D、NaHCO3
E、NaCl
F、Na2O2
2Na2O2+2CO2=2Na2CO3+O2
NaHCO3+HCl=NaCl+CO2↑+H2O
2Na+2H20=2NaOH+H2↑
18.Na
Na2CO3
⑤⑥
2Na+2H2O=2Na++2OH—+H2↑
2Na2O2+2CO2=2Na2CO3+O2
19.Fe
Fe3O4
FeCl2
FeCl3
Fe(OH)2
Fe(OH)3
2Fe2++Cl2=2Fe3++2Cl-
2Fe3++Fe=3Fe2+
4Fe(OH)2+O2+2H2O=4Fe(OH)3
20.硫酸和硝酸的混合酸中滴入过量的BaCl2溶液,反应后得到9.32g
BaSO4沉淀。根据硫守恒:n(BaSO4)=n(H2SO4)=9.32g/233g/mol=0.04mol,所以c(H2SO4)=0.04mol/0.01L=4mol/L。硫酸和硝酸的混合酸和BaCl2溶液反应时,只有SO42-和Ba2+发生了反应,H+没参与反应,所以H+全部留在了滤液中。H+消耗的NaOH的物质的量为0.025L×4mol/L=0.1mol。硫酸为0.04mol,提供的H+为0.08mol,所以硝酸提供的H+为0.1mol-0.08mol=0.02mol,所以HNO3为0.02mol,所以c(HNO3)=0.02mol/0.01L=2mol/L。故答案为:硫酸的物质的量浓度为4mol/L,硝酸的物质的量浓度为2mol/L。
21.
0.20
14.0
一、单选题
1.铁元素在地壳中含量丰富,下列有关说法不正确的是
A.不锈钢属于铁合金
B.用KSCN溶液可检验溶液中的Fe3+
C.铁制品腐蚀过程中铁被还原
D.铁矿石炼铁过程中涉及化学变化
2.下列反应的离子方程式正确的是( )
A.少量的碳酸氢钠溶液与澄清石灰水混合:2+2OH-+Ca2+=CaCO3↓++2H2O
B.过量的碳酸氢钠溶液与澄清石灰水混合:+OH-+Ca2+=CaCO3↓+H2O
C.碳酸氢钠溶液与少量的盐酸溶液混合:+H+=CO2↑+H2O
D.碳酸钠溶液与过量的盐酸溶液混合:Na2CO3+2H+=2Na++CO2↑+H2O
3.合金是常用的材料。下列产品不属于合金制品的是
A.铁锅
B.金属门窗
C.不锈钢餐具
D.水银温度计
4.将过氧化钠分别投入下列溶液中,有气体放出且溶液质量可能减少的是(
)
A.溶液
B.溶液
C.溶液
D.NaCl溶液
5.下列有关说法不正确的是(
)
A.沿海城市建筑时直接从海洋里取用海沙,可以大大降低成本
B.“地沟油”禁止使用,但处理后可以制生物柴油和肥皂
C.乙醇溶液、双氧水均可用于杀菌消毒,但原理不同
D.维生素C和铁粉是常用的抗氧化剂
6.以下进行性质比较的实验设计,不合理的是
A.比较镁、铝金属性:镁、铝(除氧化膜)分别放入4mol·L?1NaOH溶液中
B.比较氯、溴非金属性:氯气通入溴化钠溶液中
C.比较Cu、Fe2+的还原性:Cu加入FeCl3溶液中
D.比较高锰酸钾、氯气的氧化性:高锰酸钾中加入浓盐酸
7.下列有关物质应用的说法中,不正确的是(
)
A.Na2CO3是发酵粉的主要成分之一
B.MgO常用作耐高温材料
C.碘化银可用于人工降雨
D.氯气可用于自来水消毒
8.下列物质既能与盐酸反应,又能与NaOH?反应的是(
)
A.SiO2
B.(NH4)2CO3
C.Na2SO3
D.NH4Cl
9.下列反应的离子方程式正确的是
A.过氧化钠固体与水反应制氧气:2O22—+2H2O=4OH-+O2↑
B.在100ml浓度为1
mol
·
L-1
的Fe(NO3)3的溶液中通入足量SO22Fe3++SO2+2H2O==2Fe2++SO42+4H+
C.1mo·L-1
的
NaAlO2
溶液和2.5mol·
L-1
的盐酸等体积混合:2AlO2-
+
5
H+=Al(OH)3
↓+
Al3+
+
H2
O
D.向碳酸钠溶液中逐滴加入与之等体积等物质的量浓度的稀醋酸:CO+H+
===
HCO
10.下列有关金属镁的说法不正确的是( )
A.Mg在CO2中燃烧生成MgO和C,是放热反应
B.工业上通过电解MgCl2溶液制取金属镁
C.Mg和稀硫酸反应时,滴加少量硫酸铜溶液,能加快反应速率
D.镁可以用来制造信号弹和焰火,MgO可以作耐高温材料
11.氯化铁溶液的颜色是
A.无色
B.粉红色
C.棕黄色
D.浅绿色
12.在100mL
0.1mol/L的Al2(SO4)3溶液中加入0.5mol/L的NaOH溶液得到1.56g沉淀,加入NaOH溶液的体积是
A.130mL
B.120mL
C.90mL
D.50mL
13.铁是一种应用广泛的金属。下列有关铁的说法正确的是
A.铁与盐酸反应生成氯化铁和氢气
B.常温下铁在浓硫酸中钝化
C.铁在氧气中燃烧生成物为三氧化二铁
D.纯铁(块状)是黑色金属
14.把少量废铁屑溶于过量稀硫酸中,过滤,除去杂质,在滤液中加入过量氯水,再加入过量的氨水,有沉淀生成。过滤,加热沉淀物至质量不再发生变化,得到固体残渣。上述沉淀和残渣分别为
A.Fe(OH)2
;Fe2O3
B.Fe(OH)2;FeO
C.Fe(OH)2、Fe(OH)3;Fe2O3
D.Fe(OH)3;Fe2O3
二、实验题
15.孔雀石主要含Cu2(OH)2CO3以及少量Fe、Si的化合物。可以用孔雀石为原料制备胆矾(CuSO4·5H2O)
步骤如下:
请回答下列问题:
(1)试剂①是一种常见的酸,写出其化学式__________。过滤所需要的玻璃仪器有__________。
(2)实验室检验Fe3+的常用方法是________________。
(3)溶液A中的金属离子有Cu2+、Fe2+、Fe3+上述流程中需要用试剂②将溶液A中的Fe2+全部转化为Fe3+,从而形成溶液B,则试剂②能否用氯水________________(填“能”或“不能”若“不能”,请解释原因)。
(4)由溶液C获得胆矾,需要经过________、__________、过滤等操作。
(5)取25.00mL溶液A,用1.000×10-2mol/LKMnO4标准溶液滴定。反应离子方程式为:5Fe2++MnO4-+8H+→5Fe3++Mn2++4H2O,若消耗标准溶液20.00mL,则溶液A中Fe2+的浓度为_______________。
16.硫酸亚铁铵[(NH4)2Fe(SO4)2·6H2O]较硫酸亚铁不易被氧气氧化,是分析化学中重要的试剂,常用于代替硫酸亚铁。硫酸亚铁铵在
500℃时隔绝空气加热完全分解。回答下列问题:
(1)硫酸亚铁铵隔绝空气加热完全分解,发生了氧化还原反应,固体产物可能有FeO和Fe2O3,气体产物可能有NH3、SO3、H2O、N2和
。
(2)为检验分解产物的成份,设计如下实验装置进行实验,加热A中的硫酸亚铁铵至分解完全。
①A中固体充分加热较长时间后,通入氮气,目的是
。
②为验证A中残留物是否含有FeO,需要选用的试剂有
。
A.KSCN溶液
B.稀硫酸
C.浓盐酸
D.KMnO4溶液
③装置B中BaCl2溶液的作用是为了检验分解产物中是否有
气体生成,若含有该气体,观察到的现象为
。
④若A中分解产物有N2,固体残留物只有Fe2O3,Fe2O3的物质的量为bmol,C中沉淀物质的量为amol,则
b
a(填“大于”、“小于”或“等于”)
⑤实验中,观察到C中有白色沉淀生成,则C中发生的反应为
(用离子方程式表示)。
(3)已知亚铁离子被氧气氧化的反应是:4Fe2++
O2+
(4+2x)
H2O2Fe2O3?xH2O
+
8H+,硫酸亚铁铵
溶液较硫酸亚铁溶液不易被氧气氧化,其原因是
。
三、元素或物质推断题
17.A、B、C、D、F五种物质的焰色反应均为黄色,A、B、C、D与盐酸反应均生成E,此外B还生成一种可燃气体。而C、D还生成一种无色无味气体
H,该气体能使澄清石灰水变浑浊。D和A可反应生成C,F和H也可反应生成C和另一种无色无味气体。请回答下列问题:
(1)写出A、B、C、D、E、F的化学式_______________________________。
(2)写出F和H反应的化学方程式______________________________
。
(3)写出下列反应的化学方程式:①D
+
盐酸________________。②B
+
水________________。
18.下列图示中,A为一种常见的单质,B、C、D、E是含A元素的常见化合物,它们的焰色实验均为黄色。
请填写下列空白:
(1)写出下列化学式:A____________,D____________
(2)以上反应中,不属于氧化还原反应的有________________(填序号)。
(3)完成方程式
①A→C反应的离子方程式:______________________________________________,
②B→D反应的化学方程式:______________________________________________________。
19.已知A为常见的金属单质,根据如图所示的转化关系回答下列问题。
(1)写出下列各物质的化学式:A_______,B________,C_______,D______,E______,F________。
(2)反应④的离子方程式为___________,反应⑤的离子方程式为____________;反应⑧的化学方程式为________________。
四、计算题
20.有一硫酸和硝酸的混合溶液,取出其中的10mL,加入足量的BaCl2溶液,过滤、洗涤、烘干后得到9.32g沉淀,滤液跟4mol/LNaOH溶液反应,用去25mL碱液时恰好中和。求混合溶液中硫酸和硝酸的物质的量浓度
21.取表面有铁锈(Fe2O3)的铁片22.0
g,将其投入足量稀硫酸中,铁片完全溶解,产生氢气4.48
L(标准状况)。试计算:
(1)产生氢气的物质的量是________________
mol。
(2)铁片中铁的质量是__________________
g。
参考答案
1.C
2.C
3.D
4.B
5.A
6.A
7.A
8.B
9.C
10.B
11.C
12.B
13.B
14.D
15.H2SO4
漏斗、烧杯、玻璃棒
取样,向其中滴加KSCN溶液,溶液呈血红色,则含有Fe3+
不能,会引入新的杂质
蒸发浓缩
冷却结晶
0.040mol/L
16.(每空2分)(1)SO2
(2)
①使分解产生的气体在B、C中被充分吸收
②CD
③SO3溶液变浑浊
④小于
⑤SO2+H2O2+Ba2+=BaSO4↓+2H+
(3)硫酸亚铁铵溶液中NH4+发生水解增大c(H+),抑制了上述氧化还原反应的进行
17.A、NaOH
B、Na
C、Na2CO3
D、NaHCO3
E、NaCl
F、Na2O2
2Na2O2+2CO2=2Na2CO3+O2
NaHCO3+HCl=NaCl+CO2↑+H2O
2Na+2H20=2NaOH+H2↑
18.Na
Na2CO3
⑤⑥
2Na+2H2O=2Na++2OH—+H2↑
2Na2O2+2CO2=2Na2CO3+O2
19.Fe
Fe3O4
FeCl2
FeCl3
Fe(OH)2
Fe(OH)3
2Fe2++Cl2=2Fe3++2Cl-
2Fe3++Fe=3Fe2+
4Fe(OH)2+O2+2H2O=4Fe(OH)3
20.硫酸和硝酸的混合酸中滴入过量的BaCl2溶液,反应后得到9.32g
BaSO4沉淀。根据硫守恒:n(BaSO4)=n(H2SO4)=9.32g/233g/mol=0.04mol,所以c(H2SO4)=0.04mol/0.01L=4mol/L。硫酸和硝酸的混合酸和BaCl2溶液反应时,只有SO42-和Ba2+发生了反应,H+没参与反应,所以H+全部留在了滤液中。H+消耗的NaOH的物质的量为0.025L×4mol/L=0.1mol。硫酸为0.04mol,提供的H+为0.08mol,所以硝酸提供的H+为0.1mol-0.08mol=0.02mol,所以HNO3为0.02mol,所以c(HNO3)=0.02mol/0.01L=2mol/L。故答案为:硫酸的物质的量浓度为4mol/L,硝酸的物质的量浓度为2mol/L。
21.
0.20
14.0
