2.4化学反应进行的方向(人教选修4)
文档属性
| 名称 | 2.4化学反应进行的方向(人教选修4) |  | |
| 格式 | rar | ||
| 文件大小 | 6.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2011-10-26 21:16:47 | ||
图片预览









文档简介
(共31张PPT)
化学反应为什么能够自发进行?
E
反应历程
反应物的能量总和
生成物的能量总和
△H
是因为放热反应!
H+ + OH- == H2O
Ba2+ + SO42- == BaSO4↓
Cu(OH)2 + 2H+ == Cu2+ + 2H2O
4Na + O2 == 2Na2O
Cu + 4HNO3 == Cu(NO3)2 + 2NO2↑+ 2H2O
放热反应为什么需要点燃或加热?
E
反应历程
反应物的能量总和
生成物的能量总和
△H
放热反应的进行需要最初的反应动力?
C + O2 === CO2
2H2 + O2 === 2H2O
Fe + S === FeS
点燃
点燃
加热
— 活化能
Ea
Ea< △H
E
反应历程
反应物的能量总和
生成物的能量总和
△H
为什么有些放热反应需要持续加热?
Cu + 2H2SO4 === CuSO4 + SO2↑ + 2H2O
加热
△H
Ea
Ea < △H
反应过程中放出的热量,不足以产生维持反应持续进行所需的推动力
— 环境提供能量
E
反应历程
反应物的能量总和
生成物的能量总和
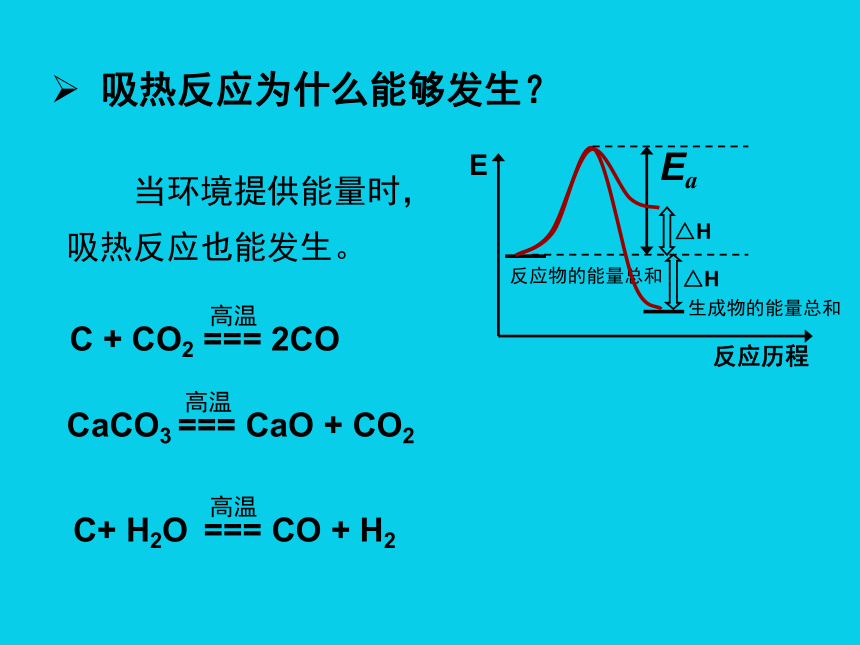
吸热反应为什么能够发生?
△H
△H
Ea
当环境提供能量时,吸热反应也能发生。
C + CO2 === 2CO
高温
CaCO3 === CaO + CO2
高温
C+ H2O === CO + H2
高温
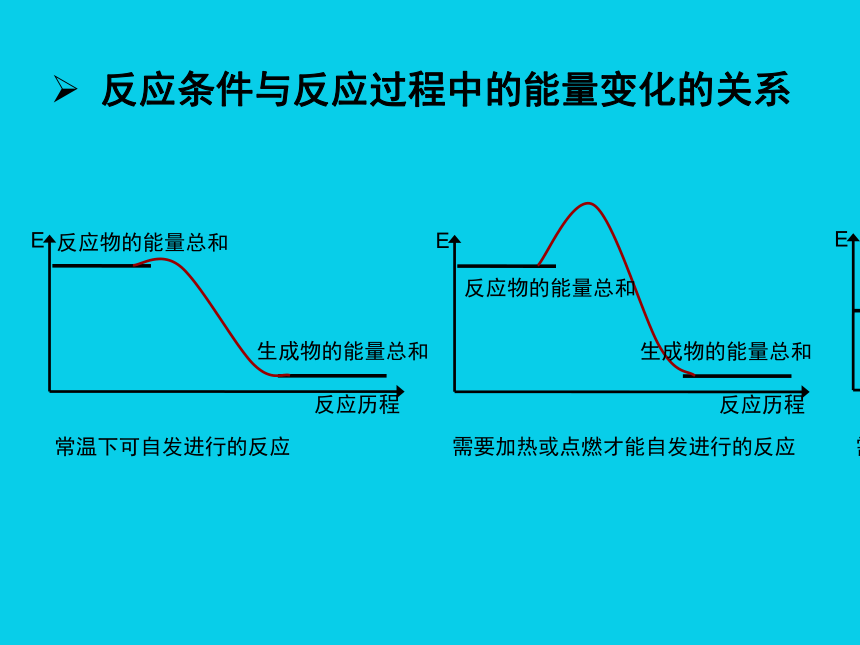
反应条件与反应过程中的能量变化的关系
反应历程
E
反应物的能量总和
生成物的能量总和
反应历程
E
反应物的能量总和
生成物的能量总和
反应历程
E
反应物的能量总和
生成物的能量总和
反应历程
E
反应物的能量总和
生成物的能量总和
常温下可自发进行的反应 需要加热或点燃才能自发进行的反应 需要持续加热才能发生的放热反应 在持续加热条件下发生的吸热反应
实验
碳酸钠固体与盐酸的反应是放热的
碳酸氢钠与盐酸反应是吸热的
碳酸钠与碳酸氢钠与盐酸的反应
取适量的Na2CO3和NaHCO3固体(约1/3药匙),
分别与盐酸反应
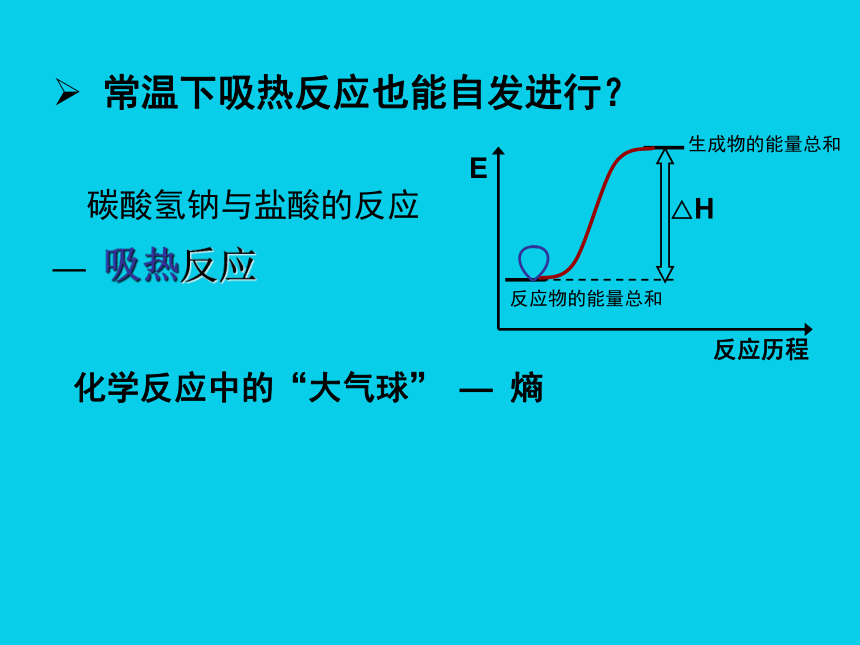
吸热反应在常温下不能自发进行吗?
反应历程
E
反应历程
E
①
②
②
Na2CO3
NaHCO3
③
③
① CO32- + H+ == HCO3-
② HCO3- + H+ == H2CO3
③ H2CO3 == H2O + CO2(g)
放热反应
吸热反应
△H < 0
△H < 0
△H > 0
碳酸钠、碳酸氢钠与盐酸反应过程中的能量变化
常温下吸热反应也能自发进行?
E
反应历程
反应物的能量总和
生成物的能量总和
△H
碳酸氢钠与盐酸的反应
— 吸热反应
化学反应中的“大气球” — 熵
描述体系混乱度的物理量,
符号:S 单位:J·mol-1·K-1
体系有自发向混乱度增加(即熵增)的方向变化的倾向,这是自然界的普遍规律。
新的物理量 — 熵
过程的自发性
能量趋于降低
混乱度趋于增加
势能的降低
混乱度的增加
实验
向试管中加入约5mL蒸馏水,滴加约1mLNaOH溶液。
再滴加酚酞!
过程的不自发性
能量趋于升高
混乱度趋于降低
与物质的状态有关
固态
液态
气态
熵增
熵增
S(冰)
< S(水)
<< S(水蒸气)
与物质的分子结构有关
S(CH4) < S(C2H6) < S(C3H8) < S(C4H10)
S(H2O) < S(H2O2)
物质熵值的特点
从反应的整体过程看,反应是吸热的,但是熵值是增大的,这是反应得以自发进行的主要原因
反应历程
E
反应历程
E
①
②
②
Na2CO3
NaHCO3
③
③
放热反应
吸热反应
碳酸钠、碳酸氢钠与盐酸反应过程中的能量变化
熵拉动反应自发进行的实例
金属K的制备
Na(l) + KCl(l) === NaCl(l) + K(g)
高温
在下列反应中为什么金属钠能还原金属钾?
平衡移动
熵的“拉动”
关键: 沸点 K < Na
SiO2的还原
熵拉动反应自发进行的实例
SiO2 + 2C === Si + 2CO
高温
—“从沙滩到用户”的关键反应
SiO2 + C === Si + CO2
高温
比较以下两个反应,何者更具优势?
实际: 高温下低价氧化物更加稳定,
即,高温有利于CO生成
熵拉动反应自发进行的实例
Al的冶炼
2Al2O3 + 6Cl2 == 4AlCl3 + 3O2
高温
Al2O3 + 3Cl2 + 3C == 2AlCl3 + 3CO
高温
2C + O2 == 2CO
高温
Al2O3 AlCl3 Al
Cl2
Na
—化学方法
能量不利
熵增不力
+)
真实反应与理性思考的契合
焓判据与熵判据与反应的自发性
焓变 熵变 反应的自发性
△H<0 △S>0
△H<0 △S<0 ?
△H>0 △S>0 ?
△H>0 △S<0
反应能够自发进行
反应不能自发进行
对化学反应进行分类的新视角
从定量的角度衡量焓变和熵变对化学自发性影响的重要
R. Clausius 克劳休斯
“熵”的概念的提出
1854年克劳修斯在表述热力学第二定律的过程中,引入一个新的概念 — “熵”。
L. Boltzmann 波耳兹曼
“熵”的物理意义
S = k logW
建立了“熵”此宏观物理量与某一宏观状态所对应的微观状态数之间的相互联系。
S = k logW
F = m a
E = m c2
牛顿运动定律
爱因斯坦质能关系
焓判据与熵判据的定量关系
研究表明:在温度、压强一定的条件下,化学反应自发进行方向的判据是
吉布斯自由能
△G = △H - T△S
△G = △H - T△S < 0 反应能自发进行
△G = △H - T△S >0 反应不能自发进行
△G = △H - T△S =0 反应达到平衡状态
( G ~吉布斯自由能)
J.W.Gibbs
吉布斯
放热反应 熵减反应
判断下列反应的进行趋势
NH3(g) + HCl(g) == NH4Cl(s)
△H < 0
△S < 0
低温对此类反应有利
高温对此类反应不利
△G = △H - T△S
H > 0 S > 0
高温对此类反应有利
低温对此类反应不利
NH4Cl(s) == NH3(s) + HCl(g)
街头一景
2NO(g) + 2CO(g) = N2(g) + 2CO2(g),
如果该反应速率极慢,如何加快反应速率?
请说明上述反应在什么条件下,可以自发进行?
思考:
已知, 298K、101KPa下反应
△H = - 113.0 KJ·mol-1 ,△S = - 143.5 J·mol-1·K-1
汽车尾气中含有NO、CO等有害气体。怎样将它们转化为可参与大气循环的气体?
T< 787K t<514℃
知识回顾
化学反应与能量的变化
化学反应与熵值的变化
“焓”与“熵”共同对化学反应的自发性产生影响
吉布斯自由能的定量判断
理解反应
设计反应
OH-
无色
紫色
反应进行的方向 ~ 焓判据与熵判据
+ NaOH
+ H2O
CH3CH2OH + NaOH
CH3CH2ONa + H2O
×
结构与性质的关系
值得说明的若干问题
对反应以上的讨论,仅限于反应体系的自身行为
反应的可行性与反应的现实性的关系
(人为的干预,可以改变反应的进行方向)
(反应的趋势的强弱不等同于反应速率的快慢)
从“熵”的角度看世界
薛定谔所著《生命是什么?》
“热力学第二定律是一个最深刻、最普遍的定律。它有着自身忧郁的美,象所有重要定律一样,引起人们的崇敬之情。”
— 英国作家 C.P.Snow
正如“能”的观点被人们普遍接受一样,“熵”的观点也越来越多地被人们用来解释物理、化学、生命、信息、生活中的诸多行为与现象。
知识回顾
化学反应与能量的变化
化学反应与熵值的变化
“焓”与“熵”共同对化学反应的自发性产生影响
吉布斯自由能的定量判断
理解反应
设计反应
谢 谢!
化学反应为什么能够自发进行?
E
反应历程
反应物的能量总和
生成物的能量总和
△H
是因为放热反应!
H+ + OH- == H2O
Ba2+ + SO42- == BaSO4↓
Cu(OH)2 + 2H+ == Cu2+ + 2H2O
4Na + O2 == 2Na2O
Cu + 4HNO3 == Cu(NO3)2 + 2NO2↑+ 2H2O
放热反应为什么需要点燃或加热?
E
反应历程
反应物的能量总和
生成物的能量总和
△H
放热反应的进行需要最初的反应动力?
C + O2 === CO2
2H2 + O2 === 2H2O
Fe + S === FeS
点燃
点燃
加热
— 活化能
Ea
Ea< △H
E
反应历程
反应物的能量总和
生成物的能量总和
△H
为什么有些放热反应需要持续加热?
Cu + 2H2SO4 === CuSO4 + SO2↑ + 2H2O
加热
△H
Ea
Ea < △H
反应过程中放出的热量,不足以产生维持反应持续进行所需的推动力
— 环境提供能量
E
反应历程
反应物的能量总和
生成物的能量总和
吸热反应为什么能够发生?
△H
△H
Ea
当环境提供能量时,吸热反应也能发生。
C + CO2 === 2CO
高温
CaCO3 === CaO + CO2
高温
C+ H2O === CO + H2
高温
反应条件与反应过程中的能量变化的关系
反应历程
E
反应物的能量总和
生成物的能量总和
反应历程
E
反应物的能量总和
生成物的能量总和
反应历程
E
反应物的能量总和
生成物的能量总和
反应历程
E
反应物的能量总和
生成物的能量总和
常温下可自发进行的反应 需要加热或点燃才能自发进行的反应 需要持续加热才能发生的放热反应 在持续加热条件下发生的吸热反应
实验
碳酸钠固体与盐酸的反应是放热的
碳酸氢钠与盐酸反应是吸热的
碳酸钠与碳酸氢钠与盐酸的反应
取适量的Na2CO3和NaHCO3固体(约1/3药匙),
分别与盐酸反应
吸热反应在常温下不能自发进行吗?
反应历程
E
反应历程
E
①
②
②
Na2CO3
NaHCO3
③
③
① CO32- + H+ == HCO3-
② HCO3- + H+ == H2CO3
③ H2CO3 == H2O + CO2(g)
放热反应
吸热反应
△H < 0
△H < 0
△H > 0
碳酸钠、碳酸氢钠与盐酸反应过程中的能量变化
常温下吸热反应也能自发进行?
E
反应历程
反应物的能量总和
生成物的能量总和
△H
碳酸氢钠与盐酸的反应
— 吸热反应
化学反应中的“大气球” — 熵
描述体系混乱度的物理量,
符号:S 单位:J·mol-1·K-1
体系有自发向混乱度增加(即熵增)的方向变化的倾向,这是自然界的普遍规律。
新的物理量 — 熵
过程的自发性
能量趋于降低
混乱度趋于增加
势能的降低
混乱度的增加
实验
向试管中加入约5mL蒸馏水,滴加约1mLNaOH溶液。
再滴加酚酞!
过程的不自发性
能量趋于升高
混乱度趋于降低
与物质的状态有关
固态
液态
气态
熵增
熵增
S(冰)
< S(水)
<< S(水蒸气)
与物质的分子结构有关
S(CH4) < S(C2H6) < S(C3H8) < S(C4H10)
S(H2O) < S(H2O2)
物质熵值的特点
从反应的整体过程看,反应是吸热的,但是熵值是增大的,这是反应得以自发进行的主要原因
反应历程
E
反应历程
E
①
②
②
Na2CO3
NaHCO3
③
③
放热反应
吸热反应
碳酸钠、碳酸氢钠与盐酸反应过程中的能量变化
熵拉动反应自发进行的实例
金属K的制备
Na(l) + KCl(l) === NaCl(l) + K(g)
高温
在下列反应中为什么金属钠能还原金属钾?
平衡移动
熵的“拉动”
关键: 沸点 K < Na
SiO2的还原
熵拉动反应自发进行的实例
SiO2 + 2C === Si + 2CO
高温
—“从沙滩到用户”的关键反应
SiO2 + C === Si + CO2
高温
比较以下两个反应,何者更具优势?
实际: 高温下低价氧化物更加稳定,
即,高温有利于CO生成
熵拉动反应自发进行的实例
Al的冶炼
2Al2O3 + 6Cl2 == 4AlCl3 + 3O2
高温
Al2O3 + 3Cl2 + 3C == 2AlCl3 + 3CO
高温
2C + O2 == 2CO
高温
Al2O3 AlCl3 Al
Cl2
Na
—化学方法
能量不利
熵增不力
+)
真实反应与理性思考的契合
焓判据与熵判据与反应的自发性
焓变 熵变 反应的自发性
△H<0 △S>0
△H<0 △S<0 ?
△H>0 △S>0 ?
△H>0 △S<0
反应能够自发进行
反应不能自发进行
对化学反应进行分类的新视角
从定量的角度衡量焓变和熵变对化学自发性影响的重要
R. Clausius 克劳休斯
“熵”的概念的提出
1854年克劳修斯在表述热力学第二定律的过程中,引入一个新的概念 — “熵”。
L. Boltzmann 波耳兹曼
“熵”的物理意义
S = k logW
建立了“熵”此宏观物理量与某一宏观状态所对应的微观状态数之间的相互联系。
S = k logW
F = m a
E = m c2
牛顿运动定律
爱因斯坦质能关系
焓判据与熵判据的定量关系
研究表明:在温度、压强一定的条件下,化学反应自发进行方向的判据是
吉布斯自由能
△G = △H - T△S
△G = △H - T△S < 0 反应能自发进行
△G = △H - T△S >0 反应不能自发进行
△G = △H - T△S =0 反应达到平衡状态
( G ~吉布斯自由能)
J.W.Gibbs
吉布斯
放热反应 熵减反应
判断下列反应的进行趋势
NH3(g) + HCl(g) == NH4Cl(s)
△H < 0
△S < 0
低温对此类反应有利
高温对此类反应不利
△G = △H - T△S
H > 0 S > 0
高温对此类反应有利
低温对此类反应不利
NH4Cl(s) == NH3(s) + HCl(g)
街头一景
2NO(g) + 2CO(g) = N2(g) + 2CO2(g),
如果该反应速率极慢,如何加快反应速率?
请说明上述反应在什么条件下,可以自发进行?
思考:
已知, 298K、101KPa下反应
△H = - 113.0 KJ·mol-1 ,△S = - 143.5 J·mol-1·K-1
汽车尾气中含有NO、CO等有害气体。怎样将它们转化为可参与大气循环的气体?
T< 787K t<514℃
知识回顾
化学反应与能量的变化
化学反应与熵值的变化
“焓”与“熵”共同对化学反应的自发性产生影响
吉布斯自由能的定量判断
理解反应
设计反应
OH-
无色
紫色
反应进行的方向 ~ 焓判据与熵判据
+ NaOH
+ H2O
CH3CH2OH + NaOH
CH3CH2ONa + H2O
×
结构与性质的关系
值得说明的若干问题
对反应以上的讨论,仅限于反应体系的自身行为
反应的可行性与反应的现实性的关系
(人为的干预,可以改变反应的进行方向)
(反应的趋势的强弱不等同于反应速率的快慢)
从“熵”的角度看世界
薛定谔所著《生命是什么?》
“热力学第二定律是一个最深刻、最普遍的定律。它有着自身忧郁的美,象所有重要定律一样,引起人们的崇敬之情。”
— 英国作家 C.P.Snow
正如“能”的观点被人们普遍接受一样,“熵”的观点也越来越多地被人们用来解释物理、化学、生命、信息、生活中的诸多行为与现象。
知识回顾
化学反应与能量的变化
化学反应与熵值的变化
“焓”与“熵”共同对化学反应的自发性产生影响
吉布斯自由能的定量判断
理解反应
设计反应
谢 谢!
