人教版(2019)化学 选择性必修1 第一章 化学反应的热效应 复习课件(28张ppt)
文档属性
| 名称 | 人教版(2019)化学 选择性必修1 第一章 化学反应的热效应 复习课件(28张ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 930.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-11-20 15:22:08 | ||
图片预览





文档简介
化学反应的热效应复习
1.能解释化学反应中能量变化的本质。
2.能用热化学方程式表示化学反应中的能量变化,并进
行简单计算。
3.能综合考虑化学变化中的物质变化和能量变化来分析、
解决实际问题。
学习目标
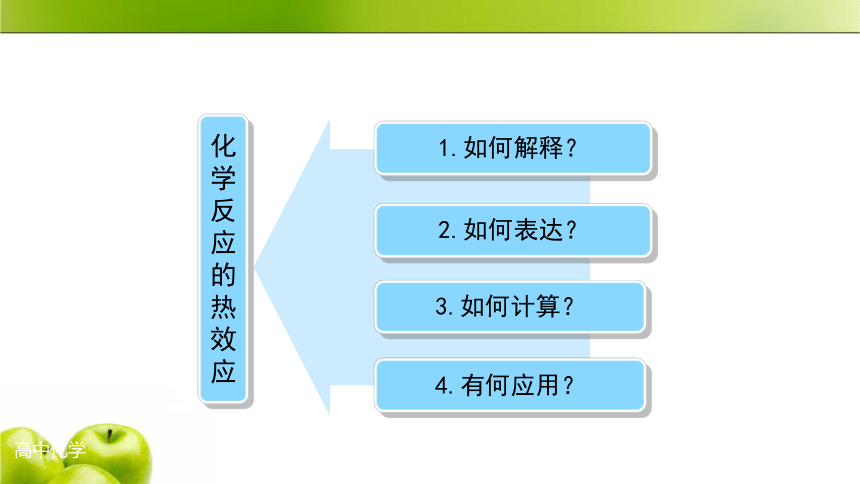
化
学
反
应
的
热
效
应
1.如何解释?
2.如何表达?
3.如何计算?
4.有何应用?
思考1
生活中我们每天都在用着天然气(主要成分:CH4),利用天然气燃烧放出的热量供我们烧水、做饭等。那么,一个化学反应到底是吸热还是放热取决于哪些因素呢?
1. 如何解释?
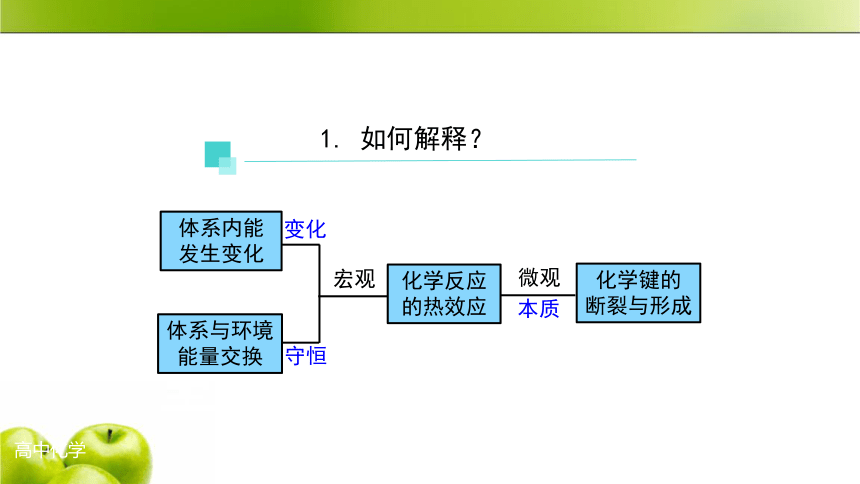
1. 如何解释?
化学反应
的热效应
体系内能
发生变化
体系与环境能量交换
化学键的
断裂与形成
宏观
微观
变化
守恒
本质
2. 如何表达?
思考2
已知:25 ℃和101 kPa时,
CH4(g)的燃烧热: ?H =-890.3 kJ/mol
1.写出表示甲烷燃烧的热化学方程式;
2.在右图中画出表示甲烷燃烧热的焓的
变化示意图。
焓( H )
2. 如何表达?
思考2
\
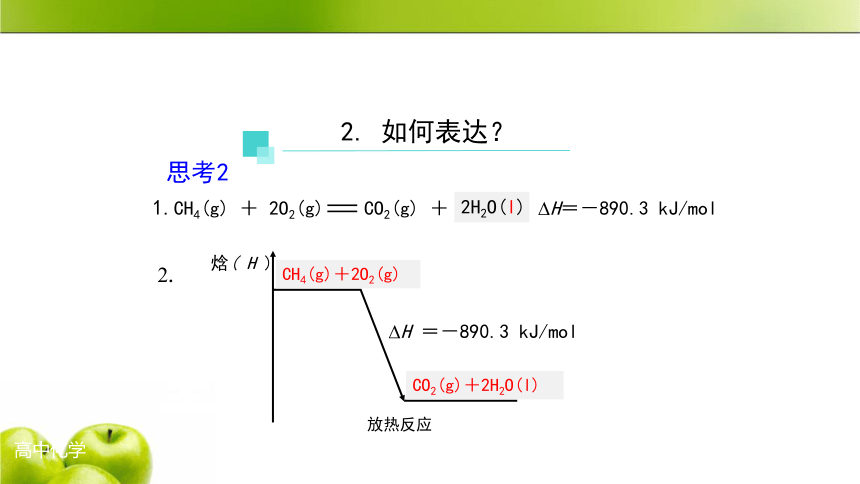
1.CH4(g) + 2O2(g) CO2(g) + 2H2O(g) ?H=-890.3 kJ/mol
2H2O(l)
2. 如何表达?
思考2
\
1.CH4(g) + 2O2(g) CO2(g) + 2H2O(g) ?H=-890.3 kJ/mol
2.
焓( H )
CH4 + O2
CO2 + 2H2O
?H =-890.3 kJ/mol
放热反应
CH4(g)+2O2(g)
CO2(g)+2H2O(l)
2H2O(l)
2. 如何表达?
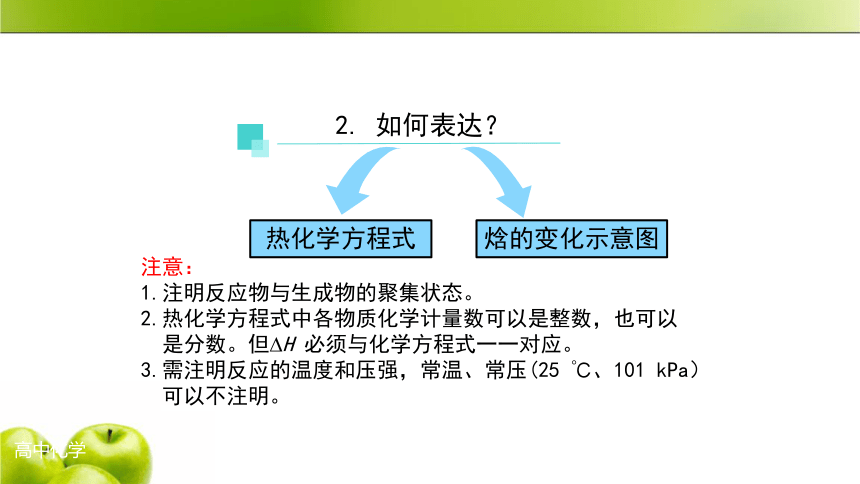
焓的变化示意图
热化学方程式
注意:
1.注明反应物与生成物的聚集状态。
2.热化学方程式中各物质化学计量数可以是整数,也可以
是分数。但?H 必须与化学方程式一一对应。
3.需注明反应的温度和压强,常温、常压(25 ℃、101 kPa)
可以不注明。
3. 如何计算?
多个反应间
(盖斯定律)
单个反应内
(键能数据)
思考3
CH4燃烧热的数据除了可以通过实验测得,在理论上可以通过哪些方法来求算呢?
思考3-1
3. 如何计算?
?H(估算)=∑E(反应物键能)?∑E(生成物键能)
答案: ?H =4a+2b-2c-4d
根据键能,请表示该反应的?H 与键能的关系。
{5C22544A-7EE6-4342-B048-85BDC9FD1C3A}共价键
C-H
O=O
C=O
H-O
键 能
a
b
c
d
这是CH4燃烧热的表达?
计算甲烷的燃烧热还需要哪些数据?
CH4(g) + 2O2(g) CO2(g) + 2H2O(g) ?H =?
CH4(g) + 2O2(g) CO2(g) + 2H2O(g)
?H =4a+2b-2c-4d
CH4(g) + 2O2(g) CO2(g) + 2H2O(l)
H2O (g) H2O(l) ?H =-44 kJ/mol
?H =4a+2b-2c-4d-88 kJ/mol
3. 如何计算?
3. 如何计算?
化学式
?H (kJ/mol)
C(s)
?393.5
H2(g)
?285.8
CO(g)
?283.0
CH4(g)
?890.3
燃烧热
(25 oC,101 kPa)
思考3-2
做饭时,锅底常会出现发黑的现象。写出1 mol CH4(g)不完全燃烧生成C(s)和H2O(l)的热化学方程式。
3. 如何计算?
尝试设计转化路径进行分析。
CH4(g)+ O2(g)
C(s)+ 2H2O(l)
?H =?
CO2(g)+ 2H2O(l)
?H1
?890.3 kJ/mol
?H2
?393.5 kJ/mol
2
+ O2(g)
?H1 = ?H + ?H2
?H = ?H1? ?H2=-496.8 kJ/mol
答案:CH4(g) + O2(g) C(s) + 2H2O(l) ?H=-496.8 kJ/mol
注意
1. ?H(估算)=∑E(反应物键能) ? ∑E(生成物键能)
2.利用盖斯定律求算反应的焓变, ?H 间的运算是代数运算。
3. 如何计算?
多个反应间
(盖斯定律)
单个反应内
(键能数据)
4.有何应用?
甲烷除燃烧供能外,在工业生产中也有重要的应用。
综合考虑
分析解决
实际问题
化学变化
物质变化
能量变化
4.有何应用?
思考4-1
我国海底蕴藏着大量的“可燃冰”。
(1)甲烷水蒸气催化重整是制高纯氢的方法之一。
已知反应器中存在如下三个反应,其中iii为积炭反应,为解决积炭问题,在利用?H1和?H2计算?H3时,还需要
利用 反应的?H。
i.CH4(g) + H2O(g) CO(g) + 3H2(g) ?H1
ii.CO(g) + H2O(g) CO2(g) + H2(g) ?H2
iii.CH4(g) C(s) + 2H2(g) ?H3
4.有何应用?
思考4-1 利用?H1和?H2计算?H3,还需要利用什么反应的?H ?
(1) i.CH4(g)+ H2O(g) CO(g)+ 3H2(g) ?H1
ii.CO(g)+ H2O(g) CO2(g)+ H2(g) ?H2
iii.CH4(g) C(s) + 2H2(g) ?H3
盖斯定律
盖斯定律
ⅳ. …… …… ?H4
4.有何应用?
思考4-1
(1)i.CH4(g) + H2O(g) CO(g) + 3H2(g) ?H1
ii.CO(g) + H2O(g) CO2(g) + H2(g) ?H2
iii.CH4(g) C(s) + 2H2(g) ?H3
①—iii 可得
i + ii 可得
甲同学
CH4(g) + 2H2O(g) CO2(g) + 4H2(g)
①
2
C(s) + 2H2O(g) CO2(g) + 2H2(g)
答案1:
4.有何应用?
设计转化路径
计算焓变
思考4-1
(1)i.CH4(g) + H2O(g) CO(g) + 3H2(g) ?H1
ii.CO(g) + H2O(g) CO2(g) + H2(g) ?H2
iii.CH4(g) C(s) + 2H2(g) ?H3
②—iii 可得
i — ii 可得
乙同学
CH4(g) + CO2 (g) 2CO (g) + 2H2(g)
②
2
CO2(g) + C(s) 2CO(g)
答案2:
思考4-2
4.有何应用?
(2)用甲烷先制水煤气(CO、H2),再合成甲醇(CH3OH)来代替日益供应紧张的燃油。制水煤气的原理除反应i外,还可用如下反应iv:
i.CH4(g) + H2O(g) CO(g) + 3H2(g) ?H1>0
iv.CH4(g)+ O2(g) CO(g) + 2H2(g) ?H4<0
对比分析反应i与反应iv,哪种方法更适宜合成甲醇?你的理由是什么?
1
2
思考4-2
4.有何应用?
i.CH4(g) + H2O(g) CO(g) + 3H2(g) ?H1>0
iv.CH4(g) + O2(g) CO(g) + 2H2(g) ?H4<0
CO + 2H2 CH3OH
1
2
思考4-2
4.有何应用?
反应iv更适宜。理由:
1.原料:反应iv的原子利用率更高;
2.能源:反应iv 是放热反应,有利于节约能源。
……
运用焓变
合理选择反应
i.CH4(g) + H2O(g) CO(g) + 3H2(g) ?H1>0
iv.CH4(g) + O2(g) CO(g) + 2H2(g) ?H4<0
CO + 2H2 CH3OH
1
2
运用焓变
合理选择反应
设计转化路径
计算焓变
本节课我们从生活到生产都在谈论着天然气话题,大家知道天然气是不可再生资源,那么我国天然气的储量如何?
4.有何应用?
脚踏实地 展望未来
我国天然气消费量的增长速度明显高于产量的增长速度。因此出现了天然气的供需严重失衡,导致我国天然气对外依存度逐年升高。
如何提高我国天然气产量来满足日益增长的消费量?
2017年5月18日,一则振奋人心的好消息传来,我国在南海神狐海域天然气水合物(又称“可燃冰”)试采成功。标志着我国可燃冰开采取得了历史性突破,这将对能源生产和消费革命产生深远影响。
脚踏实地 展望未来
目前发现的可燃冰储量大约是化石燃料综合的两倍,可燃冰释放能量高出石油等能源的十倍,被国际公认为石油、天然气的接替能源。
脚踏实地 展望未来
可燃冰是甲烷和水在高压、低温条件下混合而成的一种固态物质,其结构是水分子形成的笼状结晶包裹着甲烷分子。
我国南海海底蕴藏着大量的“可燃冰”,但在开发利用方面仍存在着很多实际问题有待解决。
化
学
反
应
的
热
效
应
1.如何解释?
2.如何表达?
3.如何计算?
4.有何应用?
热化学方程式
焓的变化示意图
键能数据
盖斯定律
设计路径算焓变
用焓变选择反应
宏观
微观
1.能解释化学反应中能量变化的本质。
2.能用热化学方程式表示化学反应中的能量变化,并进
行简单计算。
3.能综合考虑化学变化中的物质变化和能量变化来分析、
解决实际问题。
学习目标
化
学
反
应
的
热
效
应
1.如何解释?
2.如何表达?
3.如何计算?
4.有何应用?
思考1
生活中我们每天都在用着天然气(主要成分:CH4),利用天然气燃烧放出的热量供我们烧水、做饭等。那么,一个化学反应到底是吸热还是放热取决于哪些因素呢?
1. 如何解释?
1. 如何解释?
化学反应
的热效应
体系内能
发生变化
体系与环境能量交换
化学键的
断裂与形成
宏观
微观
变化
守恒
本质
2. 如何表达?
思考2
已知:25 ℃和101 kPa时,
CH4(g)的燃烧热: ?H =-890.3 kJ/mol
1.写出表示甲烷燃烧的热化学方程式;
2.在右图中画出表示甲烷燃烧热的焓的
变化示意图。
焓( H )
2. 如何表达?
思考2
\
1.CH4(g) + 2O2(g) CO2(g) + 2H2O(g) ?H=-890.3 kJ/mol
2H2O(l)
2. 如何表达?
思考2
\
1.CH4(g) + 2O2(g) CO2(g) + 2H2O(g) ?H=-890.3 kJ/mol
2.
焓( H )
CH4 + O2
CO2 + 2H2O
?H =-890.3 kJ/mol
放热反应
CH4(g)+2O2(g)
CO2(g)+2H2O(l)
2H2O(l)
2. 如何表达?
焓的变化示意图
热化学方程式
注意:
1.注明反应物与生成物的聚集状态。
2.热化学方程式中各物质化学计量数可以是整数,也可以
是分数。但?H 必须与化学方程式一一对应。
3.需注明反应的温度和压强,常温、常压(25 ℃、101 kPa)
可以不注明。
3. 如何计算?
多个反应间
(盖斯定律)
单个反应内
(键能数据)
思考3
CH4燃烧热的数据除了可以通过实验测得,在理论上可以通过哪些方法来求算呢?
思考3-1
3. 如何计算?
?H(估算)=∑E(反应物键能)?∑E(生成物键能)
答案: ?H =4a+2b-2c-4d
根据键能,请表示该反应的?H 与键能的关系。
{5C22544A-7EE6-4342-B048-85BDC9FD1C3A}共价键
C-H
O=O
C=O
H-O
键 能
a
b
c
d
这是CH4燃烧热的表达?
计算甲烷的燃烧热还需要哪些数据?
CH4(g) + 2O2(g) CO2(g) + 2H2O(g) ?H =?
CH4(g) + 2O2(g) CO2(g) + 2H2O(g)
?H =4a+2b-2c-4d
CH4(g) + 2O2(g) CO2(g) + 2H2O(l)
H2O (g) H2O(l) ?H =-44 kJ/mol
?H =4a+2b-2c-4d-88 kJ/mol
3. 如何计算?
3. 如何计算?
化学式
?H (kJ/mol)
C(s)
?393.5
H2(g)
?285.8
CO(g)
?283.0
CH4(g)
?890.3
燃烧热
(25 oC,101 kPa)
思考3-2
做饭时,锅底常会出现发黑的现象。写出1 mol CH4(g)不完全燃烧生成C(s)和H2O(l)的热化学方程式。
3. 如何计算?
尝试设计转化路径进行分析。
CH4(g)+ O2(g)
C(s)+ 2H2O(l)
?H =?
CO2(g)+ 2H2O(l)
?H1
?890.3 kJ/mol
?H2
?393.5 kJ/mol
2
+ O2(g)
?H1 = ?H + ?H2
?H = ?H1? ?H2=-496.8 kJ/mol
答案:CH4(g) + O2(g) C(s) + 2H2O(l) ?H=-496.8 kJ/mol
注意
1. ?H(估算)=∑E(反应物键能) ? ∑E(生成物键能)
2.利用盖斯定律求算反应的焓变, ?H 间的运算是代数运算。
3. 如何计算?
多个反应间
(盖斯定律)
单个反应内
(键能数据)
4.有何应用?
甲烷除燃烧供能外,在工业生产中也有重要的应用。
综合考虑
分析解决
实际问题
化学变化
物质变化
能量变化
4.有何应用?
思考4-1
我国海底蕴藏着大量的“可燃冰”。
(1)甲烷水蒸气催化重整是制高纯氢的方法之一。
已知反应器中存在如下三个反应,其中iii为积炭反应,为解决积炭问题,在利用?H1和?H2计算?H3时,还需要
利用 反应的?H。
i.CH4(g) + H2O(g) CO(g) + 3H2(g) ?H1
ii.CO(g) + H2O(g) CO2(g) + H2(g) ?H2
iii.CH4(g) C(s) + 2H2(g) ?H3
4.有何应用?
思考4-1 利用?H1和?H2计算?H3,还需要利用什么反应的?H ?
(1) i.CH4(g)+ H2O(g) CO(g)+ 3H2(g) ?H1
ii.CO(g)+ H2O(g) CO2(g)+ H2(g) ?H2
iii.CH4(g) C(s) + 2H2(g) ?H3
盖斯定律
盖斯定律
ⅳ. …… …… ?H4
4.有何应用?
思考4-1
(1)i.CH4(g) + H2O(g) CO(g) + 3H2(g) ?H1
ii.CO(g) + H2O(g) CO2(g) + H2(g) ?H2
iii.CH4(g) C(s) + 2H2(g) ?H3
①—iii 可得
i + ii 可得
甲同学
CH4(g) + 2H2O(g) CO2(g) + 4H2(g)
①
2
C(s) + 2H2O(g) CO2(g) + 2H2(g)
答案1:
4.有何应用?
设计转化路径
计算焓变
思考4-1
(1)i.CH4(g) + H2O(g) CO(g) + 3H2(g) ?H1
ii.CO(g) + H2O(g) CO2(g) + H2(g) ?H2
iii.CH4(g) C(s) + 2H2(g) ?H3
②—iii 可得
i — ii 可得
乙同学
CH4(g) + CO2 (g) 2CO (g) + 2H2(g)
②
2
CO2(g) + C(s) 2CO(g)
答案2:
思考4-2
4.有何应用?
(2)用甲烷先制水煤气(CO、H2),再合成甲醇(CH3OH)来代替日益供应紧张的燃油。制水煤气的原理除反应i外,还可用如下反应iv:
i.CH4(g) + H2O(g) CO(g) + 3H2(g) ?H1>0
iv.CH4(g)+ O2(g) CO(g) + 2H2(g) ?H4<0
对比分析反应i与反应iv,哪种方法更适宜合成甲醇?你的理由是什么?
1
2
思考4-2
4.有何应用?
i.CH4(g) + H2O(g) CO(g) + 3H2(g) ?H1>0
iv.CH4(g) + O2(g) CO(g) + 2H2(g) ?H4<0
CO + 2H2 CH3OH
1
2
思考4-2
4.有何应用?
反应iv更适宜。理由:
1.原料:反应iv的原子利用率更高;
2.能源:反应iv 是放热反应,有利于节约能源。
……
运用焓变
合理选择反应
i.CH4(g) + H2O(g) CO(g) + 3H2(g) ?H1>0
iv.CH4(g) + O2(g) CO(g) + 2H2(g) ?H4<0
CO + 2H2 CH3OH
1
2
运用焓变
合理选择反应
设计转化路径
计算焓变
本节课我们从生活到生产都在谈论着天然气话题,大家知道天然气是不可再生资源,那么我国天然气的储量如何?
4.有何应用?
脚踏实地 展望未来
我国天然气消费量的增长速度明显高于产量的增长速度。因此出现了天然气的供需严重失衡,导致我国天然气对外依存度逐年升高。
如何提高我国天然气产量来满足日益增长的消费量?
2017年5月18日,一则振奋人心的好消息传来,我国在南海神狐海域天然气水合物(又称“可燃冰”)试采成功。标志着我国可燃冰开采取得了历史性突破,这将对能源生产和消费革命产生深远影响。
脚踏实地 展望未来
目前发现的可燃冰储量大约是化石燃料综合的两倍,可燃冰释放能量高出石油等能源的十倍,被国际公认为石油、天然气的接替能源。
脚踏实地 展望未来
可燃冰是甲烷和水在高压、低温条件下混合而成的一种固态物质,其结构是水分子形成的笼状结晶包裹着甲烷分子。
我国南海海底蕴藏着大量的“可燃冰”,但在开发利用方面仍存在着很多实际问题有待解决。
化
学
反
应
的
热
效
应
1.如何解释?
2.如何表达?
3.如何计算?
4.有何应用?
热化学方程式
焓的变化示意图
键能数据
盖斯定律
设计路径算焓变
用焓变选择反应
宏观
微观
