4.3 金属的腐蚀与防护 课件(41张ppt)+内嵌视频
文档属性
| 名称 | 4.3 金属的腐蚀与防护 课件(41张ppt)+内嵌视频 |  | |
| 格式 | pptx | ||
| 文件大小 | 6.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-11-20 16:16:22 | ||
图片预览








文档简介
金属的腐蚀与防护
金属腐蚀带来的问题
我国每年因为金属腐蚀所造成的经济损失约占国民生产总值的5%,全世界每年因生锈损失的钢铁约占世界钢铁年产量的1/4,超过每年各项大灾(火灾、风灾及地震等)损失的总和。
什么是金属的腐蚀?
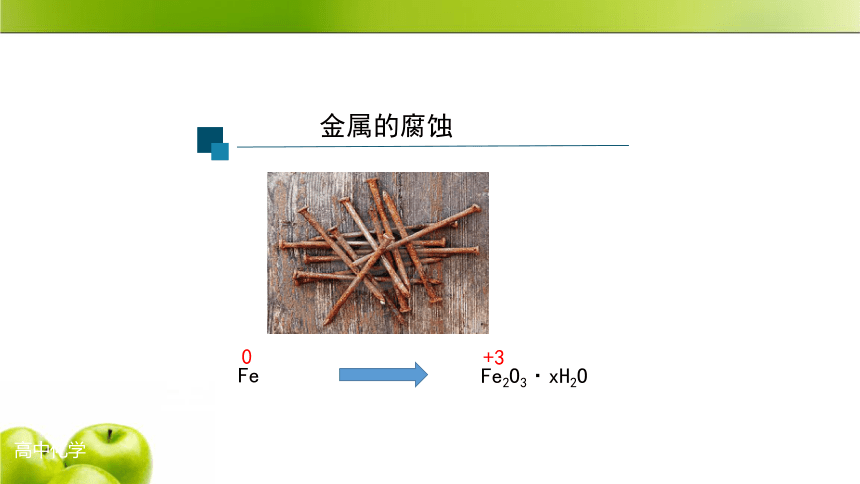
金属的腐蚀
Fe
Fe2O3·xH2O
0
+3
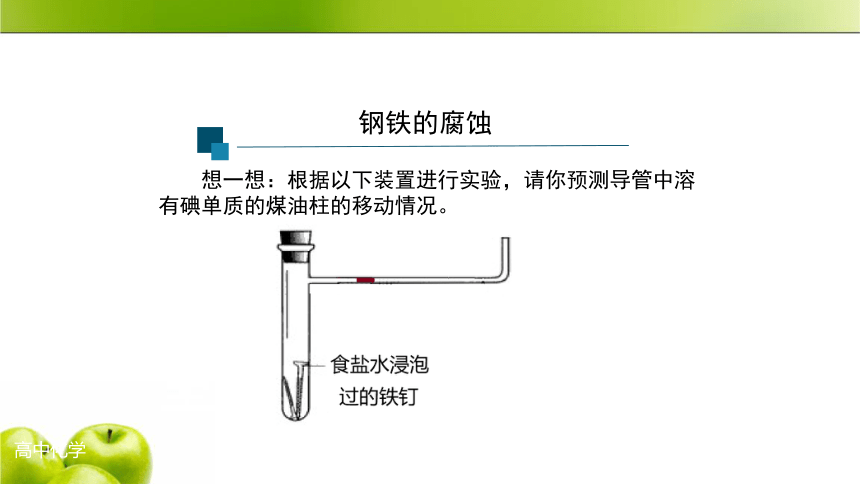
钢铁的腐蚀
想一想:根据以下装置进行实验,请你预测导管中溶有碘单质的煤油柱的移动情况。
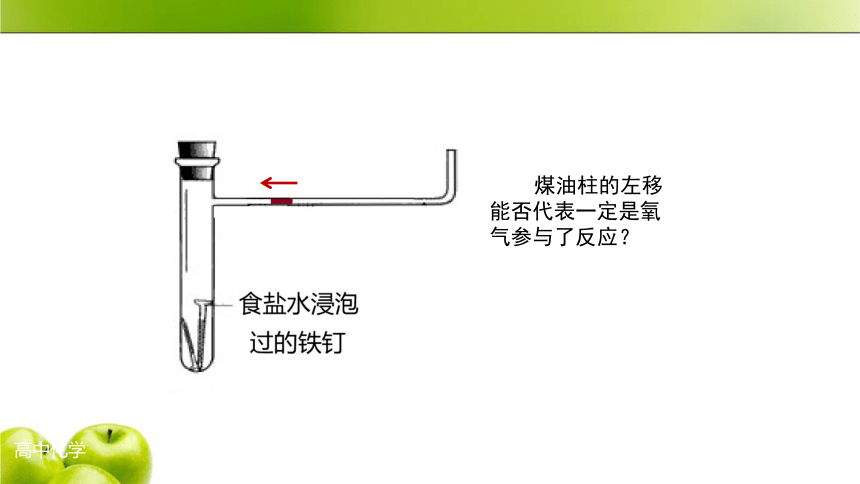
什么原因导致
煤油柱的左移?
煤油柱的左移
能否代表一定是氧气参与了反应?
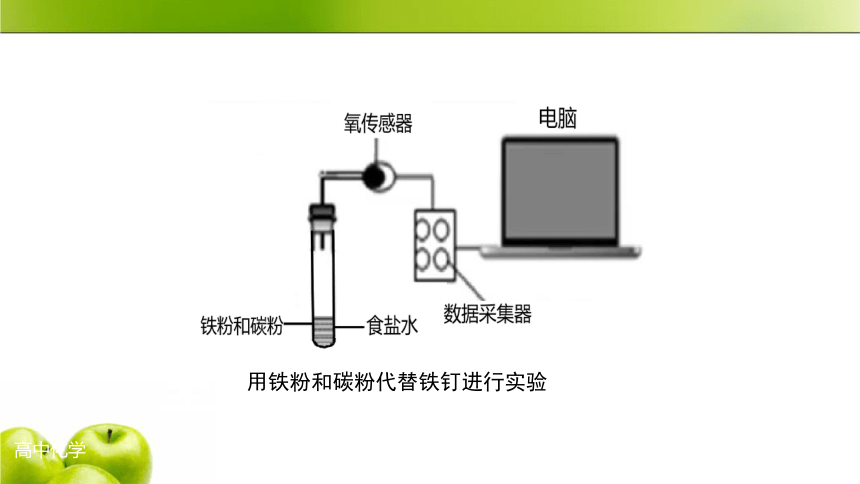
用铁粉和碳粉代替铁钉进行实验
试管中氧气浓度随时间变化图像
一段时间后,试管内壁出现铁锈。
1.钢铁的成分
铁碳合金
2.钢铁生锈时所处的环境
潮湿的空气
任务一 研究钢铁是如何生锈的
3.借助原电池原理分析钢铁是如何生锈的
如何证明有电
化学反应发生?
灵敏电流计指针偏转
3.借助原电池原理分析钢铁是如何生锈的
负极(Fe): Fe ? 2e? Fe2+
负极产物该如何检验?
资料:Fe2+可以与K3[Fe(CN)6]溶液产生
特征蓝色沉淀。
取铁电极周围的溶液于试管中,加入K3[Fe(CN)6]溶
液,发现产生特征蓝色沉淀,证明负极有Fe2+生成。
正极反应式应该如何书写?
资料:电池工作一段时间后,取正极周围的溶液于试管中,加入酚酞溶液后变红。
正极(C): O2 + 4e? + 2H2O 4OH?
3.借助原电池原理分析钢铁是如何生锈的
正极:C : O2 + 4e? + 2H2O 4OH?
总反应:2Fe + O2 + 2H2O 2Fe(OH)2
后续反应:4Fe(OH)2 + O2 + 2H2O 4Fe(OH)3
Fe2O3·xH2O
3.借助原电池原理分析钢铁是如何生锈的
负极:Fe: Fe ? 2e? Fe2+
(吸氧腐蚀)
4.如果水膜酸性较强,会发生怎样的腐蚀呢?请你根据图示用电极反应来表达。
- +
正极(C) : 2H+ + 2e? H2↑
负极(Fe): Fe ? 2e? Fe2+
如果水膜酸性较弱时,会发生什么样的腐蚀?
(析氢腐蚀)
4.如果水膜酸性较强,会发生怎样的腐蚀呢?请你根据图示用电极反应来表达。
正极(C) : 2H+ + 2e? H2↑
负极(Fe): Fe ? 2e? Fe2+
写出pH=2.0~3.5和4.0时发生的主要正极反应。
不同pH下,试管中气体压强随时间变化情况
2H+ + 2e? H2↑
想一想:为什么钢铁吸附的水膜呈现不同性质的时候,正极的电极反应不同?
pH=2.0、3.0、3.5
pH=4.0
O2 + 4e? + 4H+ 2H2O
(析氢腐蚀)
(吸氧腐蚀)
水膜酸性较强,
c(H+)较大
氧化性
H+>O2
析氢腐蚀
2H+ + 2e- H2↑
水膜酸性较弱或呈中性,c(H+)较小
氧化性
H+<O2
吸氧腐蚀
O2 + 4e- + 2H2O 4OH-
或O2 + 4e- + 4H+ 2H2O
浓度
性质
反应
影响
决定
金属的腐蚀
铜板上的铁铆钉生锈
输送原油的钢管在无水、
无氧的情况下被腐蚀而漏油
想一想:两种腐蚀的共性是什么?区别是什么?
金属的腐蚀
直接发生化学反应引起金属腐蚀——化学腐蚀
金属的腐蚀
腐蚀过程中有电化学反应发生——电化学腐蚀
金属腐蚀过程中,两种腐蚀往往同时发生,但绝大多数属于电化学腐蚀,电化学腐蚀比化学腐蚀的速率也大得多。
+
+
-
化学腐蚀与电化学腐蚀的比较
{5940675A-B579-460E-94D1-54222C63F5DA}
化学腐蚀
电化学腐蚀
条件
特征
速率
结果
金属与氧化性物质
直接接触
不纯金属与电解质溶液
及氧化剂接触
无电流产生
有微弱电流产生
金属被氧化
相对活泼的金属被氧化
小
大
金属的腐蚀
金属腐蚀:金属或合金与周围的气体或液体发生氧化
还原反应而引起损耗的现象。
实质:M - n e? Mn+
根据金属腐蚀的实质,你能提出金属的防护方法吗?
思考角度
切断原电池反应
给予金属电子
改变金属材料组成
在金属表面覆盖保护层
喷漆
镀铬
搪瓷
发蓝处理
制成不锈钢(改变金属材料组成)
(在金属表面覆盖保护层)
切断原电池反应
按照下列装置进行实验,画出你预测的现象
任务二 利用电化学原理保护铁
资料:Fe2+可以与K3[Fe(CN)6]溶液产生特征蓝色沉淀。
实验现象1
思考:如何证明铁被保护?什么现象证明是原电池保护?
铁钉的裸露部分周围溶液没有特征蓝色物质生成。铁钉周围变红,说明氧气在铁的表面得电子,生成
了氢氧根离子,铁做正极,证明了原电池保护。
思考:生成蓝色物质说明了什么?
铁钉的裸露部分周围有亚铁离子生成,氧气在铜
丝的表面得到电子,生成氢氧根离子,铜丝附近变红。
铁没有得到保护。
实验现象2
想一想:通过以上实验,你能得出什么结论?
铁与活动性不同的金属接触时,其腐蚀程度是有差异
的,要避免铁受到腐蚀,需要与较活泼的金属相连。
1.利用原电池原理来保护铁
A
NaCl溶液
— Fe
Zn—
+
e-
-
牺牲阳极法
想一想:为什么钢制管道的内部要镶嵌镁块?
NaCl溶液
— Fe
Mg—
e-
2.利用电解池原理来保护铁
NaCl溶液
— Fe
C —
e-
阴极
辅助阳极
外加电流法
电源的哪个电极是提供电子的电极呢?
试一试:设计装置,采用外加电流法为长期浸泡在海水
中的钢闸门进行保护,画出装置图,并解释你的装置是如何
对钢闸门进行保护的。
- +
e? e?
{5940675A-B579-460E-94D1-54222C63F5DA}
牺牲阳极法
外加电流法
原理
保护方法
保护电流
注意事项
牺牲阳极法和外加电流法的比较
原电池
电解池
使被保护的金属与比
它活泼的金属接触,被保
护的金属做正极。
使被保护的金属与电源
负极接触,被保护的金属做
阴极。
较小
较大
负极(阳极)材料需要
定期更换
辅助阳极需要定期检查
任务三 船舶与海水接触部分的钢制船体长期受到强烈的腐
蚀,请你为船舶的防腐蚀提出合理化建议。
思考要点:
1.小型船舶和大型船舶防护方法的选择(牺牲阳极?
外加电流?)
2.船底漆的选择(普通底漆?富锌底漆?)
3.水下金属连接件的选择(同种金属?不同种金属?)
思考要点:
1.小型船舶和大型船舶防护方法的选择
小型船舶—船体小—航行距离短—时间短—牺牲阳极法
大型船舶—船体大—航行距离长—时间长—外加电流法
任务三 船舶与海水接触部分的钢制船体长期受到强烈的腐
蚀,请你为船舶的防腐提出合理化建议。
船底漆—富锌底漆—牺牲阳极法
任务三 船舶与海水接触部分的钢制船体长期受到强烈的腐
蚀,请你为船舶的防腐提出合理化建议。
思考要点:
2.船底漆的选择(普通底漆?富锌底漆?)
任务三 船舶与海水接触部分的钢制船体长期受到强烈的腐
蚀,请你为船舶的防腐提出合理化建议
水下金属连接件—同种金属—避免形成原电池加速腐蚀
思考要点:
3.水下金属连接件的选择(同种金属?不同种金属?)
试一试:如何防止铁锅生锈?
1.使用完毕后保持干燥或涂一层植物油
2.使用完毕后悬挂或倒扣
3.可以使用不锈钢锅
总结
金属的腐蚀
化学腐蚀
电化学腐蚀
吸氧腐蚀(水膜呈中性或酸性较弱)
析氢腐蚀(水膜呈酸性)
金属的防护
改变金属材料的组成
在金属表面覆盖保护层
电化学保护法
牺牲阳极法(利用原电池原理)
外加电流法(利用电解池原理)
金属腐蚀带来的问题
我国每年因为金属腐蚀所造成的经济损失约占国民生产总值的5%,全世界每年因生锈损失的钢铁约占世界钢铁年产量的1/4,超过每年各项大灾(火灾、风灾及地震等)损失的总和。
什么是金属的腐蚀?
金属的腐蚀
Fe
Fe2O3·xH2O
0
+3
钢铁的腐蚀
想一想:根据以下装置进行实验,请你预测导管中溶有碘单质的煤油柱的移动情况。
什么原因导致
煤油柱的左移?
煤油柱的左移
能否代表一定是氧气参与了反应?
用铁粉和碳粉代替铁钉进行实验
试管中氧气浓度随时间变化图像
一段时间后,试管内壁出现铁锈。
1.钢铁的成分
铁碳合金
2.钢铁生锈时所处的环境
潮湿的空气
任务一 研究钢铁是如何生锈的
3.借助原电池原理分析钢铁是如何生锈的
如何证明有电
化学反应发生?
灵敏电流计指针偏转
3.借助原电池原理分析钢铁是如何生锈的
负极(Fe): Fe ? 2e? Fe2+
负极产物该如何检验?
资料:Fe2+可以与K3[Fe(CN)6]溶液产生
特征蓝色沉淀。
取铁电极周围的溶液于试管中,加入K3[Fe(CN)6]溶
液,发现产生特征蓝色沉淀,证明负极有Fe2+生成。
正极反应式应该如何书写?
资料:电池工作一段时间后,取正极周围的溶液于试管中,加入酚酞溶液后变红。
正极(C): O2 + 4e? + 2H2O 4OH?
3.借助原电池原理分析钢铁是如何生锈的
正极:C : O2 + 4e? + 2H2O 4OH?
总反应:2Fe + O2 + 2H2O 2Fe(OH)2
后续反应:4Fe(OH)2 + O2 + 2H2O 4Fe(OH)3
Fe2O3·xH2O
3.借助原电池原理分析钢铁是如何生锈的
负极:Fe: Fe ? 2e? Fe2+
(吸氧腐蚀)
4.如果水膜酸性较强,会发生怎样的腐蚀呢?请你根据图示用电极反应来表达。
- +
正极(C) : 2H+ + 2e? H2↑
负极(Fe): Fe ? 2e? Fe2+
如果水膜酸性较弱时,会发生什么样的腐蚀?
(析氢腐蚀)
4.如果水膜酸性较强,会发生怎样的腐蚀呢?请你根据图示用电极反应来表达。
正极(C) : 2H+ + 2e? H2↑
负极(Fe): Fe ? 2e? Fe2+
写出pH=2.0~3.5和4.0时发生的主要正极反应。
不同pH下,试管中气体压强随时间变化情况
2H+ + 2e? H2↑
想一想:为什么钢铁吸附的水膜呈现不同性质的时候,正极的电极反应不同?
pH=2.0、3.0、3.5
pH=4.0
O2 + 4e? + 4H+ 2H2O
(析氢腐蚀)
(吸氧腐蚀)
水膜酸性较强,
c(H+)较大
氧化性
H+>O2
析氢腐蚀
2H+ + 2e- H2↑
水膜酸性较弱或呈中性,c(H+)较小
氧化性
H+<O2
吸氧腐蚀
O2 + 4e- + 2H2O 4OH-
或O2 + 4e- + 4H+ 2H2O
浓度
性质
反应
影响
决定
金属的腐蚀
铜板上的铁铆钉生锈
输送原油的钢管在无水、
无氧的情况下被腐蚀而漏油
想一想:两种腐蚀的共性是什么?区别是什么?
金属的腐蚀
直接发生化学反应引起金属腐蚀——化学腐蚀
金属的腐蚀
腐蚀过程中有电化学反应发生——电化学腐蚀
金属腐蚀过程中,两种腐蚀往往同时发生,但绝大多数属于电化学腐蚀,电化学腐蚀比化学腐蚀的速率也大得多。
+
+
-
化学腐蚀与电化学腐蚀的比较
{5940675A-B579-460E-94D1-54222C63F5DA}
化学腐蚀
电化学腐蚀
条件
特征
速率
结果
金属与氧化性物质
直接接触
不纯金属与电解质溶液
及氧化剂接触
无电流产生
有微弱电流产生
金属被氧化
相对活泼的金属被氧化
小
大
金属的腐蚀
金属腐蚀:金属或合金与周围的气体或液体发生氧化
还原反应而引起损耗的现象。
实质:M - n e? Mn+
根据金属腐蚀的实质,你能提出金属的防护方法吗?
思考角度
切断原电池反应
给予金属电子
改变金属材料组成
在金属表面覆盖保护层
喷漆
镀铬
搪瓷
发蓝处理
制成不锈钢(改变金属材料组成)
(在金属表面覆盖保护层)
切断原电池反应
按照下列装置进行实验,画出你预测的现象
任务二 利用电化学原理保护铁
资料:Fe2+可以与K3[Fe(CN)6]溶液产生特征蓝色沉淀。
实验现象1
思考:如何证明铁被保护?什么现象证明是原电池保护?
铁钉的裸露部分周围溶液没有特征蓝色物质生成。铁钉周围变红,说明氧气在铁的表面得电子,生成
了氢氧根离子,铁做正极,证明了原电池保护。
思考:生成蓝色物质说明了什么?
铁钉的裸露部分周围有亚铁离子生成,氧气在铜
丝的表面得到电子,生成氢氧根离子,铜丝附近变红。
铁没有得到保护。
实验现象2
想一想:通过以上实验,你能得出什么结论?
铁与活动性不同的金属接触时,其腐蚀程度是有差异
的,要避免铁受到腐蚀,需要与较活泼的金属相连。
1.利用原电池原理来保护铁
A
NaCl溶液
— Fe
Zn—
+
e-
-
牺牲阳极法
想一想:为什么钢制管道的内部要镶嵌镁块?
NaCl溶液
— Fe
Mg—
e-
2.利用电解池原理来保护铁
NaCl溶液
— Fe
C —
e-
阴极
辅助阳极
外加电流法
电源的哪个电极是提供电子的电极呢?
试一试:设计装置,采用外加电流法为长期浸泡在海水
中的钢闸门进行保护,画出装置图,并解释你的装置是如何
对钢闸门进行保护的。
- +
e? e?
{5940675A-B579-460E-94D1-54222C63F5DA}
牺牲阳极法
外加电流法
原理
保护方法
保护电流
注意事项
牺牲阳极法和外加电流法的比较
原电池
电解池
使被保护的金属与比
它活泼的金属接触,被保
护的金属做正极。
使被保护的金属与电源
负极接触,被保护的金属做
阴极。
较小
较大
负极(阳极)材料需要
定期更换
辅助阳极需要定期检查
任务三 船舶与海水接触部分的钢制船体长期受到强烈的腐
蚀,请你为船舶的防腐蚀提出合理化建议。
思考要点:
1.小型船舶和大型船舶防护方法的选择(牺牲阳极?
外加电流?)
2.船底漆的选择(普通底漆?富锌底漆?)
3.水下金属连接件的选择(同种金属?不同种金属?)
思考要点:
1.小型船舶和大型船舶防护方法的选择
小型船舶—船体小—航行距离短—时间短—牺牲阳极法
大型船舶—船体大—航行距离长—时间长—外加电流法
任务三 船舶与海水接触部分的钢制船体长期受到强烈的腐
蚀,请你为船舶的防腐提出合理化建议。
船底漆—富锌底漆—牺牲阳极法
任务三 船舶与海水接触部分的钢制船体长期受到强烈的腐
蚀,请你为船舶的防腐提出合理化建议。
思考要点:
2.船底漆的选择(普通底漆?富锌底漆?)
任务三 船舶与海水接触部分的钢制船体长期受到强烈的腐
蚀,请你为船舶的防腐提出合理化建议
水下金属连接件—同种金属—避免形成原电池加速腐蚀
思考要点:
3.水下金属连接件的选择(同种金属?不同种金属?)
试一试:如何防止铁锅生锈?
1.使用完毕后保持干燥或涂一层植物油
2.使用完毕后悬挂或倒扣
3.可以使用不锈钢锅
总结
金属的腐蚀
化学腐蚀
电化学腐蚀
吸氧腐蚀(水膜呈中性或酸性较弱)
析氢腐蚀(水膜呈酸性)
金属的防护
改变金属材料的组成
在金属表面覆盖保护层
电化学保护法
牺牲阳极法(利用原电池原理)
外加电流法(利用电解池原理)
