河北省尚义县第一中学2020-2021学年高二第一学期期中考试化学试卷 含答案
文档属性
| 名称 | 河北省尚义县第一中学2020-2021学年高二第一学期期中考试化学试卷 含答案 |  | |
| 格式 | doc | ||
| 文件大小 | 207.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-11-21 17:21:14 | ||
图片预览


文档简介
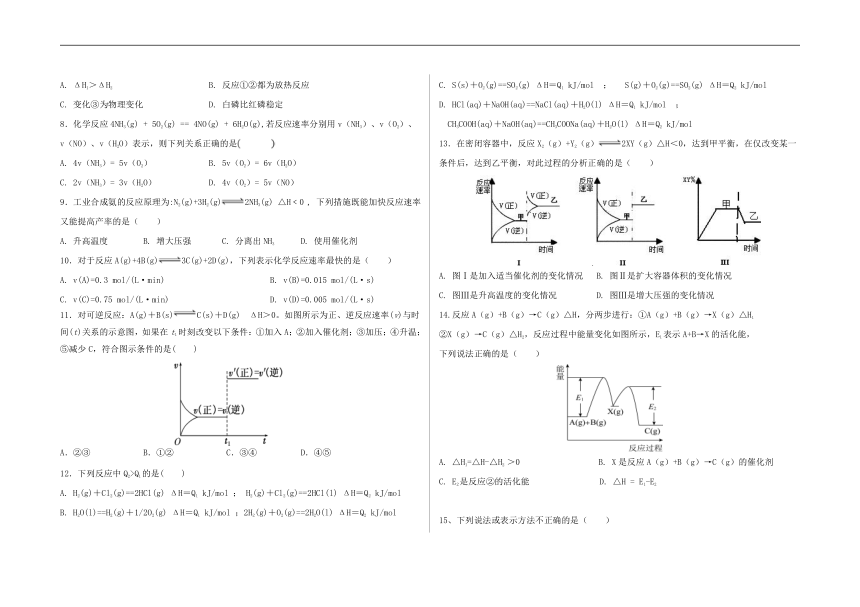
尚义一中2020~2021学年第一学期高二年级期中考试试卷
化 学
本试卷分第I卷(选择题)和第II卷(非选择题)两部分,全卷满分100 分,考试时间90 分钟。
注意事项:
1.答卷前,考生务必用0.5mm黑色签字笔在答题卡相应栏内填写自己的班级、姓名、考场、准考证号,并用2B铅笔将考试科目、准考证号涂写在答题卡上。
2.II卷内容须用0.5mm黑色签字笔写在答题卡相应空格或区域内。
3.考试结束,将答题卡交回。
可能用到的相对分子质量:H-1,C-12,N-14,O-16,Na-23,Mg-24,Al-27,S-32,Fe-56,Cu-64
第I卷(选择题,共44分)
一.选择题(本大题共10小题,每题2分,共20分。每题只有一个正确答案。)
1.下列说法不正确的是( )
A. 增大压强,活化分子百分数不变,化学反应速率增大
B. 升高温度,活化分子百分数增大,化学反应速率增大
C. 加入反应物,活化分子百分数增大,化学反应速率增大
D. 使用催化剂,活化分子百分数增大,化学反应速率增大
2.下列说法正确的是( )
A. 需要加热才能进行的反应一定是吸热反应
B. 等质量的硫蒸气和硫固体分别完全燃烧,后者放出热量更多
C. 同温同压下,H2(g)+ Cl2(g)==2HCl(g)在光照和点燃条件下的ΔH相同
D. 与同浓度的NaOH溶液反应时,稀硫酸中和热的绝对值是盐酸的两倍
3.密闭容器内进行反应X(g)+Y(s)== 2Z(g),下列条件不能改变化学反应速率的是( )
A. 升高温度 B. 加入催化剂 C. 扩大容器体积 D. 再加入一定量的Y
4.反应C(s)+H2O(g) CO(g)+H2(g)在一可变容积的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是( )
①增加C的量; ②将容器体积缩小一半;③保持体积不变,充入N2使体系压强增大;?????
④保持压强不变,充入N2使容器体积变大。
A. ①④ B. ②③ C. ①③ D. ②④
5.已知:①N2(g)+2O2(g)==2NO2(g) ΔH=+67.7 kJ·mol-1,②N2H4(g)+O2(g)==N2(g)+2H2O(g)
ΔH=-534 kJ·mol-1。下列关于肼和NO2反应的热化学方程式中正确的是( )
A. 2N2H4(g)+2NO2(g)==3N2(g)+4H2O(l) ΔH=-1135.7 kJ·mol-1
B. 2N2H4(g)+2NO2(g)==3N2(g)+4H2O(g) ΔH=-1000.3 kJ·mol-1
C. N2H4(g)+NO2(g)==N2(g)+2H2O(l) ΔH=-1135.7 kJ·mol-1
D. 2N2H4(g)+2NO2(g)==3N2(g)+4H2O(g) ΔH=-1135.7 kJ·mol-1
6.某实验小组以H2O2分解为例,研究浓度、催化剂对反应速率的影响。在常温下按照如下方案完成实验。实验②的反应物应为( )
实验编号 反应物 催化剂
① 10mL 2%H2O2溶液 无
②
无
③ 10mL 5%H2O2溶液 MnO2 固体
A.5mL 2% H2O2溶液 B. 10mL 5% H2O2溶液 C. 10mL 2% H2O2溶液 D. 5mL 10% H2O2溶液
7.白磷和红磷互为同素异形体,它们都可以在氧气中燃烧,已知
①P4(白磷s)+5O2(g)==2P2O5(s) ?ΔH1 ;?②4P(红磷s)+5O2(g)==2P2O5(s) ?ΔH2 ;
③P4(白磷s)==4P(红磷s) ?ΔH3 =-29.2 kJ·mol?1
下列有关说法正确的是( )
A. ΔH1>ΔH2 B. 反应①②都为放热反应
C. 变化③为物理变化 D. 白磷比红磷稳定
8.化学反应4NH3(g) + 5O2(g) == 4NO(g) + 6H2O(g),若反应速率分别用v(NH3)、v(O2)、
v(NO)、v(H2O)表示,则下列关系正确的是? ??
A. 4v(NH3)= 5v(O2) B. 5v(O2)= 6v(H2O)
C. 2v(NH3)= 3v(H2O) D. 4v(O2)= 5v(NO)
9.工业合成氨的反应原理为:N2(g)+3H2(g)2NH3(g) △H﹤0 , 下列措施既能加快反应速率又能提高产率的是( )
A. 升高温度 B. 增大压强 C. 分离出NH3 D. 使用催化剂
10.对于反应A(g)+4B(g)3C(g)+2D(g),下列表示化学反应速率最快的是(? )
A. v(A)=0.3 mol/(L·min) B. v(B)=0.015 mol/(L·s)
C. v(C)=0.75 mol/(L·min) D. v(D)=0.005 mol/(L·s)
11.对可逆反应:A(g)+B(s)C(s)+D(g) ΔH>0。如图所示为正、逆反应速率(v)与时间(t)关系的示意图,如果在t1时刻改变以下条件:①加入A;②加入催化剂;③加压;④升温;⑤减少C,符合图示条件的是( )
A.②③ B.①② C.③④ D.④⑤
12.下列反应中Q2>Q1的是( )
A. H2(g)+Cl2(g)==2HCl(g) ΔH=Q1 kJ/mol ; H2(g)+Cl2(g)==2HCl(l) ΔH=Q2 kJ/mol
B. H2O(l)==H2(g)+1/2O2(g) ΔH=Q1 kJ/mol ;2H2(g)+O2(g)==2H2O(l) ΔH=Q2 kJ/mol
C. S(s)+O2(g)==SO2(g) ΔH=Q1 kJ/mol ; S(g)+O2(g)==SO2(g) ΔH=Q2 kJ/mol
D. HCl(aq)+NaOH(aq)==NaCl(aq)+H2O(l) ΔH=Q1 kJ/mol ;
?CH3COOH(aq)+NaOH(aq)==CH3COONa(aq)+H2O(l) ΔH=Q2 kJ/mol
13.在密闭容器中,反应X2(g)+Y2(g)2XY(g)△H<0,达到甲平衡,在仅改变某一条件后,达到乙平衡,对此过程的分析正确的是( )
A. 图Ⅰ是加入适当催化剂的变化情况 B. 图Ⅱ是扩大容器体积的变化情况
C. 图Ⅲ是升高温度的变化情况 D. 图Ⅲ是增大压强的变化情况
14.反应A(g)+B(g)→C(g)△H,分两步进行:①A(g)+B(g)→X(g)△H1?
②X(g)→C(g)△H2,反应过程中能量变化如图所示,E1表示A+B→X的活化能,
下列说法正确的是( )
A. △H1=△H-△H2 >0 B. X是反应A(g)+B(g)→C(g)的催化剂
C. E2是反应②的活化能 D. △H = E1-E2
15、下列说法或表示方法不正确的是( )
A. 盖斯定律实质上是能量守恒定律的体现
B. 在稀溶液中:H+(aq)+OH-(aq)=H2O(l);△H=-57.3kJ/mol,若将含0.5mol?H2SO4的浓硫酸与含1molNaOH的溶液混合,放出的热量大于57.3kJ
C. 由C(石墨)→C(金刚石);△H=+73?kJ/mol,可知石墨比金刚石稳定
D. 在101kPa时,2gH2完全燃烧生成液态水,放出285.8kJ热量,氢气燃烧的热化学方程式表示为:2H2(g)+O2(g)=2H2O(l);△H=-285.8kJ/mol
16.对于可逆反应:2A(g)+B(g)2C(g)△H<0,下列各图中正确的是( )
A. B.
C. D.
17.在一定条件下,将A2和B2两种气体通入1L密闭容器中,反应按下式进行:
xA2(g)+yB2(g2C(g),2S后测得反应速率如下V(A2)= 0.4mol/(L?s),
V(B2)=1.2mol/(L?s),V(C)=0.8mol/(L?s)则该x和y的值分别为( )
A. 2和3 B. 3和2 C. 3和1 D. 1和3
温度为T时,向2V L的密闭容器中充入一定量的A和B,发生反应:
A(g)+B(g)C(s)+xD(g);△H>0,容器中A、B、D的物质的量浓度随时间的变化如图所示,下列说法正确的是( )
A. 反应在前10min的平均反应速率v(D)= 0.15mol?L-1?min-1
B. 该反应的平衡常数表达式K=
C. 若平衡时保持温度不变,压缩容器体积平衡向逆反应方向移动
D. 反应至15min时,改变的条件是降低温度
第Ⅱ卷(非选择题,共46分)
二.填空题(本题共 4个小题,共计46分,每小题做出答案后,请写在答题卡上。)
19.(每空2分,共10分)在一定条件下,aA+bBcC的可逆反应达到平衡:
(1)若A、B、C都是气体,缩小容器体积,则反应速率______________(填“增大”或“减小”或“不变”)。
(2)若A、B、C都是气体,减小压强,平衡向逆反应方向移动,则a+b__________c(填“>”或“=”或“<”)。
(3)若A为固体、B为无色气体、C为有色气体,再加入适量的A物质,则平衡__________移动(填“向左”或“向右”或“不”),气体的颜色_________(填“加深”或“变浅”或“不变”)。
(4)若加热后C的质量分数减少,则正反应是__________反应(填“放热”或“吸热”)。
(每空2分,共10分)在化学反应中,人们把能够发生有效碰撞的分子叫做活化分子,同时把活化分子多出的那部分能量称作活化能,单位:kJ·mol-1。请根据下图回答问题:
(1) 图中所示反应是____(填“吸热”或“放热”)反应,该反应的ΔH=____kJ·mol-1 (用含E1、E2的代数式表示)。
(2) 对于同一反应,上图虚线(Ⅱ)与实线(Ⅰ)相比,活化分子最低能量明显降低,反应速率加快,你认为最有可能的原因是____。
(3) 下列4个反应中符合示意图描述的反应的是____(填代号)。
A.氧化钙与水反应
B.A(g)+2B(g)C(g) 反应中C的能量高于A的能量
C.铝粉与铁红反应
D.灼热的碳与CO2反应? ?
(4) 已知热化学方程式:A(g)+2B(g)=C(g) ΔH=+a kJ·mol-1。该反应的活化能为 b kJ·mol-1,则其逆反应的活化能为____kJ·mol-1。
21、(每空3分,共12分)依据事实,写出下列反应的热化学方程式。
(1)在25℃、101 kPa下,1 g甲醇燃烧生成CO2和液态水时放热22.68 kJ。则表示甲醇燃烧热的热化学方程式为________________________________。
(2)若适量的N2和O2完全反应,每生成23 g NO2需要吸收16.95 kJ热量,则表示该反应的热化学方程式为________________________________。
(3)用NA表示阿伏加德罗常数,在C2H2(气态)完全燃烧生成CO2和液态水的反应中,每有5NA个电子转移时,放出650 kJ的热量, 则表示该反应的热化学方程式为________________________________ 。
(4)H2、CO、CH3OH都是重要的能源物质,它们的燃烧热依次为285.8 kJ·mol-1、282.5 kJ·mol-1、726.7 kJ·mol-1。已知CO和H2在一定条件下可以合成甲醇请写出CO与H2反应合成甲醇的热化学方程式_______________________________________________
22、(每空2分共14 分)Ⅰ将镁带2.4g投入盛放在敞口容器100ml 1.5mol/L的盐酸里,产生H2的速率与时间的关系可由图表示。
(1)写出离子反应方程式_______________________________
(2)在下列因素中①H+的浓度②镁带的表面积③溶液的温度④ Cl-的浓度,能影响该反应速率的因素有__________(填序号);
(3)解释图中AB段速率变快的原因__________________。
Ⅱ在2L的密闭容器中放入4molN2O5,发生如下反应:2N2O5(g)?4NO2(g)+ O2(g)。反应5min后,测得N2O5转化了20%,则:
(1)用以下物质表示的反应速率V(NO2)为__________、V(O2)为___________;
(2)5min时,N2O5占混合气体体积分数是_______。?c(O2)?=_________________?
答案
一 、选择题
1、C 2、C 3、D 4、C 5、D 6、B 7、B 8、D 9、B 10、A
11、A 12、D 13、C 14、A 15、A 16、C 17、D 18、A
二填空题
19、(1)增大(2)>(3)不;不变(4)放热
20、(1)吸热;+(E2-E1);(2)使用了催化剂;(3)D;(4)b-a。
21、(1) CH3OH(l)+O2(g)=CO2(g)+2H2O(l)?? ΔH=-725.76 kJ·mol-1
(2) N2(g)+2O2(g)=2NO2(g)? ΔH=+67.8 kJ·mol-1
(3) 2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l)? ΔH=-2 600 kJ·mol-1
(4)CO(g)+2H2(g)=CH3OH (l)??? ΔH=-127.4 kJ·mol-1
22、Ⅰ ⑴Mg+2H+=Mg2++H2↑?
(2)①②③?
(3)反应放热,温度升高,反应速率增大
Ⅱ⑴ 0.16mol/(L·min);0.04mol/(L·min)??
???????(2)61.5%;0.2mol/L
化 学
本试卷分第I卷(选择题)和第II卷(非选择题)两部分,全卷满分100 分,考试时间90 分钟。
注意事项:
1.答卷前,考生务必用0.5mm黑色签字笔在答题卡相应栏内填写自己的班级、姓名、考场、准考证号,并用2B铅笔将考试科目、准考证号涂写在答题卡上。
2.II卷内容须用0.5mm黑色签字笔写在答题卡相应空格或区域内。
3.考试结束,将答题卡交回。
可能用到的相对分子质量:H-1,C-12,N-14,O-16,Na-23,Mg-24,Al-27,S-32,Fe-56,Cu-64
第I卷(选择题,共44分)
一.选择题(本大题共10小题,每题2分,共20分。每题只有一个正确答案。)
1.下列说法不正确的是( )
A. 增大压强,活化分子百分数不变,化学反应速率增大
B. 升高温度,活化分子百分数增大,化学反应速率增大
C. 加入反应物,活化分子百分数增大,化学反应速率增大
D. 使用催化剂,活化分子百分数增大,化学反应速率增大
2.下列说法正确的是( )
A. 需要加热才能进行的反应一定是吸热反应
B. 等质量的硫蒸气和硫固体分别完全燃烧,后者放出热量更多
C. 同温同压下,H2(g)+ Cl2(g)==2HCl(g)在光照和点燃条件下的ΔH相同
D. 与同浓度的NaOH溶液反应时,稀硫酸中和热的绝对值是盐酸的两倍
3.密闭容器内进行反应X(g)+Y(s)== 2Z(g),下列条件不能改变化学反应速率的是( )
A. 升高温度 B. 加入催化剂 C. 扩大容器体积 D. 再加入一定量的Y
4.反应C(s)+H2O(g) CO(g)+H2(g)在一可变容积的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是( )
①增加C的量; ②将容器体积缩小一半;③保持体积不变,充入N2使体系压强增大;?????
④保持压强不变,充入N2使容器体积变大。
A. ①④ B. ②③ C. ①③ D. ②④
5.已知:①N2(g)+2O2(g)==2NO2(g) ΔH=+67.7 kJ·mol-1,②N2H4(g)+O2(g)==N2(g)+2H2O(g)
ΔH=-534 kJ·mol-1。下列关于肼和NO2反应的热化学方程式中正确的是( )
A. 2N2H4(g)+2NO2(g)==3N2(g)+4H2O(l) ΔH=-1135.7 kJ·mol-1
B. 2N2H4(g)+2NO2(g)==3N2(g)+4H2O(g) ΔH=-1000.3 kJ·mol-1
C. N2H4(g)+NO2(g)==N2(g)+2H2O(l) ΔH=-1135.7 kJ·mol-1
D. 2N2H4(g)+2NO2(g)==3N2(g)+4H2O(g) ΔH=-1135.7 kJ·mol-1
6.某实验小组以H2O2分解为例,研究浓度、催化剂对反应速率的影响。在常温下按照如下方案完成实验。实验②的反应物应为( )
实验编号 反应物 催化剂
① 10mL 2%H2O2溶液 无
②
无
③ 10mL 5%H2O2溶液 MnO2 固体
A.5mL 2% H2O2溶液 B. 10mL 5% H2O2溶液 C. 10mL 2% H2O2溶液 D. 5mL 10% H2O2溶液
7.白磷和红磷互为同素异形体,它们都可以在氧气中燃烧,已知
①P4(白磷s)+5O2(g)==2P2O5(s) ?ΔH1 ;?②4P(红磷s)+5O2(g)==2P2O5(s) ?ΔH2 ;
③P4(白磷s)==4P(红磷s) ?ΔH3 =-29.2 kJ·mol?1
下列有关说法正确的是( )
A. ΔH1>ΔH2 B. 反应①②都为放热反应
C. 变化③为物理变化 D. 白磷比红磷稳定
8.化学反应4NH3(g) + 5O2(g) == 4NO(g) + 6H2O(g),若反应速率分别用v(NH3)、v(O2)、
v(NO)、v(H2O)表示,则下列关系正确的是? ??
A. 4v(NH3)= 5v(O2) B. 5v(O2)= 6v(H2O)
C. 2v(NH3)= 3v(H2O) D. 4v(O2)= 5v(NO)
9.工业合成氨的反应原理为:N2(g)+3H2(g)2NH3(g) △H﹤0 , 下列措施既能加快反应速率又能提高产率的是( )
A. 升高温度 B. 增大压强 C. 分离出NH3 D. 使用催化剂
10.对于反应A(g)+4B(g)3C(g)+2D(g),下列表示化学反应速率最快的是(? )
A. v(A)=0.3 mol/(L·min) B. v(B)=0.015 mol/(L·s)
C. v(C)=0.75 mol/(L·min) D. v(D)=0.005 mol/(L·s)
11.对可逆反应:A(g)+B(s)C(s)+D(g) ΔH>0。如图所示为正、逆反应速率(v)与时间(t)关系的示意图,如果在t1时刻改变以下条件:①加入A;②加入催化剂;③加压;④升温;⑤减少C,符合图示条件的是( )
A.②③ B.①② C.③④ D.④⑤
12.下列反应中Q2>Q1的是( )
A. H2(g)+Cl2(g)==2HCl(g) ΔH=Q1 kJ/mol ; H2(g)+Cl2(g)==2HCl(l) ΔH=Q2 kJ/mol
B. H2O(l)==H2(g)+1/2O2(g) ΔH=Q1 kJ/mol ;2H2(g)+O2(g)==2H2O(l) ΔH=Q2 kJ/mol
C. S(s)+O2(g)==SO2(g) ΔH=Q1 kJ/mol ; S(g)+O2(g)==SO2(g) ΔH=Q2 kJ/mol
D. HCl(aq)+NaOH(aq)==NaCl(aq)+H2O(l) ΔH=Q1 kJ/mol ;
?CH3COOH(aq)+NaOH(aq)==CH3COONa(aq)+H2O(l) ΔH=Q2 kJ/mol
13.在密闭容器中,反应X2(g)+Y2(g)2XY(g)△H<0,达到甲平衡,在仅改变某一条件后,达到乙平衡,对此过程的分析正确的是( )
A. 图Ⅰ是加入适当催化剂的变化情况 B. 图Ⅱ是扩大容器体积的变化情况
C. 图Ⅲ是升高温度的变化情况 D. 图Ⅲ是增大压强的变化情况
14.反应A(g)+B(g)→C(g)△H,分两步进行:①A(g)+B(g)→X(g)△H1?
②X(g)→C(g)△H2,反应过程中能量变化如图所示,E1表示A+B→X的活化能,
下列说法正确的是( )
A. △H1=△H-△H2 >0 B. X是反应A(g)+B(g)→C(g)的催化剂
C. E2是反应②的活化能 D. △H = E1-E2
15、下列说法或表示方法不正确的是( )
A. 盖斯定律实质上是能量守恒定律的体现
B. 在稀溶液中:H+(aq)+OH-(aq)=H2O(l);△H=-57.3kJ/mol,若将含0.5mol?H2SO4的浓硫酸与含1molNaOH的溶液混合,放出的热量大于57.3kJ
C. 由C(石墨)→C(金刚石);△H=+73?kJ/mol,可知石墨比金刚石稳定
D. 在101kPa时,2gH2完全燃烧生成液态水,放出285.8kJ热量,氢气燃烧的热化学方程式表示为:2H2(g)+O2(g)=2H2O(l);△H=-285.8kJ/mol
16.对于可逆反应:2A(g)+B(g)2C(g)△H<0,下列各图中正确的是( )
A. B.
C. D.
17.在一定条件下,将A2和B2两种气体通入1L密闭容器中,反应按下式进行:
xA2(g)+yB2(g2C(g),2S后测得反应速率如下V(A2)= 0.4mol/(L?s),
V(B2)=1.2mol/(L?s),V(C)=0.8mol/(L?s)则该x和y的值分别为( )
A. 2和3 B. 3和2 C. 3和1 D. 1和3
温度为T时,向2V L的密闭容器中充入一定量的A和B,发生反应:
A(g)+B(g)C(s)+xD(g);△H>0,容器中A、B、D的物质的量浓度随时间的变化如图所示,下列说法正确的是( )
A. 反应在前10min的平均反应速率v(D)= 0.15mol?L-1?min-1
B. 该反应的平衡常数表达式K=
C. 若平衡时保持温度不变,压缩容器体积平衡向逆反应方向移动
D. 反应至15min时,改变的条件是降低温度
第Ⅱ卷(非选择题,共46分)
二.填空题(本题共 4个小题,共计46分,每小题做出答案后,请写在答题卡上。)
19.(每空2分,共10分)在一定条件下,aA+bBcC的可逆反应达到平衡:
(1)若A、B、C都是气体,缩小容器体积,则反应速率______________(填“增大”或“减小”或“不变”)。
(2)若A、B、C都是气体,减小压强,平衡向逆反应方向移动,则a+b__________c(填“>”或“=”或“<”)。
(3)若A为固体、B为无色气体、C为有色气体,再加入适量的A物质,则平衡__________移动(填“向左”或“向右”或“不”),气体的颜色_________(填“加深”或“变浅”或“不变”)。
(4)若加热后C的质量分数减少,则正反应是__________反应(填“放热”或“吸热”)。
(每空2分,共10分)在化学反应中,人们把能够发生有效碰撞的分子叫做活化分子,同时把活化分子多出的那部分能量称作活化能,单位:kJ·mol-1。请根据下图回答问题:
(1) 图中所示反应是____(填“吸热”或“放热”)反应,该反应的ΔH=____kJ·mol-1 (用含E1、E2的代数式表示)。
(2) 对于同一反应,上图虚线(Ⅱ)与实线(Ⅰ)相比,活化分子最低能量明显降低,反应速率加快,你认为最有可能的原因是____。
(3) 下列4个反应中符合示意图描述的反应的是____(填代号)。
A.氧化钙与水反应
B.A(g)+2B(g)C(g) 反应中C的能量高于A的能量
C.铝粉与铁红反应
D.灼热的碳与CO2反应? ?
(4) 已知热化学方程式:A(g)+2B(g)=C(g) ΔH=+a kJ·mol-1。该反应的活化能为 b kJ·mol-1,则其逆反应的活化能为____kJ·mol-1。
21、(每空3分,共12分)依据事实,写出下列反应的热化学方程式。
(1)在25℃、101 kPa下,1 g甲醇燃烧生成CO2和液态水时放热22.68 kJ。则表示甲醇燃烧热的热化学方程式为________________________________。
(2)若适量的N2和O2完全反应,每生成23 g NO2需要吸收16.95 kJ热量,则表示该反应的热化学方程式为________________________________。
(3)用NA表示阿伏加德罗常数,在C2H2(气态)完全燃烧生成CO2和液态水的反应中,每有5NA个电子转移时,放出650 kJ的热量, 则表示该反应的热化学方程式为________________________________ 。
(4)H2、CO、CH3OH都是重要的能源物质,它们的燃烧热依次为285.8 kJ·mol-1、282.5 kJ·mol-1、726.7 kJ·mol-1。已知CO和H2在一定条件下可以合成甲醇请写出CO与H2反应合成甲醇的热化学方程式_______________________________________________
22、(每空2分共14 分)Ⅰ将镁带2.4g投入盛放在敞口容器100ml 1.5mol/L的盐酸里,产生H2的速率与时间的关系可由图表示。
(1)写出离子反应方程式_______________________________
(2)在下列因素中①H+的浓度②镁带的表面积③溶液的温度④ Cl-的浓度,能影响该反应速率的因素有__________(填序号);
(3)解释图中AB段速率变快的原因__________________。
Ⅱ在2L的密闭容器中放入4molN2O5,发生如下反应:2N2O5(g)?4NO2(g)+ O2(g)。反应5min后,测得N2O5转化了20%,则:
(1)用以下物质表示的反应速率V(NO2)为__________、V(O2)为___________;
(2)5min时,N2O5占混合气体体积分数是_______。?c(O2)?=_________________?
答案
一 、选择题
1、C 2、C 3、D 4、C 5、D 6、B 7、B 8、D 9、B 10、A
11、A 12、D 13、C 14、A 15、A 16、C 17、D 18、A
二填空题
19、(1)增大(2)>(3)不;不变(4)放热
20、(1)吸热;+(E2-E1);(2)使用了催化剂;(3)D;(4)b-a。
21、(1) CH3OH(l)+O2(g)=CO2(g)+2H2O(l)?? ΔH=-725.76 kJ·mol-1
(2) N2(g)+2O2(g)=2NO2(g)? ΔH=+67.8 kJ·mol-1
(3) 2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l)? ΔH=-2 600 kJ·mol-1
(4)CO(g)+2H2(g)=CH3OH (l)??? ΔH=-127.4 kJ·mol-1
22、Ⅰ ⑴Mg+2H+=Mg2++H2↑?
(2)①②③?
(3)反应放热,温度升高,反应速率增大
Ⅱ⑴ 0.16mol/(L·min);0.04mol/(L·min)??
???????(2)61.5%;0.2mol/L
同课章节目录
