山东省商河县第一中学2020-2021学年高二上学期期中考试化学试卷 含答案
文档属性
| 名称 | 山东省商河县第一中学2020-2021学年高二上学期期中考试化学试卷 含答案 |

|
|
| 格式 | doc | ||
| 文件大小 | 925.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-11-21 00:00:00 | ||
图片预览



文档简介
商河县第一中学2020-2021学年高二上学期期中考试
化学试卷
相当原子量:H 1 C12 N14 O16 Na23 Fe56 Cu64 Ag108
一、单项选择题(15 个小题,共 30 分)
1.下列生产生活的实际应用中,不能用勒夏特列原理解释的是( )
A.用饱和食盐水除去CL2中的HCL
B.使用更有效的催化剂,提高可逆反应的转化率
C.工业合成NH3是放热反应,为提高NH3的产率,理论上应采取低温的措施
D.工业生产硫酸的过程中使用过量的空气以提高二氧化硫的利用率(2SO2+O2 2SO3)
2.下列有关化学反应速率和化学反应限度的叙述不正确的是( )
A.Na与水反应时,增加水的质量,能明显增大原反应的化学反应速率
B.制取乙酸乙酯时加入浓硫酸作催化剂并加热,可加快酯化反应的速率
C.实验室制取H2时,常用锌粉代替锌粒或滴加几滴CuSO4溶液可加快反应速率
D. 3moH2 与1molN2一定条件下反应:N2+3H22NH3,电子转移小于6×1023
3. X、Y、z表示三种元素的原子,其最外层电子排布分别为ns1、3s23p4和2s2p4,由这三种元素组成的化合物的化学式不可能是
A. X2Y2Z3 B. X2YZ3 C. XYZ2 D. X2YZ4
4.下列有关说法不用正确的是( )
A.金属腐蚀的实质是M-ne=Mn+
B.铁上镀锌或铜,铁做阴极.镀层被破坏后,铁都易被腐蚀
C.已知浓度的NaOH溶液滴定未知浓度的HCL溶液,滴定时,先俯视刻度线,结束时平视,
测定结果偏高
D.铅蓄电池工作一段时间后,正极质量增重3.2g,外电路转移0.1mol电子
5 .已知常温下反应:的平衡常数K=0.3。现将含和的混合溶液倒入烧杯甲中,将含的溶液倒入烧杯乙中(如图),闭合开关K,关于该原电池的说法正确的是( )
A.原电池发生的总反应中氧化 B.盐桥中阳离子从左往右作定向移动
C.石墨为负极,电极反应为 D.当电流计指针归零时,总反应达到平衡状态
6.下列有关说法正确的是( )
A. 反应NH3(g)+HCl(g)=NH4Cl(s)在室温下可自发进行,则该反应的△H>0
B. 0.1mol·L-1氨水加水稀释后,溶液中的值减小
C. 用pH均为2的盐酸和醋酸分别中和等物质的量的NaOH,消耗醋酸的体积更大
D. 精炼铜时,两电极经过电量相等,其质量改变量也相同
7.理论研究表明,在101kPa和298K下,HCN(g)HNC(g)异构化反应过程的能量变化如图所示。下列说法错误的是
A. HCN比HNC稳定
B. 该异构化反应的
C. 正反应的活化能大于逆反应的活化能
D. 使用催化剂,反应物和产物能量改变,也改变反应的反应热
8已知反应①和反应②在相同的某温度下的平衡常数分别为K1和K2,该温度下反应③的平衡常数为K。则下列说法正确的是( )
A.反应①的平衡常数K1=
B.反应③的平衡常数K=
C.对于反应③,恒容时,温度升高,H2浓度减小,则该反应的焓变为正值
D.对于反应③,恒温恒容下,增大压强,H2浓度一定减小
9 .常温下,下列各组离子在指定溶液中一定能大量共存的是( )
A.在水电离出的:
B.在 的溶液中:
C.在0.1 mol/L的溶液中:
D.使甲基橙溶液变红的溶液中:
10.某蓄电池放电充电时反应为:,下列推
断不正确的是( )
A.放电时,负极附近PH值减小
B.充电时,阳极的电极反应式是
C.该蓄电池的电极一定浸在某种碱性电解质溶液中
D.充电时,原Fe极板连接电源正极,
11. 下列 说法错误的是
A. pH相等的①NaHCO3、②Na2CO3、③NaOH溶液的物质的量浓度大小:①>②>③
B. 浓度均为0.1 mol·L-1的①(NH4)2CO3、②(NH4)2SO4、③(NH4)2Fe(SO4)2溶液中,
c()的大小顺序为①>②>③
C. 在NH4Cl溶液中加入稀HNO3,能抑制水解
D. 将硫酸亚铁溶液加热蒸干得不到原溶质
12.一定温度下,在三个体积均为0.5 L的恒容密闭容器中发生反应:
CO(g)+Cl2(g) COCl2(g),其中容器Ⅰ中反应在5 min时达到平衡状态。
容器编号 温度/℃ 起始物质的量/mol 平衡物质的量/mol
CO Cl2 COCl2 COCl2
Ⅰ 500 1.0 1.0 0 0.8
Ⅱ 500 1.0 a 0 0.5
Ⅲ 600 0.5 0.5 0.5 0.7
下列说法中正确的是
A.该反应正反应为吸热反应
B.容器Ⅰ中前5 min的平均反应速率v(CO)=0.16 mol·L-1·min-1
C.?容器Ⅱ中,a=0.55 mol
D.若容器Ⅰ为恒压,达到平衡时CO转化率小于80%
13.常温下,体积相同、浓度均为的HX溶液、HY溶液,分别加水稀释,溶液的pH随
稀释倍数的常用对数的变化如图所示,下列叙述正确的是( )
A.HX是强酸,溶液每稀释10倍,pH始终增大1
B.常温下HY的电离常数约为
C.溶液中水的电离程度:a点大于b点
D. 用同浓度的NaOH溶液滴定两酸,都可以用甲基橙做指示剂
14. 将一定量氨基甲酸铵(NH2COONH4)加入密闭容器中,发生反应NH2COONH4(s)2NH3(g)+CO2(g)。该反应的平衡常数的负对数(-lgK)值随温度(T)的变化曲线如图所示,下列说法不正确的是
A. 该反应的ΔH>0
B. NH3的体积分数不变时,该反应一定达到平衡状态
C. A点对应状态的平衡常数K(A)=10-2.294
D. 30℃时,B点对应状态的v(正)15.有一种瓦斯分析仪(图甲)能够在煤矿巷道中的甲烷达到一定浓度时,通过传感器显示出来,其装置如图乙所示,ab间充有固体电解质Y2O3-Na2O,允许O2-自由移动。下列叙述正确的是
A.瓦斯分析仪工作时,电池内电路中, O2-由电极a流向电极b
B.电池外电路中电子由正极流向负极
C.电极a的反应式为:CH4+4O2-―8e-=CO2+2H2O
D.当固体电解质中有1 mol O2-通过时,电子转移4 mol
二.不定项选择题(每题有一个或两个正确选项共20分)
16.以酚酞为指示剂,用0.1000 mol·L?1的NaOH溶液滴定20.00 mL未知浓度的二元酸H2A溶液。溶液中,pH、分布系数随滴加NaOH溶液体积VNaOH的变化关系如图所示。[比如A2?的分布系数:]
下列叙述正确的是
A. 曲线①代表,曲线②代表
B. H2A溶液的浓度为0.2000 mol·L?1
C. HA?的电离常数Ka=1.0×10?2
D. 滴定终点时,溶液中
17.根据下列图示所得出的结论正确的是(? ?)
图甲表示1mL pH=2某一元酸溶液加水稀释时,pH随溶液总体积的变化曲线,说明该酸是强酸
B.图乙表示恒容密闭容器中其他条件相同时改变温度,反应CO2(g)+3H2(g) CH3OH(g)+H2O(g)
中n(CH3OH)随时间的变化曲线,说明反应平衡常数KⅠ>KⅡ
C.图丙表示不同温度下水溶液中-lg c(H+)、-lg c(OH-)变化曲线,说明T1D.图丁表示1mol H2和0.5mol O2反应生成1mol H2O过程中的能量变化曲线,说明H2的
燃烧热是241.8kJ·mol-1
18.室温下,将两种浓度均为的溶液等体积混合,若溶液混合引起的体积变化可忽略,下列各混合溶液中微粒物质的量浓度关系正确的是( )
A. 混合溶液(pH=10.30):
B. 氨水-NH4Cl混合溶液(pH=9.25):
C. 混合溶液(pH=4.76):
D. 混合溶液(pH=1.68,H2C2O4为二元弱酸):
19.是一种二元弱酸。25℃时,向溶液中逐滴加入NaOH溶液,混合溶液中lg X[X为或]与pH的变化关系如图所示。下列说法一定正确的是( )
A.Ⅱ表 示lg与pH的变化关系
B.pH=1.22 的溶液中:
C.NaHR 溶液中
D.当溶液呈中性时:
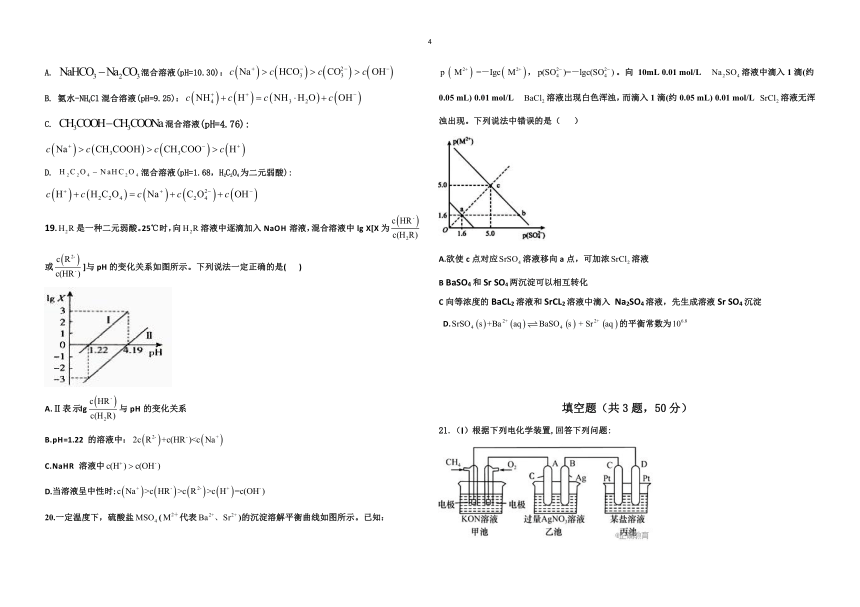
20.一定温度下,硫酸盐(代表)的沉淀溶解平衡曲线如图所示。已知:,。向 10mL 0.01 mol/L 溶液中滴入1滴(约0.05 mL) 0.01 mol/L 溶液岀现白色浑浊,而滴入1滴(约0.05 mL) 0.01 mol/L 溶液无浑浊出现。下列说法中错误的是( )
A.欲使c点对应溶液移向a点,可加浓溶液
B BaSO4和Sr SO4两沉淀可以相互转化
C向等浓度的BaCL2溶液和SrCL2溶液中滴入 Na2SO4溶液,先生成溶液Sr SO4沉淀
D.的平衡常数为
填空题(共3题,50分)
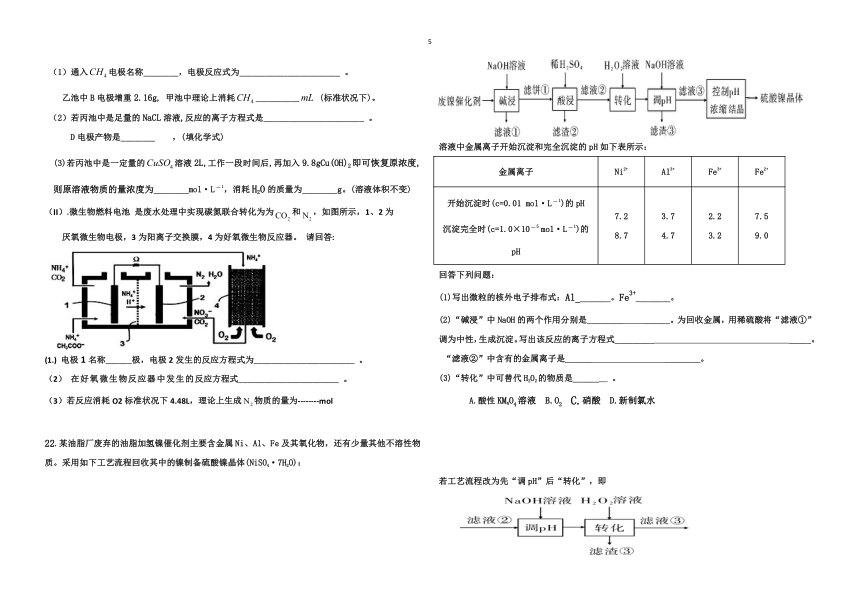
21.(I)根据下列电化学装置,回答下列问题:
通入电极名称________,电极反应式为_______________________ 。
乙池中B电极增重2.16g, 甲池中理论上消耗__________ (标准状况下)。
若丙池中是足量的NaCL溶液,反应的离子方程式是_______________________ 。
D电极产物是________,(填化学式)
(3)若丙池中是一定量的溶液2L,工作一段时间后,再加入9.8gCu(OH)2即可恢复原浓度,则原溶液物质的量浓度为________mol·L?1,消耗H2O的质量为________g。(溶液体积不变)
(II).微生物燃料电池 是废水处理中实现碳氮联合转化为为和,如图所示,1、2为
厌氧微生物电极,3为阳离子交换膜,4为好氧微生物反应器。 请回答:
(1.) 电极1名称______极,电极2发生的反应方程式为_______________________ 。
(2) 在好氧微生物反应器中发生的反应方程式_______________________ 。
(3)若反应消耗O2标准状况下4.48L,理论上生成物质的量为--------mol
22.某油脂厂废弃的油脂加氢镍催化剂主要含金属Ni、Al、Fe及其氧化物,还有少量其他不溶性物质。采用如下工艺流程回收其中的镍制备硫酸镍晶体(NiSO4·7H2O):
溶液中金属离子开始沉淀和完全沉淀的pH如下表所示:
金属离子 Ni2+ Al3+ Fe3+ Fe2+
开始沉淀时(c=0.01 mol·L?1)的pH 沉淀完全时(c=1.0×10?5 mol·L?1)的pH 7.2
8.7 3.7
4.7 2.2
3.2 7.5
9.0
回答下列问题:
(1)写出微粒的核外电子排布式:Al________。Fe3+________。
(2)“碱浸”中NaOH的两个作用分别是________ ______。为回收金属,用稀硫酸将“滤液①”调为中性,生成沉淀。写出该反应的离子方程式_________ _____。
“滤液②”中含有的金属离子是______ ________。
(3)“转化”中可替代H2O2的物质是______ 。
A.酸性KMNO4溶液 B.O2 C.硝酸 D.新制氯水
若工艺流程改为先“调pH”后“转化”,即
则“滤液③”中可能含有的杂质离子为__________ 。
(4)利用上述表格数据,计算Ni(OH)2的Ksp=________ 。
如果“转化”后的溶液中Ni2+浓度为1.0 mol·L?1,则“调pH”应控制的pH范围是______ 。
硫酸镍在强碱溶液中用NaClO氧化,可沉淀出能用作镍镉电池正极材料的NiOOH。
写出该反应的离子方程式_______ 。
(6)将分离出硫酸镍晶体后的母液收集、循环使用,其意义是______ 。
23. “绿水青山就是金山银山”。近年来,绿色发展、生态保护成为中国展示给世界的一张新“名片”。汽车尾气是造成大气污染的重要原因之一,减少氮的氧化物在大气中的排放是环境保护的重要内容之一。请回答下列问题:
(1)已知:N2(g)+O2(g)===2NO(g) ΔH1=+180.5 kJ·mol-1
C(s)+O2(g)===CO2(g) ΔH2=-393.5 kJ·mol-1
2C(s)+O2(g)===2CO(g) ΔH3=-221 kJ·mol-1
若某反应的平衡常数表达式为K=,则此反应的热化学方程式为________________________________________________________________________。
(2)N2O5在一定条件下可发生分解反应:2N2O5(g)4NO2(g)+O2(g),某温度下向恒容密闭容器中加入一定量N2O5,测得N2O5浓度随时间的变化如下表:
t/min 0 1 2 3 4 5
c(N2O5)/(mol·L-1) 1.00 0.71 0.50 0.35 0.25 0.17
①反应开始时体系压强为p0,第2 min时体系压强为p1,则p1∶p0=________。2~5 min内用NO2表示的该反应的平均反应速率为________________。
②一定温度下,在恒容密闭容器中充入一定量N2O5进行该反应,能判断反应已达到化学平衡状态的是________________(填字母)。
a.NO2和O2的浓度比保持不变 b.容器中压强不再变化
c.2v正(NO2)=v逆(N2O5) d.气体的密度保持不变
(3)Kp是用反应体系中气体物质的分压来表示的平衡常数,即将K表达式中平衡浓度用平衡分压代替。已知反应:NO2(g)+CO(g)NO(g)+CO2(g),该反应中正反应速率v正=k正·p(NO2)·p(CO),
逆反应速率v逆=k逆·p(NO)·p(CO2),其中k正、k逆为速率常数,则Kp为________________(用k正、k
逆表示)。
(4)如图是密闭反应器中按n(N2)∶n(H2)=1∶3投料后,在200 ℃、400 ℃、600 ℃下,合成NH3反应达到平衡时,混合物中NH3的物质的量分数随压强的变化曲线,已知该反应为放热反应。
①曲线a对应的温度是________。
②M点对应的H2的转化率是________。
期中化学答案
1B 2 A 3 c 4 B 5D 6C 7D 8B 9 D 10D 11B 12C 13B
14 B 15C 16 C 17 BC 18 AD 19 C 20AC
13 解析:题图中的HX溶液的pH=0,说明HX为强酸,加水稀释,溶液pH最终接近7,溶液每稀释10倍,pH增大的值不一定始终是1,A项错误;常温下,HY溶液的pH=2.0,,则HY的电离常数,B项正确;HX为强酸,HY为弱酸,加水稀释相同倍数,a点HX溶液中氢离子浓度大于b点HY溶液中氢离子浓度,故溶液中水的电离程度:a点小于b点,C项错误;a点和b点分别为相同浓度和相同体积的HX和HY溶液分别稀释相同的倍数后所得溶液,则恰好中和时消耗同浓度的NaOH溶液的体积相同,D项错误。
16详解:A.根据分析,曲线①代表δ(HA-),曲线②代表δ(A2-),A错误;B.当加入40.00mLNaOH溶液时,溶液的pH发生突变,说明恰好完全反应,结合分析,根据反应2NaOH+H2A=Na2A+2H2O,c(H2A)= =0.1000mol/L,B错误;C.由于H2A第一步完全电离,则HA-的起始浓度为0.1000mol/L,根据图像,当VNaOH=0时,HA-的分布系数为0.9,溶液的pH=1,A2-的分布系数为0.1,则HA-的电离平衡常数Ka==≈1×10-2,C正确;D.用酚酞作指示剂,酚酞变色pH范围为8.2~10,终点时溶液呈碱性,c(OH-)>c(H+),溶液中的电荷守恒为c(Na+)+c(H+)=2c(A2-)+c(HA-)+c(OH-),则c(Na+)>2c(A2-)+c(HA-),D错误;答案选C。
点睛:本题的难点是判断H2A的电离,根据pH的突变和粒子分布分数的变化确定H2A的电离方程式为H2A=H++A2-,HA-?H++A2-。
17.解析:A. 图甲表示1mL pH=2某一元酸溶液加水稀释时,pH随溶液总体积的变化曲线,当体积为100mL时,溶液体积增大100倍,pH<4,说明存在电离平衡,则该酸是弱酸,选项A错误;
B、根据图中信息可知曲线Ⅱ反应速率快,温度较高,升高温度,平衡时n(CH3OH)较小,则平衡向逆反应方向移动,平衡常数KⅠ>KⅡ,选项B正确;
C. 升高温度促进水的电离,c(H+)、c(OH-)增大,-lg c(H+)、-lg c(OH-)减小,图丙表示不同温度下水溶液中-lg c(H+)、-lg c(OH-)变化曲线,说明T1D、在温度为25℃,压力为101kPa时,1mol纯物质完全燃烧生成稳定的氧化物时所放出的热量为燃烧热,图中表示的是生成气态水,不是稳定氧化物,选项D错误;
答案选BC
18答案:AD解析:A. NaHCO3水溶液呈碱性,说明的水解程度大于其电离程度,等浓度的NaHCO3和Na2CO3水解关系为:,溶液中剩余微粒浓度关系为:,和水解程度微弱,生成的OH-浓度较低,由NaHCO3和Na2CO3化学式可知,该混合溶液中Na+浓度最大,则混合溶液中微粒浓度大小关系为:,故A正确;B.该混合溶液中电荷守恒为:,物料守恒为:,两式联立消去c(Cl-)可得:,故B错误;C.若不考虑溶液中相关微粒行为,则c(CH3COOH)=c(CH3COO-)=c(Na+),该溶液呈酸性,说明CH3COOH电离程度大于CH3COONa水解程度,则溶液中微粒浓度关系为:c(CH3COO-)>c(Na+)>c(CH3COOH)>c(H+),故C错误;D.该混合溶液中物料守恒为:,电荷守恒为:,两式相加可得:,故D正确;
综上所述,浓度关系正确的是:AD。
19.解析:二元弱酸的,当溶液的pH相同时,相同,lg X:Ⅰ >Ⅱ,则 I 表示 lg与pH的变化关系,Ⅱ表示lg与pH的变化关系。A.根据分析可知Ⅱ表示lg? pH的变化关系,故A错误;B.pH = 1.22时,溶液呈酸性,则,根据电荷守恒可知,,故 B 错误;C. pH = 1. 22 时和 4. 19 时,lg X = 0,则、,, ,的水解平衡常数,说明的电离程度大于其水解程度,溶液呈酸性,则NaHR溶液中,故 C正确;D.表 示与pH的变化关系,
时pH = 4. 19,溶液呈酸性,此时,由于为增函数,若使溶液呈中性,则K HR- :)21(1) .负; 56
写(2)CL-+2H2OH2+2OH-+CL2
(3)0.05 3.6
(1) 负 其电极反应式为
(2)
(3)0.036
22.(1)1S22S22P63S23P1 1S22S22P63S23P63d5
(2)解析:由工艺流程分析可得,向废镍催化剂中加入NaOH溶液进行碱浸,可除去油脂,并发生反应2Al+2NaOH+2H2O=2NaAlO2+3H2↑、2Al2O3+4NaOH=4NaAlO2+2H2O将Al及其氧化物溶解,得到的滤液①含有NaAlO2,滤饼①为Ni、Fe及其氧化物和少量其他不溶性杂质,加稀H2SO4酸浸后得到含有Ni2+、Fe2+、Fe3+的滤液②,Fe2+经H2O2氧化为Fe3+后,加入NaOH调节pH使Fe3+转化为Fe(OH)3沉淀除去,再控制pH浓缩结晶得到硫酸镍的晶体,据此分析解答问题。
详解: (1)根据分析可知,向废镍催化剂中加入NaOH溶液进行碱浸,可除去油脂,并将Al及其氧化物溶解,滤液①中含有NaAlO2(或Na[Al(OH)4]),加入稀硫酸可发生反应+H++H2O=Al(OH)3↓或+H+=Al(OH)3↓+H2O,故答案为:除去油脂、溶解铝及其氧化物;+H++H2O=Al(OH)3↓或+H+=Al(OH)3↓+H2O; 加入稀硫酸酸浸,Ni、Fe及其氧化物溶解,所以“滤液②”中含有的金属离子是Ni2+、Fe2+、Fe3+,故答案为:Ni2+、Fe2+、Fe3+;(3)“转化”在H2O2的作用是将Fe2+氧化为Fe3+,可用O2或空气替代;若将工艺流程改为先“调pH”后“转化”,会使调pH过滤后的溶液中含有Fe2+,则滤液③中可能含有转化生成的Fe3+,故答案为:B ;Fe3+;(4)由上述表格可知,Ni2+完全沉淀时的pH=8.7,此时c(Ni2+)=1.0×10-5mol·L-1,c(H+)=1.0×10-8.7mol·L-1,则c(OH-)=,则Ni(OH)2的;或者当Ni2+开始沉淀时pH=7.2,此时c(Ni2+)=0.01mol·L-1,c(H+)=1.0×10-7.2mol·L-1,则c(OH-)=,则Ni(OH)2的;如果“转化”后的溶液中Ni2+浓度为1.0mol·L-1,为避免镍离子沉淀,此时,则,即pH=6.2;Fe3+完全沉淀的pH为3.2,因此“调节pH”应控制的pH范围是3.2~6.2,故答案为:;3.2~6.2;(5)由题干信息,硫酸镍在强碱中被NaClO氧化得到NiOOH沉淀,即反应中Ni2+被氧化为NiOOH沉淀,ClOˉ被还原为Clˉ,则根据氧化还原得失电子守恒可得离子方程式为2Ni2++ClOˉ+4OHˉ=2NiOOH↓+Clˉ+H2O,故答案为:2Ni2++ClOˉ+4OHˉ=2NiOOH↓+Clˉ+H2O;
(6)分离出硫酸镍晶体后的母液中还含有Ni2+,可将其收集、循环使用,从而提高镍的回收率,故答案为:提高镍的回收率。
23.解析:(1)若某反应的平衡常数表达式为K=,则其化学方程式为2NO(g)+2CO(g)===N2(g)+2CO2(g),将题中3个已知热化学方程式依次编号为①②③,根据盖斯定律,由②×2-①-③,可得:2NO(g)+2CO(g)===N2(g)+2CO2(g) ΔH=(-393.5 kJ·mol-1)×2-(+180.5 kJ·mol-1)-(-221 kJ·mol-1)=-746.5 kJ·mol-1。(2)①根据题表中数据及三段式法有:
2N2O5(g)??4NO2(g)+O2(g)
开始/(mol·L-1) 1.00 0 0
转化/(mol·L-1) 0.50 1.00 0.25
2 min时/(mol·L-1) 0.50 1.00 0.25
该反应在恒温恒容条件下发生,反应前后气体的压强之比等于物质的量之比,也等于物质的量浓度之比,所以p1∶p0=(0.50+1.00+0.25)∶1.00=7∶4。2~5 min内,v(N2O5)==0.11 mol·L-1·min-1,v(NO2)=2v(N2O5)=0.22 mol·L-1·min-1。②反应过程中N2O5和O2的浓度比开始为变量,当不再变化时, 说明反应已经达到化学平衡状态.a项符合题意;该反应在反应前后气体分子数不相等,反应过程中容器内压强为变量,容器内压强不再变化可以说明反应已经达到化学平衡状态,b项符合题意;v正(NO2)=2v逆(N2O5)时,正、逆反应速率相等,而2v正(NO2)=v逆(N2O5)时,正、逆反应速率不相等,c项不能说明反应已经达到化学平衡状态;反应物和生成物全为气体,气体总质量不变,而容器恒容,故反应过程中气体密度始终不变,d项不能说明反应已经达到化学平衡状态。(3)Kp=,v正=k正·p(NO2)·p(CO),v逆=k逆·p(NO)·p(CO2),平衡时正、逆反应速率相等,即k正·p(NO2)·p(CO)=k逆·p(NO)·p(CO2),则=,故Kp=。(4)①合成氨反应为放热反应,升高温度,平衡向逆反应方向移动,NH3的产率降低,NH3的物质的量分数减小,曲线a、b、c中,在相同条件下曲线a对应NH3的物质的量分数最高,其反应温度最低,所以曲线a、b、c对应的温度为200 ℃,400 ℃,600 ℃.则Ka> Kb> Kc ②M点NH3的物质的量分数为60%,设NH3为0.6a mol,则N2、H2共为0.4a mol,因为反应器中按n(N2)∶n(H2)=1∶3投料,故M点时H2为0.3a mol,结合N2(g)+3H2(g)??2NH3(g)可知,转化的H2的物质的量为0.9a mol,所以M点对应H2的转化率为×100%=75%。(5)由题图可知,在电解池的阳极发生Mn2+转化为MnO2的反应,电极反应式为Mn2++2H2O-2e-===MnO2↓+4H+。
答案:(1)2NO(g)+2CO(g)===N2(g)+2CO2(g) ΔH=-746.5 kJ·mol-1
(2)①7∶4 0.22 mol·L-1·min-1 ②ab
(3)
(4)①Ka> Kb> Kc ②75%
1
化学试卷
相当原子量:H 1 C12 N14 O16 Na23 Fe56 Cu64 Ag108
一、单项选择题(15 个小题,共 30 分)
1.下列生产生活的实际应用中,不能用勒夏特列原理解释的是( )
A.用饱和食盐水除去CL2中的HCL
B.使用更有效的催化剂,提高可逆反应的转化率
C.工业合成NH3是放热反应,为提高NH3的产率,理论上应采取低温的措施
D.工业生产硫酸的过程中使用过量的空气以提高二氧化硫的利用率(2SO2+O2 2SO3)
2.下列有关化学反应速率和化学反应限度的叙述不正确的是( )
A.Na与水反应时,增加水的质量,能明显增大原反应的化学反应速率
B.制取乙酸乙酯时加入浓硫酸作催化剂并加热,可加快酯化反应的速率
C.实验室制取H2时,常用锌粉代替锌粒或滴加几滴CuSO4溶液可加快反应速率
D. 3moH2 与1molN2一定条件下反应:N2+3H22NH3,电子转移小于6×1023
3. X、Y、z表示三种元素的原子,其最外层电子排布分别为ns1、3s23p4和2s2p4,由这三种元素组成的化合物的化学式不可能是
A. X2Y2Z3 B. X2YZ3 C. XYZ2 D. X2YZ4
4.下列有关说法不用正确的是( )
A.金属腐蚀的实质是M-ne=Mn+
B.铁上镀锌或铜,铁做阴极.镀层被破坏后,铁都易被腐蚀
C.已知浓度的NaOH溶液滴定未知浓度的HCL溶液,滴定时,先俯视刻度线,结束时平视,
测定结果偏高
D.铅蓄电池工作一段时间后,正极质量增重3.2g,外电路转移0.1mol电子
5 .已知常温下反应:的平衡常数K=0.3。现将含和的混合溶液倒入烧杯甲中,将含的溶液倒入烧杯乙中(如图),闭合开关K,关于该原电池的说法正确的是( )
A.原电池发生的总反应中氧化 B.盐桥中阳离子从左往右作定向移动
C.石墨为负极,电极反应为 D.当电流计指针归零时,总反应达到平衡状态
6.下列有关说法正确的是( )
A. 反应NH3(g)+HCl(g)=NH4Cl(s)在室温下可自发进行,则该反应的△H>0
B. 0.1mol·L-1氨水加水稀释后,溶液中的值减小
C. 用pH均为2的盐酸和醋酸分别中和等物质的量的NaOH,消耗醋酸的体积更大
D. 精炼铜时,两电极经过电量相等,其质量改变量也相同
7.理论研究表明,在101kPa和298K下,HCN(g)HNC(g)异构化反应过程的能量变化如图所示。下列说法错误的是
A. HCN比HNC稳定
B. 该异构化反应的
C. 正反应的活化能大于逆反应的活化能
D. 使用催化剂,反应物和产物能量改变,也改变反应的反应热
8已知反应①和反应②在相同的某温度下的平衡常数分别为K1和K2,该温度下反应③的平衡常数为K。则下列说法正确的是( )
A.反应①的平衡常数K1=
B.反应③的平衡常数K=
C.对于反应③,恒容时,温度升高,H2浓度减小,则该反应的焓变为正值
D.对于反应③,恒温恒容下,增大压强,H2浓度一定减小
9 .常温下,下列各组离子在指定溶液中一定能大量共存的是( )
A.在水电离出的:
B.在 的溶液中:
C.在0.1 mol/L的溶液中:
D.使甲基橙溶液变红的溶液中:
10.某蓄电池放电充电时反应为:,下列推
断不正确的是( )
A.放电时,负极附近PH值减小
B.充电时,阳极的电极反应式是
C.该蓄电池的电极一定浸在某种碱性电解质溶液中
D.充电时,原Fe极板连接电源正极,
11. 下列 说法错误的是
A. pH相等的①NaHCO3、②Na2CO3、③NaOH溶液的物质的量浓度大小:①>②>③
B. 浓度均为0.1 mol·L-1的①(NH4)2CO3、②(NH4)2SO4、③(NH4)2Fe(SO4)2溶液中,
c()的大小顺序为①>②>③
C. 在NH4Cl溶液中加入稀HNO3,能抑制水解
D. 将硫酸亚铁溶液加热蒸干得不到原溶质
12.一定温度下,在三个体积均为0.5 L的恒容密闭容器中发生反应:
CO(g)+Cl2(g) COCl2(g),其中容器Ⅰ中反应在5 min时达到平衡状态。
容器编号 温度/℃ 起始物质的量/mol 平衡物质的量/mol
CO Cl2 COCl2 COCl2
Ⅰ 500 1.0 1.0 0 0.8
Ⅱ 500 1.0 a 0 0.5
Ⅲ 600 0.5 0.5 0.5 0.7
下列说法中正确的是
A.该反应正反应为吸热反应
B.容器Ⅰ中前5 min的平均反应速率v(CO)=0.16 mol·L-1·min-1
C.?容器Ⅱ中,a=0.55 mol
D.若容器Ⅰ为恒压,达到平衡时CO转化率小于80%
13.常温下,体积相同、浓度均为的HX溶液、HY溶液,分别加水稀释,溶液的pH随
稀释倍数的常用对数的变化如图所示,下列叙述正确的是( )
A.HX是强酸,溶液每稀释10倍,pH始终增大1
B.常温下HY的电离常数约为
C.溶液中水的电离程度:a点大于b点
D. 用同浓度的NaOH溶液滴定两酸,都可以用甲基橙做指示剂
14. 将一定量氨基甲酸铵(NH2COONH4)加入密闭容器中,发生反应NH2COONH4(s)2NH3(g)+CO2(g)。该反应的平衡常数的负对数(-lgK)值随温度(T)的变化曲线如图所示,下列说法不正确的是
A. 该反应的ΔH>0
B. NH3的体积分数不变时,该反应一定达到平衡状态
C. A点对应状态的平衡常数K(A)=10-2.294
D. 30℃时,B点对应状态的v(正)
A.瓦斯分析仪工作时,电池内电路中, O2-由电极a流向电极b
B.电池外电路中电子由正极流向负极
C.电极a的反应式为:CH4+4O2-―8e-=CO2+2H2O
D.当固体电解质中有1 mol O2-通过时,电子转移4 mol
二.不定项选择题(每题有一个或两个正确选项共20分)
16.以酚酞为指示剂,用0.1000 mol·L?1的NaOH溶液滴定20.00 mL未知浓度的二元酸H2A溶液。溶液中,pH、分布系数随滴加NaOH溶液体积VNaOH的变化关系如图所示。[比如A2?的分布系数:]
下列叙述正确的是
A. 曲线①代表,曲线②代表
B. H2A溶液的浓度为0.2000 mol·L?1
C. HA?的电离常数Ka=1.0×10?2
D. 滴定终点时,溶液中
17.根据下列图示所得出的结论正确的是(? ?)
图甲表示1mL pH=2某一元酸溶液加水稀释时,pH随溶液总体积的变化曲线,说明该酸是强酸
B.图乙表示恒容密闭容器中其他条件相同时改变温度,反应CO2(g)+3H2(g) CH3OH(g)+H2O(g)
中n(CH3OH)随时间的变化曲线,说明反应平衡常数KⅠ>KⅡ
C.图丙表示不同温度下水溶液中-lg c(H+)、-lg c(OH-)变化曲线,说明T1
燃烧热是241.8kJ·mol-1
18.室温下,将两种浓度均为的溶液等体积混合,若溶液混合引起的体积变化可忽略,下列各混合溶液中微粒物质的量浓度关系正确的是( )
A. 混合溶液(pH=10.30):
B. 氨水-NH4Cl混合溶液(pH=9.25):
C. 混合溶液(pH=4.76):
D. 混合溶液(pH=1.68,H2C2O4为二元弱酸):
19.是一种二元弱酸。25℃时,向溶液中逐滴加入NaOH溶液,混合溶液中lg X[X为或]与pH的变化关系如图所示。下列说法一定正确的是( )
A.Ⅱ表 示lg与pH的变化关系
B.pH=1.22 的溶液中:
C.NaHR 溶液中
D.当溶液呈中性时:
20.一定温度下,硫酸盐(代表)的沉淀溶解平衡曲线如图所示。已知:,。向 10mL 0.01 mol/L 溶液中滴入1滴(约0.05 mL) 0.01 mol/L 溶液岀现白色浑浊,而滴入1滴(约0.05 mL) 0.01 mol/L 溶液无浑浊出现。下列说法中错误的是( )
A.欲使c点对应溶液移向a点,可加浓溶液
B BaSO4和Sr SO4两沉淀可以相互转化
C向等浓度的BaCL2溶液和SrCL2溶液中滴入 Na2SO4溶液,先生成溶液Sr SO4沉淀
D.的平衡常数为
填空题(共3题,50分)
21.(I)根据下列电化学装置,回答下列问题:
通入电极名称________,电极反应式为_______________________ 。
乙池中B电极增重2.16g, 甲池中理论上消耗__________ (标准状况下)。
若丙池中是足量的NaCL溶液,反应的离子方程式是_______________________ 。
D电极产物是________,(填化学式)
(3)若丙池中是一定量的溶液2L,工作一段时间后,再加入9.8gCu(OH)2即可恢复原浓度,则原溶液物质的量浓度为________mol·L?1,消耗H2O的质量为________g。(溶液体积不变)
(II).微生物燃料电池 是废水处理中实现碳氮联合转化为为和,如图所示,1、2为
厌氧微生物电极,3为阳离子交换膜,4为好氧微生物反应器。 请回答:
(1.) 电极1名称______极,电极2发生的反应方程式为_______________________ 。
(2) 在好氧微生物反应器中发生的反应方程式_______________________ 。
(3)若反应消耗O2标准状况下4.48L,理论上生成物质的量为--------mol
22.某油脂厂废弃的油脂加氢镍催化剂主要含金属Ni、Al、Fe及其氧化物,还有少量其他不溶性物质。采用如下工艺流程回收其中的镍制备硫酸镍晶体(NiSO4·7H2O):
溶液中金属离子开始沉淀和完全沉淀的pH如下表所示:
金属离子 Ni2+ Al3+ Fe3+ Fe2+
开始沉淀时(c=0.01 mol·L?1)的pH 沉淀完全时(c=1.0×10?5 mol·L?1)的pH 7.2
8.7 3.7
4.7 2.2
3.2 7.5
9.0
回答下列问题:
(1)写出微粒的核外电子排布式:Al________。Fe3+________。
(2)“碱浸”中NaOH的两个作用分别是________ ______。为回收金属,用稀硫酸将“滤液①”调为中性,生成沉淀。写出该反应的离子方程式_________ _____。
“滤液②”中含有的金属离子是______ ________。
(3)“转化”中可替代H2O2的物质是______ 。
A.酸性KMNO4溶液 B.O2 C.硝酸 D.新制氯水
若工艺流程改为先“调pH”后“转化”,即
则“滤液③”中可能含有的杂质离子为__________ 。
(4)利用上述表格数据,计算Ni(OH)2的Ksp=________ 。
如果“转化”后的溶液中Ni2+浓度为1.0 mol·L?1,则“调pH”应控制的pH范围是______ 。
硫酸镍在强碱溶液中用NaClO氧化,可沉淀出能用作镍镉电池正极材料的NiOOH。
写出该反应的离子方程式_______ 。
(6)将分离出硫酸镍晶体后的母液收集、循环使用,其意义是______ 。
23. “绿水青山就是金山银山”。近年来,绿色发展、生态保护成为中国展示给世界的一张新“名片”。汽车尾气是造成大气污染的重要原因之一,减少氮的氧化物在大气中的排放是环境保护的重要内容之一。请回答下列问题:
(1)已知:N2(g)+O2(g)===2NO(g) ΔH1=+180.5 kJ·mol-1
C(s)+O2(g)===CO2(g) ΔH2=-393.5 kJ·mol-1
2C(s)+O2(g)===2CO(g) ΔH3=-221 kJ·mol-1
若某反应的平衡常数表达式为K=,则此反应的热化学方程式为________________________________________________________________________。
(2)N2O5在一定条件下可发生分解反应:2N2O5(g)4NO2(g)+O2(g),某温度下向恒容密闭容器中加入一定量N2O5,测得N2O5浓度随时间的变化如下表:
t/min 0 1 2 3 4 5
c(N2O5)/(mol·L-1) 1.00 0.71 0.50 0.35 0.25 0.17
①反应开始时体系压强为p0,第2 min时体系压强为p1,则p1∶p0=________。2~5 min内用NO2表示的该反应的平均反应速率为________________。
②一定温度下,在恒容密闭容器中充入一定量N2O5进行该反应,能判断反应已达到化学平衡状态的是________________(填字母)。
a.NO2和O2的浓度比保持不变 b.容器中压强不再变化
c.2v正(NO2)=v逆(N2O5) d.气体的密度保持不变
(3)Kp是用反应体系中气体物质的分压来表示的平衡常数,即将K表达式中平衡浓度用平衡分压代替。已知反应:NO2(g)+CO(g)NO(g)+CO2(g),该反应中正反应速率v正=k正·p(NO2)·p(CO),
逆反应速率v逆=k逆·p(NO)·p(CO2),其中k正、k逆为速率常数,则Kp为________________(用k正、k
逆表示)。
(4)如图是密闭反应器中按n(N2)∶n(H2)=1∶3投料后,在200 ℃、400 ℃、600 ℃下,合成NH3反应达到平衡时,混合物中NH3的物质的量分数随压强的变化曲线,已知该反应为放热反应。
①曲线a对应的温度是________。
②M点对应的H2的转化率是________。
期中化学答案
1B 2 A 3 c 4 B 5D 6C 7D 8B 9 D 10D 11B 12C 13B
14 B 15C 16 C 17 BC 18 AD 19 C 20AC
13 解析:题图中的HX溶液的pH=0,说明HX为强酸,加水稀释,溶液pH最终接近7,溶液每稀释10倍,pH增大的值不一定始终是1,A项错误;常温下,HY溶液的pH=2.0,,则HY的电离常数,B项正确;HX为强酸,HY为弱酸,加水稀释相同倍数,a点HX溶液中氢离子浓度大于b点HY溶液中氢离子浓度,故溶液中水的电离程度:a点小于b点,C项错误;a点和b点分别为相同浓度和相同体积的HX和HY溶液分别稀释相同的倍数后所得溶液,则恰好中和时消耗同浓度的NaOH溶液的体积相同,D项错误。
16详解:A.根据分析,曲线①代表δ(HA-),曲线②代表δ(A2-),A错误;B.当加入40.00mLNaOH溶液时,溶液的pH发生突变,说明恰好完全反应,结合分析,根据反应2NaOH+H2A=Na2A+2H2O,c(H2A)= =0.1000mol/L,B错误;C.由于H2A第一步完全电离,则HA-的起始浓度为0.1000mol/L,根据图像,当VNaOH=0时,HA-的分布系数为0.9,溶液的pH=1,A2-的分布系数为0.1,则HA-的电离平衡常数Ka==≈1×10-2,C正确;D.用酚酞作指示剂,酚酞变色pH范围为8.2~10,终点时溶液呈碱性,c(OH-)>c(H+),溶液中的电荷守恒为c(Na+)+c(H+)=2c(A2-)+c(HA-)+c(OH-),则c(Na+)>2c(A2-)+c(HA-),D错误;答案选C。
点睛:本题的难点是判断H2A的电离,根据pH的突变和粒子分布分数的变化确定H2A的电离方程式为H2A=H++A2-,HA-?H++A2-。
17.解析:A. 图甲表示1mL pH=2某一元酸溶液加水稀释时,pH随溶液总体积的变化曲线,当体积为100mL时,溶液体积增大100倍,pH<4,说明存在电离平衡,则该酸是弱酸,选项A错误;
B、根据图中信息可知曲线Ⅱ反应速率快,温度较高,升高温度,平衡时n(CH3OH)较小,则平衡向逆反应方向移动,平衡常数KⅠ>KⅡ,选项B正确;
C. 升高温度促进水的电离,c(H+)、c(OH-)增大,-lg c(H+)、-lg c(OH-)减小,图丙表示不同温度下水溶液中-lg c(H+)、-lg c(OH-)变化曲线,说明T1
答案选BC
18答案:AD解析:A. NaHCO3水溶液呈碱性,说明的水解程度大于其电离程度,等浓度的NaHCO3和Na2CO3水解关系为:,溶液中剩余微粒浓度关系为:,和水解程度微弱,生成的OH-浓度较低,由NaHCO3和Na2CO3化学式可知,该混合溶液中Na+浓度最大,则混合溶液中微粒浓度大小关系为:,故A正确;B.该混合溶液中电荷守恒为:,物料守恒为:,两式联立消去c(Cl-)可得:,故B错误;C.若不考虑溶液中相关微粒行为,则c(CH3COOH)=c(CH3COO-)=c(Na+),该溶液呈酸性,说明CH3COOH电离程度大于CH3COONa水解程度,则溶液中微粒浓度关系为:c(CH3COO-)>c(Na+)>c(CH3COOH)>c(H+),故C错误;D.该混合溶液中物料守恒为:,电荷守恒为:,两式相加可得:,故D正确;
综上所述,浓度关系正确的是:AD。
19.解析:二元弱酸的,当溶液的pH相同时,相同,lg X:Ⅰ >Ⅱ,则 I 表示 lg与pH的变化关系,Ⅱ表示lg与pH的变化关系。A.根据分析可知Ⅱ表示lg? pH的变化关系,故A错误;B.pH = 1.22时,溶液呈酸性,则,根据电荷守恒可知,,故 B 错误;C. pH = 1. 22 时和 4. 19 时,lg X = 0,则、,, ,的水解平衡常数,说明的电离程度大于其水解程度,溶液呈酸性,则NaHR溶液中,故 C正确;D.表 示与pH的变化关系,
时pH = 4. 19,溶液呈酸性,此时,由于为增函数,若使溶液呈中性,则K HR- :)
写(2)CL-+2H2OH2+2OH-+CL2
(3)0.05 3.6
(1) 负 其电极反应式为
(2)
(3)0.036
22.(1)1S22S22P63S23P1 1S22S22P63S23P63d5
(2)解析:由工艺流程分析可得,向废镍催化剂中加入NaOH溶液进行碱浸,可除去油脂,并发生反应2Al+2NaOH+2H2O=2NaAlO2+3H2↑、2Al2O3+4NaOH=4NaAlO2+2H2O将Al及其氧化物溶解,得到的滤液①含有NaAlO2,滤饼①为Ni、Fe及其氧化物和少量其他不溶性杂质,加稀H2SO4酸浸后得到含有Ni2+、Fe2+、Fe3+的滤液②,Fe2+经H2O2氧化为Fe3+后,加入NaOH调节pH使Fe3+转化为Fe(OH)3沉淀除去,再控制pH浓缩结晶得到硫酸镍的晶体,据此分析解答问题。
详解: (1)根据分析可知,向废镍催化剂中加入NaOH溶液进行碱浸,可除去油脂,并将Al及其氧化物溶解,滤液①中含有NaAlO2(或Na[Al(OH)4]),加入稀硫酸可发生反应+H++H2O=Al(OH)3↓或+H+=Al(OH)3↓+H2O,故答案为:除去油脂、溶解铝及其氧化物;+H++H2O=Al(OH)3↓或+H+=Al(OH)3↓+H2O; 加入稀硫酸酸浸,Ni、Fe及其氧化物溶解,所以“滤液②”中含有的金属离子是Ni2+、Fe2+、Fe3+,故答案为:Ni2+、Fe2+、Fe3+;(3)“转化”在H2O2的作用是将Fe2+氧化为Fe3+,可用O2或空气替代;若将工艺流程改为先“调pH”后“转化”,会使调pH过滤后的溶液中含有Fe2+,则滤液③中可能含有转化生成的Fe3+,故答案为:B ;Fe3+;(4)由上述表格可知,Ni2+完全沉淀时的pH=8.7,此时c(Ni2+)=1.0×10-5mol·L-1,c(H+)=1.0×10-8.7mol·L-1,则c(OH-)=,则Ni(OH)2的;或者当Ni2+开始沉淀时pH=7.2,此时c(Ni2+)=0.01mol·L-1,c(H+)=1.0×10-7.2mol·L-1,则c(OH-)=,则Ni(OH)2的;如果“转化”后的溶液中Ni2+浓度为1.0mol·L-1,为避免镍离子沉淀,此时,则,即pH=6.2;Fe3+完全沉淀的pH为3.2,因此“调节pH”应控制的pH范围是3.2~6.2,故答案为:;3.2~6.2;(5)由题干信息,硫酸镍在强碱中被NaClO氧化得到NiOOH沉淀,即反应中Ni2+被氧化为NiOOH沉淀,ClOˉ被还原为Clˉ,则根据氧化还原得失电子守恒可得离子方程式为2Ni2++ClOˉ+4OHˉ=2NiOOH↓+Clˉ+H2O,故答案为:2Ni2++ClOˉ+4OHˉ=2NiOOH↓+Clˉ+H2O;
(6)分离出硫酸镍晶体后的母液中还含有Ni2+,可将其收集、循环使用,从而提高镍的回收率,故答案为:提高镍的回收率。
23.解析:(1)若某反应的平衡常数表达式为K=,则其化学方程式为2NO(g)+2CO(g)===N2(g)+2CO2(g),将题中3个已知热化学方程式依次编号为①②③,根据盖斯定律,由②×2-①-③,可得:2NO(g)+2CO(g)===N2(g)+2CO2(g) ΔH=(-393.5 kJ·mol-1)×2-(+180.5 kJ·mol-1)-(-221 kJ·mol-1)=-746.5 kJ·mol-1。(2)①根据题表中数据及三段式法有:
2N2O5(g)??4NO2(g)+O2(g)
开始/(mol·L-1) 1.00 0 0
转化/(mol·L-1) 0.50 1.00 0.25
2 min时/(mol·L-1) 0.50 1.00 0.25
该反应在恒温恒容条件下发生,反应前后气体的压强之比等于物质的量之比,也等于物质的量浓度之比,所以p1∶p0=(0.50+1.00+0.25)∶1.00=7∶4。2~5 min内,v(N2O5)==0.11 mol·L-1·min-1,v(NO2)=2v(N2O5)=0.22 mol·L-1·min-1。②反应过程中N2O5和O2的浓度比开始为变量,当不再变化时, 说明反应已经达到化学平衡状态.a项符合题意;该反应在反应前后气体分子数不相等,反应过程中容器内压强为变量,容器内压强不再变化可以说明反应已经达到化学平衡状态,b项符合题意;v正(NO2)=2v逆(N2O5)时,正、逆反应速率相等,而2v正(NO2)=v逆(N2O5)时,正、逆反应速率不相等,c项不能说明反应已经达到化学平衡状态;反应物和生成物全为气体,气体总质量不变,而容器恒容,故反应过程中气体密度始终不变,d项不能说明反应已经达到化学平衡状态。(3)Kp=,v正=k正·p(NO2)·p(CO),v逆=k逆·p(NO)·p(CO2),平衡时正、逆反应速率相等,即k正·p(NO2)·p(CO)=k逆·p(NO)·p(CO2),则=,故Kp=。(4)①合成氨反应为放热反应,升高温度,平衡向逆反应方向移动,NH3的产率降低,NH3的物质的量分数减小,曲线a、b、c中,在相同条件下曲线a对应NH3的物质的量分数最高,其反应温度最低,所以曲线a、b、c对应的温度为200 ℃,400 ℃,600 ℃.则Ka> Kb> Kc ②M点NH3的物质的量分数为60%,设NH3为0.6a mol,则N2、H2共为0.4a mol,因为反应器中按n(N2)∶n(H2)=1∶3投料,故M点时H2为0.3a mol,结合N2(g)+3H2(g)??2NH3(g)可知,转化的H2的物质的量为0.9a mol,所以M点对应H2的转化率为×100%=75%。(5)由题图可知,在电解池的阳极发生Mn2+转化为MnO2的反应,电极反应式为Mn2++2H2O-2e-===MnO2↓+4H+。
答案:(1)2NO(g)+2CO(g)===N2(g)+2CO2(g) ΔH=-746.5 kJ·mol-1
(2)①7∶4 0.22 mol·L-1·min-1 ②ab
(3)
(4)①Ka> Kb> Kc ②75%
1
同课章节目录
