【2012优化方案 精品课件】苏教版 化学 选修3专题4第2单元 配合物的形成和应用(共48张PPT)
文档属性
| 名称 | 【2012优化方案 精品课件】苏教版 化学 选修3专题4第2单元 配合物的形成和应用(共48张PPT) |

|
|
| 格式 | rar | ||
| 文件大小 | 665.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2011-10-28 00:00:00 | ||
图片预览









文档简介
(共48张PPT)
第二单元 配合物的形成和应用
学习目标
1.掌握配合物的概念。
2.了解配合物的结构、性质和应用。
3.能说明配合物的成键情况。
课堂互动讲练
探究整合应用
知能优化训练
第
二
单
元
课前自主学案
课前自主学案
自主学习
一、 人类对配合物结构的认识
1.概念
由___________________的配位体与接受
___________的中心原子以________键结合形成的化合物。
提供孤电子对
孤电子对
配位
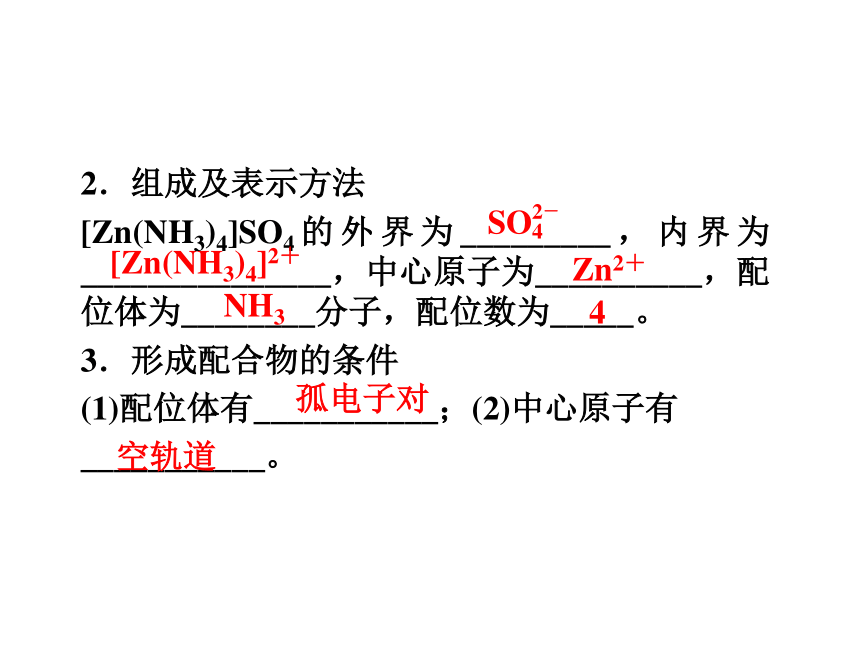
2.组成及表示方法
[Zn(NH3)4]SO4的外界为_________,内界为_______________,中心原子为__________,配位体为________分子,配位数为_____。
3.形成配合物的条件
(1)配位体有___________;(2)中心原子有
___________。
[Zn(NH3)4]2+
Zn2+
NH3
4
孤电子对
空轨道
二、配合物的结构和性质
1.配合物形成的条件和过程
形成配合物的中心原子M必须存在接受孤电子对的__________,配位体L存在着
____________。当配位体L接近中心原子时,为了增加成键能力,中心原子M用_______的空轨道杂化,配位体L的____________填到已杂化的空轨道中形成配离子。
空轨道
孤电子对
外围
孤电子对
2.空间构型
配合物的___________、配位体的________和 _______的不同,可以形成不同空间构型的配合物。例如:Ag+与NH3反应生成[Ag(NH3)2]+,NH3分子中的N原子有一孤电子对,进入Ag+空的sp杂化轨道,形成直线形结构。而[Zn(NH3)4]2+、[Ni(CN)4]2-、[AlF6]3-空间构型分别为___________、________、___________。
中心原子
种类
数目
正四面体
平面形
正八面体
3.顺、反异构体
含有两种或两种以上___________的配合物,若配位体在空间排列方式不同,就能形成不同几何构型的配合物,且性质不同。如Pt(NH3)2Cl2有________和_________两种异构体,它们的颜色分别为__________和__________,分子极性为_______和___________。
配位体
顺式
反式
棕黄色
淡黄色
极性
非极性
思考感悟
指出[Pt(NH3)4]Cl2中的配离子、中心原子、配位体、配位数及配位原子。
【提示】 Cl- Pt2+ NH3 4 N
三、配合物的应用
1.在实验研究中,人们常用形成配合物的方法来检验______________、分离物质、定量测定物质的组成。
2.在生产中,配合物被广泛用于______、
______、___________、___________领域。
3.生命体中的许多金属元素都以配合物形式存在。
4.配合物在医疗方面应用也很广泛。
5.模拟生物固氮也与配合物有关。
金属离子
染色
电镀
硬水软化
金属冶炼
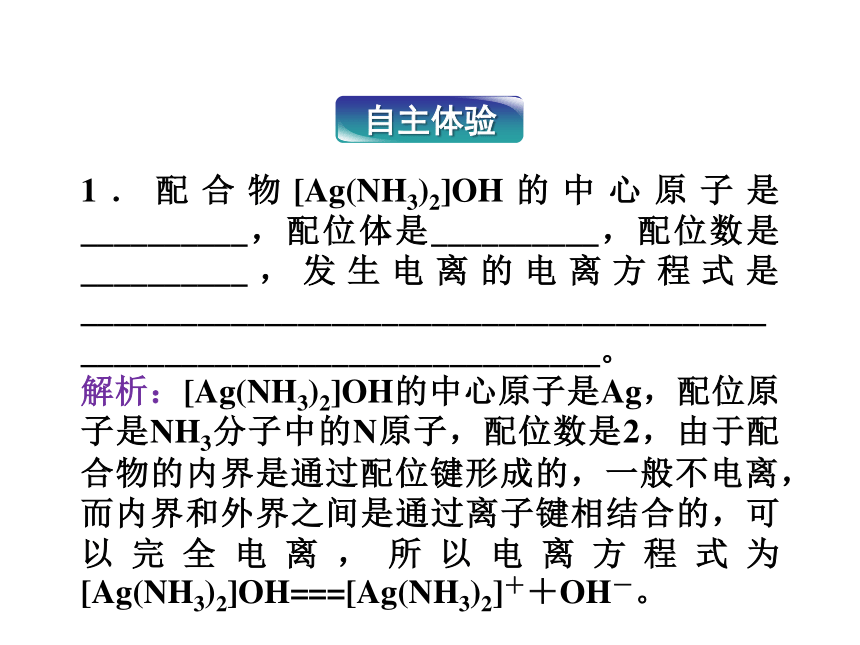
自主体验
1.配合物[Ag(NH3)2]OH的中心原子是__________,配位体是__________,配位数是__________,发生电离的电离方程式是________________________________________________________________________。
解析:[Ag(NH3)2]OH的中心原子是Ag,配位原子是NH3分子中的N原子,配位数是2,由于配合物的内界是通过配位键形成的,一般不电离,而内界和外界之间是通过离子键相结合的,可以完全电离,所以电离方程式为[Ag(NH3)2]OH===[Ag(NH3)2]++OH-。
答案:Ag NH3 2
[Ag(NH3)2]OH===[Ag(NH3)2]++OH
答案:D
3.(2011年无锡高二检测)已知[Pt(Cl)2(OH)2]有两种不同的结构,请推测[Pt(Cl)2(OH)2]的空间构型,并简述你的理由。
解析:[Pt(Cl)2(OH)2]配位数是4,可以形成四面体形或平面四方形两种空间构型,当[Pt(Cl)2(OH)2]以四面体形存在时没有同分异构体,以平面四方形存在时有两种同分异构体,所以它是平面四方形。
答案:[Pt(Cl2)(OH)2]是平面四方形结构。因为根据成键规则[Pt(Cl)2(OH)2]有两种合理结构,四面体形或平面四方形,但如果是四面体形则无同分异构体,所以它是平面四方形结构。
课堂互动讲练
配合物
1.概念:由可以提供孤电子对的配位体与接受孤电子对的中心原子以配位键结合形成的化合物。
配合物可以是中性分子,也可以是带电荷的离子。
2.中心原子
配合物的中心原子一般都是带正电的阳离子,过渡金属离子最常见,但也有电中性的原子甚至还有极少数的阴离子。
3.配位体
配位体可以是阴离子,如X-、SCN-、CN-等,也可以是中性分子,如H2O、NH3、CO等。
配位体中直接同中心原子配合的原子叫做配位原子。配位原子必须是含有孤电子对的原子,如NH3中的N原子,H2O分子中的O原子,配位原子常是VA族、ⅥA族、ⅦA族的元素。
4.配位数
直接同中心原子配位的原子数目叫中心原子的配位数。如[Fe(CN)6]4-中Fe2+的配位数为6。
5.中心原子与配位体构成了配合物的内界,通常把它们放在中括号内。内外界之间是离子键,在水中全部电离。
特别提醒:记住配合物结构,如:
例1
【解析】
K2[Co(NCS)4] Na2[SiF6] Na3[AlF6] [Cu(NH3)4]Cl2
配位体 NCS- F- F- NH3
配位数 4 6 6 4
【答案】 AD
答案:Cu2+有空轨道,NH3分子中氮原子的孤电子对进入Cu2+的空轨道,Cu2+与NH3分子中氮原子提供的孤电子对形成配位键,结合成 [Cu(NH3)4]2+。
配离子的空间结构
1.当配位体在中心原子周围配位时,为了减小配位体(尤其是阴离子配位体)之间的静电排斥作用(或成键电子对之间的斥力),以达到能量上的稳定状态,配位体要尽量互相远离,因而在中心原子周围采取对称分布的状态。表中列出了不同配位数的配合单元的空间结构。
配位数 配合单元的空间结构 实例
2 [Co(NH3)2]2+、[Ag(NH3)2]+、[Ag(CN)2]-
4 [ZnCl4]2-、[Cd(NH3)4]2+、[Cd(CN)4]2-、[CoCl4]-
[PtCl4]2-、[PdCl4]2-、[PtCl2(NH3)2]、[Ni(CN)4]2-
6 [Co(NH3)6]3+、[AlF6]3-、[SiF6]2-
注:图中“ ”代表中心原子,“·”代表配位体。
从表中看出,不仅配位数不同时,配离子的空间结构不同,即使配位数相同,由于中心离子和配位体的种类以及相互作用的情况不同,空间结构也可能不同。例如[ZnCl4]2-为四面体,[PtCl4]2-则为平面正方形。
2.配合物的结构
化学组成相同的配合物可以有不同的结构,这就是配合物的异构现象。如Pt(NH3)2Cl2有顺式和反式两种异构体:
(2011年新沂高二检测)已知[Co(NH3)6]3+的立体结构如图,其中数字处的小圆圈表示NH3分子,且各相邻的NH3分子间的距离相等,Co3+位于八面体的中心。若其中两个NH3被Cl-取代,所形成的[Co(NH3)4Cl2]+同分异构体的种数有( )
A.2种 B.3种
C.4种 D.5种
例2
【思路点拨】 配离子的构型由配位体的数目决定,考虑[Co(NH3)6]3+是完全对称的结构,其中两个NH3被Cl-取代生成[Co(NH3)4Cl2]+时,要考虑Cl-取代NH3的相对位置,确定其结构。
【解析】 [Co(NH3)6]3+中6个配位体NH3分子的位置完全相同,因此,任意取代两个相邻位置只有一种结构,任意取代两个不相邻的位置也只有一种结构,故其同分异构体只有两种。
【答案】 A
【规律方法】 配合物中由于配位体连接的位置和顺序不同,可能产生不同的空间结构,得到性质不同的配合物,因此,解答这类问题的关键是理解同分异构体的概念,准确把握概念的要点(分子式相同,结构不同),从概念入手进行分析判断,同时要借助几何知识进行合理的空间结构分析。
变式训练2 根据下表所示回答下列问题:
顺式、反式Pt(NH3)2Cl2的性质差异
配合物 颜色 极性 在水中的溶解性 抗癌活性
A 棕黄色 极性 0.2577 g/100 g H2O 有活性
B 淡黄色 非极性 0.0366 g/100 g H2O 无活性
(1)指出A、B各为哪种结构的Pt(NH3)2Cl2,写出相关的结构简式。
(2)哪一种结构的Pt(NH3)2Cl2易溶解于H2O,为什么?
(3)若为Pt(NH3)2Cl4且在H2O中溶解度较大,试写出其结构式。
解析:(1)根据分子极性可知A为顺式
(2)结构B对称,正负电荷中心重合,因此分子无极性,由相似相溶经验规律可知,它在极性分子中溶解度小,而A分子结构不对称,分子中正负电荷中心不能重合,分子有极性,所以水溶性大。
(3)Pt(NH3)2Cl4中Pt原子为八面体的中心,四个氯原子和两个氨分子在八面体六个顶点的位置上,可有以下两种:
结构c对称,分子无极性,
c d
在水中溶解度较小,结构d不对称,分子有极性,在水中溶解度较大,故d结构符合题意。
配合物的性质
1.配合物中,中心原子在配位体的影响下,其价层轨道进行杂化,配位原子的孤对电子进入中心原子的空轨道产生较强的作用,因而配合物有较强的稳定性。
2.(1)[Cu(NH3)4]SO4·H2O的制取:
(2)Fe3+的检验:
[生成了血红色的Fe(SCN)2+等]。
Fe3++SCN-===[Fe(SCN)]2+
例3
【解析】 在配合物中,内界以配位键结合很牢固,难以在溶液中电离;而内界和外界之间以离子键相结合,在溶液中能够完全电离。不难看出A、C、D三项中配合物在水中均电离产生Cl-,而B项无外界离子,不能电离。
【答案】 B
【规律方法】 作为配位体的Cl-不能电离。
变式训练3 现有两种配合物晶体[Co(NH3)6]Cl3和[Co(NH3)5Cl]Cl2,一种为橙黄色,另一种为紫红色。请设计实验方案将这两种配合物区别开来。
解析:在[Co(NH3)6]Cl3中Co3+与6个NH3分子配合成[Co(NH3)6]3+,3个Cl-都是外界离子。而[Co(NH3)5Cl]Cl2中Co3+与5个NH3分子和1个Cl-配合成[Co(NH3)5Cl]2+,只有两个Cl-是外界离子。由于配合物中内界以配位键结合很牢固,难以在溶液中电离,而内界和外界之间以离子键结合,在溶液中能够完全电离。
不难看出,相同质量的两种晶体在溶液中能够电离出的Cl-数是不同的,我们可以利用这一点进行鉴别。
答案:称取相同质量的两种晶体分别配成溶液,向两种溶液中分别滴加足量的AgNO3溶液,静置、过滤、干燥、称量,所得AgCl固体多的,原晶体为[Co(NH3)6]Cl3,另一种为[Co(NH3)5Cl]Cl2。
配合物的计算
配合物的计算主要是通过定量计算来确定配合物的配离子、中心原子和配位数。其主要手段是通过实验中沉淀的质量变化来做定量分析、推理。
(2011年浙江温州高二检测)有两种配合物A和B,它们的组成为21.95%的Co,39.61%的Cl,26.09%的N,6.39%的H,5.96%的O,且中心原子Co的配位数为6,试根据下面的实验结果确定它们的化学式及配离子。
探究整合应用
例
(1)A和B的水溶液都呈微酸性,加入强碱并加热至沸腾时,有氨放出,同时析出Co2O3沉淀。
(2)向A和B的溶液中加入硝酸银溶液时都生成AgCl沉淀。
(3)过滤除去两种溶液中的沉淀后,再加硝酸银均无变化,但加热至沸腾时,在B的溶液中又有AgCl沉淀生成,其质量为原来析出沉淀的一半。
由实验(3)可知:将沉淀过滤后,A再滴加AgNO3溶液,并加热至沸腾时无沉淀,说明Cl-全部在外界;而B再滴加AgNO3溶液,加热至沸腾后出现沉淀AgCl,且沉淀为原来的一半,证明B中有两个Cl-在外界,一个Cl-在内界,再结合配位数是6,可知两种化合物分别为:
A.[Co(NH3)5(H2O)]Cl3,
配离子:[Co(NH3)5(H2O)]3+;
B.[Co(NH3)5Cl]Cl2·H2O,配离子:[Co(NH3)5Cl]2+。
【答案】 A.[Co(NH3)5(H2O)]Cl3;
配离子:[Co(NH3)5(H2O)]3+;
B.[Co(NH3)5Cl]Cl2·H2O;
配离子:[Co(NH3)5Cl]2+。
知能优化训练
本部分内容讲解结束
点此进入课件目录
按ESC键退出全屏播放
谢谢使用
第二单元 配合物的形成和应用
学习目标
1.掌握配合物的概念。
2.了解配合物的结构、性质和应用。
3.能说明配合物的成键情况。
课堂互动讲练
探究整合应用
知能优化训练
第
二
单
元
课前自主学案
课前自主学案
自主学习
一、 人类对配合物结构的认识
1.概念
由___________________的配位体与接受
___________的中心原子以________键结合形成的化合物。
提供孤电子对
孤电子对
配位
2.组成及表示方法
[Zn(NH3)4]SO4的外界为_________,内界为_______________,中心原子为__________,配位体为________分子,配位数为_____。
3.形成配合物的条件
(1)配位体有___________;(2)中心原子有
___________。
[Zn(NH3)4]2+
Zn2+
NH3
4
孤电子对
空轨道
二、配合物的结构和性质
1.配合物形成的条件和过程
形成配合物的中心原子M必须存在接受孤电子对的__________,配位体L存在着
____________。当配位体L接近中心原子时,为了增加成键能力,中心原子M用_______的空轨道杂化,配位体L的____________填到已杂化的空轨道中形成配离子。
空轨道
孤电子对
外围
孤电子对
2.空间构型
配合物的___________、配位体的________和 _______的不同,可以形成不同空间构型的配合物。例如:Ag+与NH3反应生成[Ag(NH3)2]+,NH3分子中的N原子有一孤电子对,进入Ag+空的sp杂化轨道,形成直线形结构。而[Zn(NH3)4]2+、[Ni(CN)4]2-、[AlF6]3-空间构型分别为___________、________、___________。
中心原子
种类
数目
正四面体
平面形
正八面体
3.顺、反异构体
含有两种或两种以上___________的配合物,若配位体在空间排列方式不同,就能形成不同几何构型的配合物,且性质不同。如Pt(NH3)2Cl2有________和_________两种异构体,它们的颜色分别为__________和__________,分子极性为_______和___________。
配位体
顺式
反式
棕黄色
淡黄色
极性
非极性
思考感悟
指出[Pt(NH3)4]Cl2中的配离子、中心原子、配位体、配位数及配位原子。
【提示】 Cl- Pt2+ NH3 4 N
三、配合物的应用
1.在实验研究中,人们常用形成配合物的方法来检验______________、分离物质、定量测定物质的组成。
2.在生产中,配合物被广泛用于______、
______、___________、___________领域。
3.生命体中的许多金属元素都以配合物形式存在。
4.配合物在医疗方面应用也很广泛。
5.模拟生物固氮也与配合物有关。
金属离子
染色
电镀
硬水软化
金属冶炼
自主体验
1.配合物[Ag(NH3)2]OH的中心原子是__________,配位体是__________,配位数是__________,发生电离的电离方程式是________________________________________________________________________。
解析:[Ag(NH3)2]OH的中心原子是Ag,配位原子是NH3分子中的N原子,配位数是2,由于配合物的内界是通过配位键形成的,一般不电离,而内界和外界之间是通过离子键相结合的,可以完全电离,所以电离方程式为[Ag(NH3)2]OH===[Ag(NH3)2]++OH-。
答案:Ag NH3 2
[Ag(NH3)2]OH===[Ag(NH3)2]++OH
答案:D
3.(2011年无锡高二检测)已知[Pt(Cl)2(OH)2]有两种不同的结构,请推测[Pt(Cl)2(OH)2]的空间构型,并简述你的理由。
解析:[Pt(Cl)2(OH)2]配位数是4,可以形成四面体形或平面四方形两种空间构型,当[Pt(Cl)2(OH)2]以四面体形存在时没有同分异构体,以平面四方形存在时有两种同分异构体,所以它是平面四方形。
答案:[Pt(Cl2)(OH)2]是平面四方形结构。因为根据成键规则[Pt(Cl)2(OH)2]有两种合理结构,四面体形或平面四方形,但如果是四面体形则无同分异构体,所以它是平面四方形结构。
课堂互动讲练
配合物
1.概念:由可以提供孤电子对的配位体与接受孤电子对的中心原子以配位键结合形成的化合物。
配合物可以是中性分子,也可以是带电荷的离子。
2.中心原子
配合物的中心原子一般都是带正电的阳离子,过渡金属离子最常见,但也有电中性的原子甚至还有极少数的阴离子。
3.配位体
配位体可以是阴离子,如X-、SCN-、CN-等,也可以是中性分子,如H2O、NH3、CO等。
配位体中直接同中心原子配合的原子叫做配位原子。配位原子必须是含有孤电子对的原子,如NH3中的N原子,H2O分子中的O原子,配位原子常是VA族、ⅥA族、ⅦA族的元素。
4.配位数
直接同中心原子配位的原子数目叫中心原子的配位数。如[Fe(CN)6]4-中Fe2+的配位数为6。
5.中心原子与配位体构成了配合物的内界,通常把它们放在中括号内。内外界之间是离子键,在水中全部电离。
特别提醒:记住配合物结构,如:
例1
【解析】
K2[Co(NCS)4] Na2[SiF6] Na3[AlF6] [Cu(NH3)4]Cl2
配位体 NCS- F- F- NH3
配位数 4 6 6 4
【答案】 AD
答案:Cu2+有空轨道,NH3分子中氮原子的孤电子对进入Cu2+的空轨道,Cu2+与NH3分子中氮原子提供的孤电子对形成配位键,结合成 [Cu(NH3)4]2+。
配离子的空间结构
1.当配位体在中心原子周围配位时,为了减小配位体(尤其是阴离子配位体)之间的静电排斥作用(或成键电子对之间的斥力),以达到能量上的稳定状态,配位体要尽量互相远离,因而在中心原子周围采取对称分布的状态。表中列出了不同配位数的配合单元的空间结构。
配位数 配合单元的空间结构 实例
2 [Co(NH3)2]2+、[Ag(NH3)2]+、[Ag(CN)2]-
4 [ZnCl4]2-、[Cd(NH3)4]2+、[Cd(CN)4]2-、[CoCl4]-
[PtCl4]2-、[PdCl4]2-、[PtCl2(NH3)2]、[Ni(CN)4]2-
6 [Co(NH3)6]3+、[AlF6]3-、[SiF6]2-
注:图中“ ”代表中心原子,“·”代表配位体。
从表中看出,不仅配位数不同时,配离子的空间结构不同,即使配位数相同,由于中心离子和配位体的种类以及相互作用的情况不同,空间结构也可能不同。例如[ZnCl4]2-为四面体,[PtCl4]2-则为平面正方形。
2.配合物的结构
化学组成相同的配合物可以有不同的结构,这就是配合物的异构现象。如Pt(NH3)2Cl2有顺式和反式两种异构体:
(2011年新沂高二检测)已知[Co(NH3)6]3+的立体结构如图,其中数字处的小圆圈表示NH3分子,且各相邻的NH3分子间的距离相等,Co3+位于八面体的中心。若其中两个NH3被Cl-取代,所形成的[Co(NH3)4Cl2]+同分异构体的种数有( )
A.2种 B.3种
C.4种 D.5种
例2
【思路点拨】 配离子的构型由配位体的数目决定,考虑[Co(NH3)6]3+是完全对称的结构,其中两个NH3被Cl-取代生成[Co(NH3)4Cl2]+时,要考虑Cl-取代NH3的相对位置,确定其结构。
【解析】 [Co(NH3)6]3+中6个配位体NH3分子的位置完全相同,因此,任意取代两个相邻位置只有一种结构,任意取代两个不相邻的位置也只有一种结构,故其同分异构体只有两种。
【答案】 A
【规律方法】 配合物中由于配位体连接的位置和顺序不同,可能产生不同的空间结构,得到性质不同的配合物,因此,解答这类问题的关键是理解同分异构体的概念,准确把握概念的要点(分子式相同,结构不同),从概念入手进行分析判断,同时要借助几何知识进行合理的空间结构分析。
变式训练2 根据下表所示回答下列问题:
顺式、反式Pt(NH3)2Cl2的性质差异
配合物 颜色 极性 在水中的溶解性 抗癌活性
A 棕黄色 极性 0.2577 g/100 g H2O 有活性
B 淡黄色 非极性 0.0366 g/100 g H2O 无活性
(1)指出A、B各为哪种结构的Pt(NH3)2Cl2,写出相关的结构简式。
(2)哪一种结构的Pt(NH3)2Cl2易溶解于H2O,为什么?
(3)若为Pt(NH3)2Cl4且在H2O中溶解度较大,试写出其结构式。
解析:(1)根据分子极性可知A为顺式
(2)结构B对称,正负电荷中心重合,因此分子无极性,由相似相溶经验规律可知,它在极性分子中溶解度小,而A分子结构不对称,分子中正负电荷中心不能重合,分子有极性,所以水溶性大。
(3)Pt(NH3)2Cl4中Pt原子为八面体的中心,四个氯原子和两个氨分子在八面体六个顶点的位置上,可有以下两种:
结构c对称,分子无极性,
c d
在水中溶解度较小,结构d不对称,分子有极性,在水中溶解度较大,故d结构符合题意。
配合物的性质
1.配合物中,中心原子在配位体的影响下,其价层轨道进行杂化,配位原子的孤对电子进入中心原子的空轨道产生较强的作用,因而配合物有较强的稳定性。
2.(1)[Cu(NH3)4]SO4·H2O的制取:
(2)Fe3+的检验:
[生成了血红色的Fe(SCN)2+等]。
Fe3++SCN-===[Fe(SCN)]2+
例3
【解析】 在配合物中,内界以配位键结合很牢固,难以在溶液中电离;而内界和外界之间以离子键相结合,在溶液中能够完全电离。不难看出A、C、D三项中配合物在水中均电离产生Cl-,而B项无外界离子,不能电离。
【答案】 B
【规律方法】 作为配位体的Cl-不能电离。
变式训练3 现有两种配合物晶体[Co(NH3)6]Cl3和[Co(NH3)5Cl]Cl2,一种为橙黄色,另一种为紫红色。请设计实验方案将这两种配合物区别开来。
解析:在[Co(NH3)6]Cl3中Co3+与6个NH3分子配合成[Co(NH3)6]3+,3个Cl-都是外界离子。而[Co(NH3)5Cl]Cl2中Co3+与5个NH3分子和1个Cl-配合成[Co(NH3)5Cl]2+,只有两个Cl-是外界离子。由于配合物中内界以配位键结合很牢固,难以在溶液中电离,而内界和外界之间以离子键结合,在溶液中能够完全电离。
不难看出,相同质量的两种晶体在溶液中能够电离出的Cl-数是不同的,我们可以利用这一点进行鉴别。
答案:称取相同质量的两种晶体分别配成溶液,向两种溶液中分别滴加足量的AgNO3溶液,静置、过滤、干燥、称量,所得AgCl固体多的,原晶体为[Co(NH3)6]Cl3,另一种为[Co(NH3)5Cl]Cl2。
配合物的计算
配合物的计算主要是通过定量计算来确定配合物的配离子、中心原子和配位数。其主要手段是通过实验中沉淀的质量变化来做定量分析、推理。
(2011年浙江温州高二检测)有两种配合物A和B,它们的组成为21.95%的Co,39.61%的Cl,26.09%的N,6.39%的H,5.96%的O,且中心原子Co的配位数为6,试根据下面的实验结果确定它们的化学式及配离子。
探究整合应用
例
(1)A和B的水溶液都呈微酸性,加入强碱并加热至沸腾时,有氨放出,同时析出Co2O3沉淀。
(2)向A和B的溶液中加入硝酸银溶液时都生成AgCl沉淀。
(3)过滤除去两种溶液中的沉淀后,再加硝酸银均无变化,但加热至沸腾时,在B的溶液中又有AgCl沉淀生成,其质量为原来析出沉淀的一半。
由实验(3)可知:将沉淀过滤后,A再滴加AgNO3溶液,并加热至沸腾时无沉淀,说明Cl-全部在外界;而B再滴加AgNO3溶液,加热至沸腾后出现沉淀AgCl,且沉淀为原来的一半,证明B中有两个Cl-在外界,一个Cl-在内界,再结合配位数是6,可知两种化合物分别为:
A.[Co(NH3)5(H2O)]Cl3,
配离子:[Co(NH3)5(H2O)]3+;
B.[Co(NH3)5Cl]Cl2·H2O,配离子:[Co(NH3)5Cl]2+。
【答案】 A.[Co(NH3)5(H2O)]Cl3;
配离子:[Co(NH3)5(H2O)]3+;
B.[Co(NH3)5Cl]Cl2·H2O;
配离子:[Co(NH3)5Cl]2+。
知能优化训练
本部分内容讲解结束
点此进入课件目录
按ESC键退出全屏播放
谢谢使用
