【2012优化方案 精品课件】苏教版 化学 选修6专题3课题1 牙膏和火柴头中某些成分的检验(共68张PPT)
文档属性
| 名称 | 【2012优化方案 精品课件】苏教版 化学 选修6专题3课题1 牙膏和火柴头中某些成分的检验(共68张PPT) |  | |
| 格式 | rar | ||
| 文件大小 | 935.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2011-10-28 19:15:47 | ||
图片预览









文档简介
(共68张PPT)
课题1 牙膏和火柴头中某些成分的检验
学习目标
1.知道牙膏的主要成分及其功能。
2.理解检验牙膏中含有的碳酸钙、甘油的化学原理,学会检验的操作方法。
3.知道火柴头的主要化学成分及火柴起火的原理,理解检验火柴头中含有的硫元素、氯元素的化学原理,学会检验的操作方法。
4.通过实验,了解物质的检验过程,初步学会设计实验方案进行其他物质的检验。
课堂互动讲练
知能优化训练
课前自主学案
探究整合应用
课题1
课前自主学案
自主学习
一、实验原理
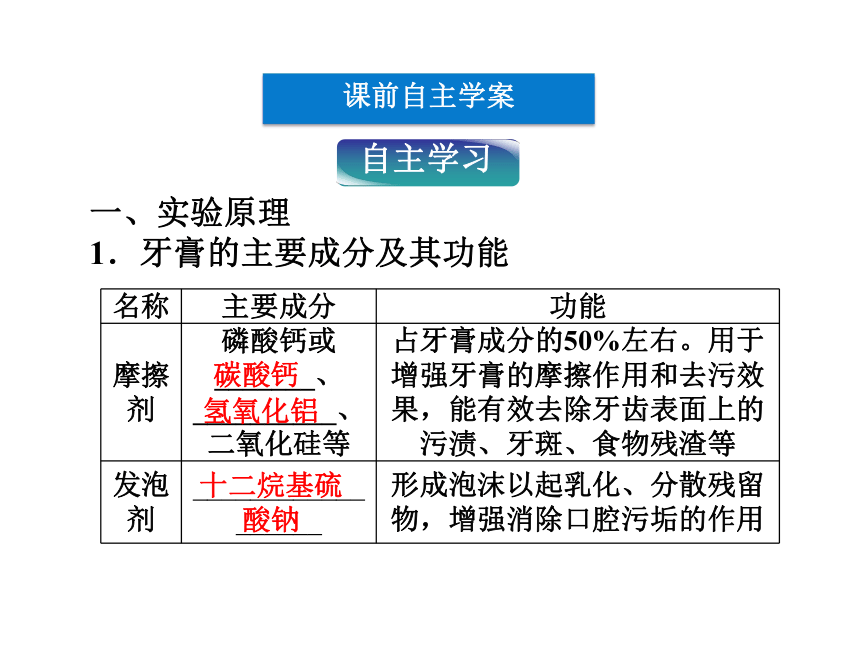
1.牙膏的主要成分及其功能
名称 主要成分 功能
摩擦剂 磷酸钙或_______、__________、二氧化硅等 占牙膏成分的50%左右。用于增强牙膏的摩擦作用和去污效果,能有效去除牙齿表面上的污渍、牙斑、食物残渣等
发泡剂 __________________ 形成泡沫以起乳化、分散残留物,增强消除口腔污垢的作用
碳酸钙
氢氧化铝
十二烷基硫酸钠
名称 主要成分 功能
保湿剂 _____和水 使牙膏保持湿润
增稠剂 角叉胶或羧甲基纤维素钠 防止牙膏分离出水分,同时使牙膏具有适宜的黏度,易于从牙膏管中挤出成型
防腐剂 ___________ 抵制牙膏中微生物的生长
增香剂甜味剂 香精、糖精 改善牙膏的口感
着色剂 二氧化钛、食用色素 使牙膏变白或呈现不同的颜色
氟化物 氟化钠或一氟磷酸钠 主要用于预防龋齿
甘油
安息香酸钠
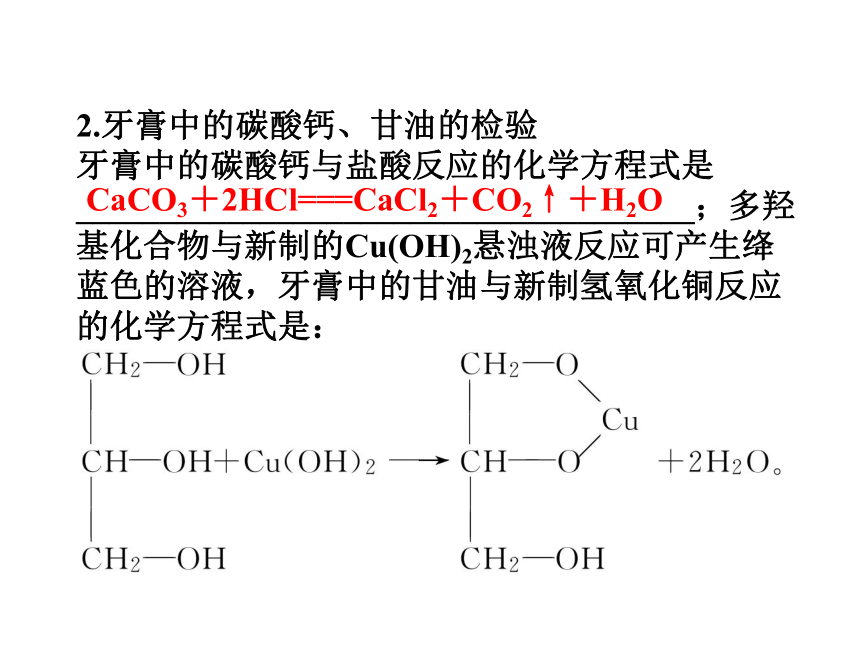
2.牙膏中的碳酸钙、甘油的检验
牙膏中的碳酸钙与盐酸反应的化学方程式是_____________________________________;多羟基化合物与新制的Cu(OH)2悬浊液反应可产生绛蓝色的溶液,牙膏中的甘油与新制氢氧化铜反应的化学方程式是:
CaCO3+2HCl===CaCl2+CO2↑+H2O
利用上述反应,可检验牙膏中碳酸钙和甘油的存在。
牙膏中的十二烷基硫酸钠、氟化钠等溶于水水解使溶液显___性。
碱
3.火柴起火的原理
安全火柴的火柴盒侧面涂有______ (发火剂)和Sb2S3(易燃物)等,火柴头上的物质一般是_______、MnO2等氧化剂和易燃物如___等。当两者摩擦时,因摩擦产生的热使与氯酸钾等接触的红磷燃烧,并引起火柴头上的易燃物燃烧,生成一定量的__________。
红磷
KClO3
硫
二氧化硫
思考感悟
(1)检验牙膏中的CaCO3时,能否用稀H2SO4代替稀盐酸?
(2)检验牙膏中的甘油时,应注意哪些问题?
【提示】 (1)不能。因为CaCO3和稀H2SO4反应生成微溶的CaSO4覆盖在CaCO3的表面,阻止反应继续进行,现象不明显。
(2)①氢氧化铜悬浊液要现用现配。②牙膏中甘油含量较少,新制Cu(OH)2悬浊液不宜加得太多,否则Cu(OH)2的颜色会对实验现象产生干扰。
二、实验步骤
1.牙膏中某些主要成分的检验
2.火柴头中硫元素、氯元素的检验
(1)检验火柴头燃烧后是否有二氧化硫气体生成
用稀_____________溶液检验火柴头燃烧时产生的气体中是否含有二氧化硫气体。
KMnO4酸性
方案1:取两只洁净的小烧杯,标记为甲、乙,在乙烧杯中加入10 mL 0.0005 mol·L-1浅红色KMnO4酸性溶液。将两根安全火柴伸入甲烧杯里,再用一根燃着的火柴点燃火柴头(如图所示),待火柴头烧完即将火柴移出,迅速将甲烧杯倒扣在乙烧杯上,轻轻振荡乙烧杯,可见烧杯中_____________________。
KMnO4酸性溶液褪色
方案2:用漏斗、试管、注射器、导管等组成如图所示的装置。将两根安全火柴放在漏斗下面,用一根燃着的火柴点燃火柴头,使火柴头燃烧。慢慢拉动注射器的活塞进行抽气,让火柴头燃烧产生的气体通过浅红色的0.0005 mol·L-1KMnO4酸性溶液。可见____________________。
KMnO4酸性溶液褪色
AgNO3溶液
稀硝酸
溶液中出现白色沉淀
NaNO2
白色沉淀
自主体验
1.(2011年徐州高二检测)牙膏中的摩擦剂主要是不溶于水的碳酸钙、磷酸钙、氢氧化铝、二氧化硅等。下表中关于摩擦剂所属物质类别的判断错误的是( )
A B C D
碳酸钙 磷酸钙 氢氧化铝 二氧化硅
强电解质 无机盐 两性氢氧化物 两性氧化物
解析:选D。SiO2是酸性氧化物而非两性氧化物。
答案:B
3.检验火柴头完全燃烧生成的气体中含有二氧化硫的最佳试剂是( )
A.澄清石灰水 B.品红溶液
C.双氧水 D.氯化钡溶液
解析:选B。能使澄清石灰水变浑浊的也可能是CO2,SO2不能与氯化钡溶液反应,SO2有还原性可以与H2O2反应,但没有明显现象,故也不能用于检验二氧化硫,SO2具有漂白性,能使品红溶液褪色,故可以用于检验。
课堂互动讲练
牙膏中某些主要成分的检验
(2011年无锡高二检测)如图是牙膏中某些主要成分检验流程图,请回答以下问题:
例1
(1)牙膏中的摩擦剂约占牙膏成分的50%,主要用于增强牙膏的摩擦作用和去污效果,不同种类的牙膏含有的摩擦剂有所不同,在上述流程图的第③步加入盐酸后会产生不同现象,请你填空:
摩擦剂 实验中出现的现象 解释
SiO2
CaCO3
Ca3(PO4)2 溶解无气体,加NaOH溶液至过量后又产生沉淀
Al(OH)3 溶解无气体,加NaOH溶液至过量先产生沉淀后溶解
请你写出上述方案中有关反应的化学方程式:
a.________________________________________________________________________,
b.________________________________________________________________________,
c.________________________________________________________________________。
(3)新制Cu(OH)2的配制方法是________________________________________________________________________。
牙膏中含有一定量的甘油,其主要功能是作保湿剂,在流程图的第②步得到的澄清溶液中加入新制Cu(OH)2,产生的现象是__________________________,化学方程式为____________________________________________________________。
(4)实验测定澄清溶液的pH>7,可能原因是________________________________________________________________________
________________________________________________________________________(用离子方程式表示)。
根据以上原理,请你提出一种其它促进矿化的方法:___________________________________
_____________________________________。
【解析】 本题以牙膏中主要成分的检验为背景,综合考查了摩擦剂SiO2、CaCO3、Ca3(PO4)2、Al(OH)3与盐酸反应的现象;CaCO3―→CaO―→Ca(OH)2―→CaCO3的转化;甘油的检验以及盐的水解、难溶电解质的溶解平衡等有关知识。
【答案】 (1)
摩擦剂 实验中出现的现象 解释
SiO2 无明显现象 SiO2不与盐酸反应
CaCO3 溶解,有气泡产生 CaCO3+2HCl=== CaCl2+CO2↑+H2O
Ca3(PO4)2 溶解无气体,加NaOH溶液至过量后又产生沉淀 Ca3(PO4)2+6HCl===3CaCl2+2H3PO4,
H3PO4+3NaOH=== Na3PO4+3H2O,
2Na3PO4+3CaCl2=== Ca3(PO4)2↓+6NaCl
Al(OH)3 溶解无气体,加NaOH溶液至过量先产生沉淀后溶解 Al(OH)3+3HCl=== AlCl3+3H2O,
AlCl3+3NaOH=== Al(OH)3↓+3NaCl,
Al(OH)3+NaOH===Na[Al(OH)4]
(4)F-+H2O?? HF+OH-
(5)进食后细菌和酶作用于食物,产生有机酸,使反应Ca5(PO4)3OH(s)?? 5Ca2++3PO3-4+OH-平衡向右移动,导致牙齿表面的保护物质破坏
Ca5(PO4)3OH+F-?? Ca5(PO4)3F+OH-
饮食中增加含Ca2+比较丰富的食物
变式训练1 (2011年高考福建卷)化学兴趣小组对某品牌牙膏中摩擦剂成分及其含量进行以下探究:
查得资料:该牙膏摩擦剂由碳酸钙、氢氧化铝组成;牙膏中其他成分遇到盐酸时无气体产生。
Ⅰ.摩擦剂中氢氧化铝的定性检验
取适量牙膏样品,加水充分搅拌、过滤。
(1)往滤渣中加入过量NaOH溶液,过滤。氢氧化铝与NaOH溶液反应的离子方程式是____________________。
(2)往(1)所得滤液中先通入过量二氧化碳,再加入过量稀盐酸。观察到的现象是____________________________。
Ⅱ.牙膏样品中碳酸钙的定量测定
利用下图所示装置(图中夹持仪器略去)进行实验,充分反应后,测定C中生成的BaCO3沉淀质量,以确定碳酸钙的质量分数。
依据实验过程回答下列问题:
(3)实验过程中需持续缓缓通入空气。其作用除了可搅拌B、C中的反应物外,还有:________________________________________________________________________。
(4)C中反应生成BaCO3的化学方程式是________________________________________________________________________
________________________________________________________________________。
(5)下列各项措施中,不能提高测定准确度的是________(填标号)。
a.在加入盐酸之前,应排净装置内的CO2气体
b.滴加盐酸不宜过快
c.在A~B之间增添盛有浓硫酸的洗气装置
d.在B~C之间增添盛有饱和碳酸氢钠溶液的洗气装置
(6)实验中准确称取8.00 g样品三份,进行三次测定,测得BaCO3平均质量为3.94 g。则样品中碳酸钙的质量分数为__________。
(7)有人认为不必测定C中生成的BaCO3质量,只要测定装置C在吸收CO2前后的质量差,一样可以确定碳酸钙的质量分数。实验证明按此方法测定的结果明显偏高,原因是
________________________________________________________________________
________________________________________________________________________。
Ⅱ.(3)从装置图分析可知,为保证实验的准确性,应将装置内的空气排尽,防止空气中CO2的干扰;同时要将反应产生的CO2尽可能全部被Ba(OH)2溶液吸收,因此需要持续通入吸收掉CO2后的空气。
(4)Ba(OH)2溶液足量,因此反应方程式为CO2+Ba(OH)2===BaCO3↓+H2O。
(5)由前面分析知,a可提高测定准确度;B装置中有酸碱指示剂,说明反应中盐酸的加入量是有限制的,为保证准确,滴加过程要慢,b不符合题意;B中装有溶液,因此气体通入前没必要干燥,c符合题意;在B~C之间连接盛有饱和NaHCO3溶液的洗气瓶会造成Ba(OH)2溶液还可能吸收由挥发出的氯化氢与NaHCO3反应生成的CO2气体,干扰实验,d符合题意。
火柴头中硫元素、氯元素的检验
实验一:取两只洁净的小烧杯,标记为甲、乙,在乙烧杯中加入10 mL 0.001 mol·L-1 KMnO4酸性溶液。将两根火柴伸入甲烧杯里,再用一根燃着的火柴点燃火柴头(如图所示),待火柴头燃尽,即将火柴移出,迅速将甲烧杯倒扣在乙烧杯上,轻轻振荡乙烧杯,观察实验现象。
例2
实验二:用漏斗、试管、注射器、导管等组成如图装置,将两根火柴放在漏斗下面,用一根燃着的火柴点燃火柴头,使火柴头燃烧。慢慢拉动注射器的活塞进行抽气,让火柴头燃烧产生的气体通过0.001 mol·L-1KMnO4酸性溶液,观察实验现象。
实验三:将燃尽的火柴头浸泡在少量水中,片刻后取少量溶液于试管中,滴加AgNO3溶液和稀硝酸,观察实验现象。
实验四:将3~4根火柴头摘下浸于水中,片刻后取少量溶液于试管中,加AgNO3溶液、稀硝酸和NaNO2溶液,观察实验现象。
问题1:安全火柴盒侧面涂有红磷(发火剂)和Sb2O3(易燃物)等,火柴头上的物质一般是________、________等氧化剂和________等易燃物。
问题2:实验一和实验二均可观察到的实验现象是
________________________________________________________________________,
请用化学方程式说明产生这种现象的原因________________________________________________________________________
________________________________________________________________________。
实验一设计的方案还利用了SO2的一种________性质。
问题3:写出以下反应的化学方程式。
(1)将SO2通入氯水中,浅黄绿色褪成无色________________________________________________________________________
________________________________________________________________________。
体现了SO2的________性。
(2)将SO2通入溴水中,红棕色褪为无色__________________________________________________________________________________
________________________________________________________________________。
体现了SO2的________性。
(3)将SO2通入无色的氢硫酸溶液,溶液变浑浊________________________________________________________,
体现了SO2的____________性。
问题4:实验三可观察到白色沉淀________产生,说明将燃尽的火柴头浸泡在少量水中,会有________物质被浸出,产生该物质的反应方程式为________________________________________
________________________________,
主要是把火柴头中含有的________转化为________。
问题5:实验四产生的白色沉淀为________,NaNO2的作用是________,反应的离子方程式为________________________________________________________________________。
【解析】 火柴头上的氯、硫元素存在的形式分别是KClO3和S单质。其中S燃烧生成SO2,利用SO2的还原性可以使KMnO4酸性溶液、氯水等褪色,利用SO2的氧化性可以与H2S反应生成S检验硫元素的存在。而氯元素,KClO3可以氧化NaNO2而本身被还原成Cl-,与Ag+结合生成白色沉淀AgCl。
变式训练2 (2011年金华高二检测)某兴趣小组为验证日常生活用的火柴头上含有KClO3、MnO2、S,设计了以下实验流程图:
请回答以下问题:
(1)为验证气体A,按右图所示
进行实验:若能观察到
________________________的
现象,即可证明火柴头上含有
硫元素;可用于替代试管中高
锰酸钾酸性溶液的试剂有________(填编号)。
A.品红溶液
B.饱和石灰水
C.稀溴水
D.烧碱溶液
(2)步骤②的实验操作装置如图所示,其中仪器A的名称是________,仪器B的名称是________,该操作的工作原理是
________________________________________________________________________。
有关的离子反应方程式为______________________,有人提出上述方法中出现白色沉淀并不能充分说明火柴头上KClO3的存在,其理由是
________________________________________________________________________。
(5)写出步骤①中发生反应的化学方程式
________________________________________________________________________。
解析:A气体为SO2,可用高锰酸钾酸性溶液检验,也可用溴水或品红溶液检验,但不可用Ca(OH)2溶液,因为CO2具有同样的现象。氯元素的检验可利用AgNO3溶液加稀HNO3,但要注意AgNO2也为白色沉淀。
探究整合应用
(2)抽气测定——每次抽50 mL待测气体
例
②准确量取2 mL 1×10-4 mol·L-1KMnO4溶液,注入试管中,加入1滴6 mol· L-1H2SO4溶液,按如图所示组装好装置,置于待测地点,缓慢抽气,每次抽气50 mL。记录抽气次数,计算实验结果。
请回答:
(1)取出1 mL此溶液后,稀释至100 mL时,还需要用到的定量仪器是________。
(2)不直接配制1×10-4 mol·L-1KMnO4溶液的原因是______________________________________
__________________________________。
不使用1×10-2 mol·L-1KMnO4溶液的原因是
________________________________________________________________________。
(3)判断实验达到终点时的现象是_________________。
(4)抽气速度太快,对实验结果的影响是________(填“偏大”、“偏小”或“无影响”)。
(5)若某同学三次实验的结果是平均抽气次数为20次,设实验时处于标准状况,通过计算说明,该室内的空气中甲醛的浓度是否超标?
【解析】 本实验是一个定量实验,为了减小实验误差,应注意以下几方面:
①配制KMnO4酸性溶液时,浓度不能太小,避免称量误差太大;同时为了避免实验的繁琐,KMnO4酸性溶液的浓度也不能太大。
②用KMnO4酸性溶液吸收甲醛时,抽气速度不能太快,避免吸收不完全。
③做三次平行实验,结果取平均值,以减小实验误差。
【答案】 (1)100 mL容量瓶
(2)直接配制1×10-4 mol·L-1 KMnO4溶液时,称量的KMnO4的质量太小,称量不方便,误差较大 若使用1×10-2 mol·L-1 KMnO4溶液,抽气次数多,操作繁琐
(3)溶液由浅红色刚好变为无色
(4)偏小
(5)7.5 mg/m3,超标
知能优化训练
本部分内容讲解结束
点此进入课件目录
按ESC键退出全屏播放
谢谢使用
课题1 牙膏和火柴头中某些成分的检验
学习目标
1.知道牙膏的主要成分及其功能。
2.理解检验牙膏中含有的碳酸钙、甘油的化学原理,学会检验的操作方法。
3.知道火柴头的主要化学成分及火柴起火的原理,理解检验火柴头中含有的硫元素、氯元素的化学原理,学会检验的操作方法。
4.通过实验,了解物质的检验过程,初步学会设计实验方案进行其他物质的检验。
课堂互动讲练
知能优化训练
课前自主学案
探究整合应用
课题1
课前自主学案
自主学习
一、实验原理
1.牙膏的主要成分及其功能
名称 主要成分 功能
摩擦剂 磷酸钙或_______、__________、二氧化硅等 占牙膏成分的50%左右。用于增强牙膏的摩擦作用和去污效果,能有效去除牙齿表面上的污渍、牙斑、食物残渣等
发泡剂 __________________ 形成泡沫以起乳化、分散残留物,增强消除口腔污垢的作用
碳酸钙
氢氧化铝
十二烷基硫酸钠
名称 主要成分 功能
保湿剂 _____和水 使牙膏保持湿润
增稠剂 角叉胶或羧甲基纤维素钠 防止牙膏分离出水分,同时使牙膏具有适宜的黏度,易于从牙膏管中挤出成型
防腐剂 ___________ 抵制牙膏中微生物的生长
增香剂甜味剂 香精、糖精 改善牙膏的口感
着色剂 二氧化钛、食用色素 使牙膏变白或呈现不同的颜色
氟化物 氟化钠或一氟磷酸钠 主要用于预防龋齿
甘油
安息香酸钠
2.牙膏中的碳酸钙、甘油的检验
牙膏中的碳酸钙与盐酸反应的化学方程式是_____________________________________;多羟基化合物与新制的Cu(OH)2悬浊液反应可产生绛蓝色的溶液,牙膏中的甘油与新制氢氧化铜反应的化学方程式是:
CaCO3+2HCl===CaCl2+CO2↑+H2O
利用上述反应,可检验牙膏中碳酸钙和甘油的存在。
牙膏中的十二烷基硫酸钠、氟化钠等溶于水水解使溶液显___性。
碱
3.火柴起火的原理
安全火柴的火柴盒侧面涂有______ (发火剂)和Sb2S3(易燃物)等,火柴头上的物质一般是_______、MnO2等氧化剂和易燃物如___等。当两者摩擦时,因摩擦产生的热使与氯酸钾等接触的红磷燃烧,并引起火柴头上的易燃物燃烧,生成一定量的__________。
红磷
KClO3
硫
二氧化硫
思考感悟
(1)检验牙膏中的CaCO3时,能否用稀H2SO4代替稀盐酸?
(2)检验牙膏中的甘油时,应注意哪些问题?
【提示】 (1)不能。因为CaCO3和稀H2SO4反应生成微溶的CaSO4覆盖在CaCO3的表面,阻止反应继续进行,现象不明显。
(2)①氢氧化铜悬浊液要现用现配。②牙膏中甘油含量较少,新制Cu(OH)2悬浊液不宜加得太多,否则Cu(OH)2的颜色会对实验现象产生干扰。
二、实验步骤
1.牙膏中某些主要成分的检验
2.火柴头中硫元素、氯元素的检验
(1)检验火柴头燃烧后是否有二氧化硫气体生成
用稀_____________溶液检验火柴头燃烧时产生的气体中是否含有二氧化硫气体。
KMnO4酸性
方案1:取两只洁净的小烧杯,标记为甲、乙,在乙烧杯中加入10 mL 0.0005 mol·L-1浅红色KMnO4酸性溶液。将两根安全火柴伸入甲烧杯里,再用一根燃着的火柴点燃火柴头(如图所示),待火柴头烧完即将火柴移出,迅速将甲烧杯倒扣在乙烧杯上,轻轻振荡乙烧杯,可见烧杯中_____________________。
KMnO4酸性溶液褪色
方案2:用漏斗、试管、注射器、导管等组成如图所示的装置。将两根安全火柴放在漏斗下面,用一根燃着的火柴点燃火柴头,使火柴头燃烧。慢慢拉动注射器的活塞进行抽气,让火柴头燃烧产生的气体通过浅红色的0.0005 mol·L-1KMnO4酸性溶液。可见____________________。
KMnO4酸性溶液褪色
AgNO3溶液
稀硝酸
溶液中出现白色沉淀
NaNO2
白色沉淀
自主体验
1.(2011年徐州高二检测)牙膏中的摩擦剂主要是不溶于水的碳酸钙、磷酸钙、氢氧化铝、二氧化硅等。下表中关于摩擦剂所属物质类别的判断错误的是( )
A B C D
碳酸钙 磷酸钙 氢氧化铝 二氧化硅
强电解质 无机盐 两性氢氧化物 两性氧化物
解析:选D。SiO2是酸性氧化物而非两性氧化物。
答案:B
3.检验火柴头完全燃烧生成的气体中含有二氧化硫的最佳试剂是( )
A.澄清石灰水 B.品红溶液
C.双氧水 D.氯化钡溶液
解析:选B。能使澄清石灰水变浑浊的也可能是CO2,SO2不能与氯化钡溶液反应,SO2有还原性可以与H2O2反应,但没有明显现象,故也不能用于检验二氧化硫,SO2具有漂白性,能使品红溶液褪色,故可以用于检验。
课堂互动讲练
牙膏中某些主要成分的检验
(2011年无锡高二检测)如图是牙膏中某些主要成分检验流程图,请回答以下问题:
例1
(1)牙膏中的摩擦剂约占牙膏成分的50%,主要用于增强牙膏的摩擦作用和去污效果,不同种类的牙膏含有的摩擦剂有所不同,在上述流程图的第③步加入盐酸后会产生不同现象,请你填空:
摩擦剂 实验中出现的现象 解释
SiO2
CaCO3
Ca3(PO4)2 溶解无气体,加NaOH溶液至过量后又产生沉淀
Al(OH)3 溶解无气体,加NaOH溶液至过量先产生沉淀后溶解
请你写出上述方案中有关反应的化学方程式:
a.________________________________________________________________________,
b.________________________________________________________________________,
c.________________________________________________________________________。
(3)新制Cu(OH)2的配制方法是________________________________________________________________________。
牙膏中含有一定量的甘油,其主要功能是作保湿剂,在流程图的第②步得到的澄清溶液中加入新制Cu(OH)2,产生的现象是__________________________,化学方程式为____________________________________________________________。
(4)实验测定澄清溶液的pH>7,可能原因是________________________________________________________________________
________________________________________________________________________(用离子方程式表示)。
根据以上原理,请你提出一种其它促进矿化的方法:___________________________________
_____________________________________。
【解析】 本题以牙膏中主要成分的检验为背景,综合考查了摩擦剂SiO2、CaCO3、Ca3(PO4)2、Al(OH)3与盐酸反应的现象;CaCO3―→CaO―→Ca(OH)2―→CaCO3的转化;甘油的检验以及盐的水解、难溶电解质的溶解平衡等有关知识。
【答案】 (1)
摩擦剂 实验中出现的现象 解释
SiO2 无明显现象 SiO2不与盐酸反应
CaCO3 溶解,有气泡产生 CaCO3+2HCl=== CaCl2+CO2↑+H2O
Ca3(PO4)2 溶解无气体,加NaOH溶液至过量后又产生沉淀 Ca3(PO4)2+6HCl===3CaCl2+2H3PO4,
H3PO4+3NaOH=== Na3PO4+3H2O,
2Na3PO4+3CaCl2=== Ca3(PO4)2↓+6NaCl
Al(OH)3 溶解无气体,加NaOH溶液至过量先产生沉淀后溶解 Al(OH)3+3HCl=== AlCl3+3H2O,
AlCl3+3NaOH=== Al(OH)3↓+3NaCl,
Al(OH)3+NaOH===Na[Al(OH)4]
(4)F-+H2O?? HF+OH-
(5)进食后细菌和酶作用于食物,产生有机酸,使反应Ca5(PO4)3OH(s)?? 5Ca2++3PO3-4+OH-平衡向右移动,导致牙齿表面的保护物质破坏
Ca5(PO4)3OH+F-?? Ca5(PO4)3F+OH-
饮食中增加含Ca2+比较丰富的食物
变式训练1 (2011年高考福建卷)化学兴趣小组对某品牌牙膏中摩擦剂成分及其含量进行以下探究:
查得资料:该牙膏摩擦剂由碳酸钙、氢氧化铝组成;牙膏中其他成分遇到盐酸时无气体产生。
Ⅰ.摩擦剂中氢氧化铝的定性检验
取适量牙膏样品,加水充分搅拌、过滤。
(1)往滤渣中加入过量NaOH溶液,过滤。氢氧化铝与NaOH溶液反应的离子方程式是____________________。
(2)往(1)所得滤液中先通入过量二氧化碳,再加入过量稀盐酸。观察到的现象是____________________________。
Ⅱ.牙膏样品中碳酸钙的定量测定
利用下图所示装置(图中夹持仪器略去)进行实验,充分反应后,测定C中生成的BaCO3沉淀质量,以确定碳酸钙的质量分数。
依据实验过程回答下列问题:
(3)实验过程中需持续缓缓通入空气。其作用除了可搅拌B、C中的反应物外,还有:________________________________________________________________________。
(4)C中反应生成BaCO3的化学方程式是________________________________________________________________________
________________________________________________________________________。
(5)下列各项措施中,不能提高测定准确度的是________(填标号)。
a.在加入盐酸之前,应排净装置内的CO2气体
b.滴加盐酸不宜过快
c.在A~B之间增添盛有浓硫酸的洗气装置
d.在B~C之间增添盛有饱和碳酸氢钠溶液的洗气装置
(6)实验中准确称取8.00 g样品三份,进行三次测定,测得BaCO3平均质量为3.94 g。则样品中碳酸钙的质量分数为__________。
(7)有人认为不必测定C中生成的BaCO3质量,只要测定装置C在吸收CO2前后的质量差,一样可以确定碳酸钙的质量分数。实验证明按此方法测定的结果明显偏高,原因是
________________________________________________________________________
________________________________________________________________________。
Ⅱ.(3)从装置图分析可知,为保证实验的准确性,应将装置内的空气排尽,防止空气中CO2的干扰;同时要将反应产生的CO2尽可能全部被Ba(OH)2溶液吸收,因此需要持续通入吸收掉CO2后的空气。
(4)Ba(OH)2溶液足量,因此反应方程式为CO2+Ba(OH)2===BaCO3↓+H2O。
(5)由前面分析知,a可提高测定准确度;B装置中有酸碱指示剂,说明反应中盐酸的加入量是有限制的,为保证准确,滴加过程要慢,b不符合题意;B中装有溶液,因此气体通入前没必要干燥,c符合题意;在B~C之间连接盛有饱和NaHCO3溶液的洗气瓶会造成Ba(OH)2溶液还可能吸收由挥发出的氯化氢与NaHCO3反应生成的CO2气体,干扰实验,d符合题意。
火柴头中硫元素、氯元素的检验
实验一:取两只洁净的小烧杯,标记为甲、乙,在乙烧杯中加入10 mL 0.001 mol·L-1 KMnO4酸性溶液。将两根火柴伸入甲烧杯里,再用一根燃着的火柴点燃火柴头(如图所示),待火柴头燃尽,即将火柴移出,迅速将甲烧杯倒扣在乙烧杯上,轻轻振荡乙烧杯,观察实验现象。
例2
实验二:用漏斗、试管、注射器、导管等组成如图装置,将两根火柴放在漏斗下面,用一根燃着的火柴点燃火柴头,使火柴头燃烧。慢慢拉动注射器的活塞进行抽气,让火柴头燃烧产生的气体通过0.001 mol·L-1KMnO4酸性溶液,观察实验现象。
实验三:将燃尽的火柴头浸泡在少量水中,片刻后取少量溶液于试管中,滴加AgNO3溶液和稀硝酸,观察实验现象。
实验四:将3~4根火柴头摘下浸于水中,片刻后取少量溶液于试管中,加AgNO3溶液、稀硝酸和NaNO2溶液,观察实验现象。
问题1:安全火柴盒侧面涂有红磷(发火剂)和Sb2O3(易燃物)等,火柴头上的物质一般是________、________等氧化剂和________等易燃物。
问题2:实验一和实验二均可观察到的实验现象是
________________________________________________________________________,
请用化学方程式说明产生这种现象的原因________________________________________________________________________
________________________________________________________________________。
实验一设计的方案还利用了SO2的一种________性质。
问题3:写出以下反应的化学方程式。
(1)将SO2通入氯水中,浅黄绿色褪成无色________________________________________________________________________
________________________________________________________________________。
体现了SO2的________性。
(2)将SO2通入溴水中,红棕色褪为无色__________________________________________________________________________________
________________________________________________________________________。
体现了SO2的________性。
(3)将SO2通入无色的氢硫酸溶液,溶液变浑浊________________________________________________________,
体现了SO2的____________性。
问题4:实验三可观察到白色沉淀________产生,说明将燃尽的火柴头浸泡在少量水中,会有________物质被浸出,产生该物质的反应方程式为________________________________________
________________________________,
主要是把火柴头中含有的________转化为________。
问题5:实验四产生的白色沉淀为________,NaNO2的作用是________,反应的离子方程式为________________________________________________________________________。
【解析】 火柴头上的氯、硫元素存在的形式分别是KClO3和S单质。其中S燃烧生成SO2,利用SO2的还原性可以使KMnO4酸性溶液、氯水等褪色,利用SO2的氧化性可以与H2S反应生成S检验硫元素的存在。而氯元素,KClO3可以氧化NaNO2而本身被还原成Cl-,与Ag+结合生成白色沉淀AgCl。
变式训练2 (2011年金华高二检测)某兴趣小组为验证日常生活用的火柴头上含有KClO3、MnO2、S,设计了以下实验流程图:
请回答以下问题:
(1)为验证气体A,按右图所示
进行实验:若能观察到
________________________的
现象,即可证明火柴头上含有
硫元素;可用于替代试管中高
锰酸钾酸性溶液的试剂有________(填编号)。
A.品红溶液
B.饱和石灰水
C.稀溴水
D.烧碱溶液
(2)步骤②的实验操作装置如图所示,其中仪器A的名称是________,仪器B的名称是________,该操作的工作原理是
________________________________________________________________________。
有关的离子反应方程式为______________________,有人提出上述方法中出现白色沉淀并不能充分说明火柴头上KClO3的存在,其理由是
________________________________________________________________________。
(5)写出步骤①中发生反应的化学方程式
________________________________________________________________________。
解析:A气体为SO2,可用高锰酸钾酸性溶液检验,也可用溴水或品红溶液检验,但不可用Ca(OH)2溶液,因为CO2具有同样的现象。氯元素的检验可利用AgNO3溶液加稀HNO3,但要注意AgNO2也为白色沉淀。
探究整合应用
(2)抽气测定——每次抽50 mL待测气体
例
②准确量取2 mL 1×10-4 mol·L-1KMnO4溶液,注入试管中,加入1滴6 mol· L-1H2SO4溶液,按如图所示组装好装置,置于待测地点,缓慢抽气,每次抽气50 mL。记录抽气次数,计算实验结果。
请回答:
(1)取出1 mL此溶液后,稀释至100 mL时,还需要用到的定量仪器是________。
(2)不直接配制1×10-4 mol·L-1KMnO4溶液的原因是______________________________________
__________________________________。
不使用1×10-2 mol·L-1KMnO4溶液的原因是
________________________________________________________________________。
(3)判断实验达到终点时的现象是_________________。
(4)抽气速度太快,对实验结果的影响是________(填“偏大”、“偏小”或“无影响”)。
(5)若某同学三次实验的结果是平均抽气次数为20次,设实验时处于标准状况,通过计算说明,该室内的空气中甲醛的浓度是否超标?
【解析】 本实验是一个定量实验,为了减小实验误差,应注意以下几方面:
①配制KMnO4酸性溶液时,浓度不能太小,避免称量误差太大;同时为了避免实验的繁琐,KMnO4酸性溶液的浓度也不能太大。
②用KMnO4酸性溶液吸收甲醛时,抽气速度不能太快,避免吸收不完全。
③做三次平行实验,结果取平均值,以减小实验误差。
【答案】 (1)100 mL容量瓶
(2)直接配制1×10-4 mol·L-1 KMnO4溶液时,称量的KMnO4的质量太小,称量不方便,误差较大 若使用1×10-2 mol·L-1 KMnO4溶液,抽气次数多,操作繁琐
(3)溶液由浅红色刚好变为无色
(4)偏小
(5)7.5 mg/m3,超标
知能优化训练
本部分内容讲解结束
点此进入课件目录
按ESC键退出全屏播放
谢谢使用
同课章节目录
- 专题一 物质的分离与提纯
- 课题1 海带中碘元素的分离及检验
- 拓展课题1-1 茶叶中某些元素的鉴定
- 课题2 用纸层析法分离铁离子和铜离子
- 拓展课题1-2 菠菜的叶绿体中色素的提取和分离
- 拓展课题1-3 用粉笔进行层析分离
- 课题3 硝酸钾晶体的制备
- 拓展课题1-4 粗盐提纯
- 专题二 物质性质的研究
- 课题1 铝及其化合物的性质
- 拓展课题2-1 铝热反应
- 课题2 乙醇和苯酚的性质
- 拓展课题2-2 苯酚与甲醛的反应
- 专题三 物质的检验与鉴别
- 课题1 牙膏和火柴中某些成分的检验
- 拓展课题3-1 新装修居室内空气中甲醛浓度的检测
- 拓展课题3-2 汽车尾气成分的检验
- 课题2 亚硝酸钠和食盐的鉴别
- 拓展课题3-3 真假碘盐的鉴别
- 专题四 化学反应条件的控制
- 课题1 硫代硫酸钠与酸反应速率的影响因素
- 拓展课题4-1 “蓝瓶子”实验
- 课题2 催化剂对过氧化氢分解反应速率的影响
- 拓展课题4-2 过氧化氢酶的催化作用
- 拓展课题4-3 蔗糖的燃烧
- 课题3 反应条件对化学平衡的影响
- 拓展课题4-4 淀粉与碘显色现象的探究
- 拓展课题4-5 压强对化学平衡的影响
- 专题五 电化学问题研究
- 课题1 原电池
- 拓展课题5-1 干电池模拟实验
- 课题2 电解与电镀
- 拓展课题5-2 阿伏加德罗常数的测定
- 专题六 物质的定量分析
- 课题1 食醋总酸含量的测定
- 拓展课题6-1 配制并标定氢氧化钠溶液
- 课题2 镀锌铁皮锌镀层厚度的测定
- 拓展课题6-2 水果中维生素C含量的测定
- 专题七 物质的制备与合成
- 课题1 硫酸亚铁铵的制备
- 拓展课题7-1 用制氢废液制备硫酸锌晶体
- 课题2 阿司匹林的合成
- 拓展课题7-2 对氨基苯磺酸的合成
