【2012优化方案 精品课件】苏教版 化学 选修6专题3课题2 亚硝酸钠和食盐的鉴别(共57张PPT)
文档属性
| 名称 | 【2012优化方案 精品课件】苏教版 化学 选修6专题3课题2 亚硝酸钠和食盐的鉴别(共57张PPT) |  | |
| 格式 | rar | ||
| 文件大小 | 911.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2011-10-28 19:15:47 | ||
图片预览









文档简介
(共57张PPT)
课题2 亚硝酸钠和食盐的鉴别
学习目标
1.认识亚硝酸钠的物理性质(外观)和重要的化学性质(氧化性和还原性)。
2.认识亚硝酸的酸性和不稳定性;通过对亚硝酸钠和食盐性质的认识,设计实验方案进行两者的鉴别。
3.通过对已知物质中所含离子的检验,学会物质检验实验方案的设计原理和方法,体验观察和分析实验现象在化学实验中的重要作用。
课堂互动讲练
知能优化训练
课前自主学案
探究整合应用
课题2
课前自主学案
自主学习
一、实验原理
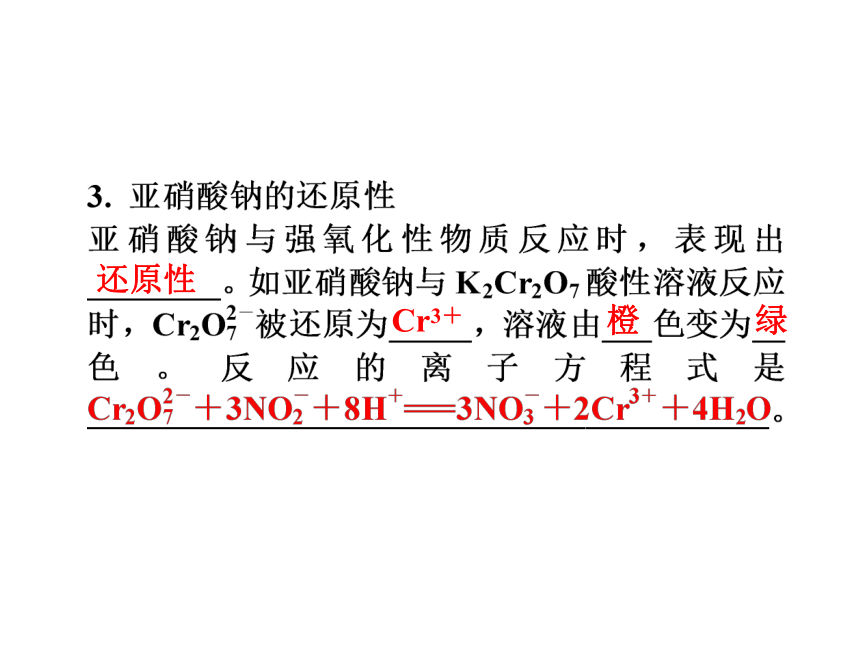
1.亚硝酸的生成及其不稳定性
向NaNO2溶液中加酸,生成亚硝酸(HNO2)。亚硝酸________,仅存在于冷的稀溶液中,微热甚至常温下也会分解,产生_____色的二氧化氮气体。反应的化学方程式是__________________________________、______________________________。
不稳定
红棕
NaNO2+H2SO4===NaHSO4+HNO2
2HNO2===NO↑+NO2↑+H2O
+3
棕黄
还原性
Cr3+
橙
绿
可
白
碱
二、实验步骤
在设计实验方案时,要注意选择试剂______、现象______、操作______且安全的反应,在检验过程中最好不要产生对环境有污染的物质。根据食盐和亚硝酸钠的性质以及实验条件,设计鉴别食盐和亚硝酸钠的多种实验方案如下:
易得
明显
简便
实验方案 加入试剂 实验操作要点 主要实验现象
方案1 AgNO3溶液和稀硝酸 在两支试管中分别加入0.1 mol·L-1亚硝酸钠和氯化钠溶液,并向其中滴加几滴0.1 mol·L-1硝酸银溶液 两支试管中均产生__________;再向试管中滴加几滴 2 mol·L-1硝酸并振荡,一支试管中的沉淀溶解,为盛有________溶液的试管;另一支试管中沉淀不消失,为盛有_____溶液的试管
方案2 1%酚酞溶液 分别往0.1 mol·L-1未知(亚硝酸钠或氯化钠)溶液中加入几滴1%酚酞溶液 溶液颜色变为浅红色的为_________溶液
方案3 2 mol ·L-1硫酸溶液 分别取1~2 g两种晶体于小试管中,加1~2 mL水溶解。趁此低温条件,沿试管壁逐滴滴加2 mol·L-1硫酸 试管内液面上方有红棕色气体产生,且能嗅到刺激性气味的是_________。氯化钠晶体则不会产生此现象
白色沉淀
NaNO2
NaCl
NaNO2
NaNO2
实验方案 加入试剂 实验操作要点 主要实验现象
方案4 0.001 mol·L-1 KMnO4溶液 在两支试管中均加入0.001 mol·L-1KMnO4溶液和2滴2 mol·L-1的硫酸溶液,再在两支试管中分别滴加0.1 mol·L-1亚硝酸钠和氯化钠溶液,摇匀 使KMnO4溶液浅红色褪去的试管,加入的是________溶液
方案5 0.1 mol·L-1KI 淀粉溶液 分别取1 mL 0.1 mol·L-1亚硝酸钠溶液和氯化钠溶液于两支试管中,向试管中加入0.5 mL 0.1 mol·L-1碘化钾溶液,观察溶液颜色变化。再滴加2滴2 mol·L-1硫酸和2滴2%淀粉溶液,观察溶液颜色变化 加入0.5 mL 0.1 mol·L-1碘化钾溶液,溶液由无色变成___色或更深;再滴加2滴2 mol·L-1硫酸和2滴2%淀粉溶液,溶液由___色变为___色,此为NaNO2溶液;氯化钠溶液始终没有明显现象
NaNO2
黄
黄
蓝
实验方案 加入试剂 实验操作要点 主要实验现象
方案6 加入(NH4)2Fe(SO4)2溶液 在两支试管中均加入1 mL 0.1 mol·L-1硫酸亚铁铵溶液,溶液呈淡绿色;分别滴加 0.1 mol·L-1亚硝酸钠和氯化钠溶液,摇匀 若加入前后无明显现象,则加入的是_____溶液。溶液颜色由淡绿色变为_____色,则加入的为________溶液
方案7 pH试纸 分别用pH试纸测定0.1 mol·L-1两种未知(亚硝酸钠或氯化钠)溶液的pH 一种溶液的pH为7,为_____溶液;另一种溶液的pH为8~9,为_______溶液
NaCl
棕黄
NaNO2
NaCl
NaNO2
思考感悟
如何鉴别下列两组物质?写出流程图。
(1)Na2CO3、NaCl、Na2SO4、NaNO2。
(2)NaNO2、NaCl、NaNO3。
【提示】
(1)
(2)
自主体验
1.(2011年莆田高二检测)小明学习化学后,在家里想用化学方法来鉴别碱面(主要成分是碳酸钠)和食盐,你认为下列方法可行的是( )
A.观察它们的颜色
B.分别倒入水中观察是否溶解
C.取少量分别倒入食醋
D分别取少量加热
2.只能用焰色反应实验区分的是( )
A.钠和锌 B.KCl和K2CO3
C.NaCl和Na2CO3 D.KCl和NaCl
解析:选D。KCl与NaCl的阴离子均为Cl-,只能鉴别K+、Na+,在中学阶段应使用焰色反应区分。
解析:选C。亚硝酸钠也是一种食品添加剂,但是需要严格控制用量。
课堂互动讲练
亚硝酸钠、氯化钠的鉴别
例1
(2)写出上述所有反应的离子方程式。
方案1:____________________________________
____________________________________;
方案2:_____________________________________
___________________________________;
方案3:_____________________________________
___________________________________;
方案4:_____________________________________
___________________________________;
方案5:_____________________________________
___________________________________。
(5)人体血红蛋白中含有Fe2+离子,如果误食亚硝酸盐,会使人中毒,因为亚硝酸盐会使Fe2+离子转变成Fe3+离子,生成高铁血红蛋白而丧失与O2结合的能力。服用维生素C可缓解亚硝酸盐的中毒,这说明维生素C具有________。
A.酸性 B.碱性
C.氧化性 D.还原性
【解析】 (1)结合题给信息,①②③④⑤可以设计出五种鉴别方案。
(2)离子方程式的书写(见答案)。
(3)因为HNO2是一种弱酸,故NaNO2溶液水解显碱性,可以用pH试纸鉴别。
(4)根据框图中的信息可以设计溶解吸热的方案鉴别NaNO2和NaCl。
(5)由亚硝酸盐会使Fe2+转变为Fe3+,说明亚硝酸盐的氧化性较强,从而说明了维生素C具有还原性。
【答案】 (1)
变式训练1 亚硝酸钠俗称“工业盐”,有很强的毒性,因外观与口感与食盐相似,而常常被误用、误食,为了区分亚硝酸钠与食盐,某研究性小组通过查阅资料后得知:亚硝酸钠具有强氧化性,可与硝酸银溶液反应产生沉淀,亚硝酸是一种弱酸,不稳定,易分解为两种气体,据此设计了如下方案:①分别向盛有两种溶液的试管中加入稀硫酸,试管中有红棕色气体产生的为亚硝酸钠;
②用洁净的玻璃棒分别蘸取两种无色溶液滴在淀粉碘化钾试纸上,出现蓝色的是亚硝酸钠;③向两支盛有硫酸亚铁溶液的试管中分别加入两种物质,溶液变棕黄色的是亚硝酸钠;④分别向盛有两种溶液的试管中加入硝酸银,有白色沉淀产生的是氯化钠,另一支试管内是亚硝酸钠。其中能够区分亚硝酸钠与食盐的操作及结论正确的是( )
A.①②③④ B.①②④
C.①②③ D.①③④
解析:选C。亚硝酸钠可与硝酸银溶液反应产生沉淀即不能利用硝酸银溶液来区别亚硝酸钠和氯化钠,所以操作④错误。
物质的鉴别
1.含义
通常是指对两种或两种以上的物质进行定性辨认,可根据一种物质的特性区别于另一种物质,也可根据几种物质的气味、溶解性、溶解时的热效应等性质的不同加以区别。
2.基本思路
(1)利用阳离子的特性:
(2)利用阴离子的特性
3.一般原则
(1)若有n种物质需鉴别,一般检验出n-1种物质即可。
(2)方法或试剂选择得越简单越好,条件越简单越好,实验现象越明显、越典型越好。
(3)若无限定要求,一般首先考虑用物理方法,当物理方法无法鉴别时,再考虑用化学方法。
(4)用物理方法鉴别的步骤:
观察法―→嗅试法―→水溶法
(5)用化学方法鉴别的步骤:
固体:加热法―→水溶法―→指示剂测试法―→指定试剂法
液体:指示剂测试法―→指定试剂法
气体:点燃法―→通入指定试剂法
(6)在检验过程中最好不要产生对环境有污染的物质。
例2
③向D溶液中滴加Ba(NO3)2溶液,无明显现象;
④向F溶液中滴加氨水,生成白色絮状沉淀,沉淀迅速变成灰绿色,最后变成红褐色。
根据上述实验现象,回答下列问题:
(1)实验②中反应的化学方程式是________________________________________________________________________;
(2)E溶液是________,判断依据是__________________
________________________________________________________________________;
(3)写出下列四种化合物的化学式:
A____________________、
C____________________、
D____________________、F____________________。
【解析】
【答案】 (1)AgNO3+NH3·H2O===AgOH↓+NH4NO3,
AgOH+2NH3·H2O===Ag(NH3)2OH+2H2O
(2)碳酸钾 由①中碱性强弱的顺序可知,E是碳酸盐。六种阳离子中可以与碳酸根形成可溶性盐的只有钾离子,所以E是碳酸钾
(3)Ba(OH)2 (CH3COO)2Ca AlCl3 FeSO4
【规律方法】 物质的鉴别技巧
(1)若被鉴别的溶液酸碱性不同,可选用适当的指示剂或pH试纸,如鉴别(NH4)2SO4、K2CO3、Na2SO4三种溶液,可选用pH试纸。
(2)若几种溶液中含有不同的阳离子,可选用强碱(NaOH、KOH)等与之反应,如鉴别K2SO4、(NH4)2SO4、Fe2(SO4)3、Al2(SO4)3、CuSO4溶液等。
(3)若几种溶液中含有不同的阴离子,可选用强酸(盐酸、H2SO4等)与之反应,如鉴别NaCl、Na2S、Na2SO3、Na2CO3、Na2SiO3、Na2S2O3溶液等,可选用盐酸。
(4)若有金属及不同的金属氧化物,可考虑用强酸,如鉴别MnO2、FeO、CuO等黑色粉末,可选用浓盐酸。
(5)用一种试剂鉴别多种物质时,常用到的是“相反原理”,即“阴同阳不同用碱,阳同阴不同用酸,阴阳各不同用盐”。
变式训练2 下列4组溶液,不用试剂也能鉴别开来的是( )
①AgNO3溶液、稀氨水
②Na[Al(OH)4]溶液和盐酸
③NaHCO3、NaHSO4、Ba(NO3)2、NH4Cl
④NaNO3、FeCl3、NaCl、AgNO3
A.① B.①②
C.①②③ D.全部
解析:选D。①②相互滴加,现象不同可鉴别。AgNO3溶液逐滴加入到稀氨水中,得到银氨溶液,稀氨水逐滴滴加到AgNO3溶液中,先产生白色沉淀AgOH,继续滴加氨水,沉淀溶解。Na[Al(OH)4]溶液滴加到盐酸中,生成AlCl3,无沉淀产生,而盐酸滴加到Na[Al(OH)4]溶液中,先产生白色沉淀Al(OH)3,继续滴加盐酸,沉淀溶解。
③将溶液两两混合即可鉴别,NaHCO3与NaHSO4反应有气体放出,NaHSO4与Ba(NO3)2反应V有沉淀生成。④由溶液显棕黄色的是FeCl3溶液,以FeCl3溶液为试剂,滴加到余下的三种溶液中,有白色沉淀产生的是AgNO3溶液,再以AgNO3溶液为试剂滴加到另两种溶液中,有白色沉淀产生的是NaCl溶液,无现象的是NaNO3溶液。
探究整合应用
某食用精制盐的包装袋上有如下说明:
例
产品标准 GB5461
产品等级 一级
配料 食盐、碘酸钾、抗结剂
碘含量(以I计) 20 mg·kg-1~50 mg·kg-1
分装日期 ××××年××月××日
分装企业 ××××厂
(1)碘酸钾与碘化钾在酸性条件下发生如下反应,配平化学方程式(将化学计量数填于空白处)
________KIO3+________KI+________H2SO4―→
________K2SO4+________I2+________H2O
(2)上述反应生成的I2可用四氯化碳检验。向碘的四氯化碳溶液中加入Na2SO3稀溶液,将I2还原,以回收四氯化碳。
①Na2SO3稀溶液与I2反应的离子方程式是__________________________________________________________________________________。
②某同学设计回收四氯化碳的操作步骤为:
a.将碘的四氯化碳溶液置于分液漏斗中;
b.加入适量Na2SO3稀溶液;
c.分离出下层液体。
以上设计中,遗漏的操作及其在上述步骤中的位置是____________________________________
____________________________________。
①判断c中反应恰好完全的现象是________________________________________________________________________
________________________________________________________________________。
②b中反应所产生的I2的物质的量是________mol。
③根据以上实验和包装袋说明,所测精制盐的碘含量是(以含w的代数式表示)________mg·kg-1。
知能优化训练
本部分内容讲解结束
点此进入课件目录
按ESC键退出全屏播放
谢谢使用
课题2 亚硝酸钠和食盐的鉴别
学习目标
1.认识亚硝酸钠的物理性质(外观)和重要的化学性质(氧化性和还原性)。
2.认识亚硝酸的酸性和不稳定性;通过对亚硝酸钠和食盐性质的认识,设计实验方案进行两者的鉴别。
3.通过对已知物质中所含离子的检验,学会物质检验实验方案的设计原理和方法,体验观察和分析实验现象在化学实验中的重要作用。
课堂互动讲练
知能优化训练
课前自主学案
探究整合应用
课题2
课前自主学案
自主学习
一、实验原理
1.亚硝酸的生成及其不稳定性
向NaNO2溶液中加酸,生成亚硝酸(HNO2)。亚硝酸________,仅存在于冷的稀溶液中,微热甚至常温下也会分解,产生_____色的二氧化氮气体。反应的化学方程式是__________________________________、______________________________。
不稳定
红棕
NaNO2+H2SO4===NaHSO4+HNO2
2HNO2===NO↑+NO2↑+H2O
+3
棕黄
还原性
Cr3+
橙
绿
可
白
碱
二、实验步骤
在设计实验方案时,要注意选择试剂______、现象______、操作______且安全的反应,在检验过程中最好不要产生对环境有污染的物质。根据食盐和亚硝酸钠的性质以及实验条件,设计鉴别食盐和亚硝酸钠的多种实验方案如下:
易得
明显
简便
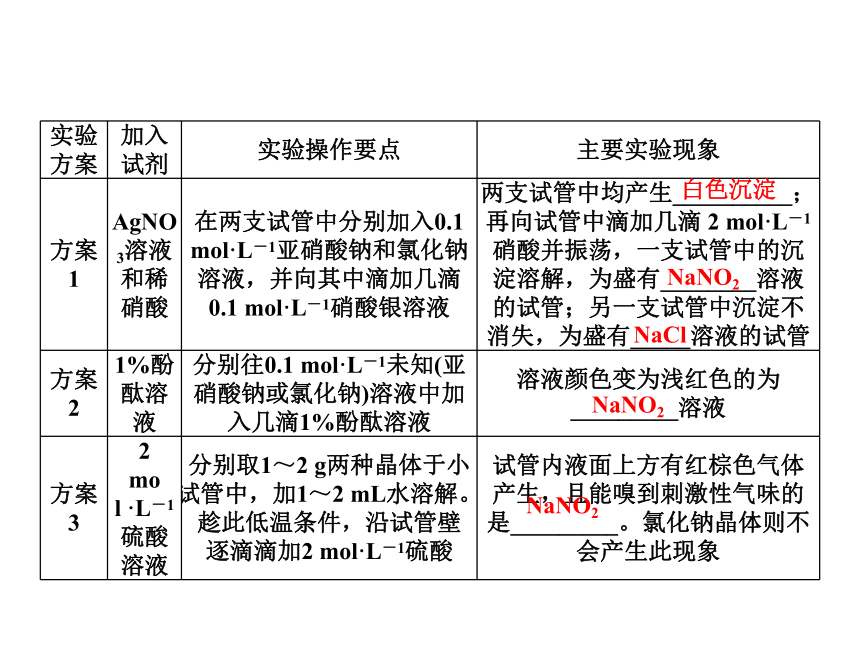
实验方案 加入试剂 实验操作要点 主要实验现象
方案1 AgNO3溶液和稀硝酸 在两支试管中分别加入0.1 mol·L-1亚硝酸钠和氯化钠溶液,并向其中滴加几滴0.1 mol·L-1硝酸银溶液 两支试管中均产生__________;再向试管中滴加几滴 2 mol·L-1硝酸并振荡,一支试管中的沉淀溶解,为盛有________溶液的试管;另一支试管中沉淀不消失,为盛有_____溶液的试管
方案2 1%酚酞溶液 分别往0.1 mol·L-1未知(亚硝酸钠或氯化钠)溶液中加入几滴1%酚酞溶液 溶液颜色变为浅红色的为_________溶液
方案3 2 mol ·L-1硫酸溶液 分别取1~2 g两种晶体于小试管中,加1~2 mL水溶解。趁此低温条件,沿试管壁逐滴滴加2 mol·L-1硫酸 试管内液面上方有红棕色气体产生,且能嗅到刺激性气味的是_________。氯化钠晶体则不会产生此现象
白色沉淀
NaNO2
NaCl
NaNO2
NaNO2
实验方案 加入试剂 实验操作要点 主要实验现象
方案4 0.001 mol·L-1 KMnO4溶液 在两支试管中均加入0.001 mol·L-1KMnO4溶液和2滴2 mol·L-1的硫酸溶液,再在两支试管中分别滴加0.1 mol·L-1亚硝酸钠和氯化钠溶液,摇匀 使KMnO4溶液浅红色褪去的试管,加入的是________溶液
方案5 0.1 mol·L-1KI 淀粉溶液 分别取1 mL 0.1 mol·L-1亚硝酸钠溶液和氯化钠溶液于两支试管中,向试管中加入0.5 mL 0.1 mol·L-1碘化钾溶液,观察溶液颜色变化。再滴加2滴2 mol·L-1硫酸和2滴2%淀粉溶液,观察溶液颜色变化 加入0.5 mL 0.1 mol·L-1碘化钾溶液,溶液由无色变成___色或更深;再滴加2滴2 mol·L-1硫酸和2滴2%淀粉溶液,溶液由___色变为___色,此为NaNO2溶液;氯化钠溶液始终没有明显现象
NaNO2
黄
黄
蓝
实验方案 加入试剂 实验操作要点 主要实验现象
方案6 加入(NH4)2Fe(SO4)2溶液 在两支试管中均加入1 mL 0.1 mol·L-1硫酸亚铁铵溶液,溶液呈淡绿色;分别滴加 0.1 mol·L-1亚硝酸钠和氯化钠溶液,摇匀 若加入前后无明显现象,则加入的是_____溶液。溶液颜色由淡绿色变为_____色,则加入的为________溶液
方案7 pH试纸 分别用pH试纸测定0.1 mol·L-1两种未知(亚硝酸钠或氯化钠)溶液的pH 一种溶液的pH为7,为_____溶液;另一种溶液的pH为8~9,为_______溶液
NaCl
棕黄
NaNO2
NaCl
NaNO2
思考感悟
如何鉴别下列两组物质?写出流程图。
(1)Na2CO3、NaCl、Na2SO4、NaNO2。
(2)NaNO2、NaCl、NaNO3。
【提示】
(1)
(2)
自主体验
1.(2011年莆田高二检测)小明学习化学后,在家里想用化学方法来鉴别碱面(主要成分是碳酸钠)和食盐,你认为下列方法可行的是( )
A.观察它们的颜色
B.分别倒入水中观察是否溶解
C.取少量分别倒入食醋
D分别取少量加热
2.只能用焰色反应实验区分的是( )
A.钠和锌 B.KCl和K2CO3
C.NaCl和Na2CO3 D.KCl和NaCl
解析:选D。KCl与NaCl的阴离子均为Cl-,只能鉴别K+、Na+,在中学阶段应使用焰色反应区分。
解析:选C。亚硝酸钠也是一种食品添加剂,但是需要严格控制用量。
课堂互动讲练
亚硝酸钠、氯化钠的鉴别
例1
(2)写出上述所有反应的离子方程式。
方案1:____________________________________
____________________________________;
方案2:_____________________________________
___________________________________;
方案3:_____________________________________
___________________________________;
方案4:_____________________________________
___________________________________;
方案5:_____________________________________
___________________________________。
(5)人体血红蛋白中含有Fe2+离子,如果误食亚硝酸盐,会使人中毒,因为亚硝酸盐会使Fe2+离子转变成Fe3+离子,生成高铁血红蛋白而丧失与O2结合的能力。服用维生素C可缓解亚硝酸盐的中毒,这说明维生素C具有________。
A.酸性 B.碱性
C.氧化性 D.还原性
【解析】 (1)结合题给信息,①②③④⑤可以设计出五种鉴别方案。
(2)离子方程式的书写(见答案)。
(3)因为HNO2是一种弱酸,故NaNO2溶液水解显碱性,可以用pH试纸鉴别。
(4)根据框图中的信息可以设计溶解吸热的方案鉴别NaNO2和NaCl。
(5)由亚硝酸盐会使Fe2+转变为Fe3+,说明亚硝酸盐的氧化性较强,从而说明了维生素C具有还原性。
【答案】 (1)
变式训练1 亚硝酸钠俗称“工业盐”,有很强的毒性,因外观与口感与食盐相似,而常常被误用、误食,为了区分亚硝酸钠与食盐,某研究性小组通过查阅资料后得知:亚硝酸钠具有强氧化性,可与硝酸银溶液反应产生沉淀,亚硝酸是一种弱酸,不稳定,易分解为两种气体,据此设计了如下方案:①分别向盛有两种溶液的试管中加入稀硫酸,试管中有红棕色气体产生的为亚硝酸钠;
②用洁净的玻璃棒分别蘸取两种无色溶液滴在淀粉碘化钾试纸上,出现蓝色的是亚硝酸钠;③向两支盛有硫酸亚铁溶液的试管中分别加入两种物质,溶液变棕黄色的是亚硝酸钠;④分别向盛有两种溶液的试管中加入硝酸银,有白色沉淀产生的是氯化钠,另一支试管内是亚硝酸钠。其中能够区分亚硝酸钠与食盐的操作及结论正确的是( )
A.①②③④ B.①②④
C.①②③ D.①③④
解析:选C。亚硝酸钠可与硝酸银溶液反应产生沉淀即不能利用硝酸银溶液来区别亚硝酸钠和氯化钠,所以操作④错误。
物质的鉴别
1.含义
通常是指对两种或两种以上的物质进行定性辨认,可根据一种物质的特性区别于另一种物质,也可根据几种物质的气味、溶解性、溶解时的热效应等性质的不同加以区别。
2.基本思路
(1)利用阳离子的特性:
(2)利用阴离子的特性
3.一般原则
(1)若有n种物质需鉴别,一般检验出n-1种物质即可。
(2)方法或试剂选择得越简单越好,条件越简单越好,实验现象越明显、越典型越好。
(3)若无限定要求,一般首先考虑用物理方法,当物理方法无法鉴别时,再考虑用化学方法。
(4)用物理方法鉴别的步骤:
观察法―→嗅试法―→水溶法
(5)用化学方法鉴别的步骤:
固体:加热法―→水溶法―→指示剂测试法―→指定试剂法
液体:指示剂测试法―→指定试剂法
气体:点燃法―→通入指定试剂法
(6)在检验过程中最好不要产生对环境有污染的物质。
例2
③向D溶液中滴加Ba(NO3)2溶液,无明显现象;
④向F溶液中滴加氨水,生成白色絮状沉淀,沉淀迅速变成灰绿色,最后变成红褐色。
根据上述实验现象,回答下列问题:
(1)实验②中反应的化学方程式是________________________________________________________________________;
(2)E溶液是________,判断依据是__________________
________________________________________________________________________;
(3)写出下列四种化合物的化学式:
A____________________、
C____________________、
D____________________、F____________________。
【解析】
【答案】 (1)AgNO3+NH3·H2O===AgOH↓+NH4NO3,
AgOH+2NH3·H2O===Ag(NH3)2OH+2H2O
(2)碳酸钾 由①中碱性强弱的顺序可知,E是碳酸盐。六种阳离子中可以与碳酸根形成可溶性盐的只有钾离子,所以E是碳酸钾
(3)Ba(OH)2 (CH3COO)2Ca AlCl3 FeSO4
【规律方法】 物质的鉴别技巧
(1)若被鉴别的溶液酸碱性不同,可选用适当的指示剂或pH试纸,如鉴别(NH4)2SO4、K2CO3、Na2SO4三种溶液,可选用pH试纸。
(2)若几种溶液中含有不同的阳离子,可选用强碱(NaOH、KOH)等与之反应,如鉴别K2SO4、(NH4)2SO4、Fe2(SO4)3、Al2(SO4)3、CuSO4溶液等。
(3)若几种溶液中含有不同的阴离子,可选用强酸(盐酸、H2SO4等)与之反应,如鉴别NaCl、Na2S、Na2SO3、Na2CO3、Na2SiO3、Na2S2O3溶液等,可选用盐酸。
(4)若有金属及不同的金属氧化物,可考虑用强酸,如鉴别MnO2、FeO、CuO等黑色粉末,可选用浓盐酸。
(5)用一种试剂鉴别多种物质时,常用到的是“相反原理”,即“阴同阳不同用碱,阳同阴不同用酸,阴阳各不同用盐”。
变式训练2 下列4组溶液,不用试剂也能鉴别开来的是( )
①AgNO3溶液、稀氨水
②Na[Al(OH)4]溶液和盐酸
③NaHCO3、NaHSO4、Ba(NO3)2、NH4Cl
④NaNO3、FeCl3、NaCl、AgNO3
A.① B.①②
C.①②③ D.全部
解析:选D。①②相互滴加,现象不同可鉴别。AgNO3溶液逐滴加入到稀氨水中,得到银氨溶液,稀氨水逐滴滴加到AgNO3溶液中,先产生白色沉淀AgOH,继续滴加氨水,沉淀溶解。Na[Al(OH)4]溶液滴加到盐酸中,生成AlCl3,无沉淀产生,而盐酸滴加到Na[Al(OH)4]溶液中,先产生白色沉淀Al(OH)3,继续滴加盐酸,沉淀溶解。
③将溶液两两混合即可鉴别,NaHCO3与NaHSO4反应有气体放出,NaHSO4与Ba(NO3)2反应V有沉淀生成。④由溶液显棕黄色的是FeCl3溶液,以FeCl3溶液为试剂,滴加到余下的三种溶液中,有白色沉淀产生的是AgNO3溶液,再以AgNO3溶液为试剂滴加到另两种溶液中,有白色沉淀产生的是NaCl溶液,无现象的是NaNO3溶液。
探究整合应用
某食用精制盐的包装袋上有如下说明:
例
产品标准 GB5461
产品等级 一级
配料 食盐、碘酸钾、抗结剂
碘含量(以I计) 20 mg·kg-1~50 mg·kg-1
分装日期 ××××年××月××日
分装企业 ××××厂
(1)碘酸钾与碘化钾在酸性条件下发生如下反应,配平化学方程式(将化学计量数填于空白处)
________KIO3+________KI+________H2SO4―→
________K2SO4+________I2+________H2O
(2)上述反应生成的I2可用四氯化碳检验。向碘的四氯化碳溶液中加入Na2SO3稀溶液,将I2还原,以回收四氯化碳。
①Na2SO3稀溶液与I2反应的离子方程式是__________________________________________________________________________________。
②某同学设计回收四氯化碳的操作步骤为:
a.将碘的四氯化碳溶液置于分液漏斗中;
b.加入适量Na2SO3稀溶液;
c.分离出下层液体。
以上设计中,遗漏的操作及其在上述步骤中的位置是____________________________________
____________________________________。
①判断c中反应恰好完全的现象是________________________________________________________________________
________________________________________________________________________。
②b中反应所产生的I2的物质的量是________mol。
③根据以上实验和包装袋说明,所测精制盐的碘含量是(以含w的代数式表示)________mg·kg-1。
知能优化训练
本部分内容讲解结束
点此进入课件目录
按ESC键退出全屏播放
谢谢使用
同课章节目录
- 专题一 物质的分离与提纯
- 课题1 海带中碘元素的分离及检验
- 拓展课题1-1 茶叶中某些元素的鉴定
- 课题2 用纸层析法分离铁离子和铜离子
- 拓展课题1-2 菠菜的叶绿体中色素的提取和分离
- 拓展课题1-3 用粉笔进行层析分离
- 课题3 硝酸钾晶体的制备
- 拓展课题1-4 粗盐提纯
- 专题二 物质性质的研究
- 课题1 铝及其化合物的性质
- 拓展课题2-1 铝热反应
- 课题2 乙醇和苯酚的性质
- 拓展课题2-2 苯酚与甲醛的反应
- 专题三 物质的检验与鉴别
- 课题1 牙膏和火柴中某些成分的检验
- 拓展课题3-1 新装修居室内空气中甲醛浓度的检测
- 拓展课题3-2 汽车尾气成分的检验
- 课题2 亚硝酸钠和食盐的鉴别
- 拓展课题3-3 真假碘盐的鉴别
- 专题四 化学反应条件的控制
- 课题1 硫代硫酸钠与酸反应速率的影响因素
- 拓展课题4-1 “蓝瓶子”实验
- 课题2 催化剂对过氧化氢分解反应速率的影响
- 拓展课题4-2 过氧化氢酶的催化作用
- 拓展课题4-3 蔗糖的燃烧
- 课题3 反应条件对化学平衡的影响
- 拓展课题4-4 淀粉与碘显色现象的探究
- 拓展课题4-5 压强对化学平衡的影响
- 专题五 电化学问题研究
- 课题1 原电池
- 拓展课题5-1 干电池模拟实验
- 课题2 电解与电镀
- 拓展课题5-2 阿伏加德罗常数的测定
- 专题六 物质的定量分析
- 课题1 食醋总酸含量的测定
- 拓展课题6-1 配制并标定氢氧化钠溶液
- 课题2 镀锌铁皮锌镀层厚度的测定
- 拓展课题6-2 水果中维生素C含量的测定
- 专题七 物质的制备与合成
- 课题1 硫酸亚铁铵的制备
- 拓展课题7-1 用制氢废液制备硫酸锌晶体
- 课题2 阿司匹林的合成
- 拓展课题7-2 对氨基苯磺酸的合成
