【2012优化方案 精品课件】苏教版 化学 选修6专题5课题1 原电池(共56张PPT)
文档属性
| 名称 | 【2012优化方案 精品课件】苏教版 化学 选修6专题5课题1 原电池(共56张PPT) |

|
|
| 格式 | rar | ||
| 文件大小 | 671.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2011-10-28 19:15:47 | ||
图片预览









文档简介
(共56张PPT)
课题1 原电池
学习目标
1.通过原电池实验,加深对原电池工作原理的认识。
2.通过制作氢氧燃料电池,了解燃料电池的工作原理。
3.能用实验的方法证明钢铁的析氢腐蚀和吸氧腐蚀的发生,并能用化学知识加以解释。
课堂互动讲练
知能优化训练
课前自主学案
探究整合应用
课题1
课前自主学案
自主学习
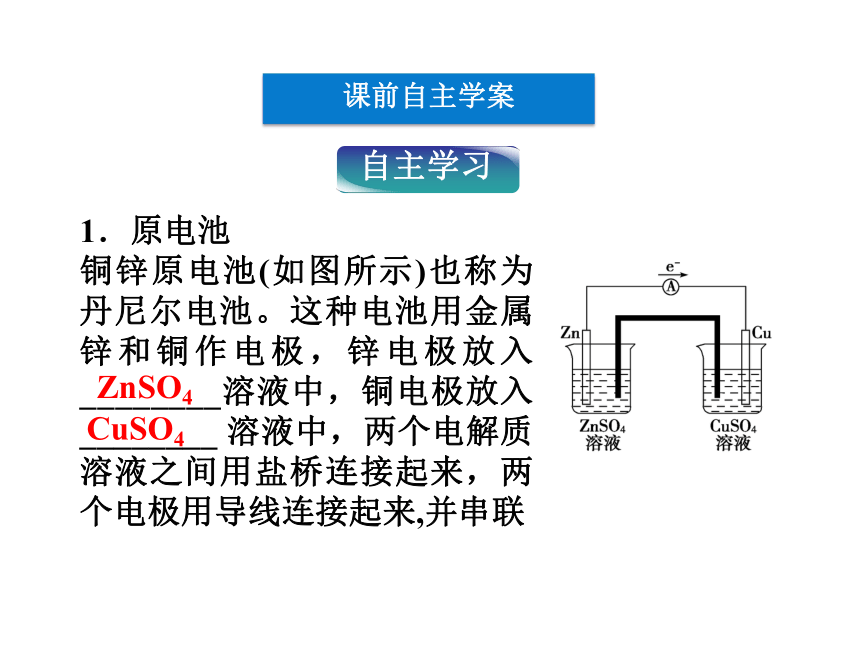
1.原电池
铜锌原电池(如图所示)也称为丹尼尔电池。这种电池用金属锌和铜作电极,锌电极放入________溶液中,铜电极放入________ 溶液中,两个电解质溶液之间用盐桥连接起来,两个电极用导线连接起来,并串联
ZnSO4
CuSO4
一个电流计以便观察电流的产生和方向。在该原电池中,电流从铜电极流向锌电极(即电子由锌电极流向铜电极)。电子流出的电极叫____极,电子流入的电极叫____极。电极反应为:
负极:_________________
正极: _________________
电池反应: ________________________
因此,会出现锌片质量_____,铜片上有红色物质析出,质量增加,通过电流计指针变化的现象,判断有______产生。
负
正
Zn-2e-===Zn2+
Cu2++2e-===Cu
Zn+Cu2+===Zn2++Cu
减小
电流
2.燃料电池
燃料电池是将燃料与氧化剂发生氧化还原反应时的______能转化为_____能的装置。燃料电池广泛用于航天事业。氢氧燃料电池的电极反应如下:
负极:___________________
正极:_________________________
电池反应:__________________
化学
电
2H2-4e-===4H+
O2+2H2O+4e-===4OH-
2H2+O2===2H2O
3.电化学腐蚀
金属的电化学腐蚀是由于发生_________反应而引起的。例如,在潮湿的空气中,金属表面吸附了一层水膜,这层水膜中又溶解有少量__________ __________等气体,结果在金属表面形成了一薄层电解质溶液。钢铁是铁和碳的合金,它可以与表面的一层电解质溶液形成很多微小的原电池。在此原电池中,铁作为____极,碳作为____极。
若钢铁表面形成的溶液呈酸性,则H+在正极获得电子变为H2,负极的Fe失去电子成为Fe2+进入水膜,发生_______腐蚀。其电极反应为:
原电池
CO2、
SO2、O2
负
正
析氢
负极:__________________
正极:___________________
电池反应:_______________________
若钢铁表面形成一层中性或偏碱性的电解质溶液,则溶解在水中的氧气将在正极获得电子,发生______腐蚀。其电极反应为:
Fe-2e-===Fe2+
2H++2e-===H2↑
Fe+2H+===Fe2++H2↑
吸氧
负极:_____________________
正极: _________________________
电池反应: ____________________________
Fe(OH)2可进一步氧化成Fe(OH)3,反应的化学方程式: ________________________________
Fe(OH)3又可失水变成铁锈(通常以Fe2O3·nH2O表示)。
2Fe-4e-===2Fe2+
O2+2H2O+4e-===4OH-
2Fe+O2+2H2O===2Fe(OH)2
4Fe(OH)2+O2+2H2O===4Fe(OH)3
思考感悟
(1)钢铁在空气中很容易被腐蚀,而纯铁却有较强的抗蚀性,为什么?
(2)怎样利用电化学原理来防止金属的腐蚀?
【提示】 (1)金属的腐蚀是以电化学腐蚀为主的。钢铁都是铁的合金,其中含有一定量的碳,在潮湿的空气中,形成许多微小的原电池,加快了铁的腐蚀,而纯铁在空气中不发生原电池反应,仅有化学腐蚀,非常缓慢,故纯铁有较强的抗蚀性。
(2)①可在被保护的金属上连接一更活泼的金属,如在轮船壳体上连接锌板。②也可用外接电源,将直流电源的负极接在被保护的金属上,防止金属被氧化。
二、实验步骤
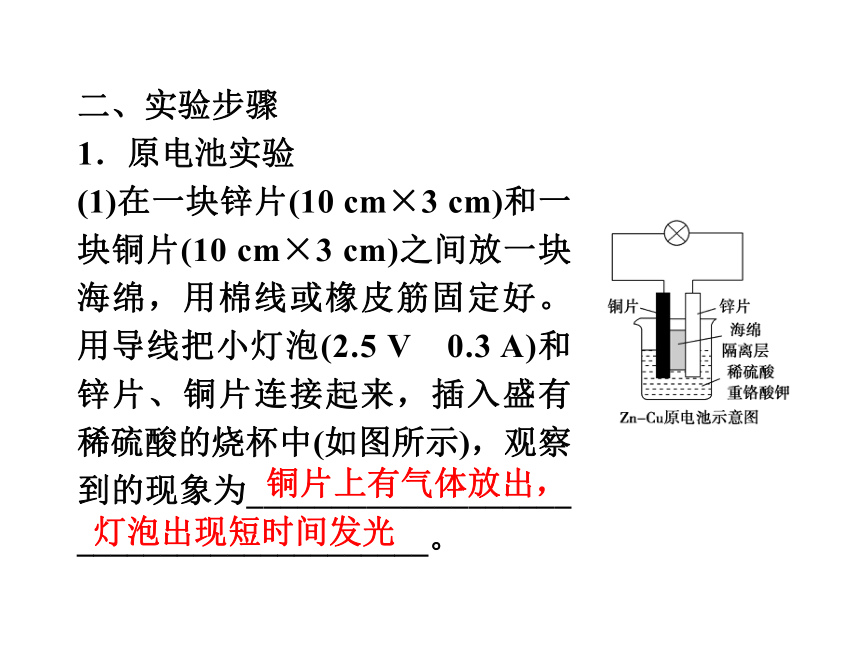
1.原电池实验
(1)在一块锌片(10 cm×3 cm)和一块铜片(10 cm×3 cm)之间放一块海绵,用棉线或橡皮筋固定好。用导线把小灯泡(2.5 V 0.3 A)和锌片、铜片连接起来,插入盛有稀硫酸的烧杯中(如图所示),观察到的现象为___________________ _____________________。
铜片上有气体放出,
灯泡出现短时间发光
(2)一段时间后,向烧杯中加入1~2 g重铬酸钾晶体(或高锰酸钾晶体,或5~10 mL 6% H2O2溶液),振荡,观察到的现象为_______________________ ______________________。
(3)改用Zn?C、Al?Cu为电极材料,分别与稀硫酸组合成原电池,按照上述实验装置和操作方法进行实验,会观察到类似的实验现象。
2.制作氢氧燃料电池
(1)把两根碳棒放在酒精喷灯(或煤气灯)火焰上灼烧2~3 min后,立即投入到冷水中,反复操作3~5次,目的是________________________。
灯泡又开始发光,亮度
增大且持续时间较长
使碳棒表面变得粗糙多孔
(2)将经过灼烧的两根碳棒插入2 mol·L-1 KNO3溶液中,并与6 V直流电源连接(如图中Ⅰ所示),电解约20 s,使两电极的碳棒上吸附较多的气泡。
(3)切断电池,在两电极之间接上音乐集成电路(原来连接直流电源正极的碳棒应该与音乐集成电路的正极相连接,如图中Ⅱ所示),观察到的现象为_______________ ________________,说明装置中产生电流。
音乐集成电路
产生动听的音乐
3.金属的电化学腐蚀
(1)析氢腐蚀
取两根3~5 cm长的铁钉,用稀盐酸除去铁锈。在其中一根铁钉上疏散地绕几圈光亮的细铜丝,使铜丝与铁钉紧密接触。
把上述两根铁钉分别放入两支试管中,各加入3 mL 0.1 mol·L-1盐酸和2滴K3[Fe(CN)6](铁氰化钾)溶液,观察到_________________上产生的气泡多,________________周围先出现蓝色沉淀(Fe2+能与[Fe(CN)6]3-反应生成蓝色沉淀)。
绕有铜丝的铁钉
绕有铜丝的铁钉
(2)吸氧腐蚀
取一片铁片,用砂纸擦去铁锈,在铁片上滴1滴含酚酞的食盐水(如图所示),静置1~2 min,观察到的现象为___________。
溶液变红色
自主体验
1.铜片和锌片用导线连接后插入稀H2SO4中,锌片是( )
A.阴极 B.正极
C.阳极 D.负极
解析:选D。原电池的两极分别命名为正、负极。铜片和锌片用导线连接后插入稀H2SO4中形成了原电池,其中锌失去电子作原电池的负极。
2.茫茫黑夜中,航标灯为航海员指明了方向。航标灯的电源必须长效、稳定。我国科技工作者研制出以铝合金、Pt?Fe合金网为电极材料的海水电池。在这种电池中( )
①铝合金是阳极 ②铝合金是负极 ③海水是电解液 ④铝合金电极发生还原反应
A.②③ B.②④
C.①③ D.①④
解析:选A。较活泼的铝合金为负极(②对),Pt?Fe合金网为正极,海水是电解液(③对),负极上发生氧化反应(④错)。
解析:选B。二次电池,即可充电电池,所以A项对。在铜锌原电池中,活泼金属Zn是负极,负极失电子发生氧化反应,因此电子的流向是由负极(锌电极)流向正极(铜电极),B项错。
课堂互动讲练
两种原电池的工作原理
下列是我们常见的两种原电池装置,将它们进行比较:
1.实验现象
电流产生情况 电极表面
变化情况 温度变化情况 能量变化情况
左上图装置 有电流产生 锌片质量减小,同时锌片上有红色物质析出,铜片质量增加 溶液温度升高 化学能转化为电能、热能
右上图装置 有电流产生 锌片质量减小,铜片上有红色物质析出,铜片质量增加 溶液温度不变 化学能转化为电能
2.实验分析
(1)对于左上图装置,Zn片:Zn-2e-===Zn2+
Cu片:Cu2++2e-===Cu
同时在Zn片上,Zn可直接与CuSO4溶液反应,生成Cu与ZnSO4,因此该装置中既有化学能转化为电能,同时也有化学能转化为热能。
(2)对于右上图所示原电池:使用盐桥,避免了Zn与CuSO4溶液的直接反应,电极名称及电极反应:
锌片:负极 Zn-2e-===Zn2+(氧化反应)
铜片:正极 Cu2++2e-===Cu(还原反应)
总化学方程式:Zn+CuSO4===Cu+ZnSO4
当有盐桥存在时,在ZnSO4溶液中,Zn片逐渐溶解,即Zn被氧化,锌原子失去电子,形成Zn2+进入溶液,从锌片上释放出的电子,经过导线流向铜片,CuSO4溶液中的Cu2+从铜片上得到电子,还原成为金属铜并沉积在铜片上,随着反应的进行,左边烧杯中溶液c(Zn2+)增大,右边烧杯中c(Cu2+)减小,此时,盐桥中的Cl-会移向ZnSO4溶液,K+移向CuSO4溶液,使ZnSO4溶液和CuSO4溶液均保持电中性,氧化还原反应得以继续进行,从而使原电池不断地产生电流。即:
依据氧化还原反应:2Ag+(aq)+Cu(s)===Cu2+(aq)+2Ag(s)设计的原电池如图所示。
例1
请回答下列问题:
(1)电极X的材料是__________;电解质溶液Y是________;
(2)银电极为电池的________极,发生的电极反应为____________________________;X电极上发生的电极反应为__________________________;
(3)外电路中的电子是从______电极流向______电极。
【解析】 根据所给氧化还原反应方程式,结合原电池反应原理以及所给原电池装置,Cu应作负极,AgNO3溶液为电解质溶液,从而推知:
(1)电极X的材料为铜,电解质溶液Y是AgNO3溶液。
(2)银为原电池的正极,发生的电极反应为Ag++e-===Ag。X电极上发生的电极反应为Cu-2e-===Cu2+。
(3)外电路中的电子从X(Cu)电极流向银(Ag)电极。
【答案】 (1)铜 AgNO3溶液
(2)正 Ag++e-===Ag Cu-2e-===Cu2+
(3)X(Cu) 银(Ag)
变式训练1 (2011年绍兴高二检测)用铜片、银片、Cu(NO3)2溶液、AgNO3溶液、导线和盐桥(装有琼脂 KNO3的U形管)构成一个原电池。以下有关该原电池的叙述正确的是( )
①在外电路中,电流由铜电极流向银电极
②正极反应为Ag++e-===Ag
③实验过程中取出盐桥,原电池仍继续工作
④将铜片浸入AgNO3溶液中发生的化学反应与该原电池反应相同
A.①② B.②③
C.②④ D.③④
解析:选C。①Cu为负极,电子由Cu电极流向Ag电极;③取出盐桥,电池不能形成闭合回路,不能继续工作。
燃料电池
1.制作氢氧燃料电池
2.燃料电池电极反应方程式的书写
(1)燃料电池的电极不参与反应,有很强的催化活性,起导电作用。
(2)燃料电池在负极上发生氧化反应的是燃料(如H2、CH4、CH3OH等),在正极上参与反应的是空气或氧气,电解质溶液一般是KOH溶液。
(3)书写电极反应方程式时,酸性条件下可用H+和H2O配平;碱性条件下可用OH-和H2O配平。
例2
解析:选AB。放电时,负极氢气失去电子被氧化产生的H+与碳酸根离子结合生成二氧化碳,碳酸根离子将向负极移动;正极氧气得到电子被还原生成氢氧根离子,氢氧根离子与二氧化碳结合生成碳酸根离子;反应的实质是2H2+O2===2H2O,每转移2 mol电子生成1 mol水,因此电路中通过a mol电子时,理论上可以生成9a g水蒸气。
金属的电化学腐蚀
1.类型
2.影响金属腐蚀的因素及腐蚀快慢规律
(1)影响金属腐蚀的因素
①金属本性
金属越活泼,就越容易失去电子而被腐蚀。
②介质
介质对金属腐蚀的影响也很大,如果金属在潮湿的空气中,接触腐蚀性气体或电解质溶液,都容易被腐蚀。
(2)判断金属腐蚀快慢的规律
①电解原理引起的腐蚀>原电池原理引起的腐蚀>化学腐蚀>有防护措施的腐蚀。
②对同一种金属来说,腐蚀的快慢:强电解质溶液>弱电解质溶液>非电解质溶液。
③活泼性不同的两金属,活泼性差别越大,腐蚀越快。
④对同一种电解质溶液来说,电解质溶液浓度越大,腐蚀越快。
某探究小组用铁钉被腐蚀的快慢实验来研究防止钢铁腐蚀的方法。所用试剂有:材质相同的无锈铁钉数个、食盐水、碳酸水、植物油各多量,实验温度为298 K ,308 K,每次实验取用铁钉的数量相同,液体体积相同且足量,用大小相同的试管实验。
(1)请完成以下实验设计表,并在实验目的一栏中填出对应的实验编号:
例3
实验编号 T/K 试管内取用液体 实验目的
① 298 食盐水 (Ⅰ)实验①和②探究不同电解质溶液对铁钉腐蚀快慢的影响;
(Ⅱ)实验①和____探究温度对铁钉腐蚀快慢的影响;
(Ⅲ)实验①和____探究铁钉是否接触电解质溶液对铁钉腐蚀快慢的影响。
②
③
④
(2)请根据上述实验和金属腐蚀原理,判断下列有关钢铁制品防腐蚀的说法正确的是________(填字母)。
A.在铁门、铁窗表面涂上油漆
B.自行车各部件因有防护涂层或电镀等防腐措施,所以不需要停放在有遮雨的地方
C.家用铁制厨具每次用完后应擦干放置在干燥处
D.把挡水铁闸门与直流电源的正极连接且构成回路,可减小铁闸门被腐蚀的速率
【思路点拨】 解答本题要注意以下两点:
(1)比较实验应只有一个条件不同,其他条件相同,进行对比。
(2)结合金属腐蚀的原理和条件判断防腐蚀措施的正误。
【解析】 (1)根据实验目的(Ⅰ)可知,①和②实验的不同之处为电解质溶液,故其实验温度应相同,即②亦为298 K,②取用的电解质溶液为碳酸水;由(Ⅱ)可知①和另外一组(可为③)实验探究温度对铁钉腐蚀快慢的影响,故③中试管内取用液体与①相同,而温度不同,应为308 K;由(Ⅲ)可知④实验中试管内取用液体应为非电解质(即植物油),温度与①相同,为298 K。(2)根据实验,钢铁制品防腐蚀可涂油漆、电镀等保护层,并保持干燥以防止电化学腐蚀,故A、C正确,B错误;D项挡水铁闸门若与直流电源的正极连接构成回路,则Fe作阳极腐蚀加快,不会被保护,D错误。
【答案】 (1)
(2)AC
实验编号 T/K 试管内取用液体 实验目的
① (Ⅱ)③
(Ⅲ)④
② 298 碳酸水
③ 308 食盐水
④ 298 植物油
变式训练3 如图装置中,U形管内为红墨水,a、b试管内分别盛有食盐水和氯化铵溶液,各加入生铁块,放置一段时间。下列有关描述错误的是( )
A.生铁块中的碳是原电池的正极
B.红墨水柱两边的液面变为左低右高
C.两试管中相同的电极反应式是:Fe-2e-===Fe2+
D.a试管中发生了吸氧腐蚀,b试管中发生了析氢腐蚀
解析:选B。粗看装置虽感到陌生,但仔细分析得知该实验是吸氧腐蚀与析氢腐蚀的简单综合。a试管内盛装食盐水,溶液呈中性,发生的是吸氧腐蚀,负极反应式为Fe-2e-=== Fe2+,正极反应式为O2+2H2O+4e-===4OH-,显然a装置内气体的物质的量减少,压强减小。b试管内盛装氯化铵溶液,溶液呈酸性,发生的是析氢腐蚀,负极反应式为Fe-2e-===Fe2+,正极反应式为2H++2e-===H2↑,气体的物质的量增加,压强增大。综上分析选项B错。
探究整合应用
Zn?MnO2干电池应用广泛,其电解质溶液是ZnCl2?NH4Cl 混合溶液。
(1)该电池的负极材料是________。电池工作时,电子流向________(填“正极”或“负极”)。
(2)若ZnCl2?NH4Cl混合溶液中含有杂质Cu2+,会加速某电极的腐蚀,其主要原因是_________。
欲除去Cu2+,最好选用下列试剂中的________(填代号)。
a.NaOH b.Zn
c.Fe d.NH3·H2O
例
(3)MnO2的生产方法之一是以石墨为电极,电解酸化的MnSO4溶液。阴极的电极反应式是________________________________________________________________________。
若电解电路中通过2 mol电子,MnO2的理论产量为________g。
【解析】 (1)原电池的负极是发生氧化反应的一极:Zn-2e-===Zn2+;电池工作时,电子是从负极流向正极。
(2)Zn与Cu2+发生氧化还原反应,生成的Cu附着在Zn的表面构成铜锌原电池,加快反应速率,从而加快Zn的腐蚀。
(3)电解池的阴极是发生还原反应的一极:2H++2e-===H2↑;每生成1 mol MnO2需转移2 mol电子,故每通过2 mol电子,理论上生成1 mol MnO2,质量为87 g。
【答案】 (1)Zn(或锌) 正极
(2)锌与还原出的铜构成铜锌原电池而加快锌的腐蚀 b
(3)2H++2e-===H2↑ 87
知能优化训练
本部分内容讲解结束
点此进入课件目录
按ESC键退出全屏播放
谢谢使用
课题1 原电池
学习目标
1.通过原电池实验,加深对原电池工作原理的认识。
2.通过制作氢氧燃料电池,了解燃料电池的工作原理。
3.能用实验的方法证明钢铁的析氢腐蚀和吸氧腐蚀的发生,并能用化学知识加以解释。
课堂互动讲练
知能优化训练
课前自主学案
探究整合应用
课题1
课前自主学案
自主学习
1.原电池
铜锌原电池(如图所示)也称为丹尼尔电池。这种电池用金属锌和铜作电极,锌电极放入________溶液中,铜电极放入________ 溶液中,两个电解质溶液之间用盐桥连接起来,两个电极用导线连接起来,并串联
ZnSO4
CuSO4
一个电流计以便观察电流的产生和方向。在该原电池中,电流从铜电极流向锌电极(即电子由锌电极流向铜电极)。电子流出的电极叫____极,电子流入的电极叫____极。电极反应为:
负极:_________________
正极: _________________
电池反应: ________________________
因此,会出现锌片质量_____,铜片上有红色物质析出,质量增加,通过电流计指针变化的现象,判断有______产生。
负
正
Zn-2e-===Zn2+
Cu2++2e-===Cu
Zn+Cu2+===Zn2++Cu
减小
电流
2.燃料电池
燃料电池是将燃料与氧化剂发生氧化还原反应时的______能转化为_____能的装置。燃料电池广泛用于航天事业。氢氧燃料电池的电极反应如下:
负极:___________________
正极:_________________________
电池反应:__________________
化学
电
2H2-4e-===4H+
O2+2H2O+4e-===4OH-
2H2+O2===2H2O
3.电化学腐蚀
金属的电化学腐蚀是由于发生_________反应而引起的。例如,在潮湿的空气中,金属表面吸附了一层水膜,这层水膜中又溶解有少量__________ __________等气体,结果在金属表面形成了一薄层电解质溶液。钢铁是铁和碳的合金,它可以与表面的一层电解质溶液形成很多微小的原电池。在此原电池中,铁作为____极,碳作为____极。
若钢铁表面形成的溶液呈酸性,则H+在正极获得电子变为H2,负极的Fe失去电子成为Fe2+进入水膜,发生_______腐蚀。其电极反应为:
原电池
CO2、
SO2、O2
负
正
析氢
负极:__________________
正极:___________________
电池反应:_______________________
若钢铁表面形成一层中性或偏碱性的电解质溶液,则溶解在水中的氧气将在正极获得电子,发生______腐蚀。其电极反应为:
Fe-2e-===Fe2+
2H++2e-===H2↑
Fe+2H+===Fe2++H2↑
吸氧
负极:_____________________
正极: _________________________
电池反应: ____________________________
Fe(OH)2可进一步氧化成Fe(OH)3,反应的化学方程式: ________________________________
Fe(OH)3又可失水变成铁锈(通常以Fe2O3·nH2O表示)。
2Fe-4e-===2Fe2+
O2+2H2O+4e-===4OH-
2Fe+O2+2H2O===2Fe(OH)2
4Fe(OH)2+O2+2H2O===4Fe(OH)3
思考感悟
(1)钢铁在空气中很容易被腐蚀,而纯铁却有较强的抗蚀性,为什么?
(2)怎样利用电化学原理来防止金属的腐蚀?
【提示】 (1)金属的腐蚀是以电化学腐蚀为主的。钢铁都是铁的合金,其中含有一定量的碳,在潮湿的空气中,形成许多微小的原电池,加快了铁的腐蚀,而纯铁在空气中不发生原电池反应,仅有化学腐蚀,非常缓慢,故纯铁有较强的抗蚀性。
(2)①可在被保护的金属上连接一更活泼的金属,如在轮船壳体上连接锌板。②也可用外接电源,将直流电源的负极接在被保护的金属上,防止金属被氧化。
二、实验步骤
1.原电池实验
(1)在一块锌片(10 cm×3 cm)和一块铜片(10 cm×3 cm)之间放一块海绵,用棉线或橡皮筋固定好。用导线把小灯泡(2.5 V 0.3 A)和锌片、铜片连接起来,插入盛有稀硫酸的烧杯中(如图所示),观察到的现象为___________________ _____________________。
铜片上有气体放出,
灯泡出现短时间发光
(2)一段时间后,向烧杯中加入1~2 g重铬酸钾晶体(或高锰酸钾晶体,或5~10 mL 6% H2O2溶液),振荡,观察到的现象为_______________________ ______________________。
(3)改用Zn?C、Al?Cu为电极材料,分别与稀硫酸组合成原电池,按照上述实验装置和操作方法进行实验,会观察到类似的实验现象。
2.制作氢氧燃料电池
(1)把两根碳棒放在酒精喷灯(或煤气灯)火焰上灼烧2~3 min后,立即投入到冷水中,反复操作3~5次,目的是________________________。
灯泡又开始发光,亮度
增大且持续时间较长
使碳棒表面变得粗糙多孔
(2)将经过灼烧的两根碳棒插入2 mol·L-1 KNO3溶液中,并与6 V直流电源连接(如图中Ⅰ所示),电解约20 s,使两电极的碳棒上吸附较多的气泡。
(3)切断电池,在两电极之间接上音乐集成电路(原来连接直流电源正极的碳棒应该与音乐集成电路的正极相连接,如图中Ⅱ所示),观察到的现象为_______________ ________________,说明装置中产生电流。
音乐集成电路
产生动听的音乐
3.金属的电化学腐蚀
(1)析氢腐蚀
取两根3~5 cm长的铁钉,用稀盐酸除去铁锈。在其中一根铁钉上疏散地绕几圈光亮的细铜丝,使铜丝与铁钉紧密接触。
把上述两根铁钉分别放入两支试管中,各加入3 mL 0.1 mol·L-1盐酸和2滴K3[Fe(CN)6](铁氰化钾)溶液,观察到_________________上产生的气泡多,________________周围先出现蓝色沉淀(Fe2+能与[Fe(CN)6]3-反应生成蓝色沉淀)。
绕有铜丝的铁钉
绕有铜丝的铁钉
(2)吸氧腐蚀
取一片铁片,用砂纸擦去铁锈,在铁片上滴1滴含酚酞的食盐水(如图所示),静置1~2 min,观察到的现象为___________。
溶液变红色
自主体验
1.铜片和锌片用导线连接后插入稀H2SO4中,锌片是( )
A.阴极 B.正极
C.阳极 D.负极
解析:选D。原电池的两极分别命名为正、负极。铜片和锌片用导线连接后插入稀H2SO4中形成了原电池,其中锌失去电子作原电池的负极。
2.茫茫黑夜中,航标灯为航海员指明了方向。航标灯的电源必须长效、稳定。我国科技工作者研制出以铝合金、Pt?Fe合金网为电极材料的海水电池。在这种电池中( )
①铝合金是阳极 ②铝合金是负极 ③海水是电解液 ④铝合金电极发生还原反应
A.②③ B.②④
C.①③ D.①④
解析:选A。较活泼的铝合金为负极(②对),Pt?Fe合金网为正极,海水是电解液(③对),负极上发生氧化反应(④错)。
解析:选B。二次电池,即可充电电池,所以A项对。在铜锌原电池中,活泼金属Zn是负极,负极失电子发生氧化反应,因此电子的流向是由负极(锌电极)流向正极(铜电极),B项错。
课堂互动讲练
两种原电池的工作原理
下列是我们常见的两种原电池装置,将它们进行比较:
1.实验现象
电流产生情况 电极表面
变化情况 温度变化情况 能量变化情况
左上图装置 有电流产生 锌片质量减小,同时锌片上有红色物质析出,铜片质量增加 溶液温度升高 化学能转化为电能、热能
右上图装置 有电流产生 锌片质量减小,铜片上有红色物质析出,铜片质量增加 溶液温度不变 化学能转化为电能
2.实验分析
(1)对于左上图装置,Zn片:Zn-2e-===Zn2+
Cu片:Cu2++2e-===Cu
同时在Zn片上,Zn可直接与CuSO4溶液反应,生成Cu与ZnSO4,因此该装置中既有化学能转化为电能,同时也有化学能转化为热能。
(2)对于右上图所示原电池:使用盐桥,避免了Zn与CuSO4溶液的直接反应,电极名称及电极反应:
锌片:负极 Zn-2e-===Zn2+(氧化反应)
铜片:正极 Cu2++2e-===Cu(还原反应)
总化学方程式:Zn+CuSO4===Cu+ZnSO4
当有盐桥存在时,在ZnSO4溶液中,Zn片逐渐溶解,即Zn被氧化,锌原子失去电子,形成Zn2+进入溶液,从锌片上释放出的电子,经过导线流向铜片,CuSO4溶液中的Cu2+从铜片上得到电子,还原成为金属铜并沉积在铜片上,随着反应的进行,左边烧杯中溶液c(Zn2+)增大,右边烧杯中c(Cu2+)减小,此时,盐桥中的Cl-会移向ZnSO4溶液,K+移向CuSO4溶液,使ZnSO4溶液和CuSO4溶液均保持电中性,氧化还原反应得以继续进行,从而使原电池不断地产生电流。即:
依据氧化还原反应:2Ag+(aq)+Cu(s)===Cu2+(aq)+2Ag(s)设计的原电池如图所示。
例1
请回答下列问题:
(1)电极X的材料是__________;电解质溶液Y是________;
(2)银电极为电池的________极,发生的电极反应为____________________________;X电极上发生的电极反应为__________________________;
(3)外电路中的电子是从______电极流向______电极。
【解析】 根据所给氧化还原反应方程式,结合原电池反应原理以及所给原电池装置,Cu应作负极,AgNO3溶液为电解质溶液,从而推知:
(1)电极X的材料为铜,电解质溶液Y是AgNO3溶液。
(2)银为原电池的正极,发生的电极反应为Ag++e-===Ag。X电极上发生的电极反应为Cu-2e-===Cu2+。
(3)外电路中的电子从X(Cu)电极流向银(Ag)电极。
【答案】 (1)铜 AgNO3溶液
(2)正 Ag++e-===Ag Cu-2e-===Cu2+
(3)X(Cu) 银(Ag)
变式训练1 (2011年绍兴高二检测)用铜片、银片、Cu(NO3)2溶液、AgNO3溶液、导线和盐桥(装有琼脂 KNO3的U形管)构成一个原电池。以下有关该原电池的叙述正确的是( )
①在外电路中,电流由铜电极流向银电极
②正极反应为Ag++e-===Ag
③实验过程中取出盐桥,原电池仍继续工作
④将铜片浸入AgNO3溶液中发生的化学反应与该原电池反应相同
A.①② B.②③
C.②④ D.③④
解析:选C。①Cu为负极,电子由Cu电极流向Ag电极;③取出盐桥,电池不能形成闭合回路,不能继续工作。
燃料电池
1.制作氢氧燃料电池
2.燃料电池电极反应方程式的书写
(1)燃料电池的电极不参与反应,有很强的催化活性,起导电作用。
(2)燃料电池在负极上发生氧化反应的是燃料(如H2、CH4、CH3OH等),在正极上参与反应的是空气或氧气,电解质溶液一般是KOH溶液。
(3)书写电极反应方程式时,酸性条件下可用H+和H2O配平;碱性条件下可用OH-和H2O配平。
例2
解析:选AB。放电时,负极氢气失去电子被氧化产生的H+与碳酸根离子结合生成二氧化碳,碳酸根离子将向负极移动;正极氧气得到电子被还原生成氢氧根离子,氢氧根离子与二氧化碳结合生成碳酸根离子;反应的实质是2H2+O2===2H2O,每转移2 mol电子生成1 mol水,因此电路中通过a mol电子时,理论上可以生成9a g水蒸气。
金属的电化学腐蚀
1.类型
2.影响金属腐蚀的因素及腐蚀快慢规律
(1)影响金属腐蚀的因素
①金属本性
金属越活泼,就越容易失去电子而被腐蚀。
②介质
介质对金属腐蚀的影响也很大,如果金属在潮湿的空气中,接触腐蚀性气体或电解质溶液,都容易被腐蚀。
(2)判断金属腐蚀快慢的规律
①电解原理引起的腐蚀>原电池原理引起的腐蚀>化学腐蚀>有防护措施的腐蚀。
②对同一种金属来说,腐蚀的快慢:强电解质溶液>弱电解质溶液>非电解质溶液。
③活泼性不同的两金属,活泼性差别越大,腐蚀越快。
④对同一种电解质溶液来说,电解质溶液浓度越大,腐蚀越快。
某探究小组用铁钉被腐蚀的快慢实验来研究防止钢铁腐蚀的方法。所用试剂有:材质相同的无锈铁钉数个、食盐水、碳酸水、植物油各多量,实验温度为298 K ,308 K,每次实验取用铁钉的数量相同,液体体积相同且足量,用大小相同的试管实验。
(1)请完成以下实验设计表,并在实验目的一栏中填出对应的实验编号:
例3
实验编号 T/K 试管内取用液体 实验目的
① 298 食盐水 (Ⅰ)实验①和②探究不同电解质溶液对铁钉腐蚀快慢的影响;
(Ⅱ)实验①和____探究温度对铁钉腐蚀快慢的影响;
(Ⅲ)实验①和____探究铁钉是否接触电解质溶液对铁钉腐蚀快慢的影响。
②
③
④
(2)请根据上述实验和金属腐蚀原理,判断下列有关钢铁制品防腐蚀的说法正确的是________(填字母)。
A.在铁门、铁窗表面涂上油漆
B.自行车各部件因有防护涂层或电镀等防腐措施,所以不需要停放在有遮雨的地方
C.家用铁制厨具每次用完后应擦干放置在干燥处
D.把挡水铁闸门与直流电源的正极连接且构成回路,可减小铁闸门被腐蚀的速率
【思路点拨】 解答本题要注意以下两点:
(1)比较实验应只有一个条件不同,其他条件相同,进行对比。
(2)结合金属腐蚀的原理和条件判断防腐蚀措施的正误。
【解析】 (1)根据实验目的(Ⅰ)可知,①和②实验的不同之处为电解质溶液,故其实验温度应相同,即②亦为298 K,②取用的电解质溶液为碳酸水;由(Ⅱ)可知①和另外一组(可为③)实验探究温度对铁钉腐蚀快慢的影响,故③中试管内取用液体与①相同,而温度不同,应为308 K;由(Ⅲ)可知④实验中试管内取用液体应为非电解质(即植物油),温度与①相同,为298 K。(2)根据实验,钢铁制品防腐蚀可涂油漆、电镀等保护层,并保持干燥以防止电化学腐蚀,故A、C正确,B错误;D项挡水铁闸门若与直流电源的正极连接构成回路,则Fe作阳极腐蚀加快,不会被保护,D错误。
【答案】 (1)
(2)AC
实验编号 T/K 试管内取用液体 实验目的
① (Ⅱ)③
(Ⅲ)④
② 298 碳酸水
③ 308 食盐水
④ 298 植物油
变式训练3 如图装置中,U形管内为红墨水,a、b试管内分别盛有食盐水和氯化铵溶液,各加入生铁块,放置一段时间。下列有关描述错误的是( )
A.生铁块中的碳是原电池的正极
B.红墨水柱两边的液面变为左低右高
C.两试管中相同的电极反应式是:Fe-2e-===Fe2+
D.a试管中发生了吸氧腐蚀,b试管中发生了析氢腐蚀
解析:选B。粗看装置虽感到陌生,但仔细分析得知该实验是吸氧腐蚀与析氢腐蚀的简单综合。a试管内盛装食盐水,溶液呈中性,发生的是吸氧腐蚀,负极反应式为Fe-2e-=== Fe2+,正极反应式为O2+2H2O+4e-===4OH-,显然a装置内气体的物质的量减少,压强减小。b试管内盛装氯化铵溶液,溶液呈酸性,发生的是析氢腐蚀,负极反应式为Fe-2e-===Fe2+,正极反应式为2H++2e-===H2↑,气体的物质的量增加,压强增大。综上分析选项B错。
探究整合应用
Zn?MnO2干电池应用广泛,其电解质溶液是ZnCl2?NH4Cl 混合溶液。
(1)该电池的负极材料是________。电池工作时,电子流向________(填“正极”或“负极”)。
(2)若ZnCl2?NH4Cl混合溶液中含有杂质Cu2+,会加速某电极的腐蚀,其主要原因是_________。
欲除去Cu2+,最好选用下列试剂中的________(填代号)。
a.NaOH b.Zn
c.Fe d.NH3·H2O
例
(3)MnO2的生产方法之一是以石墨为电极,电解酸化的MnSO4溶液。阴极的电极反应式是________________________________________________________________________。
若电解电路中通过2 mol电子,MnO2的理论产量为________g。
【解析】 (1)原电池的负极是发生氧化反应的一极:Zn-2e-===Zn2+;电池工作时,电子是从负极流向正极。
(2)Zn与Cu2+发生氧化还原反应,生成的Cu附着在Zn的表面构成铜锌原电池,加快反应速率,从而加快Zn的腐蚀。
(3)电解池的阴极是发生还原反应的一极:2H++2e-===H2↑;每生成1 mol MnO2需转移2 mol电子,故每通过2 mol电子,理论上生成1 mol MnO2,质量为87 g。
【答案】 (1)Zn(或锌) 正极
(2)锌与还原出的铜构成铜锌原电池而加快锌的腐蚀 b
(3)2H++2e-===H2↑ 87
知能优化训练
本部分内容讲解结束
点此进入课件目录
按ESC键退出全屏播放
谢谢使用
同课章节目录
- 专题一 物质的分离与提纯
- 课题1 海带中碘元素的分离及检验
- 拓展课题1-1 茶叶中某些元素的鉴定
- 课题2 用纸层析法分离铁离子和铜离子
- 拓展课题1-2 菠菜的叶绿体中色素的提取和分离
- 拓展课题1-3 用粉笔进行层析分离
- 课题3 硝酸钾晶体的制备
- 拓展课题1-4 粗盐提纯
- 专题二 物质性质的研究
- 课题1 铝及其化合物的性质
- 拓展课题2-1 铝热反应
- 课题2 乙醇和苯酚的性质
- 拓展课题2-2 苯酚与甲醛的反应
- 专题三 物质的检验与鉴别
- 课题1 牙膏和火柴中某些成分的检验
- 拓展课题3-1 新装修居室内空气中甲醛浓度的检测
- 拓展课题3-2 汽车尾气成分的检验
- 课题2 亚硝酸钠和食盐的鉴别
- 拓展课题3-3 真假碘盐的鉴别
- 专题四 化学反应条件的控制
- 课题1 硫代硫酸钠与酸反应速率的影响因素
- 拓展课题4-1 “蓝瓶子”实验
- 课题2 催化剂对过氧化氢分解反应速率的影响
- 拓展课题4-2 过氧化氢酶的催化作用
- 拓展课题4-3 蔗糖的燃烧
- 课题3 反应条件对化学平衡的影响
- 拓展课题4-4 淀粉与碘显色现象的探究
- 拓展课题4-5 压强对化学平衡的影响
- 专题五 电化学问题研究
- 课题1 原电池
- 拓展课题5-1 干电池模拟实验
- 课题2 电解与电镀
- 拓展课题5-2 阿伏加德罗常数的测定
- 专题六 物质的定量分析
- 课题1 食醋总酸含量的测定
- 拓展课题6-1 配制并标定氢氧化钠溶液
- 课题2 镀锌铁皮锌镀层厚度的测定
- 拓展课题6-2 水果中维生素C含量的测定
- 专题七 物质的制备与合成
- 课题1 硫酸亚铁铵的制备
- 拓展课题7-1 用制氢废液制备硫酸锌晶体
- 课题2 阿司匹林的合成
- 拓展课题7-2 对氨基苯磺酸的合成
