江苏省华东师范大学盐城实验中学2020-2021学年上学期高一期中百校联考全真模拟化学试题 含答案
文档属性
| 名称 | 江苏省华东师范大学盐城实验中学2020-2021学年上学期高一期中百校联考全真模拟化学试题 含答案 |

|
|
| 格式 | docx | ||
| 文件大小 | 546.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-11-23 10:10:32 | ||
图片预览


文档简介
华东师范大学盐城实验中学高一年级
化 学 试 题 11-18
考试时间:90 分钟 分值:100 命题人: 审核人:
相对原子质量:H 1 C 12 N 14 O 16 Na 23 Al 27 P 31 S 32 Cl 35.5 Ca 40 Fe 56 Mn 55 Ba 137
第I卷 选择题(共40分)
一.单项选择题(本题有10个小题,每小题只有一个选项符合题意,每小题2分,共20分)
1. 2020年初春,新型冠状病毒肆虐流行,严重威胁着人类的健康。化学在疫情防控中发挥了很大作用,使用含氯泡腾片[主要成分为二氧化氯(ClO2)]可有效杀死病毒。下列对于二氧化氯(ClO2)的说法不正确的是
35191700 ( )
A.ClO2属于化合物
B.ClO2属于氧化物
C.ClO2属于盐类
D.根据ClO2中氯元素的化合价为+4,推测其具有氧化性
2.如图表示的一些物质或概念间的从属关系中不正确的是( )
选项
X
Y
Z
A
盐酸
溶液
混合物
B
分解反应
氧化还原反应
化学反应
C
碱性氧化物
金属氧化物
氧化物
D
金属
单质
纯净物
A. A B. B C. C D. D
3.可用于辐照治疗癌症,下列关于说法正确的是( )
A.核电荷数为138 B.核外电子数为226
C.中子数为50 D.与互为同位素
4.晚自习的课间,同学们站在楼上的走廊里,可以看到市里的空中有移动的光柱,这就是气溶胶发生的丁达尔效应,下列说法不正确的是( )
A.胶体分散质粒子的直径介于1~100 nm之间
B.胶体和溶液都是混合物,它们属于不同的分散系
C.利用丁达尔效应可鉴别胶体和溶液
D.胶体区分于其他分散系的本质特征是丁达尔效应
5.废定影液含Ag(S2O3)23-和Br-等,实验室从中回收Ag和Br2的主要步骤为:向废定影液中加入Na2S溶液沉淀银离子,过滤、洗涤、干燥,灼烧Ag2S制取金属Ag;制取Cl2并将Cl2通入滤液中氧化Br-,再用苯萃取分液。其中部分实验操作的装置如图所示,下列叙述正确的是( ? )
下列叙述正确的是( )
A. 用装置甲分离Ag2S时,用玻璃棒不断搅拌
B. 用装置乙在通风橱中高温灼烧Ag2S制取Ag
C. 用装置丙制备Cl2
D. 用装置丁分液时,先放出水层再换个烧杯继续放出有机层
6.用NA代表阿伏加德罗常数的值,下列说法正确的是( )
A.常温常压下,11.2L二氧化硫气体中含有0.5NA个SO2分子
B.标准状况下,22.4L CCl4中含有NA个分子
C.1mol Na与一定量的O2反应生成Na2O和Na2O2,转移的电子数为NA个
D.将NA个HCl气体分子溶于1L水中得到1mol·L-1的盐酸
7.VmL Al2(SO4)3 溶液中含 Al3+a g,取 V/4mL 溶液稀释到 4V mL,则稀释后该溶液中SO42-的物质的量浓度是( )
9931400
8.下列有关物质的性质与用途具有对应关系的是( )
A.铝的金属活泼性强,可用于制作铝金属制品
B.Na2O2能吸收CO2产生O2,可用作呼吸面具供氧剂
C.NaHCO3受热分解,可用于中和过多的胃酸
D.明矾溶于水并水解形成胶体,可用于水的消毒
9.下列反应中,离子方程式不正确的是( )
A.CuO与稀盐酸反应:CuO+2H+=Cu2++H2O
B.大理石与醋酸反应:CaCO3+2CH3COOH=Ca2++2CH3COO?+H2O+CO2↑
C.钠与水反应:2Na+2H2O=2Na++2OH-+H2↑
D.Ba(OH)2溶液与稀硫酸反应:Ba2++OH?+H++SO=BaSO4↓+H2O
10.某温度下将 Cl2 通入 KOH 溶液里,反应后得到 KCl、KClO、KClO3 的混合溶液,经测定ClO-与ClO3-的个数之比为 3:1,则 Cl2 与 KOH 反应时,被还原的氯元素和被氧化的氯元素的物质的量之比为( )
A.1:3 B.4:3 C.2:1 D.3:1
二、不定项选择题(本题包括5小题,每小题4分,共20分,每小题只有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该题为0分;若正确答案包括两个选项,只选一个且正确的得2分,选两个且都正确的得满分,但只要选错一个,该小题就为0分)
11.关于与气体,下列说法正确的是( )
A.若两种气体所占体积相同,两种气体的质量之比为2∶3
B.若温度及压强相同,两种气体的密度之比为2∶3
C.若两种气体的原子数相同,两种气体的质子数之比为2∶3
D.若两种气体的质量相同,两种气体的分子数之比为3∶2
12.下列实验操作及现象与结论之间对应关系错误的是
选项
实验操作及现象
结论
A
向某溶液中加入硝酸酸化的BaCl2溶液,有白色沉淀生成
该溶液中含SO42-
B
向某溶液中滴加NaOH浓溶液并加热,生成的气体能使湿润的红色石蕊试纸变蓝
该溶液中含NH4+
C
探究新制饱和氯水成分的实验时,向氯水中滴加硝酸酸化的AgNO3溶液,有白色沉淀生成
氯水中含有Cl﹣
D
探究新制饱和氯水成分的实验时,向氯水中加入NaHCO3粉末,有气泡产生
氯水中含H+
13.四氧化钌(RuO4)是金黄色针状晶体,微溶于水,有强氧化性,能氧化浓盐酸生成Cl2和Ru3+。酸性介质中固体Na2RuO4与NaClO溶液或NaClO3溶液反应均可制得RuO4。下列说法正确的是
A.若NaClO3与Na2RuO4物质的量之比1∶3,则还原产物为Cl-
B.RuO4与浓盐酸反应生成11.2L Cl2转移电子数为NA
C.酸性介质中氧化性:RuO4>ClO>Cl2
D.在稀硫酸环境中,Na2RuO4与NaClO反应制备RuO4的化学方程式为
Na2RuO4+NaClO+H2SO4=RuO4+Na2SO4+NaCl+H2O
14.某l00mL溶液可能含有Na+、NH4+、Fe3+、CO32-、SO42-、Cl-中的若干种,取该溶液进行连续实验,实验过程如图:(所加试剂均过量,气体全部逸出)下列说法不正确的是( )。
A.原溶液一定存在CO32-和SO42-,一定不存在Fe3+
B.是否存在Na+只有通过焰色试验才能确定
C.原溶液一定存在Na+,可能存在Cl-
D.若原溶液中不存在Cl-,则c(Na+)=0.1mol·L-1
15.某研究小组对离子方程式 xR2++yH++O2=mR3++nH2O 的分析研究,下列说法中错误的是( )
A.根据电荷守恒,得出 x 与 y 的和一定等于 m
B.根据原子守恒,得出 x 和 m 的数值一定相等
C.根据电子得失守恒,得出 x=3的结论
D.根据氧化还原反应关系得出:R2+是还原剂,O2 是氧化剂,R3+是氧化产物,H2O 是还原产物
第Ⅱ卷 非选择题(共60分)
16.(11分,后面3个空格每个2分)在下面的横线上填上适当的内容。
(1)6.02×1024个Na+约含有________mol Na+,其质量为________g。?
(2)0.5mol CH4约含有________个CH4,其含有的电子数为________mol。?
(3)49 g H3PO4共含有________mol原子。
(4)3.01×1024个与__________mol 的质量相同。
(5)15.6g中含有0.4mol,则X的相对原子质量为__________。
(6)常温常压下,用等质量的、、、四种气体分别吹出四个气球,其中气体为 的是___________(填序号)。
A . B . C . D.
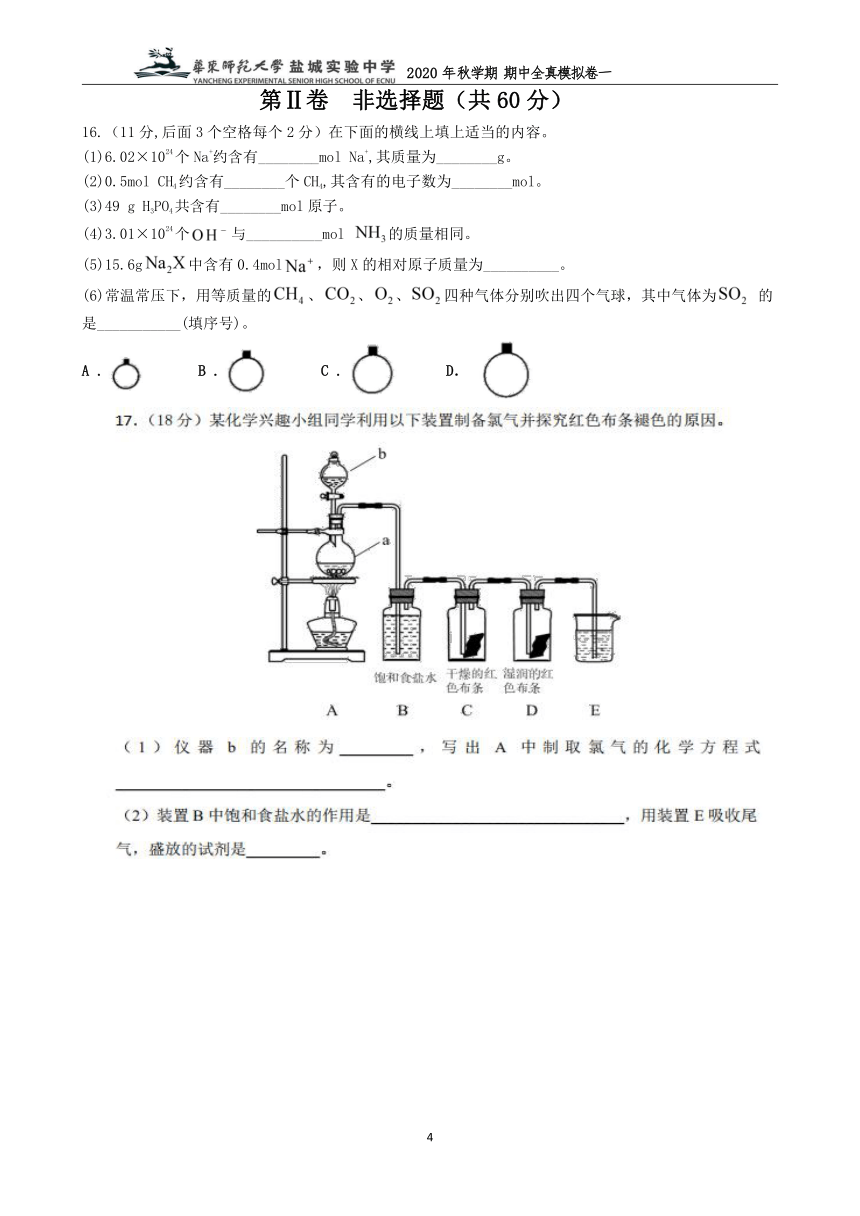
18.(9分)在呼吸面具和潜水艇中可用过氧化钠作为供氧剂.某课外小组模拟其原理选用适当的化学试剂和实验用品,用下图中的实验装置进行实验,证明潮湿的CO2可与过氧化钠反应生成O2.
可供选择的药品有:石灰石、盐酸、饱和NaHCO3溶液、NaOH溶液、Na2O2固体
(1)A是制取CO2的装置,写出A中发生反应的离子方程式 .
(2)填写表中空格:
仪器
加入试剂
加入该试剂的目的
B
饱和NaHCO3溶液
______
C
______
______
D
______
______
(3)写出过氧化钠与二氧化碳反应的化学方程式 .
(4)试管F中收集满气体后,要用拇指堵住试管口,移出水面,接下来的操作是
.
19.(10分)常温常压下,一氧化二氯(Cl2O)为棕黄色气体,沸点为3.8℃,42℃以上会分解生成Cl2和O2,Cl2O易溶于水并与水反应生成HClO。将氯气和空气不参与反应按体积比1:3混合通入含水的碳酸钠中制备Cl2O(同时生成一种使澄清石灰水变浑浊的气体和一种盐),并用水吸收Cl2O(不含Cl2)制备次氯酸溶液。(Cl2在CCl4中的溶解度较大)
(1)各装置的连接顺序为_____________________________________________。
(2)装置B中多孔球泡和搅拌棒的作用是 ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ?;装置C的作用是 。
(3)B中的化学方程式为 。
(4)反应过程中,装置B需放在冷水中,其目的是 。
20.(12分)某校化学兴趣小组为研究氯气的性质并模拟工业制备漂白粉,设计了下列装置进行实验。
已知:①A中反应为 KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O;
②石灰乳的主要成分为Ca(OH)2,其他杂质不参与反应。
(1)用“双线桥”标出A中反应电子转移的方向和数目 。
(2)B装置作用 。
(3)装置C的目的是验证氯气是否有漂白性,C中I、II、III?依次放入的物质正确的是___(填编号)。
编号
I
II
III
A
干燥的有色布条
碱石灰
湿润的有色布条
B
干燥的有色布条
浓硫酸
湿润的有色布条
C
湿润的有色布条
浓硫酸
干燥的有色布条
D
湿润的有色布条
碱石灰
干燥的有色布条
(4)待E中物质完全反应后,经过一系列加工处理,得到漂白粉样品,其主要成份为 (填化学式)
(5)F装置的作用是(用离子方程式表示) 。
(6)为测定(4)中所得漂白粉的有效成份含量。称取ag漂白粉样品溶解,往所得溶液中通入 CO2至产生沉淀最大值时,该过程的化学方程式为 ,若反应生成 沉淀的物质的量为bmol,则该漂白粉中有效成份的质量分数为 (用含a、b的式子表示)。
高一化学参考答案11-18
单项选择题(本题有10个小题,每小题只有一个选项符合题意,每小题2分,共20分)
题号
1
2
3
4
5
6
7
8
9
10
答案
C
B
D
D
C
C
C
B
D
C
二、不定项选择题(本题包括5小题,每小题4分,共20分,每小题只有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该题为0分;若正确答案包括两个选项,只选一个且正确的得2分,选两个且都正确的得满分,但只要选错一个,该小题就为0分)
题号
11
12
13
14
15
答案
B D
A
A D
B
A C
16.(11分,后面3个空格每个2分)
(1) 10 mol , 230 g。?
(2) 3.01×1023 , 5 mol。?
(3) 4 mol。
(4) 5 mol 。
(5) 32 。
(6) A (填序号)。
17(18分 (5)中每空格3分,其余每空格2分 )
18.(9分)((1)中空格2分,其余每空格1分)
(1) CaCO3+ 2H+ = Ca2+ + H2O + CO2↑ 或 HCO3 + H+ = H2O + CO2↑ .
19.(10分 每空格2分)
(1)_______A→D→B→C→E_________。
(2) ? ?加快反应速率,使反应充分进行? ? ? ?;
除去Cl2O中的Cl2 。
(3) 2Cl2+Na2CO3═Cl2O+2NaCl+CO2(或2Cl2+2Na2CO3+H2O═Cl2O+2NaCl+2NaHCO3)。
(4)防止反应放热后温度过高导致Cl2O分解 。
20.(12分(2)(3)中每空格1分,其余每空格2分 )
(1) 。
(2) 除去Cl2中的HCl 。
(3) C (填编号)。
(4) CaCl2 Ca(ClO)2 (填化学式)
(5) 。
(6)化学方程式为 ,
质量分数为 143b/a (用含a、b的式子表示)。
化 学 试 题 11-18
考试时间:90 分钟 分值:100 命题人: 审核人:
相对原子质量:H 1 C 12 N 14 O 16 Na 23 Al 27 P 31 S 32 Cl 35.5 Ca 40 Fe 56 Mn 55 Ba 137
第I卷 选择题(共40分)
一.单项选择题(本题有10个小题,每小题只有一个选项符合题意,每小题2分,共20分)
1. 2020年初春,新型冠状病毒肆虐流行,严重威胁着人类的健康。化学在疫情防控中发挥了很大作用,使用含氯泡腾片[主要成分为二氧化氯(ClO2)]可有效杀死病毒。下列对于二氧化氯(ClO2)的说法不正确的是
35191700 ( )
A.ClO2属于化合物
B.ClO2属于氧化物
C.ClO2属于盐类
D.根据ClO2中氯元素的化合价为+4,推测其具有氧化性
2.如图表示的一些物质或概念间的从属关系中不正确的是( )
选项
X
Y
Z
A
盐酸
溶液
混合物
B
分解反应
氧化还原反应
化学反应
C
碱性氧化物
金属氧化物
氧化物
D
金属
单质
纯净物
A. A B. B C. C D. D
3.可用于辐照治疗癌症,下列关于说法正确的是( )
A.核电荷数为138 B.核外电子数为226
C.中子数为50 D.与互为同位素
4.晚自习的课间,同学们站在楼上的走廊里,可以看到市里的空中有移动的光柱,这就是气溶胶发生的丁达尔效应,下列说法不正确的是( )
A.胶体分散质粒子的直径介于1~100 nm之间
B.胶体和溶液都是混合物,它们属于不同的分散系
C.利用丁达尔效应可鉴别胶体和溶液
D.胶体区分于其他分散系的本质特征是丁达尔效应
5.废定影液含Ag(S2O3)23-和Br-等,实验室从中回收Ag和Br2的主要步骤为:向废定影液中加入Na2S溶液沉淀银离子,过滤、洗涤、干燥,灼烧Ag2S制取金属Ag;制取Cl2并将Cl2通入滤液中氧化Br-,再用苯萃取分液。其中部分实验操作的装置如图所示,下列叙述正确的是( ? )
下列叙述正确的是( )
A. 用装置甲分离Ag2S时,用玻璃棒不断搅拌
B. 用装置乙在通风橱中高温灼烧Ag2S制取Ag
C. 用装置丙制备Cl2
D. 用装置丁分液时,先放出水层再换个烧杯继续放出有机层
6.用NA代表阿伏加德罗常数的值,下列说法正确的是( )
A.常温常压下,11.2L二氧化硫气体中含有0.5NA个SO2分子
B.标准状况下,22.4L CCl4中含有NA个分子
C.1mol Na与一定量的O2反应生成Na2O和Na2O2,转移的电子数为NA个
D.将NA个HCl气体分子溶于1L水中得到1mol·L-1的盐酸
7.VmL Al2(SO4)3 溶液中含 Al3+a g,取 V/4mL 溶液稀释到 4V mL,则稀释后该溶液中SO42-的物质的量浓度是( )
9931400
8.下列有关物质的性质与用途具有对应关系的是( )
A.铝的金属活泼性强,可用于制作铝金属制品
B.Na2O2能吸收CO2产生O2,可用作呼吸面具供氧剂
C.NaHCO3受热分解,可用于中和过多的胃酸
D.明矾溶于水并水解形成胶体,可用于水的消毒
9.下列反应中,离子方程式不正确的是( )
A.CuO与稀盐酸反应:CuO+2H+=Cu2++H2O
B.大理石与醋酸反应:CaCO3+2CH3COOH=Ca2++2CH3COO?+H2O+CO2↑
C.钠与水反应:2Na+2H2O=2Na++2OH-+H2↑
D.Ba(OH)2溶液与稀硫酸反应:Ba2++OH?+H++SO=BaSO4↓+H2O
10.某温度下将 Cl2 通入 KOH 溶液里,反应后得到 KCl、KClO、KClO3 的混合溶液,经测定ClO-与ClO3-的个数之比为 3:1,则 Cl2 与 KOH 反应时,被还原的氯元素和被氧化的氯元素的物质的量之比为( )
A.1:3 B.4:3 C.2:1 D.3:1
二、不定项选择题(本题包括5小题,每小题4分,共20分,每小题只有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该题为0分;若正确答案包括两个选项,只选一个且正确的得2分,选两个且都正确的得满分,但只要选错一个,该小题就为0分)
11.关于与气体,下列说法正确的是( )
A.若两种气体所占体积相同,两种气体的质量之比为2∶3
B.若温度及压强相同,两种气体的密度之比为2∶3
C.若两种气体的原子数相同,两种气体的质子数之比为2∶3
D.若两种气体的质量相同,两种气体的分子数之比为3∶2
12.下列实验操作及现象与结论之间对应关系错误的是
选项
实验操作及现象
结论
A
向某溶液中加入硝酸酸化的BaCl2溶液,有白色沉淀生成
该溶液中含SO42-
B
向某溶液中滴加NaOH浓溶液并加热,生成的气体能使湿润的红色石蕊试纸变蓝
该溶液中含NH4+
C
探究新制饱和氯水成分的实验时,向氯水中滴加硝酸酸化的AgNO3溶液,有白色沉淀生成
氯水中含有Cl﹣
D
探究新制饱和氯水成分的实验时,向氯水中加入NaHCO3粉末,有气泡产生
氯水中含H+
13.四氧化钌(RuO4)是金黄色针状晶体,微溶于水,有强氧化性,能氧化浓盐酸生成Cl2和Ru3+。酸性介质中固体Na2RuO4与NaClO溶液或NaClO3溶液反应均可制得RuO4。下列说法正确的是
A.若NaClO3与Na2RuO4物质的量之比1∶3,则还原产物为Cl-
B.RuO4与浓盐酸反应生成11.2L Cl2转移电子数为NA
C.酸性介质中氧化性:RuO4>ClO>Cl2
D.在稀硫酸环境中,Na2RuO4与NaClO反应制备RuO4的化学方程式为
Na2RuO4+NaClO+H2SO4=RuO4+Na2SO4+NaCl+H2O
14.某l00mL溶液可能含有Na+、NH4+、Fe3+、CO32-、SO42-、Cl-中的若干种,取该溶液进行连续实验,实验过程如图:(所加试剂均过量,气体全部逸出)下列说法不正确的是( )。
A.原溶液一定存在CO32-和SO42-,一定不存在Fe3+
B.是否存在Na+只有通过焰色试验才能确定
C.原溶液一定存在Na+,可能存在Cl-
D.若原溶液中不存在Cl-,则c(Na+)=0.1mol·L-1
15.某研究小组对离子方程式 xR2++yH++O2=mR3++nH2O 的分析研究,下列说法中错误的是( )
A.根据电荷守恒,得出 x 与 y 的和一定等于 m
B.根据原子守恒,得出 x 和 m 的数值一定相等
C.根据电子得失守恒,得出 x=3的结论
D.根据氧化还原反应关系得出:R2+是还原剂,O2 是氧化剂,R3+是氧化产物,H2O 是还原产物
第Ⅱ卷 非选择题(共60分)
16.(11分,后面3个空格每个2分)在下面的横线上填上适当的内容。
(1)6.02×1024个Na+约含有________mol Na+,其质量为________g。?
(2)0.5mol CH4约含有________个CH4,其含有的电子数为________mol。?
(3)49 g H3PO4共含有________mol原子。
(4)3.01×1024个与__________mol 的质量相同。
(5)15.6g中含有0.4mol,则X的相对原子质量为__________。
(6)常温常压下,用等质量的、、、四种气体分别吹出四个气球,其中气体为 的是___________(填序号)。
A . B . C . D.
18.(9分)在呼吸面具和潜水艇中可用过氧化钠作为供氧剂.某课外小组模拟其原理选用适当的化学试剂和实验用品,用下图中的实验装置进行实验,证明潮湿的CO2可与过氧化钠反应生成O2.
可供选择的药品有:石灰石、盐酸、饱和NaHCO3溶液、NaOH溶液、Na2O2固体
(1)A是制取CO2的装置,写出A中发生反应的离子方程式 .
(2)填写表中空格:
仪器
加入试剂
加入该试剂的目的
B
饱和NaHCO3溶液
______
C
______
______
D
______
______
(3)写出过氧化钠与二氧化碳反应的化学方程式 .
(4)试管F中收集满气体后,要用拇指堵住试管口,移出水面,接下来的操作是
.
19.(10分)常温常压下,一氧化二氯(Cl2O)为棕黄色气体,沸点为3.8℃,42℃以上会分解生成Cl2和O2,Cl2O易溶于水并与水反应生成HClO。将氯气和空气不参与反应按体积比1:3混合通入含水的碳酸钠中制备Cl2O(同时生成一种使澄清石灰水变浑浊的气体和一种盐),并用水吸收Cl2O(不含Cl2)制备次氯酸溶液。(Cl2在CCl4中的溶解度较大)
(1)各装置的连接顺序为_____________________________________________。
(2)装置B中多孔球泡和搅拌棒的作用是 ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ?;装置C的作用是 。
(3)B中的化学方程式为 。
(4)反应过程中,装置B需放在冷水中,其目的是 。
20.(12分)某校化学兴趣小组为研究氯气的性质并模拟工业制备漂白粉,设计了下列装置进行实验。
已知:①A中反应为 KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O;
②石灰乳的主要成分为Ca(OH)2,其他杂质不参与反应。
(1)用“双线桥”标出A中反应电子转移的方向和数目 。
(2)B装置作用 。
(3)装置C的目的是验证氯气是否有漂白性,C中I、II、III?依次放入的物质正确的是___(填编号)。
编号
I
II
III
A
干燥的有色布条
碱石灰
湿润的有色布条
B
干燥的有色布条
浓硫酸
湿润的有色布条
C
湿润的有色布条
浓硫酸
干燥的有色布条
D
湿润的有色布条
碱石灰
干燥的有色布条
(4)待E中物质完全反应后,经过一系列加工处理,得到漂白粉样品,其主要成份为 (填化学式)
(5)F装置的作用是(用离子方程式表示) 。
(6)为测定(4)中所得漂白粉的有效成份含量。称取ag漂白粉样品溶解,往所得溶液中通入 CO2至产生沉淀最大值时,该过程的化学方程式为 ,若反应生成 沉淀的物质的量为bmol,则该漂白粉中有效成份的质量分数为 (用含a、b的式子表示)。
高一化学参考答案11-18
单项选择题(本题有10个小题,每小题只有一个选项符合题意,每小题2分,共20分)
题号
1
2
3
4
5
6
7
8
9
10
答案
C
B
D
D
C
C
C
B
D
C
二、不定项选择题(本题包括5小题,每小题4分,共20分,每小题只有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该题为0分;若正确答案包括两个选项,只选一个且正确的得2分,选两个且都正确的得满分,但只要选错一个,该小题就为0分)
题号
11
12
13
14
15
答案
B D
A
A D
B
A C
16.(11分,后面3个空格每个2分)
(1) 10 mol , 230 g。?
(2) 3.01×1023 , 5 mol。?
(3) 4 mol。
(4) 5 mol 。
(5) 32 。
(6) A (填序号)。
17(18分 (5)中每空格3分,其余每空格2分 )
18.(9分)((1)中空格2分,其余每空格1分)
(1) CaCO3+ 2H+ = Ca2+ + H2O + CO2↑ 或 HCO3 + H+ = H2O + CO2↑ .
19.(10分 每空格2分)
(1)_______A→D→B→C→E_________。
(2) ? ?加快反应速率,使反应充分进行? ? ? ?;
除去Cl2O中的Cl2 。
(3) 2Cl2+Na2CO3═Cl2O+2NaCl+CO2(或2Cl2+2Na2CO3+H2O═Cl2O+2NaCl+2NaHCO3)。
(4)防止反应放热后温度过高导致Cl2O分解 。
20.(12分(2)(3)中每空格1分,其余每空格2分 )
(1) 。
(2) 除去Cl2中的HCl 。
(3) C (填编号)。
(4) CaCl2 Ca(ClO)2 (填化学式)
(5) 。
(6)化学方程式为 ,
质量分数为 143b/a (用含a、b的式子表示)。
同课章节目录
