四川省自贡市富顺一中2020-2021学年高二上学期期中考试化学试题 无答案
文档属性
| 名称 | 四川省自贡市富顺一中2020-2021学年高二上学期期中考试化学试题 无答案 |  | |
| 格式 | docx | ||
| 文件大小 | 238.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-11-23 12:45:09 | ||
图片预览



文档简介
富顺一中高2019级2020—2021学年度上学期期中考试
化 学 试 题
满分:100分 考试时间:90分钟
第I卷 选择题
一、选择题(每小题2分,共50分)
1.古代的很多成语、谚语都蕴含着科学知识,下列对成语、谚语的解释正确的是
A.“冰,水为之,而寒于水”说明相同质量和温度的水和冰,冰的能量高
B.“玉不琢,不成器”“百炼方能成钢”发生的均为化学变化
C.“爆竹声中除旧岁”爆竹爆炸发生的是分解反应,吸热反应
D.“火树银花”中的焰火实质上是金属元素的焰色反应
2.已知热化学方程式H2(g)+Br2(l)=2HBr(g) △H=-72.8 kJ·mol-1。下列叙述正确的是
A.该反应中化学能全部转化为热能 B.反应物总能量小于生成物总能量
C.1 mol H2与1 mol Br2反应放出72.8 kJ热量 D.H2(g)+Br2(g)=2HBr(g) △H<-72.8 kJ·mol-1
3.中和热是在稀溶液中,强酸、强碱发生中和反应生成1 mol液态水时放出的热量,中和热为57.3 kJ·mol -1。下列热化学方程式中正确的是
A.HNO3(aq)+KOH(aq)= H2O(l)+KNO3(aq) ΔH>-57.3 kJ·mol-1
B.HNO3(aq)+NH3·H2O(aq)=H2O(l)+NH4NO3(aq) ΔH=-57.3 kJ·mol-1
C.CH3COOH(aq)+KOH(aq)=H2O(l)+CH3COOK(aq) ΔH<-57.3 kJ·mol-1
D.CH3COOH(aq)+NH3?H2O(aq)=H2O(l)+CH3COONH4(aq) ΔH>-57.3kJ·mol-1
4.在下列说法中正确的是
A.1mol H2与0.5mol O2反应放出的热就是H2的燃烧热
B.1mol H2SO4与lmol Ba(OH)2完全反应时放出的热叫做中和热
C.已知C(s) + falseO2(g) = CO(g) △H=-110.5kJ/mol,则碳的燃烧热为110.5kJ/mol
D.同温同压下,已知两个放热反应:2A(g)+B(g)=2C(1) △H1;2A(l)+B(l)=2C(g) △H2,则△Hl<△H2
5.已知:CO(g)+2H2(g) CH3OH(g) △H,反应过程中生成1mol CH3OH(g)的能量变化如下图所示。曲线Ⅰ、Ⅱ分别表示无或有催化剂两种情况。下列判断正确的是
A.加入催化剂,△H变小 B.△H=+91 kJ/mol
C.生成1molCH3OH(l)时,△H值增大 D.反应物的总能量大于生成物的总能量
6.已知:①2C(s)+O2(g)=2CO(g) ΔH1=-221.0kJ?mol-1
②2H2(g)+O2(g)=2H2O(g) ΔH2=-483.6kJ?mol-1
则制备水煤气的反应C(s)+H2O(g)=CO(g)+H2(g),ΔH为
A.262.6kJ?mol-1B.-131.3kJ?mol-1C.-352.3kJ?mol-1D.131.3kJ?mol-1
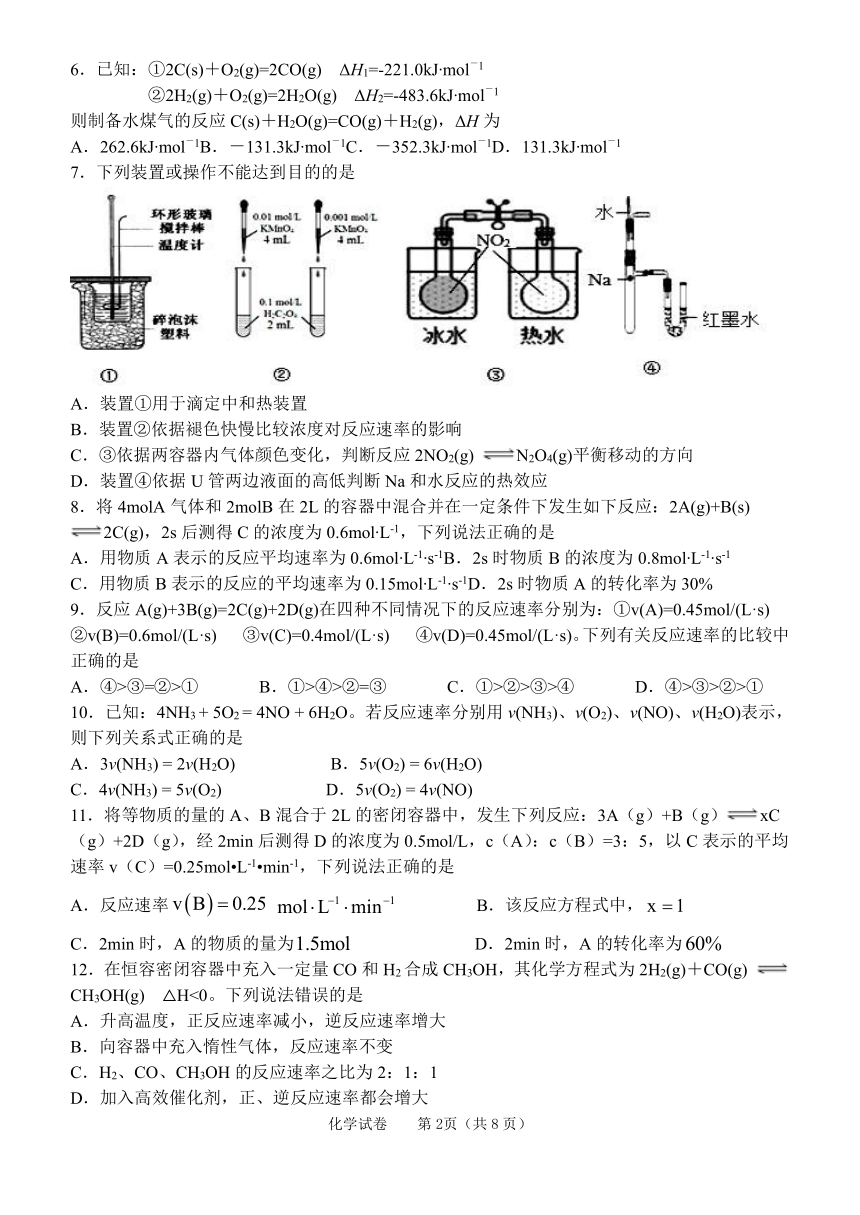
7.下列装置或操作不能达到目的的是
A.装置①用于滴定中和热装置
B.装置②依据褪色快慢比较浓度对反应速率的影响
C.③依据两容器内气体颜色变化,判断反应2NO2(g) N2O4(g)平衡移动的方向
D.装置④依据U管两边液面的高低判断Na和水反应的热效应
8.将4molA气体和2molB在2L的容器中混合并在一定条件下发生如下反应:2A(g)+B(s) 2C(g),2s后测得C的浓度为0.6mol?L-1,下列说法正确的是
A.用物质A表示的反应平均速率为0.6mol?L-1?s-1B.2s时物质B的浓度为0.8mol?L-1?s-1
C.用物质B表示的反应的平均速率为0.15mol?L-1?s-1D.2s时物质A的转化率为30%
9.反应A(g)+3B(g)=2C(g)+2D(g)在四种不同情况下的反应速率分别为:①v(A)=0.45mol/(L·s) ②v(B)=0.6mol/(L·s) ③v(C)=0.4mol/(L·s) ④v(D)=0.45mol/(L·s)。下列有关反应速率的比较中正确的是
A.④>③=②>① B.①>④>②=③ C.①>②>③>④ D.④>③>②>①
10.已知:4NH3 + 5O2 = 4NO + 6H2O。若反应速率分别用v(NH3)、v(O2)、v(NO)、v(H2O)表示,则下列关系式正确的是
A.3v(NH3) = 2v(H2O) B.5v(O2) = 6v(H2O)
C.4v(NH3) = 5v(O2) D.5v(O2) = 4v(NO)
11.将等物质的量的A、B混合于2L的密闭容器中,发生下列反应:3A(g)+B(g)xC(g)+2D(g),经2min后测得D的浓度为0.5mol/L,c(A):c(B)=3:5,以C表示的平均速率v(C)=0.25mol?L-1?min-1,下列说法正确的是
A.反应速率false?false B.该反应方程式中,false
C.2min时,A的物质的量为false D.2min时,A的转化率为false
12.在恒容密闭容器中充入一定量CO和H2合成CH3OH,其化学方程式为2H2(g)+CO(g) CH3OH(g) △H<0。下列说法错误的是
A.升高温度,正反应速率减小,逆反应速率增大
B.向容器中充入惰性气体,反应速率不变
C.H2、CO、CH3OH的反应速率之比为2:1:1
D.加入高效催化剂,正、逆反应速率都会增大
13.在恒温恒容的密闭容器中通入一定量的A、B,发生反应A(g)+2B(g) 3C(g)。如图是A的反应速率v(A)随时间变化的示意图。下列说法正确的是
A.反应物A的浓度:a点小于b点 B.该反应的生成物可能对反应起催化作用
C.曲线上的c、d两点都表示达到平衡状态 D.A的平均反应速率:ab段大于bc段
14.在一定温度下,容器内某一反应中M、N的物质的量随反应时间变化的曲线如图,下列表述正确的是
A.反应的化学方程式:2MN B.t2时,正、逆反应速率相等,达到平衡
C.t3时,正反应速率大于逆反应速率 D.t1时N的浓度是M浓度的2倍
15.硫代硫酸钠溶液与稀硫酸可发生反应:Na2S2O3 + H2SO4=Na2SO4 + SO2↑ + S↓ + H2O,某同学通过测定该反应发生时溶液变浑浊的时间,研究外界条件对化学反应速率的影响。
设计实验如下
实验编号
反应温度/℃
Na2S2O3溶液
稀H2SO4
H2O
V/mL
c/(mol·L-1)
V/mL
c/(mol·L-1)
V/mL
①
25
5
0.1
10
0.1
5
②
25
5
0.2
5
0.1
10
③
25
5
0.1
10
0.2
5
④
50
5
0.2
5
0.1
10
⑤
50
8
0.1
5
0.1
V1
下列说法正确的是
A.实验①和实验④中最先出现浑浊的是实验①
B.其他条件不变时,探究温度对化学反应速率的影响,应选择实验③和实验④
C.选择实验①和实验③,测定混合液变浑浊的时间,可探究硫酸浓度对化学反应速率的影响
D.选择实验④和实验⑤,可探究Na2S2O3 的浓度对反应速率的影响,则V1=10mL
16.反应C(s)+H2O(g) CO(g)+H2(g)在一可变容积的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是:①增加C的量 ②将容器的体积缩小一半 ③保持体积不变,充入N2使体系压强增大 ④保持压强不变,充入N2使容器体积变大
A.①④ B.②③ C.①③ D.②④
17.在一定温度下的定容容器中,当下列物理量不再发生变化时,表明反应A(s)+2B(g) C(g)+D(g) 已达到化学平衡状态的是
①混合气体的压强 ②混合气体的密度 ③B的物质的量浓度 ④混合气体总物质的量
⑤混合气体的平均相对分子质量 ⑥v(C)与v(D)的比值 ⑦混合气体总质量
A.②③⑤⑦ B.③④⑤⑥ C.①③④⑤ D.①④⑦
18.工业制硫酸中的反应:2SO2+O22SO3,等量的反应物在两个容器中反应,并达到平衡。在这过程中,甲容器保持体积不变,乙容器保持压强不变,若平衡时甲容器中SO2的百分含量p%,则平衡时乙容器中SO2的百分含量
A.等于p% B.大于p% C.小于p% D.无法判断
19.一定温度下,将气体X和气体Y各0.2mol充入10L恒容密闭容器中,发生反应:X(g)+Y(g) 2Z(g)△H<0,一段时间后达到平衡。下列说法正确的是
A.平衡后,充入He气(不参与反应),压强增大,正逆反应速率均增大,平衡不移动
B.其他条件不变,再充入0.1molX和0.1molY,再次平衡时Y的转化率不变
C.当v逆(Y)=2v正(Z)时,说明反应达到平衡
D.平衡后,充入气体X,正反应速率增大,逆反应速率减小,平衡正向移动。
20.在密闭容器中有如下反应:X2(g)+Y2(g) 2Z(g)。已知:X2、Y2、Z的起始浓度分别为0.1mol·L-1、0.3mol·L-1、0.2mol·L-1,在一定条件下,当反应达到平衡时,各物质的浓度(单位mol·L-1)可能是
A.X2为0.2 B.Y2为0.2 C.Z为0.3 D.Z为0.4
21.对于可逆反应 2AB3(g) A2(g) + 3B2(g) ; ΔH>0,下列图像正确的是
A. B.
C. D.
22.下列说法不正确的是
A.铁生锈和氢气燃烧均为自发放热过程 B.冰融化的过程中,熵值增大
C.无热效应的自发过程是不存在的 D.同一物质固态时熵值最小
23.图Ⅰ是NO2(g)+CO(g) CO2(g)+NO(g)反应过程中能量变化示意图.一定条件下,在固定容积的密闭容器中反应达平衡状态,当改变其中一个条件X,Y随X的变化关系曲线如图Ⅱ所示.
下列有关说法正确的是
A.一定条件下,向密闭容器中加入1molNO2(g)与1molCO(g)反应放出234kJ热量
B.若X表示CO的起始浓度,则Y表示的可能是NO2的转化率
C.若X表示温度,则Y表示的可能是CO2的物质的量浓度
D.若X表示反应时间,则Y表示的可能是混合气体的密度
24.某温度下,在容积为2 L的密闭容器中投入一定量的A、B发生反应3A(g)+bB(g) cC(g) ΔH=-Q kJ·mol-1(Q>0),12 s时反应达到平衡,生成C的物质的量为0.8 mol,反应过程中A、B的物质的量浓度随时间的变化关系如图所示。下列说法正确的是
A.前12 s内,A的平均反应速率为0.025 mol·L-1·s-1
B.12 s后,A的消耗速率等于B的生成速率
C.化学计量数之比b∶c=1∶2
D.12 s内,A和B反应放出的热量为0.2Q kJ
25.在一定温度下,将气体X和气体Y各0.16mol充入10L恒容密闭容器中,发生反应:X(g)+Y(g) 2Z(g)△H<0。一段时间后达到平衡,反应过程中测定的数据如下表:
t/min
2
4
7
9
n(Y)/mol
0.12
0.11
0.10
0.10
下列说法正确的是
A.其他条件不变,向平衡体系中再充入0.16mol气体X,与原平衡相比,达到新平衡时,气体Y的转化率增大,X的体积分数减小
B.其他条件不变,降低温度,反应达到新平衡前:v(逆)>v(正)
C.其他条件不变,起始时向容器中充入0.32mol气体X和0.32mol气体Y,到达平衡时,c(Z)=0.24mol?L-l
D.该温度下此反应的平衡常数:K=1.44
第II卷 非选择题
二、填空题(5个小题,共50分)
26.(10分) (1)下面所列物质中 ①氯化钾 ②乙醇 ③盐酸 ④Na2O ⑤SO2⑥HBr
⑦硫酸氢钠 ⑧一水合氨 ⑨氯气 ⑩冰醋酸
①属于弱电解质的是_______________________
②写出NH3.H2O的电离方程式__________________________________
③醋酸的电离常数表达式_________________________
(2)体积、浓度相等的③和⑩的溶液,加入形状相同且足量的Zn粒,反应速率快的是_________(用序号填空);体积、pH相同的③和⑩的溶液,生成氢气体积最多的是______(用序号填空)。
27.(10分) 某化学小组为了研究外界条件对化学反应速率的影响,进行了如下实验:
(实验原理)2KMnO4+5H2C2O4+3H2SO4==2MnSO4+10CO2↑+8H2O+K2SO4(实验内容及记录)
实验编号
室温下,试管中所加试剂及其用量/mL
室温下溶液褪色至无色所需时间/min
0.6 mol/L H2C2O4溶液
H2O
0.1 mol/L KMnO4溶液
3 mol/L H2SO4溶液
1
3.0
13.0
2.0
2.0
8.0
2
2.0
14.0
2.0
2.0
10.4
3
1.0
V1
V2
2.0
12.8
请回答:
(1)请完成上述实验设计表:V1=_________,V2=__________。
(2)根据上表中的实验数据,可以得到的结论是_________________________________。
(3)利用实验1中数据计算,反应速率为v(KMnO4)=_________________________。
(4)该小组同学依据经验绘制了n(Mn2+)随时间变化趋势的示意图,如图1所示。但有同学查阅已有的实验资料发现,该实验过程中n(Mn2+)随时间变化的趋势应如图2所示。该小组同学根据图2所示信息提出了新的假设,并继续进行实验探究。
该小组同学提出的假设是____________________________________________________。
28.(10分)运用化学反应原理研究合成氨反应有重要意义,请完成下列探究。
(1)生产氢气:将水蒸气通过红热的炭即产生水煤气。C(s)+H2O(g) H2(g)+CO(g) △H=+131.3 kJ·mol-1。写出该反应的平衡常数表达式_________________。
(2)已知在400℃时,N2(g)+3H2(g) 2NH3(g)的K=0.5。
①在400℃时,2NH3(g)? N2(g)+3H2(g)的K'=_________(填数值)。
②400℃时,在0.5 L的反应容器中进行合成氨反应,一段时间后,测得N2、H2、NH3的物质的量分别为2 mol、1 mol、2 mol,则此时反应v正(N2)_________v逆(N2)(填“>”、“<”“=”或“不能确定”)。
③若在恒温、恒压条件下向平衡体系中通入氩气,则合成氨反应的平衡_________移动(填“向左”、“向右”或“不”);加入催化剂,反应的△H_________(填“增大”、“减小”或“不改变”)。
29.(10分)(1)把0.2molX气体和0.4molY气体混合于2L密闭容器中,使它们发生如下反应:4X(g)+5Y(g) nZ(g)+6W(g);2min末生成0.3molW。若测知Z的浓度变化表示的反应速率为0.05mol/(L·min)。计算:
①2min内用Y的浓度变化表示的反应速率为。
②化学方程式中n的值是。
(2)在一定温度下,将4molSO2与2molO2放入4L的密闭容器中,在一定条件下反应,2SO2+O22SO3。10min时达到平衡状态。此时容器内压强比反应前减少20%,计算SO2的转化率为_________。
(3)某温度时在2L容器中A、B、C三种气态物质的物质的量(n)随时间(l)变化的曲线如图所示,由图中数据分析:
①该反应的化学方程式为。
②下列叙述能说明上述反应达到平衡状态的是。
A.混合气体的总物质的量不随时间的变化而变化
B.相同时间内消耗2nmol的A的同时生成4nmol的C
C.混合气体的密度不随时间的变化而变化
D.c(A):c(C)=1:3且不再发生变化
30.(10分) 甲醇是重要的能源以及化工原料。
(1)已知:(I)CH3OH(1)+?O2(g)=CO(g)+?2H2O(g)? △H1=-442.8?kJ·mol-1
(II)2CO(g)+O2(g)=2CO2(g)? △H2=-566.0?kJ·mol-1
(III)H2O(l)=H2O(g)? △H3=44.0?kJ·mol-1
25°C时,甲醇完全燃烧的热化学方程式为________________________。
(2)工业上利用CO2和H2制甲醇:
(IV)CO2?(g)+3H2(g) CH3OH(g)?+?H2O(g) △H=-49?kJ·mol-1。
①借助高分子选择性吸水膜可有效提高CO2平衡利用率。其原因是_____________。
②下列关于反应IV的说法正确的是_________(填序号)。
A.有利于减少碳排放,体现了绿色化学思想
B.充分反应后,放出热量可能大于49?kJ
C.降低温度可提高CH3OH含量,工业生产时应控制低温
D.当气体密度保持不变时,反应一定达到平衡状态
(3)经研究发现,反应IV分两步完成:
(V)CO2(g)+H2(g) CO(g)+H2O(g)
(VI)CO(g)+2H2(g) CH3OH(g)? △H<0
①当1?mol?CO2和3?mol?H2投入密闭容器中,当反应V、VI达到平衡后,经测定容器中n(CO2)=n(CO),n(H2)=n(H2O)。则混合气体中水蒸气的体积分数为_____________。
②下列关于反应VI的图像,不正确的是___________(填序号)。
化 学 试 题
满分:100分 考试时间:90分钟
第I卷 选择题
一、选择题(每小题2分,共50分)
1.古代的很多成语、谚语都蕴含着科学知识,下列对成语、谚语的解释正确的是
A.“冰,水为之,而寒于水”说明相同质量和温度的水和冰,冰的能量高
B.“玉不琢,不成器”“百炼方能成钢”发生的均为化学变化
C.“爆竹声中除旧岁”爆竹爆炸发生的是分解反应,吸热反应
D.“火树银花”中的焰火实质上是金属元素的焰色反应
2.已知热化学方程式H2(g)+Br2(l)=2HBr(g) △H=-72.8 kJ·mol-1。下列叙述正确的是
A.该反应中化学能全部转化为热能 B.反应物总能量小于生成物总能量
C.1 mol H2与1 mol Br2反应放出72.8 kJ热量 D.H2(g)+Br2(g)=2HBr(g) △H<-72.8 kJ·mol-1
3.中和热是在稀溶液中,强酸、强碱发生中和反应生成1 mol液态水时放出的热量,中和热为57.3 kJ·mol -1。下列热化学方程式中正确的是
A.HNO3(aq)+KOH(aq)= H2O(l)+KNO3(aq) ΔH>-57.3 kJ·mol-1
B.HNO3(aq)+NH3·H2O(aq)=H2O(l)+NH4NO3(aq) ΔH=-57.3 kJ·mol-1
C.CH3COOH(aq)+KOH(aq)=H2O(l)+CH3COOK(aq) ΔH<-57.3 kJ·mol-1
D.CH3COOH(aq)+NH3?H2O(aq)=H2O(l)+CH3COONH4(aq) ΔH>-57.3kJ·mol-1
4.在下列说法中正确的是
A.1mol H2与0.5mol O2反应放出的热就是H2的燃烧热
B.1mol H2SO4与lmol Ba(OH)2完全反应时放出的热叫做中和热
C.已知C(s) + falseO2(g) = CO(g) △H=-110.5kJ/mol,则碳的燃烧热为110.5kJ/mol
D.同温同压下,已知两个放热反应:2A(g)+B(g)=2C(1) △H1;2A(l)+B(l)=2C(g) △H2,则△Hl<△H2
5.已知:CO(g)+2H2(g) CH3OH(g) △H,反应过程中生成1mol CH3OH(g)的能量变化如下图所示。曲线Ⅰ、Ⅱ分别表示无或有催化剂两种情况。下列判断正确的是
A.加入催化剂,△H变小 B.△H=+91 kJ/mol
C.生成1molCH3OH(l)时,△H值增大 D.反应物的总能量大于生成物的总能量
6.已知:①2C(s)+O2(g)=2CO(g) ΔH1=-221.0kJ?mol-1
②2H2(g)+O2(g)=2H2O(g) ΔH2=-483.6kJ?mol-1
则制备水煤气的反应C(s)+H2O(g)=CO(g)+H2(g),ΔH为
A.262.6kJ?mol-1B.-131.3kJ?mol-1C.-352.3kJ?mol-1D.131.3kJ?mol-1
7.下列装置或操作不能达到目的的是
A.装置①用于滴定中和热装置
B.装置②依据褪色快慢比较浓度对反应速率的影响
C.③依据两容器内气体颜色变化,判断反应2NO2(g) N2O4(g)平衡移动的方向
D.装置④依据U管两边液面的高低判断Na和水反应的热效应
8.将4molA气体和2molB在2L的容器中混合并在一定条件下发生如下反应:2A(g)+B(s) 2C(g),2s后测得C的浓度为0.6mol?L-1,下列说法正确的是
A.用物质A表示的反应平均速率为0.6mol?L-1?s-1B.2s时物质B的浓度为0.8mol?L-1?s-1
C.用物质B表示的反应的平均速率为0.15mol?L-1?s-1D.2s时物质A的转化率为30%
9.反应A(g)+3B(g)=2C(g)+2D(g)在四种不同情况下的反应速率分别为:①v(A)=0.45mol/(L·s) ②v(B)=0.6mol/(L·s) ③v(C)=0.4mol/(L·s) ④v(D)=0.45mol/(L·s)。下列有关反应速率的比较中正确的是
A.④>③=②>① B.①>④>②=③ C.①>②>③>④ D.④>③>②>①
10.已知:4NH3 + 5O2 = 4NO + 6H2O。若反应速率分别用v(NH3)、v(O2)、v(NO)、v(H2O)表示,则下列关系式正确的是
A.3v(NH3) = 2v(H2O) B.5v(O2) = 6v(H2O)
C.4v(NH3) = 5v(O2) D.5v(O2) = 4v(NO)
11.将等物质的量的A、B混合于2L的密闭容器中,发生下列反应:3A(g)+B(g)xC(g)+2D(g),经2min后测得D的浓度为0.5mol/L,c(A):c(B)=3:5,以C表示的平均速率v(C)=0.25mol?L-1?min-1,下列说法正确的是
A.反应速率false?false B.该反应方程式中,false
C.2min时,A的物质的量为false D.2min时,A的转化率为false
12.在恒容密闭容器中充入一定量CO和H2合成CH3OH,其化学方程式为2H2(g)+CO(g) CH3OH(g) △H<0。下列说法错误的是
A.升高温度,正反应速率减小,逆反应速率增大
B.向容器中充入惰性气体,反应速率不变
C.H2、CO、CH3OH的反应速率之比为2:1:1
D.加入高效催化剂,正、逆反应速率都会增大
13.在恒温恒容的密闭容器中通入一定量的A、B,发生反应A(g)+2B(g) 3C(g)。如图是A的反应速率v(A)随时间变化的示意图。下列说法正确的是
A.反应物A的浓度:a点小于b点 B.该反应的生成物可能对反应起催化作用
C.曲线上的c、d两点都表示达到平衡状态 D.A的平均反应速率:ab段大于bc段
14.在一定温度下,容器内某一反应中M、N的物质的量随反应时间变化的曲线如图,下列表述正确的是
A.反应的化学方程式:2MN B.t2时,正、逆反应速率相等,达到平衡
C.t3时,正反应速率大于逆反应速率 D.t1时N的浓度是M浓度的2倍
15.硫代硫酸钠溶液与稀硫酸可发生反应:Na2S2O3 + H2SO4=Na2SO4 + SO2↑ + S↓ + H2O,某同学通过测定该反应发生时溶液变浑浊的时间,研究外界条件对化学反应速率的影响。
设计实验如下
实验编号
反应温度/℃
Na2S2O3溶液
稀H2SO4
H2O
V/mL
c/(mol·L-1)
V/mL
c/(mol·L-1)
V/mL
①
25
5
0.1
10
0.1
5
②
25
5
0.2
5
0.1
10
③
25
5
0.1
10
0.2
5
④
50
5
0.2
5
0.1
10
⑤
50
8
0.1
5
0.1
V1
下列说法正确的是
A.实验①和实验④中最先出现浑浊的是实验①
B.其他条件不变时,探究温度对化学反应速率的影响,应选择实验③和实验④
C.选择实验①和实验③,测定混合液变浑浊的时间,可探究硫酸浓度对化学反应速率的影响
D.选择实验④和实验⑤,可探究Na2S2O3 的浓度对反应速率的影响,则V1=10mL
16.反应C(s)+H2O(g) CO(g)+H2(g)在一可变容积的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是:①增加C的量 ②将容器的体积缩小一半 ③保持体积不变,充入N2使体系压强增大 ④保持压强不变,充入N2使容器体积变大
A.①④ B.②③ C.①③ D.②④
17.在一定温度下的定容容器中,当下列物理量不再发生变化时,表明反应A(s)+2B(g) C(g)+D(g) 已达到化学平衡状态的是
①混合气体的压强 ②混合气体的密度 ③B的物质的量浓度 ④混合气体总物质的量
⑤混合气体的平均相对分子质量 ⑥v(C)与v(D)的比值 ⑦混合气体总质量
A.②③⑤⑦ B.③④⑤⑥ C.①③④⑤ D.①④⑦
18.工业制硫酸中的反应:2SO2+O22SO3,等量的反应物在两个容器中反应,并达到平衡。在这过程中,甲容器保持体积不变,乙容器保持压强不变,若平衡时甲容器中SO2的百分含量p%,则平衡时乙容器中SO2的百分含量
A.等于p% B.大于p% C.小于p% D.无法判断
19.一定温度下,将气体X和气体Y各0.2mol充入10L恒容密闭容器中,发生反应:X(g)+Y(g) 2Z(g)△H<0,一段时间后达到平衡。下列说法正确的是
A.平衡后,充入He气(不参与反应),压强增大,正逆反应速率均增大,平衡不移动
B.其他条件不变,再充入0.1molX和0.1molY,再次平衡时Y的转化率不变
C.当v逆(Y)=2v正(Z)时,说明反应达到平衡
D.平衡后,充入气体X,正反应速率增大,逆反应速率减小,平衡正向移动。
20.在密闭容器中有如下反应:X2(g)+Y2(g) 2Z(g)。已知:X2、Y2、Z的起始浓度分别为0.1mol·L-1、0.3mol·L-1、0.2mol·L-1,在一定条件下,当反应达到平衡时,各物质的浓度(单位mol·L-1)可能是
A.X2为0.2 B.Y2为0.2 C.Z为0.3 D.Z为0.4
21.对于可逆反应 2AB3(g) A2(g) + 3B2(g) ; ΔH>0,下列图像正确的是
A. B.
C. D.
22.下列说法不正确的是
A.铁生锈和氢气燃烧均为自发放热过程 B.冰融化的过程中,熵值增大
C.无热效应的自发过程是不存在的 D.同一物质固态时熵值最小
23.图Ⅰ是NO2(g)+CO(g) CO2(g)+NO(g)反应过程中能量变化示意图.一定条件下,在固定容积的密闭容器中反应达平衡状态,当改变其中一个条件X,Y随X的变化关系曲线如图Ⅱ所示.
下列有关说法正确的是
A.一定条件下,向密闭容器中加入1molNO2(g)与1molCO(g)反应放出234kJ热量
B.若X表示CO的起始浓度,则Y表示的可能是NO2的转化率
C.若X表示温度,则Y表示的可能是CO2的物质的量浓度
D.若X表示反应时间,则Y表示的可能是混合气体的密度
24.某温度下,在容积为2 L的密闭容器中投入一定量的A、B发生反应3A(g)+bB(g) cC(g) ΔH=-Q kJ·mol-1(Q>0),12 s时反应达到平衡,生成C的物质的量为0.8 mol,反应过程中A、B的物质的量浓度随时间的变化关系如图所示。下列说法正确的是
A.前12 s内,A的平均反应速率为0.025 mol·L-1·s-1
B.12 s后,A的消耗速率等于B的生成速率
C.化学计量数之比b∶c=1∶2
D.12 s内,A和B反应放出的热量为0.2Q kJ
25.在一定温度下,将气体X和气体Y各0.16mol充入10L恒容密闭容器中,发生反应:X(g)+Y(g) 2Z(g)△H<0。一段时间后达到平衡,反应过程中测定的数据如下表:
t/min
2
4
7
9
n(Y)/mol
0.12
0.11
0.10
0.10
下列说法正确的是
A.其他条件不变,向平衡体系中再充入0.16mol气体X,与原平衡相比,达到新平衡时,气体Y的转化率增大,X的体积分数减小
B.其他条件不变,降低温度,反应达到新平衡前:v(逆)>v(正)
C.其他条件不变,起始时向容器中充入0.32mol气体X和0.32mol气体Y,到达平衡时,c(Z)=0.24mol?L-l
D.该温度下此反应的平衡常数:K=1.44
第II卷 非选择题
二、填空题(5个小题,共50分)
26.(10分) (1)下面所列物质中 ①氯化钾 ②乙醇 ③盐酸 ④Na2O ⑤SO2⑥HBr
⑦硫酸氢钠 ⑧一水合氨 ⑨氯气 ⑩冰醋酸
①属于弱电解质的是_______________________
②写出NH3.H2O的电离方程式__________________________________
③醋酸的电离常数表达式_________________________
(2)体积、浓度相等的③和⑩的溶液,加入形状相同且足量的Zn粒,反应速率快的是_________(用序号填空);体积、pH相同的③和⑩的溶液,生成氢气体积最多的是______(用序号填空)。
27.(10分) 某化学小组为了研究外界条件对化学反应速率的影响,进行了如下实验:
(实验原理)2KMnO4+5H2C2O4+3H2SO4==2MnSO4+10CO2↑+8H2O+K2SO4(实验内容及记录)
实验编号
室温下,试管中所加试剂及其用量/mL
室温下溶液褪色至无色所需时间/min
0.6 mol/L H2C2O4溶液
H2O
0.1 mol/L KMnO4溶液
3 mol/L H2SO4溶液
1
3.0
13.0
2.0
2.0
8.0
2
2.0
14.0
2.0
2.0
10.4
3
1.0
V1
V2
2.0
12.8
请回答:
(1)请完成上述实验设计表:V1=_________,V2=__________。
(2)根据上表中的实验数据,可以得到的结论是_________________________________。
(3)利用实验1中数据计算,反应速率为v(KMnO4)=_________________________。
(4)该小组同学依据经验绘制了n(Mn2+)随时间变化趋势的示意图,如图1所示。但有同学查阅已有的实验资料发现,该实验过程中n(Mn2+)随时间变化的趋势应如图2所示。该小组同学根据图2所示信息提出了新的假设,并继续进行实验探究。
该小组同学提出的假设是____________________________________________________。
28.(10分)运用化学反应原理研究合成氨反应有重要意义,请完成下列探究。
(1)生产氢气:将水蒸气通过红热的炭即产生水煤气。C(s)+H2O(g) H2(g)+CO(g) △H=+131.3 kJ·mol-1。写出该反应的平衡常数表达式_________________。
(2)已知在400℃时,N2(g)+3H2(g) 2NH3(g)的K=0.5。
①在400℃时,2NH3(g)? N2(g)+3H2(g)的K'=_________(填数值)。
②400℃时,在0.5 L的反应容器中进行合成氨反应,一段时间后,测得N2、H2、NH3的物质的量分别为2 mol、1 mol、2 mol,则此时反应v正(N2)_________v逆(N2)(填“>”、“<”“=”或“不能确定”)。
③若在恒温、恒压条件下向平衡体系中通入氩气,则合成氨反应的平衡_________移动(填“向左”、“向右”或“不”);加入催化剂,反应的△H_________(填“增大”、“减小”或“不改变”)。
29.(10分)(1)把0.2molX气体和0.4molY气体混合于2L密闭容器中,使它们发生如下反应:4X(g)+5Y(g) nZ(g)+6W(g);2min末生成0.3molW。若测知Z的浓度变化表示的反应速率为0.05mol/(L·min)。计算:
①2min内用Y的浓度变化表示的反应速率为。
②化学方程式中n的值是。
(2)在一定温度下,将4molSO2与2molO2放入4L的密闭容器中,在一定条件下反应,2SO2+O22SO3。10min时达到平衡状态。此时容器内压强比反应前减少20%,计算SO2的转化率为_________。
(3)某温度时在2L容器中A、B、C三种气态物质的物质的量(n)随时间(l)变化的曲线如图所示,由图中数据分析:
①该反应的化学方程式为。
②下列叙述能说明上述反应达到平衡状态的是。
A.混合气体的总物质的量不随时间的变化而变化
B.相同时间内消耗2nmol的A的同时生成4nmol的C
C.混合气体的密度不随时间的变化而变化
D.c(A):c(C)=1:3且不再发生变化
30.(10分) 甲醇是重要的能源以及化工原料。
(1)已知:(I)CH3OH(1)+?O2(g)=CO(g)+?2H2O(g)? △H1=-442.8?kJ·mol-1
(II)2CO(g)+O2(g)=2CO2(g)? △H2=-566.0?kJ·mol-1
(III)H2O(l)=H2O(g)? △H3=44.0?kJ·mol-1
25°C时,甲醇完全燃烧的热化学方程式为________________________。
(2)工业上利用CO2和H2制甲醇:
(IV)CO2?(g)+3H2(g) CH3OH(g)?+?H2O(g) △H=-49?kJ·mol-1。
①借助高分子选择性吸水膜可有效提高CO2平衡利用率。其原因是_____________。
②下列关于反应IV的说法正确的是_________(填序号)。
A.有利于减少碳排放,体现了绿色化学思想
B.充分反应后,放出热量可能大于49?kJ
C.降低温度可提高CH3OH含量,工业生产时应控制低温
D.当气体密度保持不变时,反应一定达到平衡状态
(3)经研究发现,反应IV分两步完成:
(V)CO2(g)+H2(g) CO(g)+H2O(g)
(VI)CO(g)+2H2(g) CH3OH(g)? △H<0
①当1?mol?CO2和3?mol?H2投入密闭容器中,当反应V、VI达到平衡后,经测定容器中n(CO2)=n(CO),n(H2)=n(H2O)。则混合气体中水蒸气的体积分数为_____________。
②下列关于反应VI的图像,不正确的是___________(填序号)。
同课章节目录
