第3章 微项目 揭秘索尔维法和侯氏制碱法——化学平衡思想的创造性应用 课件(30张ppt)+2个内嵌视频
文档属性
| 名称 | 第3章 微项目 揭秘索尔维法和侯氏制碱法——化学平衡思想的创造性应用 课件(30张ppt)+2个内嵌视频 |

|
|
| 格式 | pptx | ||
| 文件大小 | 14.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-11-23 11:30:35 | ||
图片预览









文档简介
揭秘索尔维法和侯氏制碱法
高二年级 化学
纯碱是重要的基础化工原料,工业纯碱常用于制造玻璃、洗涤剂、建筑材料等。
食用纯碱可用于食品工业,如生产味精、作为食品添加剂等。
1789年,法国奥尔良地区封建主公爵的侍从医生路布兰成功地创造了一种制碱的方法,1791年获得专利,路布兰制碱法所用的原料为食盐、硫酸、木炭和石灰石。
Nicolas Leblanc
(1742~1806)
法国化学家
纯碱制造的历史
E. Ernest Solvay
(1838-1922)
比利时工业化学家
比利时工程师索尔维以食盐、石灰石和氨为原料制得碳酸钠和氯化钙,1867年这种方法被命名为索尔维制碱法。
纯碱制造的历史
侯德榜(1890-1974)
1921年,侯德榜带领团队,经过五年摸索,用索尔维法制得了高质量的纯碱,并于1933年出版巨著《纯碱制造》,打破了技术垄断,对社会的发展作出了巨大的贡献。索尔维法的食盐利用率低,根据实际情况,侯德榜对索尔维法进行了创新,创造性地提出了侯氏制碱法。
纯碱制造的历史
项目活动1 解读索尔维制碱法
【问题1.1】
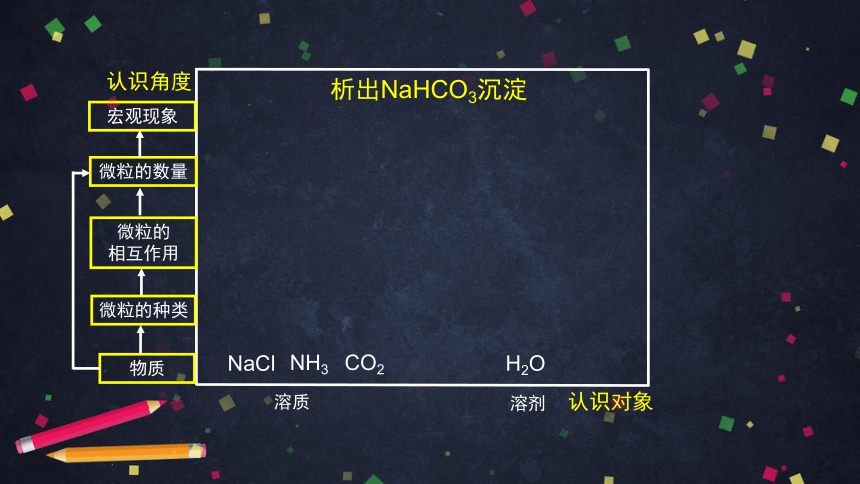
索尔维制碱法以NaCl、NH3、CO2、H2O为原料,可制得NaHCO3, NaHCO3可溶于水,而索尔维法却能得到NaHCO3沉淀,试用化学平衡的原理解释原因并书写制碱(纯碱)反应的化学方程式。
认识角度
认识对象
物质
溶质
溶剂
NaCl
NH3
CO2
H2O
微粒的
相互作用
微粒的种类
微粒的数量
宏观现象
析出NaHCO3沉淀
认识角度
认识对象
物质
溶质
溶剂
NaCl
NH3
CO2
H2O
微粒的
相互作用
微粒的种类
微粒的数量
宏观现象
析出NaHCO3沉淀
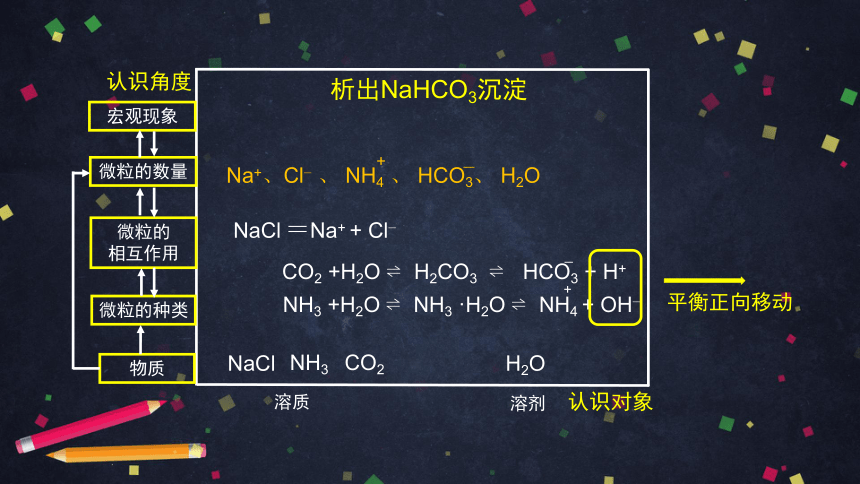
NaCl =Na+ + Cl?
NH3 +H2O ? NH3 ·H2O ? NH4 + OH?
+
CO2 +H2O ? H2CO3 ? HCO3 + H+
?
?
平衡正向移动
Na+、Cl? 、 NH4 、 HCO3、 H2O
?
+
认识角度
认识对象
物质
溶质
溶剂
NaCl
NH3
CO2
H2O
微粒的
相互作用
微粒的种类
微粒的数量
宏观现象
析出NaHCO3沉淀
NaCl =Na+ + Cl?
NH3 +H2O ? NH3 ·H2O ? NH4 + OH?
+
CO2 +H2O ? H2CO3 ? HCO3 + H+
?
?
Na+、Cl? 、 NH4 、 HCO3、 H2O
?
+
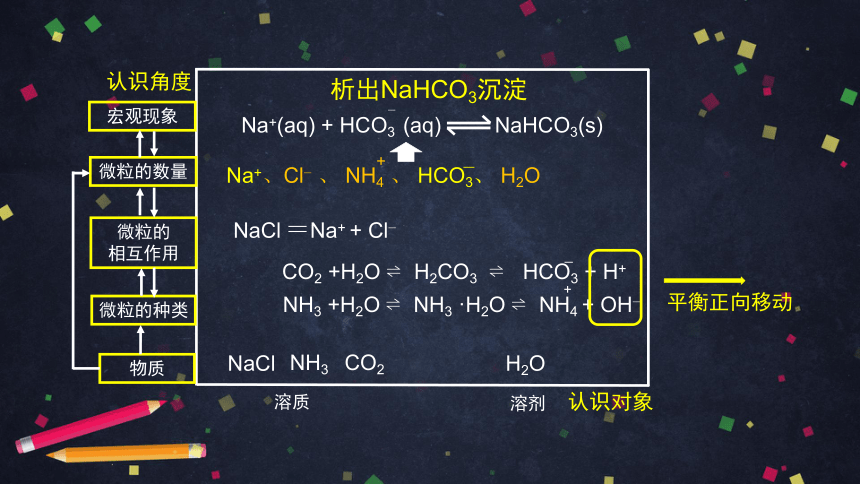
Na+(aq) + HCO3 (aq) NaHCO3(s)
?
平衡正向移动
NaCl + CO2 + NH3 + H2O NaHCO3 + NH4Cl
索尔维制碱法(1861年)
2NaHCO3 Na2CO3 + H2O + CO2
{5C22544A-7EE6-4342-B048-85BDC9FD1C3A}
NaCl
NH4Cl
Na2CO3
NH4HCO3
NaHCO3
(NH4)2CO3
溶解度/ g
(20℃,100g水)
36.0
37.2
21.5
21.7
9.6
100
表1 几种盐的溶解性数据
【问题1.2】结合表1思考为什么第一步反应中不直接生成Na2CO3?
【问题2.1】
请你思考可以通过改变哪些外界条件来增加NaHCO3产量?
认识角度
认识对象
物质
溶质
溶剂
NaCl
NH3
CO2
微粒的
相互作用
微粒的种类
微粒的数量
宏观现象
NaCl Na+ + Cl-
CO2 + H2O ? H2CO3 ? HCO3 + H+
?
?
Na+(aq) + HCO3 (aq) NaHCO3(s)
?
平衡正移
增加NaHCO3产量
调控浓度
饱和食盐水
足量CO2
饱和
氨
盐水
缓慢而持续
通入CO2
【问题2.2】
CO2 的溶解度(1:1)
NH3 的溶解度(1:700)
目标:获得更多的HCO3
?
室温下:
实际工业中为什么要先向饱和食盐水中通入氨气制得氨盐水,再通入二氧化碳?
先通NH3: 吸收的CO2量多, HCO3 产量大。
持续通入CO2(足量)即可,操作简便。
?
先通CO2:需要控制NH3的吸收量(少量)。
吸收的NH3量少, HCO3 产量小。
?
【问题2.3】
还可以通过调控什么条件促使下列平衡正向移动呢?
Na+(aq) + HCO3 (aq) NaHCO3(s)
?
影响平衡移动的因素,除了浓度,还有温度。
降低温度
Na+(aq) + HCO3 (aq) NaHCO3(s)
?
平衡正移
目标:增加NaHCO3产量
{5C22544A-7EE6-4342-B048-85BDC9FD1C3A}温度/ ℃
0℃
10℃
20℃
30℃
40℃
50℃
60℃
溶解度/ g
6.9
8.1
9.6
11.1
12.7
14.5
16.4
资料卡片:NaHCO3在不同温度下的溶解度数据
调控温度
ΔH<0
增加NaHCO3的产量
饱和食盐水
先通NH3再通CO2;通入足量CO2
降温
Na+(aq) + HCO3 (aq) NaHCO3(s)
?
调控条件
宏观目标
物质组成、微粒、平衡
实际工业中:
模拟制碱实验视频:
向冰水浴中的饱和氨盐水(含酚酞)里持续通CO2
播放速度×4
【问题2.4】请分步书写整个实验过程中反应的离子方程式。
2NH3·H2O + CO2 CO3 + 2NH4 + H2O
2?
+
CO3 + H2O + CO2 2HCO3
2?
?
Na+(aq) + HCO3 (aq) NaHCO3(s)
?
【问题2.5】下面是索尔维制碱法的工艺流程图,书写“灰蒸”这一步反应的离子方程式。从绿色化学角度,评价索尔维法的优点和不足。
不足:CaCl2、NaCl
直接排放,利用率低
优点:NH3、CO2实现循环利用
NH4 、Cl?
Na+、 HCO3
?
+
NH4 + OH? NH3 + H2O
+
Ca2+ + OH? + HCO3 CaCO3 + H2O
?
Ca2+ 、Na+、 Cl? (大量)
OH? (少量)
历史背景:合成氨已经工业化,食盐稀缺
项目活动2 体会侯氏制碱法的创新
高浓度的Cl?会使补加的食盐难以溶解
NH4 浓度过高可能会以铵盐的形式析出,影响产物的产率和纯度
+
NH4 、Cl?
Na+、 HCO3
?
+
核心目标:从母液中分离出NH4Cl
NH4Cl是优质氮肥
【问题3】
侯氏制碱法工艺流程图如下,请你思考实际工业中“吸氨”、“冷析”、“盐析”过程的具体目的是什么?
NH4 、Cl?
Na+、 HCO3
?
+
认识角度
认识对象
物质
溶质
溶剂
微粒的
相互作用
微粒的种类
微粒的数量
宏观现象
Cl? 、 NH4 、Na+、 HCO3
?
NH3 +H2O ? NH3 ·H2O ? NH4 + OH?
+
NaCl Na+ + Cl?
析出NH4Cl沉淀,实现分离
——增大c(NH4)
——增大c(Cl?)
“吸氨”
“盐析”
平衡正移
+
NH4 (aq) + Cl?(aq) NH4Cl(s)
+
+
ΔH<0
目标:析出NH4Cl沉淀,实现分离
“冷析”——降低温度
平衡正移
资料:
NH4 (aq) + Cl?(aq) NH4Cl(s)
+
NH4 (aq) + Cl?(aq) NH4Cl(s)
调控浓度:
增大反应物浓度
(“吸氨”“盐析”)
析出NH4Cl沉淀,实现分离
调控温度:
降低温度
(“冷析”)
调控条件
宏观目标
物质组成、微粒、平衡
+
实验室模拟制碱母液的处理实验装置
实验室模拟制碱母液的处理实验视频
播放速度×4
Na+、Cl?
(主要)
NH4 、 HCO3 (少量)
?
+
侯氏制碱法
(联合制碱法)
NH4 、Cl?
Na+、 HCO3
?
+
分析真实溶液问题的一般思路
单一溶质
多种溶质
调控条件
宏观目标
物质组成、
微粒、平衡
高二年级 化学
纯碱是重要的基础化工原料,工业纯碱常用于制造玻璃、洗涤剂、建筑材料等。
食用纯碱可用于食品工业,如生产味精、作为食品添加剂等。
1789年,法国奥尔良地区封建主公爵的侍从医生路布兰成功地创造了一种制碱的方法,1791年获得专利,路布兰制碱法所用的原料为食盐、硫酸、木炭和石灰石。
Nicolas Leblanc
(1742~1806)
法国化学家
纯碱制造的历史
E. Ernest Solvay
(1838-1922)
比利时工业化学家
比利时工程师索尔维以食盐、石灰石和氨为原料制得碳酸钠和氯化钙,1867年这种方法被命名为索尔维制碱法。
纯碱制造的历史
侯德榜(1890-1974)
1921年,侯德榜带领团队,经过五年摸索,用索尔维法制得了高质量的纯碱,并于1933年出版巨著《纯碱制造》,打破了技术垄断,对社会的发展作出了巨大的贡献。索尔维法的食盐利用率低,根据实际情况,侯德榜对索尔维法进行了创新,创造性地提出了侯氏制碱法。
纯碱制造的历史
项目活动1 解读索尔维制碱法
【问题1.1】
索尔维制碱法以NaCl、NH3、CO2、H2O为原料,可制得NaHCO3, NaHCO3可溶于水,而索尔维法却能得到NaHCO3沉淀,试用化学平衡的原理解释原因并书写制碱(纯碱)反应的化学方程式。
认识角度
认识对象
物质
溶质
溶剂
NaCl
NH3
CO2
H2O
微粒的
相互作用
微粒的种类
微粒的数量
宏观现象
析出NaHCO3沉淀
认识角度
认识对象
物质
溶质
溶剂
NaCl
NH3
CO2
H2O
微粒的
相互作用
微粒的种类
微粒的数量
宏观现象
析出NaHCO3沉淀
NaCl =Na+ + Cl?
NH3 +H2O ? NH3 ·H2O ? NH4 + OH?
+
CO2 +H2O ? H2CO3 ? HCO3 + H+
?
?
平衡正向移动
Na+、Cl? 、 NH4 、 HCO3、 H2O
?
+
认识角度
认识对象
物质
溶质
溶剂
NaCl
NH3
CO2
H2O
微粒的
相互作用
微粒的种类
微粒的数量
宏观现象
析出NaHCO3沉淀
NaCl =Na+ + Cl?
NH3 +H2O ? NH3 ·H2O ? NH4 + OH?
+
CO2 +H2O ? H2CO3 ? HCO3 + H+
?
?
Na+、Cl? 、 NH4 、 HCO3、 H2O
?
+
Na+(aq) + HCO3 (aq) NaHCO3(s)
?
平衡正向移动
NaCl + CO2 + NH3 + H2O NaHCO3 + NH4Cl
索尔维制碱法(1861年)
2NaHCO3 Na2CO3 + H2O + CO2
{5C22544A-7EE6-4342-B048-85BDC9FD1C3A}
NaCl
NH4Cl
Na2CO3
NH4HCO3
NaHCO3
(NH4)2CO3
溶解度/ g
(20℃,100g水)
36.0
37.2
21.5
21.7
9.6
100
表1 几种盐的溶解性数据
【问题1.2】结合表1思考为什么第一步反应中不直接生成Na2CO3?
【问题2.1】
请你思考可以通过改变哪些外界条件来增加NaHCO3产量?
认识角度
认识对象
物质
溶质
溶剂
NaCl
NH3
CO2
微粒的
相互作用
微粒的种类
微粒的数量
宏观现象
NaCl Na+ + Cl-
CO2 + H2O ? H2CO3 ? HCO3 + H+
?
?
Na+(aq) + HCO3 (aq) NaHCO3(s)
?
平衡正移
增加NaHCO3产量
调控浓度
饱和食盐水
足量CO2
饱和
氨
盐水
缓慢而持续
通入CO2
【问题2.2】
CO2 的溶解度(1:1)
NH3 的溶解度(1:700)
目标:获得更多的HCO3
?
室温下:
实际工业中为什么要先向饱和食盐水中通入氨气制得氨盐水,再通入二氧化碳?
先通NH3: 吸收的CO2量多, HCO3 产量大。
持续通入CO2(足量)即可,操作简便。
?
先通CO2:需要控制NH3的吸收量(少量)。
吸收的NH3量少, HCO3 产量小。
?
【问题2.3】
还可以通过调控什么条件促使下列平衡正向移动呢?
Na+(aq) + HCO3 (aq) NaHCO3(s)
?
影响平衡移动的因素,除了浓度,还有温度。
降低温度
Na+(aq) + HCO3 (aq) NaHCO3(s)
?
平衡正移
目标:增加NaHCO3产量
{5C22544A-7EE6-4342-B048-85BDC9FD1C3A}温度/ ℃
0℃
10℃
20℃
30℃
40℃
50℃
60℃
溶解度/ g
6.9
8.1
9.6
11.1
12.7
14.5
16.4
资料卡片:NaHCO3在不同温度下的溶解度数据
调控温度
ΔH<0
增加NaHCO3的产量
饱和食盐水
先通NH3再通CO2;通入足量CO2
降温
Na+(aq) + HCO3 (aq) NaHCO3(s)
?
调控条件
宏观目标
物质组成、微粒、平衡
实际工业中:
模拟制碱实验视频:
向冰水浴中的饱和氨盐水(含酚酞)里持续通CO2
播放速度×4
【问题2.4】请分步书写整个实验过程中反应的离子方程式。
2NH3·H2O + CO2 CO3 + 2NH4 + H2O
2?
+
CO3 + H2O + CO2 2HCO3
2?
?
Na+(aq) + HCO3 (aq) NaHCO3(s)
?
【问题2.5】下面是索尔维制碱法的工艺流程图,书写“灰蒸”这一步反应的离子方程式。从绿色化学角度,评价索尔维法的优点和不足。
不足:CaCl2、NaCl
直接排放,利用率低
优点:NH3、CO2实现循环利用
NH4 、Cl?
Na+、 HCO3
?
+
NH4 + OH? NH3 + H2O
+
Ca2+ + OH? + HCO3 CaCO3 + H2O
?
Ca2+ 、Na+、 Cl? (大量)
OH? (少量)
历史背景:合成氨已经工业化,食盐稀缺
项目活动2 体会侯氏制碱法的创新
高浓度的Cl?会使补加的食盐难以溶解
NH4 浓度过高可能会以铵盐的形式析出,影响产物的产率和纯度
+
NH4 、Cl?
Na+、 HCO3
?
+
核心目标:从母液中分离出NH4Cl
NH4Cl是优质氮肥
【问题3】
侯氏制碱法工艺流程图如下,请你思考实际工业中“吸氨”、“冷析”、“盐析”过程的具体目的是什么?
NH4 、Cl?
Na+、 HCO3
?
+
认识角度
认识对象
物质
溶质
溶剂
微粒的
相互作用
微粒的种类
微粒的数量
宏观现象
Cl? 、 NH4 、Na+、 HCO3
?
NH3 +H2O ? NH3 ·H2O ? NH4 + OH?
+
NaCl Na+ + Cl?
析出NH4Cl沉淀,实现分离
——增大c(NH4)
——增大c(Cl?)
“吸氨”
“盐析”
平衡正移
+
NH4 (aq) + Cl?(aq) NH4Cl(s)
+
+
ΔH<0
目标:析出NH4Cl沉淀,实现分离
“冷析”——降低温度
平衡正移
资料:
NH4 (aq) + Cl?(aq) NH4Cl(s)
+
NH4 (aq) + Cl?(aq) NH4Cl(s)
调控浓度:
增大反应物浓度
(“吸氨”“盐析”)
析出NH4Cl沉淀,实现分离
调控温度:
降低温度
(“冷析”)
调控条件
宏观目标
物质组成、微粒、平衡
+
实验室模拟制碱母液的处理实验装置
实验室模拟制碱母液的处理实验视频
播放速度×4
Na+、Cl?
(主要)
NH4 、 HCO3 (少量)
?
+
侯氏制碱法
(联合制碱法)
NH4 、Cl?
Na+、 HCO3
?
+
分析真实溶液问题的一般思路
单一溶质
多种溶质
调控条件
宏观目标
物质组成、
微粒、平衡
同课章节目录
- 第1章 化学反应与能量转化
- 第1节 化学反应的热效应
- 第2节 化学能转化为电能——电池
- 第3节 电能转化为化学能——电解
- 第4节 金属的腐蚀与防护
- 微项目 设计载人航天器用化学电池与氧气再生方案——化学反应中能量及物质的转化利用
- 第2章 化学反应的方向、 限度与速率
- 第1节 化学反应的方向
- 第2节 化学反应的限度
- 第3节 化学反应的速率
- 第4节 化学反应条件的优化——工业合成氨
- 微项目 探讨如何利用工业废气中的二氧化碳合成甲醇——化学反应选择与反应条件优化
- 第3章 物质在水溶液中的行为
- 第1节 水与水溶液
- 第2节 弱电解质的电离 盐类的水解
- 第3节 沉淀溶解平衡
- 第4节 离子反应
- 微项目 揭秘索尔维制碱法和侯氏制碱法——化学平衡思想的创造性应用
